ą×čĆą▒č¢čéą░ą╗čīąĮą░ ą╝ąŠą┤ąĄą╗čī ą░č鹊ą╝ą░.
ąĢą╗ąĄą║čéčĆąŠąĮ ą╝ą░čö ąŠą┤ąĮąŠčćą░čüąĮąŠ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéčÅą╝ąĖ čćą░čüčéą║ąĖ č¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ čģą▓ąĖą╗č¢. ąöą▓ąŠčŚčüčéąĖą╣ čģą░čĆą░ą║č鹥čĆ ąĄą╗ąĄą║čéčĆąŠąĮą░ ąĮą░ąĘąĖą▓ą░čÄčéčī ą║ąŠčĆą┐čāčüą║čāą╗čÅčĆąĮąŠ-čģą▓ąĖą╗čīąŠą▓ąĖą╝ ą┤čāą░ą╗č¢ąĘą╝ąŠą╝. ąóąŠą╝čā, čéč¢ą╗čīą║ąĖ ąĘ čāčĆą░čģčāą▓ą░ąĮąĮčÅą╝ ą║ąŠčĆą┐čāčüą║čāą╗čÅčĆąĮąŠ-čģą▓ąĖą╗čīąŠą▓ąŠą│ąŠ ą┤čāą░ą╗č¢ąĘą╝čā ąĄą╗ąĄą║čéčĆąŠąĮą░, ą╝ąŠąČąĮą░ čüč乊čĆą╝čāą╗čÄą▓ą░čéąĖ ąŠčĆą▒č¢čéą░ą╗čīąĮčā ą╝ąŠą┤ąĄą╗čī ą░č鹊ą╝ą░.
ą░č鹊ą╝ąĮą░ ąŠčĆą▒č¢čéą░ą╗čī – čåąĄ ą│ąĄąŠą╝ąĄčéčĆąĖčćąĮąĖą╣ ąŠą▒čĆą░ąĘ, čēąŠ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö ąŠą▒čüčÅą│čā ą┐čĆąŠčüč鹊čĆčā ąĮą░ą▓ą║ąŠą╗ąŠ ą░č鹊ą╝ąĮąŠą│ąŠ čÅą┤čĆą░, ąĘ 90%-ąŠčŚ ą╣ą╝ąŠą▓č¢čĆąĮč¢čüčéčÄ ąĘąĮą░čģąŠą┤ąČąĄąĮąĮčÅ ą▓ čåčīąŠą╝čā ąŠą▒čüčÅąĘč¢ ąĄą╗ąĄą║čéčĆąŠąĮą░ (čćą░čüčéąĖąĮą║ąĖ) č¢ ąŠą┤ąĮąŠčćą░čüąĮąŠ 90%-ąŠčŚ čēč¢ą╗čīąĮąŠčüčéč¢ ąĘą░čĆčÅą┤čā ąĄą╗ąĄą║čéčĆąŠąĮą░ (čÅą║ čģą▓ąĖą╗č¢).
ąōąŠą╗ąŠą▓ąĮąĄ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ (n) – čåąĄ ąĮąŠą╝ąĄčĆ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ čĆč¢ą▓ąĮčÅ ą▓č¢ą┤ 1 ą┤ąŠ 7. ąØąŠą╝ąĄčĆ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ čĆč¢ą▓ąĮčÅ čģą░čĆą░ą║č鹥čĆąĖąĘčāčö ąĄąĮąĄčĆą│č¢čÄ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, ąĮąĄ ą╝ąŠąČąĄ ą▒čāčéąĖ ąĮąĄą│ą░čéąĖą▓ąĮąĖą╝. ąōąŠą╗ąŠą▓ąĮąĄ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ ą▓ąĖąĘąĮą░čćą░čö čĆąŠąĘą╝č¢čĆąĖ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ čģą╝ą░čĆąĖ, čćąĖą╝ ą▒č¢ą╗čīčłąĄ ą│ąŠą╗ąŠą▓ąĮąĄ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ (č鹊ą▒č鹊 ąĄąĮąĄčĆą│č¢čÅ ąĄą╗ąĄą║čéčĆąŠąĮą░), čéąĖą╝ ą┤ą░ą╗č¢ ąĄą╗ąĄą║čéčĆąŠąĮ ą▓č¢ą┤ čÅą┤čĆą░ č¢ čéąĖą╝ ą▒č¢ą╗čīčłąĄ čĆąŠąĘą╝č¢čĆ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ čģą╝ą░čĆąĖ.
ą×čĆą▒č¢čéą░ą╗čīąĮąĄ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ (l) (ą┐ąŠą▒č¢čćąĮąĄ ą░ą▒ąŠ ą░ąĘąĖą╝čāčéą░ą╗čīąĮąĄ) – čåąĄ čćąĖčüą╗ąŠ, čÅą║ąĄ čģą░čĆą░ą║č鹥čĆąĖąĘčāčö č乊čĆą╝čā ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ čģą╝ą░čĆąĖ, č乊čĆą╝čā ą░č鹊ą╝ąĮąŠčŚ ąŠčĆą▒č¢čéą░ą╗č¢, č¢ ą┐čĆąĖą╣ą╝ą░čö čåč¢ą╗ąŠčćąĖčüąĄą╗čīąĮč¢ ąĘąĮą░č湥ąĮąĮčÅ ą▓č¢ą┤ 0 ą┤ąŠ n-1. ą¤ąĄą▓ąĮąŠą╝čā ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą╝čā čĆč¢ą▓ąĮčÄ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö ą┐ąĄą▓ąĮąĄ čćąĖčüą╗ąŠ ąŠčĆą▒č¢čéą░ą╗čīąĮąĖčģ ą║ą▓ą░ąĮč鹊ą▓ąĖčģ čćąĖčüąĄą╗ – ą░č鹊ą╝ąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ą┐ąĄą▓ąĮąŠčŚ č乊čĆą╝ąĖ, čÅą║č¢ ąĮą░ąĘąĖą▓ą░čÄčéčīčüčÅ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąĖą╝ąĖ ą┐č¢ą┤čĆč¢ą▓ąĮčÅą╝ąĖ. ąØą░ą┐čĆąĖą║ą╗ą░ą┤, ą┤ą╗čÅ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ čĆč¢ą▓ąĮčÅ 1 čģą░čĆą░ą║č鹥čĆąĮąĖą╣ ąŠą┤ąĖąĮ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąĖą╣ ą┐č¢ą┤čĆč¢ą▓ąĄąĮčī čģą░čĆą░ą║č鹥čĆąĖąĘčāčöčéčīčüčÅ ąŠčĆą▒č¢čéą░ą╗čīąĮąĖą╝ ą║ą▓ą░ąĮč鹊ą▓ąĖą╝ čćąĖčüą╗ąŠą╝ l= 0 (1 – 1 = 0); ą┤ą╗čÅ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ čĆč¢ą▓ąĮčÅ 4 čģą░čĆą░ą║č鹥čĆąĮč¢ č湊čéąĖčĆąĖ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąĖčģ ą┐č¢ą┤čĆč¢ą▓ąĮčÅ, čÅą║č¢ ą▓č¢ą┤čĆč¢ąĘąĮčÅčÄčéčīčüčÅ č乊čĆą╝ąŠčÄ: l = 0, 1, 2, 3. ąÜč¢ą╗čīą║č¢čüčéčī ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąĖčģ ą┐č¢ą┤čĆč¢ą▓ąĮč¢ą▓ čćąĖčüąĄą╗čīąĮąŠ ą┤ąŠčĆč¢ą▓ąĮčÄčö ąĮąŠą╝ąĄčĆčā ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ čĆč¢ą▓ąĮčÅ. ąĢąĮąĄčĆą│ąĄčéąĖčćąĮąĖą╝ ą┐č¢ą┤čĆč¢ą▓ąĮčÅčģ ą┐čĆąĖčüą▓ąŠčöąĮč¢ ą╗č¢č鹥čĆąĮč¢ ą┐ąŠąĘąĮą░č湥ąĮąĮčÅ: l = 0 – s-ą┐č¢ą┤čĆč¢ą▓ąĄąĮčī (ąĮą░ ąĮčīąŠą╝čā ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ s-ąĄą╗ąĄą║čéčĆąŠąĮąĖ, ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮą░ ą║č¢ą╗čīą║č¢čüčéčī ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓: 2); l = 1 – p-ą┐č¢ą┤čĆč¢ą▓ąĄąĮčī (p-ąĄą╗ąĄą║čéčĆąŠąĮąĖ, ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮą░ ą║č¢ą╗čīą║č¢čüčéčī ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓: 6); l = 2 – d-ą┐č¢ą┤čĆč¢ą▓ąĄąĮčī (d-ąĄą╗ąĄą║čéčĆąŠąĮąĖ, ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮą░ ą║č¢ą╗čīą║č¢čüčéčī ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓: 10); l = 3 – f-ą┐č¢ą┤čĆč¢ą▓ąĄąĮčī (f-ąĄą╗ąĄą║čéčĆąŠąĮąĖ, ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮą░ ą║č¢ą╗čīą║č¢čüčéčī ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓: 14).
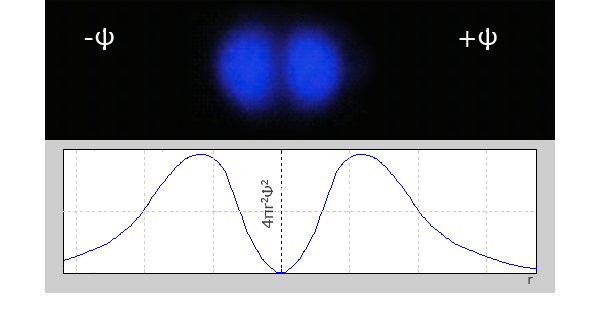
ąĢą╗ąĄą║čéčĆąŠąĮąĮąĄ čģą╝ą░čĆą░ s-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą┐ąĄčĆčłąŠą│ąŠ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ čĆč¢ą▓ąĮčÅ ą╝ą░čö čüč乥čĆąĖčćąĮąŠčŚ čüąĖą╝ąĄčéčĆč¢čöčÄ (ą╝ą░čö č乊čĆą╝čā ą║čāą╗č¢). ąĢą╗ąĄą║čéčĆąŠąĮąĮč¢ čģą╝ą░čĆąĖ s-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ 2, 3 č¢ ąĮą░čüčéčāą┐ąĮąĖčģ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąĖčģ čĆč¢ą▓ąĮč¢ą▓, čéą░ą║-čéą░ą║ąĖ ą╝ą░čÄčéčī čüč乥čĆąĖčćąĮąŠčŚ čüąĖą╝ąĄčéčĆč¢čöčÄ (ą║čāą╗čÅčüčéą░ č乊čĆą╝ą░); ą░ą╗ąĄ čģą▓ąĖą╗čīąŠą▓ą░ čäčāąĮą║čåč¢čÅ, čēąŠ ąŠą┐ąĖčüčāčö č乊čĆą╝čā ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ čģą╝ą░čĆąĖ, ąĘą╝č¢ąĮčÄčöčéčīčüčÅ ą▒č¢ą╗čīčł čüą║ą╗ą░ą┤ąĮąĖą╝ čćąĖąĮąŠą╝ č¢ ąĮąĄ čö ą╝ąŠąĮąŠč鹊ąĮąĮąŠčÄ. ą»ą║čēąŠ čā ą▓ąĖą┐ą░ą┤ą║čā 1s-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, ą│čĆą░čäč¢ą║ čĆą░ą┤č¢ą░ą╗čīąĮąŠą│ąŠ čĆąŠąĘą┐ąŠą┤č¢ą╗čā ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ čēč¢ą╗čīąĮąŠčüčéč¢ ą╝ą░čö ąŠą┤ąĖąĮ ą╝ą░ą║čüąĖą╝čāą╝, č鹊 ą│čĆą░čäč¢ą║ąĖ čĆą░ą┤č¢ą░ą╗čīąĮąŠą│ąŠ čĆąŠąĘą┐ąŠą┤č¢ą╗čā ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ ą│čāčüčéąĖąĮąĖ 2s – č¢ 3s-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, čēąŠ ą╝ą░čÄčéčī ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą┤ą▓ą░ č¢ čéčĆąĖ ą╝ą░ą║čüąĖą╝čāą╝ąĖ. ą¤čĆąĖ čåčīąŠą╝čā ą│ąŠą╗ąŠą▓ąĮąĖą╣ ą╝ą░ą║čüąĖą╝čāą╝ čĆąŠąĘčéą░čłąŠą▓čāčöčéčīčüčÅ čéąĖą╝ ą┤ą░ą╗č¢ ą▓č¢ą┤ čÅą┤čĆą░, čćąĖą╝ ą▒č¢ą╗čīčłąĄ ąĘąĮą░č湥ąĮąĮčÅ ą│ąŠą╗ąŠą▓ąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąŠą│ąŠ čćąĖčüą╗ą░.
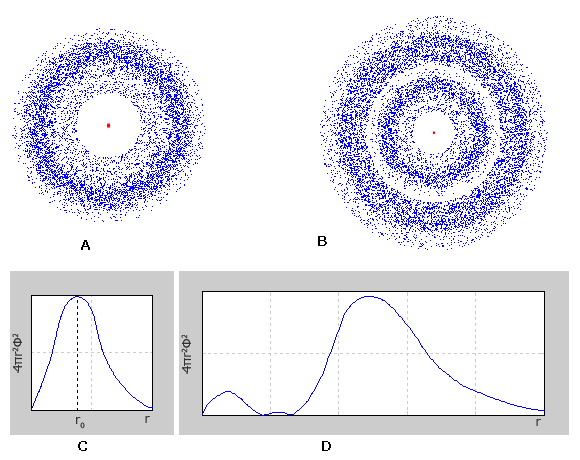
A – ąĢą╗ąĄą║čéčĆąŠąĮąĮąĄ čģą╝ą░čĆą░ 1s-ąĄą╗ąĄą║čéčĆąŠąĮą░;
B – ąĢą╗ąĄą║čéčĆąŠąĮąĮąĄ čģą╝ą░čĆą░ 2s-ąĄą╗ąĄą║čéčĆąŠąĮą░;
C – ąōčĆą░čäč¢ą║ čĆą░ą┤č¢ą░ą╗čīąĮąŠą│ąŠ čĆąŠąĘą┐ąŠą┤č¢ą╗čā ą╣ą╝ąŠą▓č¢čĆąĮąŠčüčéč¢ ą┤ą╗čÅ 1s-ąĄą╗ąĄą║čéčĆąŠąĮą░;
D – ąōčĆą░čäč¢ą║ čĆą░ą┤č¢ą░ą╗čīąĮąŠą│ąŠ čĆąŠąĘą┐ąŠą┤č¢ą╗čā ą╣ą╝ąŠą▓č¢čĆąĮąŠčüčéč¢ ą┤ą╗čÅ 2s-ąĄą╗ąĄą║čéčĆąŠąĮą░.
ąØą░ ą▓č¢ą┤ą╝č¢ąĮčā ą▓č¢ą┤ s-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ p-ąĄą╗ąĄą║čéčĆąŠąĮąĖ ąĮąĄ ą╝ą░čÄčéčī čüč乥čĆąĖčćąĮąŠčŚ čüąĖą╝ąĄčéčĆč¢čöčÄ. ążąŠčĆą╝ą░ ąĄą╗ąĄą║čéčĆąŠąĮąĮąĖčģ čģą╝ą░čĆ p-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ąĮą░ą│ą░ą┤čāčö ą┐ą╗ąĄčüą║ą░čéčā ąĘ č鹊čĆčåč¢ą▓ ą▓č¢čüč¢ą╝ą║čā.
ąōčĆą░čäč¢ą║ čĆą░ą┤č¢ą░ą╗čīąĮąŠą│ąŠ čĆąŠąĘą┐ąŠą┤č¢ą╗čā ą╣ą╝ąŠą▓č¢čĆąĮąŠčüčéč¢ ą┤ą╗čÅ 2p-ąĄą╗ąĄą║čéčĆąŠąĮą░.
ąĀą░ą┤č¢ą░ą╗čīąĮąĖą╣ čĆąŠąĘą┐ąŠą┤č¢ą╗ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ ą│čāčüčéąĖąĮąĖ ąĄą╗ąĄą║čéčĆąŠąĮąĮąĖčģ čģą╝ą░čĆ ąĮą░čüčéčāą┐ąĮąĖčģ 3p-(ą┤ą▓ą░ ą╝ą░ą║čüąĖą╝čāą╝ąĖ) 4p-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ (3 ą╝ą░ą║čüąĖą╝čāą╝čā), čéą░ą║-ąČ, ą▒čāą┤ąĄ ą╝ą░čéąĖ “čłą░čĆčāą▓ą░čéąĖą╣ čģą░čĆą░ą║č鹥čĆ, ą┐čĆąĖ čåčīąŠą╝čā, ąĮą░ą╣ą▒č¢ą╗čīčłąĖą╣ ą╝ą░ą║čüąĖą╝čāą╝ čĆąŠąĘčéą░čłąŠą▓čāčöčéčīčüčÅ ą▓čüąĄ ą┤ą░ą╗č¢ ą▓č¢ą┤ čÅą┤čĆą░. ąŚąĮą░ą║ čģą▓ąĖą╗čīąŠą▓ąŠčŚ čäčāąĮą║čåč¢čŚ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠą│ąŠ čģą╝ą░čĆąĖ p-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą╝ą░čö ąĘąĮą░č湥ąĮąĮčÅ + ą░ą▒ąŠ – ą▓ čĆč¢ąĘąĮąĖčģ čćą░čüčéąĖąĮą░čģ.
ąĢą╗ąĄą║čéčĆąŠąĮąĮč¢ čģą╝ą░čĆąĖ d-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą╝ą░čÄčéčī čēąĄ ą▒č¢ą╗čīčł čüą║ą╗ą░ą┤ąĮčā č乊čĆą╝čā, čÅą║ą░ ąĮą░ą│ą░ą┤čāčö ą┤ą▓č¢ čüą┐ą╗čÄčüąĮčāč鹥 ąĘ č鹊čĆčåč¢ą▓ ą▓č¢čüč¢ą╝ą║ąĖ ą┐ąĄčĆą┐ąĄąĮą┤ąĖą║čāą╗čÅčĆąĮč¢ ąŠą┤ąĖąĮ ąŠą┤ąĮąŠą╝čā č¢ čĆąŠąĘčéą░čłąŠą▓ą░ąĮč¢ ą▓ ąŠą┤ąĮč¢ą╣ ą┐ą╗ąŠčēąĖąĮč¢ (“č湊čéąĖčĆąĖą┐ąĄą╗čÄčüčéą║ąŠą▓ą░” čäč¢ą│čāčĆą░). ąŚąĮą░ą║ąĖ čģą▓ąĖą╗čīąŠą▓ąŠčŚ čäčāąĮą║čåč¢čŚ ą▓ ą┐ąĄą╗čÄčüčéą║ą░čģ č湥čĆą│čāčÄčéčīčüčÅ.
ą£ą░ą│ąĮč¢čéąĮąĄ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ (m) – čģą░čĆą░ą║č鹥čĆąĖąĘčāčö ą┐čĆąŠčüč鹊čĆąŠą▓čā ąŠčĆč¢čöąĮčéą░čåč¢čÄ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ čģą╝ą░čĆąĖ. ą£ą░ą│ąĮč¢čéąĮąĄ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ ą╝ąŠąČąĄ ą┐čĆąĖą╣ą╝ą░čéąĖ ą▒čāą┤čī-čÅą║č¢ čćąĖčüą╗ąŠą▓č¢ ąĘąĮą░č湥ąĮąĮčÅ, čÅą║ ą┐ąŠąĘąĖčéąĖą▓ąĮč¢, čéą░ą║ č¢ ąĮąĄą│ą░čéąĖą▓ąĮč¢ ą▓ ą╝ąĄąČą░čģ ą▓č¢ą┤ -l ą┤ąŠ +l (ą╝č¢ąĮčāčü ą╗č¢č鹥čĆą░ ąĄą╗čī ą┤ąŠ ą┐ą╗čÄčü ą╗č¢č鹥čĆą░ ąĄą╗čī). ąØą░ą┐čĆąĖą║ą╗ą░ą┤, ą┤ą╗čÅ s-ąĄą╗ąĄą║čéčĆąŠąĮą░ l = 0, ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ č¢ ąĘąĮą░č湥ąĮąĮčÅ ą╝ą░ą│ąĮč¢čéąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąŠą│ąŠ čćąĖčüą╗ą░ ą╝ąŠąČąĄ ą▒čāčéąĖ ąŠą┤ąĮąŠ čéč¢ą╗čīą║ąĖ 0. ąöą╗čÅ p-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ l = 1, č鹊ą┤č¢ m = -1, 0, 1 (čéčĆąĖ ąĘąĮą░č湥ąĮąĮčÅ m). ąöą╗čÅ d-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ l = 2, m = -2, -1, 0, 1, 2 (ą┐’čÅčéčī ąĘąĮą░č湥ąĮčī m). ąÆąĘą░ą│ą░ą╗č¢, ą┤ąĄčÅą║ąŠą╝čā ąĘąĮą░č湥ąĮąĮčÄ ąŠčĆą▒č¢čéą░ą╗čīąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąŠą│ąŠ čćąĖčüą╗ą░ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö 2l+1 ąĘąĮą░č湥ąĮčī ą╝ą░ą│ąĮč¢čéąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąŠą│ąŠ čćąĖčüą╗ą░ – č鹊ą▒č鹊 ą╝ąŠąČą╗ąĖą▓ąĖčģ čĆąŠąĘčéą░čłčāą▓ą░ąĮčī ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠą│ąŠ čģą╝ą░čĆąĖ ą▓ ą┐čĆąŠčüč鹊čĆč¢.
ą£ą░ą│ąĮč¢čéąĮąĄ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ m ąŠčéčĆąĖą╝ą░ą╗ąŠ čüą▓ąŠčÄ ąĮą░ąĘą▓čā ą╝ą░ą│ąĮč¢čéąĮąŠą│ąŠ, ąŠčüą║č¢ą╗čīą║ąĖ ą▓č¢ą┤ ą╣ąŠą│ąŠ ąĘąĮą░č湥ąĮąĮčÅ ąĘą░ą╗ąĄąČąĖčéčī ą▓ąĘą░čöą╝ąŠą┤č¢čÅ ą╝ą░ą│ąĮč¢čéąĮąŠą│ąŠ ą┐ąŠą╗čÅ, čüčéą▓ąŠčĆčÄą▓ą░ąĮąŠą│ąŠ ąĄą╗ąĄą║čéčĆąŠąĮąŠą╝, ąĘ ąĘąŠą▓ąĮč¢čłąĮč¢ą╝ ą╝ą░ą│ąĮč¢čéąĮąĖą╝ ą┐ąŠą╗ąĄą╝. ąŻ ą▓č¢ą┤čüčāčéąĮč¢čüčéčī ąĘąŠą▓ąĮč¢čłąĮčīąŠą│ąŠ ą╝ą░ą│ąĮč¢čéąĮąŠą│ąŠ ą┐ąŠą╗čÅ ąĄąĮąĄčĆą│č¢čÅ ąĄą╗ąĄą║čéčĆąŠąĮą░ ą▓ ą░č鹊ą╝č¢ ąĮąĄ ąĘą░ą╗ąĄąČąĖčéčī ą▓č¢ą┤ ąĘąĮą░č湥ąĮąĮčÅ m. ąÆ čåčīąŠą╝čā ą▓ąĖą┐ą░ą┤ą║čā ąĄą╗ąĄą║čéčĆąŠąĮąĖ ąĘ ąŠą┤ąĮą░ą║ąŠą▓ąĖą╝ąĖ ąĘąĮą░č湥ąĮąĮčÅą╝ąĖ n č¢ l, ą░ą╗ąĄ čĆč¢ąĘąĮąĖą╝ąĖ ąĘąĮą░č湥ąĮąĮčÅą╝ąĖ m ą▓ąŠą╗ąŠą┤č¢čÄčéčī ąŠą┤ąĮą░ą║ąŠą▓ąŠčÄ ąĄąĮąĄčĆą│č¢čöčÄ. ą×ą┤ąĮą░ą║ ą┐čĆąĖ ą┤č¢čŚ ąĮą░ ąĄą╗ąĄą║čéčĆąŠąĮ ąĘąŠą▓ąĮč¢čłąĮčīąŠą│ąŠ ą╝ą░ą│ąĮč¢čéąĮąŠą│ąŠ ą┐ąŠą╗čÅ ąĄąĮąĄčĆą│č¢čÅ ąĄą╗ąĄą║čéčĆąŠąĮą░ ą▓ ą░č鹊ą╝č¢ ąĘą╝č¢ąĮčÄčöčéčīčüčÅ, čéą░ą║ čēąŠ čüčéą░ąĮčā ąĄą╗ąĄą║čéčĆąŠąĮą░, čēąŠ čĆąŠąĘčĆč¢ąĘąĮčÅčÄčéčīčüčÅ ąĘąĮą░č湥ąĮąĮčÅą╝ m, čĆąŠąĘčĆč¢ąĘąĮčÅčÄčéčīčüčÅ č¢ ą┐ąŠ ąĄąĮąĄčĆą│č¢čŚ. ą”ąĄ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ č鹊ą╝čā, čēąŠ ąĄąĮąĄčĆą│č¢čÅ ą▓ąĘą░čöą╝ąŠą┤č¢čŚ ą╝ą░ą│ąĮč¢čéąĮąŠą│ąŠ ą┐ąŠą╗čÅ ąĄą╗ąĄą║čéčĆąŠąĮą░ č¢ąĘ ąĘąŠą▓ąĮč¢čłąĮč¢ą╝ ą╝ą░ą│ąĮč¢čéąĮąĖą╝ ą┐ąŠą╗ąĄą╝ ąĘą░ą╗ąĄąČąĖčéčī ą▓č¢ą┤ ą▓ąĄą╗ąĖčćąĖąĮąĖ ą╝ą░ą│ąĮč¢čéąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąŠą│ąŠ čćąĖčüą╗ą░. ąĪą░ą╝ąĄ ąĘ čåčīąŠą│ąŠ ą▓ ą╝ą░ą│ąĮč¢čéąĮąŠą╝čā ą┐ąŠą╗č¢ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ čĆąŠąĘčēąĄą┐ą╗ąĄąĮąĮčÅ ą┤ąĄčÅą║ąĖčģ ą░č鹊ą╝ąĮąĖčģ čüą┐ąĄą║čéčĆą░ą╗čīąĮąĖčģ ą╗č¢ąĮč¢ą╣: ąĘą░ą╝č¢čüčéčī ąŠą┤ąĮč¢čöčŚ ą╗č¢ąĮč¢čŚ ą▓ čüą┐ąĄą║čéčĆč¢ ą░č鹊ą╝ą░ ąĘ’čÅą▓ą╗čÅčÄčéčīčüčÅ ą║č¢ą╗čīą║ą░ (ąĄč乥ą║čé ąŚąĄčöą╝ą░ąĮą░).
ąĪčéą░ąĮ ąĄą╗ąĄą║čéčĆąŠąĮą░ ą▓ ą░č鹊ą╝č¢, čēąŠ čģą░čĆą░ą║č鹥čĆąĖąĘčāčöčéčīčüčÅ ą┐ąĄą▓ąĮąĖą╝ąĖ ąĘąĮą░č湥ąĮąĮčÅą╝ąĖ ą║ą▓ą░ąĮč鹊ą▓ąĖčģ čćąĖčüąĄą╗ n, l, m, č鹊ą▒č鹊 ą┐ąĄą▓ąĮąĖą╝ąĖ čĆąŠąĘą╝č¢čĆą░ą╝ąĖ, č乊čĆą╝ąŠčÄ č¢ ąŠčĆč¢čöąĮčéą░čåč¢čöčÄ ą▓ ą┐čĆąŠčüč鹊čĆč¢ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠą│ąŠ čģą╝ą░čĆąĖ, ąŠčéčĆąĖą╝ą░ą╗ąŠ ąĮą░ąĘą▓čā ą░č鹊ą╝ąĮąŠčŚ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ ąŠčĆą▒č¢čéą░ą╗č¢.
ąĪą┐č¢ąĮ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ (s) – čåąĄ ą▓ą╗ą░čüąĮąĖą╣ ą╝ąŠą╝ąĄąĮčé ą║č¢ą╗čīą║ąŠčüčéč¢ čĆčāčģčā ąĄą╗ąĄą║čéčĆąŠąĮą░. ą”čÄ ą▓ąĄą╗ąĖčćąĖąĮčā, čüą┐čĆąŠčēąĄąĮąŠ ą╝ąŠąČąĮą░ čĆąŠąĘą│ą╗čÅą┤ą░čéąĖ čÅą║ čĆąĄąĘčāą╗čīčéą░čé ąŠą▒ąĄčĆčéą░ąĮąĮčÅ ąĄą╗ąĄą║čéčĆąŠąĮą░ ąĮą░ą▓ą║ąŠą╗ąŠ čüą▓ąŠčöčŚ ąŠčüč¢. ąĪą┐č¢ąĮ ą║ą▓ą░ąĮč鹊ą▓ąĄ čćąĖčüą╗ąŠ ą╝ąŠąČąĄ ą┐čĆąĖą╣ą╝ą░čéąĖ čéč¢ą╗čīą║ąĖ ą┤ą▓ą░ ąĘąĮą░č湥ąĮąĮčÅ: +1/2 č¢ -1/2.
ąæą░ą│ą░č鹊ąĄą╗ąĄą║čéčĆąŠąĮąĮč¢ ą░č鹊ą╝ąĖ. ąÆ ą░č鹊ą╝č¢ ą▓ąŠą┤ąĮčÄ ąĄą╗ąĄą║čéčĆąŠąĮ ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ą▓ čüąĖą╗ąŠą▓ąŠą╝čā ą┐ąŠą╗č¢, čÅą║ąĄ čüčéą▓ąŠčĆčÄčöčéčīčüčÅ čéč¢ą╗čīą║ąĖ čÅą┤čĆąŠą╝. ąŻ ą▒ą░ą│ą░č鹊ąĄą╗ąĄą║čéčĆąŠąĮąĮąĖčģ ą░č鹊ą╝ą░čģ ąĮą░ ą║ąŠąČąĄąĮ ąĄą╗ąĄą║čéčĆąŠąĮ ą┤č¢čö ąĮąĄ čéč¢ą╗čīą║ąĖ čÅą┤čĆąŠ, ą░ą╗ąĄ č¢ ą▓čüč¢ č¢ąĮčłč¢ ąĄą╗ąĄą║čéčĆąŠąĮąĖ. ą¤čĆąĖ čåčīąŠą╝čā ąĄą╗ąĄą║čéčĆąŠąĮąĮč¢ čģą╝ą░čĆąĖ ąŠą║čĆąĄą╝ąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ čÅą║ ą▒ąĖ ąĘą╗ąĖą▓ą░čÄčéčīčüčÅ ą▓ ąŠą┤ąĮčā ąĘą░ą│ą░ą╗čīąĮčā ą▒ą░ą│ą░č鹊ąĄą╗ąĄą║čéčĆąŠąĮąĮčā čģą╝ą░čĆčā. ąŻ ą▒ą░ą│ą░č鹊ąĄą╗ąĄą║čéčĆąŠąĮąĮąĖčģ ą░č鹊ą╝ą░čģ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąĖą╣ čüčéą░ąĮ ąĄą╗ąĄą║čéčĆąŠąĮą░ ąĘą░ą╗ąĄąČąĖčéčī ąĮąĄ čéč¢ą╗čīą║ąĖ ą▓č¢ą┤ ą│ąŠą╗ąŠą▓ąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąŠą│ąŠ čćąĖčüą╗ą░, ą░ą╗ąĄ č¢ ą▓č¢ą┤ ąŠčĆą▒č¢čéą░ą╗čīąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąŠą│ąŠ čćąĖčüą╗ą░. ą”ąĄ ą┐ąŠą▓’čÅąĘą░ąĮąŠ ąĘ čéąĖą╝, čēąŠ ąĄą╗ąĄą║čéčĆąŠąĮ ą▓ ą░č鹊ą╝č¢ ąĮąĄ ą╗ąĖčłąĄ ą┐čĆąĖčéčÅą│čāčöčéčīčüčÅ čÅą┤čĆąŠą╝, ą░ą╗ąĄ č¢ ą▓č¢ą┤čćčāą▓ą░čö ą▓č¢ą┤čłč鹊ą▓čģčāą▓ą░ąĮąĮčÅ ąĘ ą▒ąŠą║čā ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, čĆąŠąĘčéą░čłąŠą▓ą░ąĮąĖčģ ą╝č¢ąČ ą┤ą░ąĮąĖą╝ąĖ ąĄą╗ąĄą║čéčĆąŠąĮąŠą╝ č¢ čÅą┤čĆąŠą╝. ąÆąĮčāčéčĆč¢čłąĮč¢ ąĄą╗ąĄą║čéčĆąŠąĮąĮč¢ čłą░čĆąĖ čāčéą▓ąŠčĆčÄčÄčéčī čÅą║ ą▒ąĖ ąĄą║čĆą░ąĮ čÅą║ąĖą╣ ą┐ąŠčüą╗ą░ą▒ą╗čÅčö ą┐čĆąĖčéčÅą│čāą▓ą░ąĮąĮčÅ ąĄą╗ąĄą║čéčĆąŠąĮą░ ą┤ąŠ čÅą┤čĆą░ – ąĄą║čĆą░ąĮčāčÄčéčī ąĘąŠą▓ąĮč¢čłąĮč¢ą╣ ąĄą╗ąĄą║čéčĆąŠąĮ ą▓č¢ą┤ čÅą┤ąĄčĆąĮąŠą│ąŠ ąĘą░čĆčÅą┤čā. ą¤čĆąĖ čåčīąŠą╝čā ą┤ą╗čÅ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, čēąŠ čĆąŠąĘčĆč¢ąĘąĮčÅčÄčéčīčüčÅ ąĘąĮą░č湥ąĮąĮčÅą╝ ąŠčĆą▒č¢čéą░ą╗čīąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąŠą│ąŠ čćąĖčüą╗ą░, ąĄą║čĆą░ąĮčāą▓ą░ąĮąĮčÅ ą▓ąĖčÅą▓ą╗čÅčöčéčīčüčÅ ąĮąĄ ąŠą┤ąĮą░ą║ąŠą▓ąĖą╝. ąÆ čĆąĄąĘčāą╗čīčéą░čéč¢, ąĄąĮąĄčĆą│č¢čÅ ąĄą╗ąĄą║čéčĆąŠąĮą░ ą▓ ąĮąĄąĘą▒čāą┤ąČąĄąĮąŠą╝čā ą░č鹊ą╝č¢, čÅą║ąĖą╣ ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ąĮą░ ą▒č¢ą╗čīčł ą▓ąĖčüąŠą║ąŠą╝čā ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą╝čā čĆč¢ą▓ąĮč¢, ą░ą╗ąĄ ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ąĮą░ s-ąŠčĆą▒č¢čéą░ą╗č¢, ą▓ąĖčÅą▓ą╗čÅčöčéčīčüčÅ ąĮąĖąČč湥 ąĄąĮąĄčĆą│č¢čŚ ąĄą╗ąĄą║čéčĆąŠąĮą░ čĆč¢ą▓ąĮąĄą╝ ąĮąĖąČč湥, ą░ą╗ąĄ čÅą║ąĖą╣ ą┐ąĄčĆąĄą▒čāą▓ą░čö ąĮą░ d-ąŠčĆą▒č¢čéą░ą╗č¢. ą”čÄ ąŠčüąŠą▒ą╗ąĖą▓č¢čüčéčī ąŠą┐ąĖčüčāčö ą┐čĆą░ą▓ąĖą╗ąŠ ąÜą╗ąĄčćą║ąŠą▓čüčīą║ąŠą│ąŠ (ą┐čĆą░ą▓ąĖą╗ąŠ ą£ą░ą┤ąĄą╗čāąĮą│ą░):
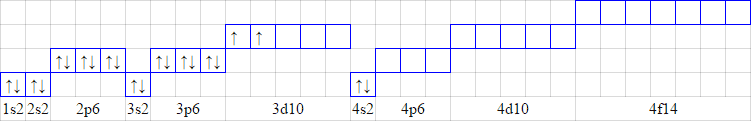
ąŚą░ą┐ąŠą▓ąĮąĄąĮąĮčÅ ąĄą╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą▓ ą┐ąŠčĆčÅą┤ą║čā ąĘčĆąŠčüčéą░ąĮąĮčÅ čüčāą╝ąĖ ą│ąŠą╗ąŠą▓ąĮąŠą│ąŠ čéą░ ąŠčĆą▒č¢čéą░ą╗čīąĮąŠą│ąŠ ą║ą▓ą░ąĮč鹊ą▓ąĖčģ čćąĖčüąĄą╗ n + l ą¤čĆąĖ ąŠą┤ąĮą░ą║ąŠą▓č¢ą╣ čüčāą╝č¢ ąĘą░ą┐ąŠą▓ąĮčÄčöčéčīčüčÅ ąŠčĆą▒č¢čéą░ą╗čī ąĘ ą╝ąĄąĮčłąĖą╝ ąĘąĮą░č湥ąĮąĮčÅą╝ n (1s2s2p3s3p4s3d4p5s).
ąŚą░ą┐ąŠą▓ąĮąĄąĮąĮčÅ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ąĄą╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ ą▓ ą╝ąĄąČą░čģ ą┐ąĄą▓ąĮąŠą│ąŠ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ ą┐č¢ą┤čĆč¢ą▓ąĮčÅ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą┤ąŠ ą┐čĆą░ą▓ąĖą╗ą░ ąż. ąźčāąĮą┤ą░ (ąĮąĄą╝. 1927 čĆ.):
ąÉč鹊ą╝ąĮč¢ ąŠčĆą▒č¢čéą░ą╗č¢, čÅą║č¢ ąĮą░ą╗ąĄąČą░čéčī ą┤ąŠ ąŠą┤ąĮąŠą│ąŠ ą┐č¢ą┤čĆč¢ą▓ąĮčÅ, ąĘą░ą┐ąŠą▓ąĮčÄčÄčéčīčüčÅ čüą┐ąŠčćą░čéą║čā ąĄą╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ ąĘ ąŠą┤ąĮą░ą║ąŠą▓ąĖą╝ čüą┐č¢ąĮąŠą▓ąĖą╝ čćąĖčüą╗ąŠą╝, ą░ ą┐ąŠčéč¢ą╝ ąĄą╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ ąĘ ą┐čĆąŠčéąĖą╗ąĄąČąĮąĖą╝ čüą┐č¢ąĮąŠą▓ąĖą╝ čćąĖčüą╗ąŠą╝.
ąÉč鹊ą╝ ą╝ą░čö ąŠčüčéą░ąĮąĮč¢ą╣ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąĖą╣ čĆč¢ą▓ąĄąĮčī, ąĮą░ čÅą║ąŠą╝čā ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ąĘąŠą▓ąĮč¢čłąĮč¢ ąĄą╗ąĄą║čéčĆąŠąĮąĖ. ąØą░ ąŠčüčéą░ąĮąĮčīąŠą╝čā ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą╝čā čĆč¢ą▓ąĮč¢ ą░č鹊ą╝ą░ ąĮąĄ ą╝ąŠąČąĄ ą▒čāčéąĖ ą▒č¢ą╗čīčłąĄ ą▓ąŠčüčīą╝ąĖ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓.
ą¤čĆąĖą║ą╗ą░ą┤:
ąĢą╗ąĄą║čéčĆąŠąĮąĮą░ č乊čĆą╝čāą╗ą░: 22Ti=1s22s22p63s23p64s23d2
ąĪčģąĄą╝ą░ čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓: 22Ti