Зміст (швидка навігація):
Алкани (насичені карбогідрогени, парафіни) CnH2n+2 – це сполуки карбону з гідрогеном, в молекулах яких, кожен атом карбону, з будь-яким сусіднім атомом карбону утворює тільки один хімічний зв’язок, валентності атома карбону невитрачені на хімічний зв’язок з іншими атомами карбону, утворюють хімічний зв’язок з атомами гідрогену.
Назва парафіни походить від латинського parum – мало, affinis – має спорідненість, що вказує на хімічну інертність алканів.
Алкани в природі
Алкани – головна складова частина нафти і природного газу. Деякі рослини синтезують алкани (восковий наліт на листках деяких рослин містить алкани).
Ізомерія алканів. Номенклатура алканів.
Розташування атомів в молекулах алканів (і представників інших класів органічних сполук) передається декількома видами хімічних формул:
- сумарна хімічна формула (емпірична хімічна формула), наприклад CH4, C6H14, C21H44. Сумарні формули не передають інформацію про структурну будову молекули;
- повна структурна хімічна формула – показує всі хімічні зв’язки між атомами в молекулі і структурні розгалуження. Така форма запису є громіздкою і в більшості випадків незручна
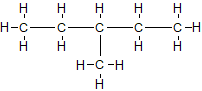
- неповна структурна формула – показує хімічні зв’язки і / або основний карбоновий скелет (основні функціональні групи, в разі сполук інших класів), хімічні зв’язки з атомами гідрогену приховані (нижнім індексом вказують кількість атомів гідрогену, або кількість повторюваних груп в дужках). Наприклад, CH3-CH2-CH2-CH2-CH2-CH3, або CH3CH2CH2CH2CH2CH3, або CH3-(CH2)4-CH3, в разі структурних ізомерів, відгалуження вказують в дужках CH3-CH2-CH(CH3)-CH2-CH3. Подібний текстовий запис хімічної формули дозволяє зрозуміти структуру молекули

- скорочена структурна формула – записується у вигляді хімічних зв’язків між атомами карбону з’єднаних під деяким кутом; такий запис вказує, що в вузлах з’єднання хімічних зв’язків знаходиться атом карбону, а не показані хімічні зв’язки з атомами гідрогену, за замовчуванням, зайняті хімічними зв’язками з атомами гідрогену. У скорочених структурних формулах вказують функціональні групи і їх атоми, крім атомів карбону і атомів гідрогену. Це найбільш компактний, графічний спосіб запису структурних формул
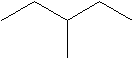
Ізомерія алканів.
Карбогідрогени CH4, C2H6, C3H8 не мають ізомерів. Для алканів характерна структурна ізомерія (ізомерія карбонового ланцюга). Число ізомерів для алкана з відомою кількістю атомів карбону обчислити не можна, але можна обчислити кількість ізомерів, якщо відома кількість ізомерів для попереднього члена гомологічного ряду.
Номенклатура алканів.
В основі номенклатури органічних сполук знаходиться гомологічний ряд алканів:
|
Формула |
Назва |
t пл. *С |
t кип. *С |
|
CH4 |
Метан |
-182,5 |
-161,6 |
|
C2H6 |
Этан |
-183,3 |
-88,6 |
|
C3H8 |
Пропан |
-187,1 |
-42,2 |
|
C4H10 |
Бутан |
-138,3 |
-0,5 |
|
C5H12 |
Пентан |
-129,7 |
+36,0 |
|
C6H14 |
Гексан |
-94,3 |
+68,7 |
|
C7H16 |
Гептан |
-90,5 |
+98,4 |
|
C8H18 |
Октан |
-56,8 |
+125,7 |
|
C9H20 |
Нонан |
-53,7 |
+150,7 |
|
C10H22 |
Декан |
-29,7 |
+174,0 |
|
C11H24 |
Ундекан |
-25,6 |
+195,9 |
|
C12H26 |
Додекан |
-9,6 |
+216,3 |
|
C13H28 |
Тридекан |
-5,4 |
+235,4 |
|
C14H30 |
Тетрадекан |
+5,863 |
+253,52 |
|
C15H32 |
Пентадекан |
+10,0 |
+270 |
|
C16H34 |
Гексадекан |
+18,2 |
+287 |
|
C17H36 |
Гептадекан |
+22,5 |
+303 |
|
C18H38 |
Октадекан |
+27,0 |
+317 |
|
C19H40 |
Нонадекан |
+31,8 |
+330 |
|
C20H42 |
Эйкозан |
+36,4 |
+345 |
Назва радикала формується шляхом заміни суфікса -ан (в назві алкана) на суфікс -іл або -ил. Наприклад: метан – метил, пентан – пентил, декан – децил, ейкозан – ейкозил, і т.д.
- Нумерацію атомів карбону головного ланцюга завжди починають з того кінця, до якого ближче розташований один або кілька замісників.
- При розміщенні різних замісників на однаковій відстані з обох кінців головною карбонового ланцюга – нумерацію проводять з того кінця, до якого ближче розташований замісник, назва якого за алфавітом раніше.
- При встановленні алфавітного порядку замісників, множинні приставки не враховуються (-етил вживається раніше за -диметил).
Приклади
3-метилгексан
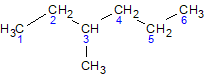
2,3,4-триметилгексан
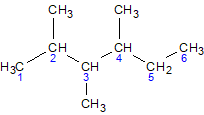
2,3,5-триметилгексан
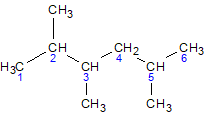
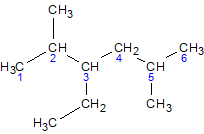
3-етил-2,5-диметилгексан
Способи отримання алканів
1. Алкани з невеликим числом атомів карбону (до 11 включно) можна виділити фракційною перегонкою природного газу або бензинової фракції нафти, або сумішей вуглеводнів, одержуваних гідруванням вугілля, а також гідруванням карбон(II) оксиду і карбон(IV) оксиду.
2. Алкани, починаючи від пентану, отримують каталітичним гідруванням етенових або більш ненасичених карбогідрогенів з тим самим числом атомів карбону і такою самою будовою карбонового ланцюга (в квадратних дужках вказують каталізатор):

3. Алкани одержують відновленням галогенопохідних каталітично активованим, атомарним гідрогеном:
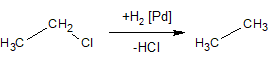
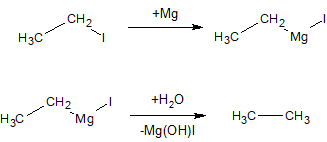
З галогенопохідних алканів можна отримати магнійорганічні сполуки і потім діяти на них водою:
4. Синтез алканів зі сполук з меншим числом атомів карбону в ланцюзі здійснюється дією натрію на галогенопохідні (реакція Вюрца):
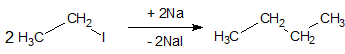
Особливістю реакції Вюрца є те, що в разі використання в якості вихідних речовин різних галогеналкілів в результаті реакції утворюється суміш трьох можливих карбогідрогенів:

Отриману суміш алканів необхідно розділяти.
Реакція Вюрца йде з хорошими виходами продуктів тільки в разі використання первинних галогенопохідних. Використання вторинних і третинних галогенопохідних дає вихід продукту всього в кілька відсотків. Основний побічний процес в реакції Вюрца – відщеплення гідрогенгалогенідів від вихідних галогенопохідних під впливом карбаніонів натрійорганічних сполук з утворенням олефінів. Замість натрію в реакції Вюрца можна використовувати і інші метали, наприклад літій, магній, цинк.
5. Отримання алканів з використанням літійорганічних сполук і солей купруму (реакція Корі-Хауса). При обробці розчину алкілгалогенідів в ефірі металевим літієм отримують літійорганічні сполуки, які потім при дії солі купруму перетворюються в літійалкілкупрати. На літійалкілкупрати діють алкілгалогенідами:

В разі первинних алкілгалогенідів вихід алканів типу R-R’ близький до 100%, в разі третинних – 30-50%.
6. Алкани можна одержати електролізом солей карбонових кислот: аніони кислот розпадаються на аноді з утворенням вільних радикалів, які об’єднуються в молекули більш складних насичених карбогідрогенів (реакція Кольбе):
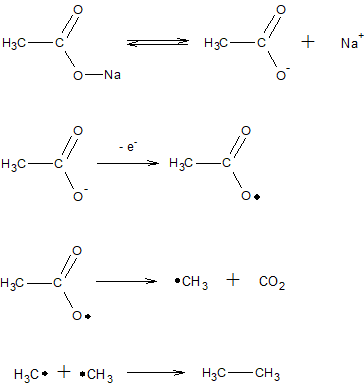
7. Алкани отримують каталітичним гідруванням вугілля, смоли, і нафтових фракцій, із застосуванням каталізаторів WS2, MoS2 при температурі 300-500*С і тиску 10-20 МПа – процес Бергіуса.
8. Низькотемпературним гідруванням буровугільної смоли, із застосуванням каталізаторів NiS/WS2/Al2O3 при температурі 280-380*С, і тиску 30 МПа.
9. Каталітичне гідрування карбон монооксиду (синтез Фішера-Тропша):

Синтез Фішера-Тропша проводять при температурі 160-200*С і нормальному (атмосферному) тиску. Продукт містить близько 15% пропану і бутану, 50% бензину, 28% гасу (керосину), 6% м’яких парафінів і 2% церезинів, з іншими каталізаторами і при високому тиску утворюються олефіни.
Фізичні властивості алканів
Температури плавлення і температури кипіння алканів наведені в таблиці. Температури кипіння в гомологічної ряду алканів зростають, причому різниця температур кипіння найближчих гомологів зменшується. Ізомери із нормальною, (нерозгалуженою) будовою карбонового ланцюга, киплять при більш високій температурі, ніж з алкани з розгалуженим ланцюгом. Це пояснюється меншою взаємодією між молекулами з розгалуженим ланцюгом в рідкому стані – відгалуження від головного ланцюга створюють просторові перешкоди для зближення молекул. Алкани з розгалуженим ланцюгом мають меншу схильність до комплексоутворення, наприклад з карбамідом, тіокарбамідом, цеолітами, деякими солями металів і ін.
Температури плавлення в гомологічної ряду алканів повільно зростають. При цьому алкани утворюють два ряди гомологів – парні і непарні. Температури плавлення парних гомологів зазвичай вище, ніж аналогічно побудованих непарних. Пояснюється це явище відмінністю в розташуванні крайніх метильних груп в молекулі; у алканів з парним числом атомів карбону, крайні метильні групи розташовані по різні боки, у алканів з непарним числом атомів карбону крайні метильні групи розташовані по одну сторону. В ряді випадків ізомери з розгалуженою структурою мають більш високі температури плавлення.
Щільність алканів спочатку швидко, а потім повільно зростає до 0,78 г./см3.
Алкани є неполярними речовинами, і важко поляризуються, тому вони практично нерозчинні в полярних розчинниках (вода, етиловий спирт, ацетон). Алкани розчинні в неполярних розчинниках (бензин, гас і т.п.).
Хімічні властивості алканів
Алкани – відносно інертні сполуки. Хімічні перетворення алканів можуть відбуватися або за рахунок відриву атомів гідрогену (зазвичай гомолітичного відриву) з подальшим заміщенням їх іншими атомами або групами. Тому для алканів характерні реакції розщеплення і заміщення.
Галогенування алканів. Швидкість галогенування алканів різко знижується в ряду: F > Cl > Br > I; з вільним флуором галогенування йде з вибухом (для проведення реакції флуорування алканів, флуор розбавляють азотом), можливим є вибух і в реакції з хлором
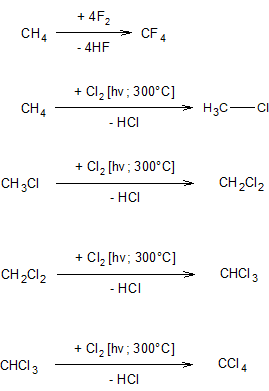
При хлоруванні найбільш легко заміщується гідрогену у найменш гідрогенізованого (третинного) атома карбону.
При каталітичному хлоруванні застосовують такі каталізатори як: сірка, йод, хлориди супруму, стибію, стануму, алюмінію і ін. металів. Процес хлорування в присутності каталізаторів, наприклад хлоридів деяких металів, може мати ланцюговий іонний механізм:
Cl : Cl + AlCl3 → AlCl4– + Cl+
Cl+ + H : CH3 → CH3+ + HCl
CH3+ + Cl : Cl → Cl : CH3 + Cl+ …
Фотохімічне хлорування алканів проходить за радикальним механізмом (SN):
зародження ланцюга під дією свілта або нагрівання
Cl2 → Cl• + •Cl
розвиток ланцюга
H3C-H + •Cl → H3C• + HCl
H3C• + Cl2 → H3C-Cl + •Cl …
обрив ланцюга
H3C• + •Cl → H3C-Cl
H3C• + •CH3 → H3C-CH3
Cl• + •Cl → Cl2
Сульфохлорування алканів. Сульфоокиснення алканів. При звичайній температурі сульфатна кислота на алкани не діє. Однак алкани легко реагують з “супер-кислотами”, наприклад сумішшю SbF5 і FSO3H, з виділенням водню і утворенням карбонієвих іонів. При нагріванні сульфатна кислота діє на алкани як окиснювач. Концентрована сульфатна кислота з вищими алканами утворює сульфокислоти:
R-H + H2SO4 → R-SO3H + H2O
Алкани беруть участь в реакції сульфохлорування, з утворенням алкансульфохлоридів
R-H + SO2 + Cl2 → R-SO2-Cl + HCl
і реакції сульфоокиснення, з утворенням алкансульфокислот
R-H + 2SO2 + O2 + H2O → R-SO2OH + H2SO4
Реакції сульфохлорування і сульфоокиснення йдуть на світлі або в присутності каталізаторів (органічні пероксиди) за ланцюговим радикальним механізмом:
Cl2 → 2Cl•
R-H + Cl• → R• + HCl
R• + SO2 → R-SO2•
R-SO2• + Cl2 → R-SO2-Cl + Cl• …
Реакція сульфохлорування алканів вперше була використана в Німеччині (1939 – 1940) для отримання замінників мила.
Утворені при сульфохлоруванні карбогідрогенових фракцій суміші хлорангідридів сульфокислот, під дією соди або силікатів перетворюються в солі сульфокислот, які застосовують як пральні порошки:
R-SO2-Cl + 2NaOH → R-SO2-ONa + NaCl + H2O
Сульфоокиснення економічно більш вигідне, ніж сульфохлорування, тому що не витрачається хлор.
Нітрування алканів. Атоми гідрогену в алканах можуть бути заміщені нітрогрупою -NO2 (реакція нітрування):
R-H + HO-NO2 → R-NO2 + H2O
Нітрування алканів здійснюється тільки розведеною нітратною кислотою при нагріванні (М.І. Коновалов, 1888). Концентрована нітратна кислота або суміш концентрованої нітратної кислоти і концентрованої сульфатної кислоти окиснюють алкани.
Найкращі результати реакції рідкофазного нітрування отримують нітруванням алканів які містять в своєму складі третинні атоми карбону.
В промисловості застосовують парофазне нітрування, яке проводять парами нітратної кислоти при 250-500*С. Вибір температури процесу залежить від довжини ланцюга і будови карбогідрогенів.
Побічними продуктами реакції нітрування можуть бути спирти, альдегіди, кетони, кислоти, ненасичені карбогідрогени.
Реакцію нітрування можна проводити нітроген оксидами (П.П. Шоригін).
Реакція нітрування алканів – радикальний процес:
R-H + •NO2 → R• + HNO2
HNO2 + HNO3 → N2O4 + H2O
N2O4 ⇄ 2NO2
взаємодія радикалів, що виникають на перших стадіях, дає нітросполуки і етери нітритної кислоти:
R• + •NO2 → R-NO2
R• + •NO2 → R-O-NO
Окиснення алканів. Кисень повітря і звичайні окиснювачі (KMnO4, K2CrO4, K2Cr2O7 і ін.) Окиснюють алкани тільки при високих температурах з розривом карбонового ланцюга і утворенням переважно кислот. При цьому, в значних кількостях утворюється карбон діоксид.
В разі нижчих алканів окиснення проходить складно і неконтрольовано, що обмежує окиснення нижчих алканів в промислових масштабах. Однак в промислових масштабах отримують оцтову кислоту шляхом окиснення бутану.
Окиснення вищих парафінів проводять при температурі близько 150*С в присутності каталізаторів (наприклад сполук мангану). При цьому виходить суміш кислот з різною довжиною ланцюга, оксикислоти, кетокислоти, естери, спирти, кетони та ін. сполуки.
При окисненні алканів, як проміжні продукти утворюються органічні гідропероксиди:
R• + O-O → R-O-O• + R-H → R-O-O-H + R•
Перша стадія розпаду будь-якого пероксиду – це розрив по зв’язку O-O. Утворюються вільних оксигенові радикали, які або відривають атоми гідрогену від присутніх в системі гідрогенвмісних частинок і утворюють спирти, або розпадаються по β-зв’язку і утворюють альдегіди або кетони.
Третинні гідропероксиди, завдяки високій стійкості, в певних умовах можуть бути і кінцевими продуктами окиснення. Третинні гідропероксиди розщеплюються з утворенням спиртів або кетонів за схемою:

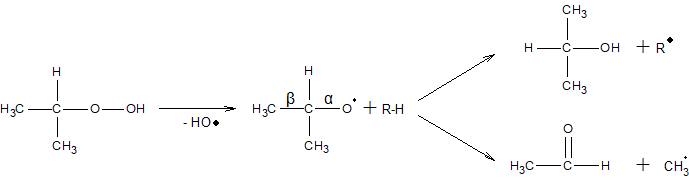
Напрямок розпаду гідропероксидів вторинних алкілів залежить від умов. При низьких температурах вони дають переважно кетони і спирти за схемою
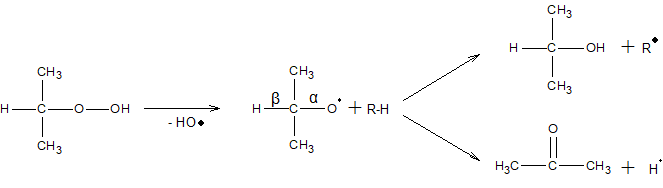
При високих температурах утворюються переважно альдегіди і спирти
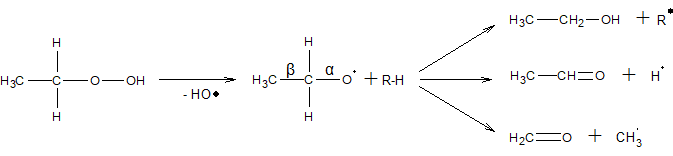
Гідропероксиди первинних алканів в цих умовах розкладаються так само
Крекінг карбогідрогенів за високих температур. При температурах вище 1000*С всі алкани розпадаються на вуглець і водень. Цей процес використовується як дешевий метод отримання водню і газової сажі. За певних умов вдається ізолювати проміжні продукти розщеплення, зокрема етін (крекінг метану з утворенням етіну).
Початкова температура розпаду алканів залежить від їх молекулярної маси і будови.
При 300-700*С алкани розпадаються з утворенням складної суміші насичених, ненасичених і ароматичних карбогідрогенів. Чим вища температура і більша глибина перетворення, тим менше склад цієї суміші залежить від природи вихідного карбогідрогену.
Основні хімічні процеси при крекінгу – дегідрогенізація карбогідрогену і розрив карбонового ланцюга. Одночасно відбуваються ізомеризація і циклізація. Проміжними продуктами в усіх цих процесах є вільні аліфатичні радикали.
Радикал – це група атомів, що має неспарений електрон “•”, зазвичай існує частку секунди.
Вільні радикали відомі з 1900 року. Вільні аліфатичні радикали були виявлені в 1929 році (досліди Панета – крекінг плюмбум(II) тетраетилу).
Хімічні перетворення вільних радикалів.
1. Захоплення атома гідрогену з перетворенням в карбогідрогени (хімічні реакції розглянуті вище).
2. Розпад вільних радикалів
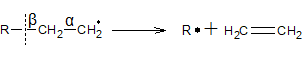
3. Диспропорціонування радикалів

4. З’єднання радикалів

Розпад вільних радикалів завжди йде по β-зв’язку (другий зв’язок після зв’язку з атомом, який містить вільний електрон). Це пояснюється тим, що β-зв’язок є розпушуючим, через взаємодію його електронів з вільним електроном. Для більшості радикалів при розпаді характерне утворення ненасиченого карбогідрогену з залишків з великим числом атомів карбону.
Введенням в зону реакції каталізаторів можна істотно змінити напрямок крекінгу. Наприклад, на деяких каталізаторах вдається з хорошими виходами отримувати з насичених карбогідрогенів олефіни і діолефіни – дегідрогенізація. В присутності алюміній хлориду переважно протікають процеси ізомеризації. На платині і деяких інших каталізаторах успішно здійснюються процеси ароматизації – утворення ароматичних карбогідрогенів.
Застосування алканів
Цінними технічними продуктами є газоподібні нижчі члени гомологічного ряду алканів.
Метан CH4 – найважливіший компонент природного газу, рудникового газу (утворюється в кам’яновугільних пластах) і болотного газу (виділяється при бактеріальному гнитті целюлози). Вміст метану в напівкоксовому газі, що отримується з бурого вугілля, становить від 10 до 25% (об.), в світильному газі близько 25%. Межі вибуховості в суміші з O2 6-12% CH4.
Метан застосовують як паливо і як вихідну речовину для нафтохімічних процесів. З метану отримують такі важливі продукти, як ацетилен, гідроген ціанід, хлорпохідні метану (розчинники, продукти у виробництві силіконів), карбон дисульфід і карбон флуориди (холодоагенти, мономери в виробництві термостійких пластмас).
Етан C2H6 – складова частина нафтових попутних газів; застосовують в основному для отримання етилену.
Пропан C3H8 отримують в нафтохімічних процесах (піроліз) і в процесі Бергіуса. Застосовують як горючий газ (пропан-бутанові суміші). Рідкий пропан транспортують в сталевих цистернах при 20*С під тиском 0,8 МПа (критичні температура і тиск пропану дорівнюють 96,81*С і 4,3 МПа).
Рідкі алкани (гомологи, рідкі при кімнатній температурі) – складова частина нафти і буровугільної смоли.
Тверді алкани (парафіни у вузькому сенсі) містяться в нафті. Гірський віск, або озокерит (в очищеному вигляді – церезин), є сумішшю твердих парафінів. Застосовують для виготовлення свічок, для просочення паперу і картону, як ізолюючий матеріал. Отримані штучно вуглеводні C10-C30 переробляють в мила, миючі засоби і пластифікатори.










