ąÉą╗ą║ąĄąĮąĖ (ąŠą╗ąĄčäč¢ąĮąĖ, ąĄčéąĖą╗ąĄąĮąŠą▓č¢ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ) CnH2n – čåąĄ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ, ą▓ ą╝ąŠą╗ąĄą║čāą╗č¢ čÅą║ąĖčģ ą╝č¢čüčéčÅčéčīčüčÅ ą░č鹊ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā, čēąŠ čāčéą▓ąŠčĆčÄčÄčéčī ąĘ čüčāčüč¢ą┤ąĮč¢ą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā ą┐ąŠą┤ą▓č¢ą╣ąĮč¢ čģč¢ą╝č¢čćąĮč¢ ąĘą▓’čÅąĘą║ąĖ (-C=C-).
ąĀąŠą┤ąŠąĮą░čćą░ą╗čīąĮąĖą║ąŠą╝ ą░ą╗ą║ąĄąĮč¢ą▓ čö ąĄč鹥ąĮ H2C=CH2.
ąÉą╗ą║ąĄąĮąĖ ą▓ ą┐čĆąĖčĆąŠą┤č¢ ąĘčāčüčéčĆč¢čćą░čÄčéčīčüčÅ ą▓ ą┤ąĄčÅą║ąĖčģ čĆąŠčüą╗ąĖąĮą░čģ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ąĄčéąĖą╗ąĄąĮ – čö čĆąŠčüą╗ąĖąĮąĮąĖą╝ ą│ąŠčĆą╝ąŠąĮąŠą╝. ą£čāčüą║ą░ą╗čāčĆ ą░ą▒ąŠ čåąĖčü-čéčĆąĖą║ąŠąĘąĄąĮ-9 – ą│ąŠčĆą╝ąŠąĮ ą╝čāčģąĖ. ąÉą╗ą║ąĄąĮąĖ ą▓čģąŠą┤čÅčéčī ą┤ąŠ čüą║ą╗ą░ą┤čā ąĮą░čäčéąĖ. ąÆ čćąĖčüč鹊ą╝čā ą▓ąĖą│ą╗čÅą┤č¢ ąĘ ąĮą░čäčéąĖ ą▓ąĖą┤č¢ą╗ąĄąĮč¢ ą░ą╗ą║ąĄąĮąĖ ą▓č¢ą┤ C6H12 ą┤ąŠ C13H26.
ąåąĘąŠą╝ąĄčĆč¢čÅ ą░ą╗ą║ąĄąĮč¢ą▓ ą┐ąŠčćąĖąĮą░čöčéčīčüčÅ ąĘ C4 čćą╗ąĄąĮą░ ą│ąŠą╝ąŠą╗ąŠą│č¢čćąĮąŠą│ąŠ čĆčÅą┤čā – ą▒čāč鹥ąĮą░. ą¤ąŠčĆčÅą┤ ąĘ č¢ąĘąŠą╝ąĄčĆč¢čöčÄ ą║ą░čĆą▒ąŠąĮąŠą▓ąŠą│ąŠ čüą║ąĄą╗ąĄčéą░ ą▓ čĆčÅą┤čā ą░ą╗ą║ąĄąĮč¢ą▓ čüą┐ąŠčüč鹥čĆč¢ą│ą░čöčéčīčüčÅ čüčéčĆčāą║čéčāčĆąĮą░ č¢ąĘąŠą╝ąĄčĆč¢čÅ ąĘčāą╝ąŠą▓ą╗ąĄąĮą░ ŌĆŗŌĆŗą┐ąŠą╗ąŠąČąĄąĮąĮčÅą╝ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā ą▓ ą║ą░čĆą▒ąŠąĮąŠą▓ąŠą╝čā ą╗ą░ąĮčåčÄąĘč¢; ą░ čéą░ą║ąŠąČ ą┐čĆąŠčüč鹊čĆąŠą▓ą░ (ą│ąĄąŠą╝ąĄčéčĆąĖčćąĮą░) č¢ąĘąŠą╝ąĄčĆč¢čÅ – čåąĖčü-čéčĆą░ąĮčü-č¢ąĘąŠą╝ąĄčĆč¢čÅ.
ąØąŠą╝ąĄąĮą║ą╗ą░čéčāčĆą░ ą░ą╗ą║ąĄąĮąŠą▓. ąØą░ąĘą▓ąĖ ą░ą╗ą║ąĄąĮč¢ą▓ čāčéą▓ąŠčĆčÄčÄčéčī ąĘ ąĮą░ąĘą▓ ą░ąĮą░ą╗ąŠą│č¢čćąĮąŠ ą┐ąŠą▒čāą┤ąŠą▓ą░ąĮąĖčģ ą░ą╗ą║ą░ąĮč¢ą▓, ąĘą░ą╝č¢ąĮčÄčÄčćąĖ čüčāčäč¢ą║čüąĖ -ą░ąĮ- ąĮą░ -ąĄąĮ-; čåąĖčäčĆąŠčÄ ą┐ąŠą║ą░ąĘčāčÄčéčī ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā (ą┐č¢čüą╗čÅ čÅą║ąŠą│ąŠ ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮčā ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║). ąŚą░ ą│ąŠą╗ąŠą▓ąĮąĖą╣ ą║ą░čĆą▒ąŠąĮąŠą▓ąĖą╣ ą╗ą░ąĮčåčÄą│ ą┐čĆąĖą╣ą╝ą░čÄčéčī ąĮą░ą╣ą┤ąŠą▓čłąĖą╣ ą╗ą░ąĮčåčÄą│, čēąŠ ą╝č¢čüčéąĖčéčī ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║. ąØčāą╝ąĄčĆą░čåč¢čÄ ą░č鹊ą╝č¢ą▓ ą║ą░čĆą▒ąŠąĮčā ą┐ąŠčćąĖąĮą░čÄčéčī ąĘ č鹊ą│ąŠ ą║č¢ąĮčåčÅ ą╗ą░ąĮčåčÄą│ą░, ą┤ąŠ čÅą║ąŠą│ąŠ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║ čĆąŠąĘčéą░čłąŠą▓ą░ąĮąĖą╣ ą▒ą╗ąĖąČč湥.
ą¤čĆąĖą║ą╗ą░ą┤ąĖ
4-ą╝ąĄčéąĖą╗ą┐ąĄąĮčé-2-ąĄąĮ
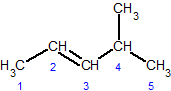
čéčĆą░ąĮčü-3,4-ą┤ąĖą╝ąĄčéąĖą╗ą│ąĄą║čü-3-ąĄąĮ
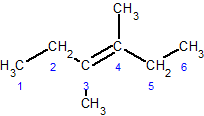
čåąĖčü-3,4-ą┤ąĖą╝ąĄčéąĖą╗ą│ąĄą║čü-3-ąĄąĮ
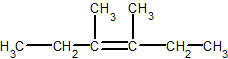
4-ąĄčéąĖą╗-4-ą╝ąĄčéąĖą╗ą│ąĄą║čü-1-ąĄąĮ
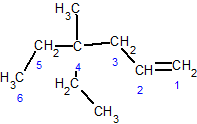
3-ąĄčéąĖą╗-2,2,6-čéčĆąĖą╝ąĄčéąĖą╗ąŠą║čé-4-ąĄąĮ
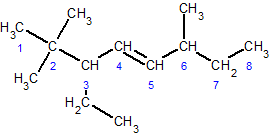
ąĪą┐ąŠčüąŠą▒ąĖ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓
1. ą¤ąĄčĆčłč¢ č湊čéąĖčĆąĖ čćą╗ąĄąĮąĖ čĆčÅą┤čā ą░ą╗ą║ąĄąĮč¢ą▓ ąŠčéčĆąĖą╝čāčÄčéčī ą▓ č鹥čģąĮč¢čåč¢ ą▓ čćąĖčüč鹊ą╝čā čüčéą░ąĮč¢ čĆąŠąĘą│ąŠąĮą║ąŠą╣ ą┐č¢ą┤ čéąĖčüą║ąŠą╝ ą░ą▒ąŠ ą┐čĆąĖ ąĮąĖąĘčīą║č¢ą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆč¢ ą│ą░ąĘąŠą┐ąŠą┤č¢ą▒ąĮąŠčŚ čćą░čüčéąĖąĮąĖ ą┐čĆąŠą┤čāą║čéč¢ą▓ ą║čĆąĄą║č¢ąĮą│čā ąĮą░čäč鹊ą▓ąĖčģ ą┤ąĖčüčéąĖą╗čÅčéč¢ą▓, ą│ą░ąĘč¢ą▓ ą║ąŠą║čüčāą▓ą░ąĮąĮčÅ (ąĄč鹥ąĮ, ą┐čĆąŠą┐ąĄąĮ).
2. ąöąĄą│č¢ą┤čĆąŠą│ąĄąĮč¢ąĘą░čåč¢čÅ ą░ą╗ą║ą░ąĮč¢ą▓ č¢ąĘ ąĘą░čüč鹊čüčāą▓ą░ąĮąĮčÅą╝ čüą┐ąĄčåč¢ą░ą╗čīąĮąĖą╝ čćąĖąĮąŠą╝ ą┐č¢ą┤ą│ąŠč鹊ą▓ą╗ąĄąĮąŠą│ąŠ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆą░ Cr2O3, ą┐čĆąĖ 300*ąĪ:
2H3C-CH2-CH2-CH3 ŌåÆ CH2=CH-CH2-CH3 + H3C-CH=CH-CH3 + 2H2
3. ąöąĄą│č¢ą┤čĆą░čéą░čåč¢čÅ (ą▓č¢ą┤čēąĄą┐ą╗ąĄąĮąĮčÅ ą▓ąŠą┤ąĖ) čüą┐ąĖčĆčéč¢ą▓ č¢ąĘ ąĘą░čüč鹊čüčāą▓ą░ąĮąĮčÅą╝ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆą░ (čĆč¢ąĘąĮč¢ ą║ąĖčüą╗ąŠčéąĖ – čüčāą╗čīčäą░čéąĮą░, č乊čüčäą░čéąĮą░, ą║ąĖčüą╗č¢ čüąŠą╗č¢ KHSO4, č乊čüč乊čĆ(V) ąŠą║čüąĖą┤, Al2O3 č¢ čüąŠą╗č¢ ą░ą╗čÄą╝č¢ąĮč¢čÄ):
H-CH2-CH2–OH ŌåÆ H2C=CH2 + H2O
ąŻą╝ąŠą▓ąĖ ą┤ąĄą│č¢ą┤čĆą░čéą░čåč¢čŚ ąĘą░ą╗ąĄąČą░čéčī ą▓č¢ą┤ ą┐čĆąĖčĆąŠą┤ąĖ čüą┐ąĖčĆčéčā. ąØą░ą╣ą╗ąĄą│čłąĄ ą▓č¢ą┤čēąĄą┐ą╗čÄčÄčéčī ą▓ąŠą┤čā čéčĆąĄčéąĖąĮąĮč¢ čüą┐ąĖčĆčéąĖ (čćą░čüč鹊, ą▓ąČąĄ ą┐čĆąĖ ą┐ąĄčĆąĄą│ąŠąĮčåč¢).
ą¤ąŠčĆčÅą┤ąŠą║ ą▓č¢ą┤čēąĄą┐ą╗ąĄąĮąĮčÅ ą▓ąŠą┤ąĖ ą▓č¢ą┤ čüą┐ąĖčĆčéč¢ą▓ (ą▓ ą▒č¢ą╗čīčłąŠčüčéč¢ ą▓ąĖą┐ą░ą┤ą║č¢ą▓) ą▓ąĖąĘąĮą░čćą░čö ą┐čĆą░ą▓ąĖą╗ąŠ ąŚą░ą╣čåąĄą▓ą░: ą┐čĆąĖ ą┤ąĄą│č¢ą┤čĆą░čéą░čåč¢čŚ ąĮą░ą╣ą▒č¢ą╗čīčł ą╗ąĄą│ą║ąŠ ą▓č¢ą┤čēąĄą┐ą╗čÄčöčéčīčüčÅ ą│č¢ą┤čĆąŠą│ąĄąĮ ą▓č¢ą┤ ąĮą░ą╣ą╝ąĄąĮčł ą│č¢ą┤čĆąŠą│ąĄąĮč¢ąĘąŠą▓ą░ąĮąŠą│ąŠ ą░č鹊ą╝čā ą║ą░čĆą▒ąŠąĮčā:
H3C-CH(OH)-C*H(CH3)-CH3 ŌåÆ H3C-CH=C*(CH3)-CH3 + H2O
“*” ą¤ąŠąĘąĮą░č湥ąĮąĖą╣ ąĮą░ą╣ą╝ąĄąĮčł ą│č¢ą┤čĆąŠą│ąĄąĮč¢ąĘąŠą▓ą░ąĮąĖą╣ ą░č鹊ą╝ ą║ą░čĆą▒ąŠąĮčā.
ąÆ ą┐čĆąŠčåąĄčüč¢ ą┤ąĄą│č¢ą┤čĆą░čéą░čåč¢čŚ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║ čćą░čüč鹊 ą┐ąĄčĆąĄą╝č¢čēą░čöčéčīčüčÅ č¢ ą▒čāą┤ąŠą▓ą░ ąŠčéčĆąĖą╝ą░ąĮąŠą│ąŠ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮčā ąĮąĄ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö ą▒čāą┤ąŠą▓č¢ ą▓ąĖčģč¢ą┤ąĮąŠą│ąŠ čüą┐ąĖčĆčéčā:
3H3C-CH(CH3)-CH2-CH2OH ŌåÆ H3C-CH(CH3-CH=CH2 + H3C-C(CH3)=CH-CH3 + H2C=C(CH3)-CH2-CH3
4. ąÆč¢ą┤čēąĄą┐ą╗ąĄąĮąĮčÅ ą│č¢ą┤čĆąŠą│ąĄąĮą│ą░ą╗ąŠą│ąĄąĮč¢ą┤č¢ą▓ ą░ą▒ąŠ ą│ą░ą╗ąŠą│ąĄąĮč¢ą▓ ą▓č¢ą┤ ą│ą░ą╗ąŠą│ąĄąĮą┐ąŠčģč¢ą┤ąĮąĖčģ (ą┤ąĄą│č¢ą┤čĆąŠą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ):
H-CH2-CH2–Cl + KOH ŌåÆ H2C=CH2 + KCl + H2O
ąöą╗čÅ ąĘą┤č¢ą╣čüąĮąĄąĮąĮčÅ čĆąĄą░ą║čåč¢čŚ ąĘą░čüč鹊čüąŠą▓čāčÄčéčī čéą▓ąĄčĆą┤ąĖą╣ ą┐ąŠą┤čĆč¢ą▒ąĮąĄąĮąĖą╣ ą╗čāą│, ąŠčĆą│ą░ąĮč¢čćąĮč¢ ąŠčüąĮąŠą▓ąĖ (ą┤ąĖą╝ąĄčéąĖą╗ą░ąĮč¢ą╗č¢ąĮ, čģč¢ąĮąŠą╗č¢ąĮ), ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī čéą░ą║ąŠąČ čüą┐ąĖčĆč鹊ą▓ąĖą╣ čĆąŠąĘčćąĖąĮ KOH ą░ą▒ąŠ NaOH. ą×ą┤ąĮą░ą║ ą▓ čĆą░ąĘč¢ ą▓ąĖą║ąŠčĆąĖčüčéą░ąĮąĮčÅ čüą┐ąĖčĆč鹊ą▓ąŠą│ąŠ čĆąŠąĘčćąĖąĮčā ą╗čāą│čā, ą╝ąŠąČą╗ąĖą▓ą░ ą┐ąŠą▒č¢čćąĮą░ čĆąĄą░ą║čåč¢čÅ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ą┐čĆąŠčüčéąĖčģ ąĄčäč¢čĆč¢ą▓:
H3C-CH2-OH + KOH Ōćä H3C-CH2-O-K + H2O
H3C-CH2-Cl + K-O-CH2-CH3 ŌåÆ H3C-CH2-O-CH2-CH3 + KCl
ąØą░ą┐čĆčÅą╝ąŠą║ ą┤ąĄą│č¢ą┤čĆąŠą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö ą┐čĆą░ą▓ąĖą╗čā ąŚą░ą╣čåąĄą▓ą░:
H3C-CHBr–HCH-CH3 ŌåÆ H3C-CH=CH-CH3 + HBr
ąöą╗čÅ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓ č¢ąĮąŠą┤č¢ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą╝ąĄč鹊ą┤ ą▓č¢ą┤čēąĄą┐ą╗ąĄąĮąĮčÅ ą│ą░ą╗ąŠą│ąĄąĮč¢ą▓ ą▓č¢ą┤ ą┤č¢ą│ą░ą╗ąŠą│ąĄąĮą┐ąŠčģč¢ą┤ąĮąĖčģ, ą▓ čÅą║ąĖčģ┬Ā ą░č鹊ą╝ą░ą╝ąĖ ą│ą░ą╗ąŠą│ąĄąĮčā čĆąŠąĘčéą░čłąŠą▓ą░ąĮč¢ ą▒č¢ą╗čÅ čüčāčüč¢ą┤ąĮč¢čģ ą░č鹊ą╝č¢ą▓ ą║ą░čĆą▒ąŠąĮčā, ąĘ ą▓ąĖą║ąŠčĆąĖčüčéą░ąĮąĮčÅą╝ čåąĖąĮą║ąŠą▓ąŠą│ąŠ ą┐ąĖą╗čā ą▓ ą▓ąŠą┤ąĮąŠ-čüą┐ąĖčĆč鹊ą▓ąŠą╝čā čüąĄčĆąĄą┤ąŠą▓ąĖčēč¢:
Br-CH2-CH2–Br + Zn ŌåÆ H2C=CH2 + ZnBr2
ąŚą░ ą▓ąĖą║ąŠčĆąĖčüčéą░ąĮąĮčÅą╝ čåąĖąĮą║čā ąĘą▒č¢ą╗čīčłčāčöčéčīčüčÅ ą╣ą╝ąŠą▓č¢čĆąĮč¢čüčéčī č¢ąĘąŠą╝ąĄčĆąĖąĘą░čåč¢čŚ ą░ą╗ą║ąĄąĮą░, čēąŠ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą▓ čÅą║ąŠčüčéč¢ ą┐čĆąŠą┤čāą║čéčā. ąÜčĆč¢ą╝ čåąĖąĮą║čā ąĘą░čüč鹊čüąŠą▓čāčÄčéčī ą╣ąŠą┤ąĖą┤ ąĮą░čéčĆč¢čÄ ą▓ ą╝ąĄčéą░ąĮąŠą╗č¢ ą░ą▒ąŠ ą░čåąĄč鹊ąĮč¢, čüąŠą╗č¢ čģčĆąŠą╝čā(II), ąĮą░čéčĆč¢ą╣ čéč¢ąŠčüčāą╗čīčäą░čé ą▓ ą┤ąĖą╝ąĄčéąĖą╗čüčāą╗čīč乊ą║čüąĖą┤, ą╗č¢čéč¢ą╣-ą░ą╗čÄą╝č¢ąĮč¢ą╣-ą│č¢ą┤čĆąĖą┤.
ąöą░ąĮąĖą╣ ą╝ąĄč鹊ą┤ ąĘą░čüč鹊čüąŠą▓čāčÄčéčī ą┤ą╗čÅ ąĘą░čģąĖčüčéčā ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā ą▓č¢ą┤ čāčćą░čüčéč¢ ą▓ č¢ąĮčłąĖčģ čĆąĄą░ą║čåč¢čÅčģ; čüą┐ąŠčćą░čéą║čā ą░ą╗ą║ąĄąĮ ąĮą░čüąĖčćčāčÄčéčī ą▒čĆąŠą╝ąŠą╝, ą┐čĆąŠą▓ąŠą┤čÅčéčī č¢ąĮčłč¢ čģč¢ą╝č¢čćąĮč¢ čĆąĄą░ą║čåč¢čŚ, ą┐ąŠčéč¢ą╝ čĆąĄą│ąĄąĮąĄčĆčāčÄčéčī ą┐ąŠą┤ą▓č¢ą╣ąĮč¢ ąĘą▓’čÅąĘą║ąĖ.
5. ąÆ ą┤ąĄčÅą║ąĖčģ ą▓ąĖą┐ą░ą┤ą║ą░čģ ąĄčéč¢ąĮąŠą▓č¢ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮąĖ ąĘ ą┐ąĄą▓ąĮąŠčÄ ą▒čāą┤ąŠą▓ąŠčÄ ąŠčéčĆąĖą╝ą░čéąĖ ą╗ąĄą│čłąĄ, ąĮč¢ąČ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮč¢ čŚą╝ ąĘą░ ą▒čāą┤ąŠą▓ąŠčÄ ą░ą╗ą║ąĄąĮąĖ. ąÆ čéą░ą║ąĖčģ ą▓ąĖą┐ą░ą┤ą║ą░čģ ą░ą╗ą║č¢ąĮąĖ ąŠčéčĆąĖą╝čāčÄčéčī čćą░čüčéą║ąŠą▓ąĖą╝ “čüąĄą╗ąĄą║čéąĖą▓ąĮąĖą╝” ą│č¢ą┤čĆčāą▓ą░ąĮąĮčÅą╝ ąĄčéč¢ąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ąĮą░ą┤ ą┐ą░ą╗ą░ą┤č¢čöą▓ąĖą╝ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆąŠą╝:
HCŌēĪCH + H2 ŌåÆ H2C=CH2
6. ąöą╗čÅ čüąĖąĮč鹥ąĘčā ą░ą╗ą║ąĄąĮč¢ą▓ ąĘ ą║čĆą░ą╣ąĮč¢ą╝ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ ąĘą▓’čÅąĘą║ąŠą╝ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī čĆąĄą░ą║čåč¢čÄ ąÆč¢čéčéč¢ą│ą░:
[(C6H5)3PCH3]Br + C4H9Li ŌåÆ (C6H5)3P╬┤+=C╬┤-H2 + C4H10 + LiBr
(C6H5)3P╬┤+=C╬┤-H2-C4H9 + ╬┤-O=C╬┤+=H-C4H9 ŌåÆ (C3H5)3P=O + H2C=CH-C4H9
ążč¢ąĘąĖčćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ ą░ą╗ą║ąĄąĮč¢ą▓
ą¤ąĄčĆčłč¢ č湊čéąĖčĆąĖ čćą╗ąĄąĮąĖ ą│ąŠą╝ąŠą╗ąŠą│č¢čćąĮąŠą│ąŠ čĆčÅą┤čā ąĄč鹥ąĮąŠą▓ąĖčģ ą║ą░čĆą▒ąŠą│č¢ą┤čĆąŠą│ąĄąĮč¢ą▓ – ą│ą░ąĘąĖ. ąÉą╗ą║ąĄąĮąĖ ąĘ čćąĖčüą╗ąŠą╝ ą░č鹊ą╝č¢ą▓ ą║ą░čĆą▒ąŠąĮčā ą▓č¢ą┤ 5 ą┤ąŠ 17 ąĘą░ ąĮąŠčĆą╝ą░ą╗čīąĮąĖčģ čāą╝ąŠą▓ ą┐ąĄčĆąĄą▒čāą▓ą░čÄčéčī ą▓ čĆč¢ą┤ą║ąŠą╝čā ą░ą│čĆąĄą│ą░čéąĮąŠą╝čā čüčéą░ąĮč¢. ąÉą╗ą║ąĄąĮąĖ ąĘ čćąĖčüą╗ąŠą╝ ą░č鹊ą╝č¢ą▓ ą║ą░čĆą▒ąŠąĮčā 18 č¢ ą▒č¢ą╗čīčłąĄ, ą┐čĆąĖ ąĮ.čā. ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ą▓ čéą▓ąĄčĆą┤ąŠą╝čā ą░ą│čĆąĄą│ą░čéąĮąŠą╝čā čüčéą░ąĮč¢.
ąÉą╗ą║ąĄąĮąĖ ąĘ ąĮąŠčĆą╝ą░ą╗čīąĮąŠčÄ ą▒čāą┤ąŠą▓ąŠčÄ ą║ą░čĆą▒ąŠąĮąŠą▓ąŠą│ąŠ ą╗ą░ąĮčåčÄą│ą░ (ąĮąĄčĆąŠąĘą│ą░ą╗čāąČąĄąĮč¢) ą║ąĖą┐ą╗čÅčéčī ą┐čĆąĖ ą▒č¢ą╗čīčł ą▓ąĖčüąŠą║č¢ą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆč¢, ąĮč¢ąČ čŚčģ č¢ąĘąŠą╝ąĄčĆąĖ ąĘ čĆąŠąĘą│ą░ą╗čāąČąĄąĮąĖą╝ ą╗ą░ąĮčåčÄą│ąŠą╝. ą¤ąĄčĆąĄą╝č¢čēąĄąĮąĮčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā ą▓ čåąĄąĮčéčĆ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą▓ąĖą║ą╗ąĖą║ą░čö ą┐č¢ą┤ą▓ąĖčēąĄąĮąĮčÅ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĖ ą║ąĖą┐č¢ąĮąĮčÅ ą░ą╗ą║ąĄąĮčā. čåąĖčü-ąåąĘąŠą╝ąĄčĆąĖ ąĘą░ąĘą▓ąĖčćą░ą╣ ą║ąĖą┐ą╗čÅčéčī ą┐čĆąĖ ą▒č¢ą╗čīčł ą▓ąĖčüąŠą║č¢ą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆč¢, ąĮč¢ąČ čéčĆą░ąĮčü-č¢ąĘąŠą╝ąĄčĆąĖ. ą¤ąĄčĆąĄą╝č¢čēąĄąĮąĮčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā ą▓ čåąĄąĮčéčĆ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą┐č¢ą┤ą▓ąĖčēčāčö č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā ą┐ą╗ą░ą▓ą╗ąĄąĮąĮčÅ. čéčĆą░ąĮčü-ąåąĘąŠą╝ąĄčĆąĖ ą┐ą╗ą░ą▓ą╗čÅčéčīčüčÅ ą┐čĆąĖ ą▒č¢ą╗čīčł ą▓ąĖčüąŠą║č¢ą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆč¢, ąĮč¢ąČ čåąĖčü-č¢ąĘąŠą╝ąĄčĆąĖ.
ą®č¢ą╗čīąĮč¢čüčéčī ą░ą╗ą║ąĄąĮąŠą▓ ą╝ąĄąĮčłą░ ąĘą░ ąŠą┤ąĖąĮąĖčåčÄ, ą░ą╗ąĄ, ą▒č¢ą╗čīčłą░, ąĮč¢ąČ čēč¢ą╗čīąĮč¢čüčéčī ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąĖčģ ą░ą╗ą║ą░ąĮč¢ą▓. ąÆ ą│ąŠą╝ąŠą╗ąŠą│č¢čćąĮąŠą╝čā čĆčÅą┤č¢ čēč¢ą╗čīąĮč¢čüčéčī ą░ą╗ą║ąĄąĮč¢ą▓ ąĘą▒č¢ą╗čīčłčāčöčéčīčüčÅ. ąöą╗čÅ ą░ą╗ą║ąĄąĮč¢ą▓ čģą░čĆą░ą║č鹥čĆąĮč¢ ą▒č¢ą╗čīčł ą▓ąĖčüąŠą║č¢ ą┐ąŠą║ą░ąĘąĮąĖą║ąĖ ąĘą░ą╗ąŠą╝ą╗ąĄąĮąĮčÅ čüą▓č¢čéą╗ą░, ąĮč¢ąČ ą┤ą╗čÅ ą░ą╗ą║ą░ąĮč¢ą▓.
ąĀąŠąĘčćąĖąĮąĮč¢čüčéčī ą░ą╗ą║ąĄąĮąŠą▓ ą▓ ą▓ąŠą┤č¢ ąĮąĄąĘąĮą░čćąĮą░, ą░ą╗ąĄ ą▓ąĖčēą░ ąĘą░ čĆąŠąĘčćąĖąĮąĮč¢čüčéčī čā ą▓ąŠą┤č¢ ą░ą╗ą║ą░ąĮč¢ą▓. ąÉą╗ą║ąĄąĮąĖ ą╝ąŠąČčāčéčī čĆąŠąĘčćąĖąĮčÅčéąĖčüčÅ ą▓ čĆąŠąĘčćąĖąĮą░čģ ą┤ąĄčÅą║ąĖčģ čüąŠą╗ąĄą╣ ą▓ą░ąČą║ąĖčģ ą╝ąĄčéą░ą╗č¢ą▓, čāčéą▓ąŠčĆčÄčÄčćąĖ ąĘ ąĮąĖą╝ąĖ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮč¢ čüą┐ąŠą╗čāą║ąĖ (ąĮą░ą┐čĆąĖą║ą╗ą░ą┤, ą▓ čĆąŠąĘčćąĖąĮą░čģ Cu2Cl2).
ąźč¢ą╝č¢čćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ ą░ą╗ą║ąĄąĮč¢ą▓
ąōąŠą╗ąŠą▓ąĮąĖą╝ čüčéčĆčāą║čéčāčĆąĮąĖą╝ ąĄą╗ąĄą╝ąĄąĮč鹊ą╝, čēąŠ ą▓ąĖąĘąĮą░čćą░čö čĆąĄą░ą║čåč¢ą╣ąĮčā ąĘą┤ą░čéąĮč¢čüčéčī ą░ą╗ą║ąĄąĮč¢ą▓, čö ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║, čēąŠ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčö čüąŠą▒ąŠčÄ ą┐ąŠčöą┤ąĮą░ąĮąĮčÅ Žā- č¢ ŽĆ-ąĘą▓’čÅąĘą║č¢ą▓ (sp2-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čÅ). ąöą╗čÅ ą░ą╗ą║ąĄąĮč¢ą▓ ąĮą░ą╣ą▒č¢ą╗čīčł čéąĖą┐ąŠą▓č¢ čĆąĄą░ą║čåč¢čŚ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ (čĆąĄą░ą║čåč¢čÅ ąĄą╗ąĄą║čéčĆąŠčäč¢ą╗čīąĮąŠą│ąŠ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ AE). ąóą░ą║ąŠąČ ą┤ą╗čÅ ą░ą╗ą║ąĄąĮč¢ą▓ čģą░čĆą░ą║č鹥čĆąĮč¢ čĆąĄą░ą║čåč¢čŚ ąĘą░ą╝č¢čēąĄąĮąĮčÅ (ąĮą░ą╣ą▒č¢ą╗čīčł ą╗ąĄą│ą║ąŠ ąĘą░ą╝č¢čēčāčöčéčīčüčÅ ą│č¢ą┤čĆąŠą│ąĄąĮ čā ╬▒-ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮą░).
ąōč¢ą┤čĆčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓. ąÉą╗ą║ąĄąĮąĖ ą┐čĆąĖčöą┤ąĮčāčÄčéčī ą│č¢ą┤čĆąŠą│ąĄąĮ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓ (Pt, Pd, Ni):
H2C=CH2 + H2 ŌåÆ H3C-CH3
ąöą╗čÅ ą│č¢ą┤čĆčāą▓ą░ąĮąĮčÅ ąĮąĄąŠą▒čģč¢ą┤ąĮą░ ą░ą┤čüąŠčĆą▒čåč¢čÅ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą░ą╗ą║ąĄąĮą░ ąĮą░ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ ąĘą░ ą╝č¢čüčåąĄą╝ čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā, ą░ą╗ą║ąĄąĮąĖ ą│č¢ą┤čĆčāčÄčéčīčüčÅ čéąĖą╝ ą╗ąĄą│čłąĄ, čćąĖą╝ ą╝ąĄąĮčłąĄ ąĘą░ą╝č¢čüąĮąĖą║č¢ą▓ ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ą▒č¢ą╗čÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā (ą┐čĆą░ą▓ąĖą╗ąŠ ąøąĄą▒ąĄą┤čöą▓ą░ ąĪ.ąÆ.).
ąōą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮąŠą▓. ąÉą╗ą║ąĄąĮąĖ ą╗ąĄą│ą║ąŠ ą┐čĆąĖčöą┤ąĮčāčÄčéčī ą│ą░ą╗ąŠą│ąĄąĮąĖ:
H2C=CH2 + Br2 ŌåÆ BrH2C-CH2Br
ą©ą▓ąĖą┤ą║č¢čüčéčī čĆąĄą░ą║čåč¢čŚ ą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓ ąĘą░ą╗ąĄąČąĖčéčī ą▓č¢ą┤ ą┐čĆąĖčĆąŠą┤ąĖ ą│ą░ą╗ąŠą│ąĄąĮčā č¢ ą▒čāą┤ąŠą▓ąĖ ą░ą╗ą║ąĄąĮą░. ążą╗čāąŠčĆ čĆąĄą░ą│čāčö ąĘ ą░ą╗ą║ąĄąĮą░ą╝ąĖ č¢ąĘ ąĘą░ą┐ą░ą╗čÄą▓ą░ąĮąĮčÅą╝; ą╣ąŠą┤ čĆąĄą░ą│čāčö ąĘ ą░ą╗ą║ąĄąĮą░ą╝ąĖ ą┐ąŠą▓č¢ą╗čīąĮąŠ, ą┐č¢ą┤ ą┤č¢čöčÄ čüą▓č¢čéą╗ą░.
ą¦ąĖą╝ ą▒č¢ą╗čīčłąĄ ąĘą░ą╝č¢čüąĮąĖą║č¢ą▓ ą▓ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą╝čā ąĘą▓’čÅąĘą║čā, čéąĖą╝ ą╗ąĄą│čłąĄ ą┐čĆąŠčģąŠą┤ąĖčéčī čĆąĄą░ą║čåč¢čÅ ą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓.
ąōą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓ ą┐čĆąŠčģąŠą┤ąĖčéčī ąĘą░ čĆą░ą┤ąĖą║ą░ą╗čīąĮąĖą╝ ą╝ąĄčģą░ąĮč¢ąĘą╝ąŠą╝ ą░ą▒ąŠ ąĘą░ č¢ąŠąĮąĮąĖą╝ ąĄą╗ąĄą║čéčĆąŠčäč¢ą╗čīąĮąĖą╝ ą╝ąĄčģą░ąĮč¢ąĘą╝ąŠą╝. ą¤čĆąĖ čĆą░ą┤ąĖą║ą░ą╗čīąĮąŠą╝čā ą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓, ą┐č¢ą┤ ą┤č¢čöčÄ čüą▓č¢čéą╗ą░ ą░ą▒ąŠ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĖ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ čāčéą▓ąŠčĆąĄąĮąĮčÅ ą│ą░ą╗ąŠą│ąĄąĮąĖą┤-čĆą░ą┤ąĖą║ą░ą╗č¢ą▓, čÅą║č¢, čüą┐ąŠčćą░čéą║čā, ą┐čĆąĖčöą┤ąĮčāčÄčéčīčüčÅ ą┤ąŠ ąĮą░ą╣ą▒č¢ą╗čīčł ą┤ąŠčüčéčāą┐ąĮąŠą│ąŠ ą░č鹊ą╝čā ą║ą░čĆą▒ąŠąĮčā ąĘ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ ąĘą▓’čÅąĘą║ąŠą╝ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ čĆą░ą┤ąĖą║ą░ą╗čā č¢ ą┐ąŠą┤ą░ą╗čīčłąĖą╝ čĆąŠąĘą▓ąĖčéą║ąŠą╝ čĆą░ą┤ąĖą║ą░ą╗čīąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ.
ąØą░ą╣čćą░čüčéč¢čłąĄ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą│ą░ą╗ąŠą│ąĄąĮčā ąĘą░ č¢ąŠąĮąĮąĖą╝ ąĄą╗ąĄą║čéčĆąŠčäč¢ą╗čīąĮąĖą╝ ą╝ąĄčģą░ąĮč¢ąĘą╝ąŠą╝. ą£ąŠą╗ąĄą║čāą╗ą░ ą│ą░ą╗ąŠą│ąĄąĮčā ą░čéą░ą║čāčö ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║, ąĘą░čģąŠą┐ą╗čÄčÄčćąĖ ąĄą╗ąĄą║čéčĆąŠąĮąĖ č¢ čāčéą▓ąŠčĆčÄčÄčćąĖ ŽĆ-ą║ąŠą╝ą┐ą╗ąĄą║čü. ą¤ąŠčéč¢ą╝ ą▓č¢ą┤ąŠą║čĆąĄą╝ą╗čÄčöčéčīčüčÅ ąĮąĄą│ą░čéąĖą▓ąĮąĖą╣ č¢ąŠąĮ ą│ą░ą╗ąŠą│ąĄąĮčā. ąöąŠ ą║ą░čĆą▒ąŠąĮč¢čöą▓ąŠą│ąŠ ą░ą▒ąŠ ą▒čĆąŠą╝ąŠąĮč¢čöą▓ąŠą│ąŠ (ąĮą░ą╣ą▓č¢čĆąŠą│č¢ą┤ąĮč¢čłąĄ) ą║ą░čéč¢ąŠąĮčā ą┐čĆąĖčöą┤ąĮčāčöčéčīčüčÅ ąĮąĄą│ą░čéąĖą▓ąĮąĖą╣ č¢ąŠąĮ ą│ą░ą╗ąŠą│ąĄąĮčā:

ąĀąĄą░ą║čåč¢čÅ ą░ą╗ą║ąĄąĮč¢ą▓ ąĘ ą│ą░ą╗ąŠą│ąĄąĮą░ą╝ąĖ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą┤ą╗čÅ čÅą║č¢čüąĮąŠą│ąŠ č¢ ą║č¢ą╗čīą║č¢čüąĮąŠą│ąŠ ą▓ąĖąĘąĮą░č湥ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓ ą▓ čüčāą╝č¢čłą░čģ. ąŚą░ ą║č¢ą╗čīą║č¢čüčéčÄ ą┐ąŠą│ą╗ąĖąĮąĄąĮąŠą│ąŠ ą▒čĆąŠą╝čā ą╝ąŠąČąĮą░ ą▓čüčéą░ąĮąŠą▓ąĖčéąĖ ąĮą░čÅą▓ąĮč¢čüčéčī č¢ ą║č¢ą╗čīą║č¢čüčéčī ą░ą╗ą║ąĄąĮčā.
ąōč¢ą┤čĆąŠą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓. ąÉą╗ą║ąĄąĮąĖ ą┐čĆąĖčöą┤ąĮčāčÄčéčī ą│č¢ą┤čĆąŠą│ąĄąĮą│ą░ą╗ąŠą│ąĄąĮč¢ą┤ąĖ:
H2C=CH2 + HCl ŌåÆ H3C-CH2Cl
ąØą░ą╣ą▒č¢ą╗čīčł ą╗ąĄą│ą║ąŠ čĆąĄą░ą│čāčö ą│č¢ą┤čĆąŠą│ąĄąĮ ą╣ąŠą┤ąĖą┤. ąōč¢ą┤čĆąŠą│ąĄąĮ čäą╗čāąŠčĆąĖą┤ (ąŠčüąŠą▒ą╗ąĖą▓ąŠ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą▓ąŠą╗ąŠą│ąĖ) ą┐čĆąĖčöą┤ąĮčāčöčéčīčüčÅ ąĘ ąŠą┤ąĮąŠčćą░čüąĮąŠčÄ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čöčÄ ą░ą╗ą║ąĄąĮčā.
ą¤čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą│č¢ą┤čĆąŠą│ąĄąĮą│ą░ą╗ąŠą│ąĄąĮč¢ą┤č¢ą▓ ą┤ąŠ ąĮąĄčüąĖą╝ąĄčéčĆąĖčćąĮąĖčģ ą░ą╗ą║ąĄąĮč¢ą▓ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą┐čĆą░ą▓ąĖą╗čā (ą┐čĆą░ą▓ąĖą╗ąŠ ą£ą░čĆą║ąŠą▓ąĮąĖą║ąŠą▓ą░ ąÆ.ąÆ.): ą│č¢ą┤čĆąŠą│ąĄąĮ ą┐čĆąĖčöą┤ąĮčāčöčéčīčüčÅ ą┤ąŠ ąĮą░ą╣ą▒č¢ą╗čīčł ą│č¢ą┤čĆąŠą│ąĄąĮč¢ąĘąŠą▓ą░ąĮąŠą│ąŠ ą░č鹊ą╝čā ą║ą░čĆą▒ąŠąĮčā.
ą¤čĆą░ą▓ąĖą╗ąŠ ą£ą░čĆą║ąŠą▓ąĮąĖą║ąŠą▓ą░ ą┤ąŠčéčĆąĖą╝čāčöčéčīčüčÅ čéč¢ą╗čīą║ąĖ ą┐čĆąĖ č¢ąŠąĮąĮąŠą╝čā (ą│ąĄč鹥čĆąŠą╗č¢čéąĖčćąĮąŠą╝čā) ą╝ąĄčģą░ąĮč¢ąĘą╝č¢ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą│č¢ą┤čĆąŠą│ąĄąĮą│ą░ą╗ąŠą│ąĄąĮč¢ą┤č¢ą▓.
ą¤čĆąĖ čĆą░ą┤ąĖą║ą░ą╗čīąĮąŠą╝čā (ą│ąŠą╝ąŠą╗č¢čéąĖčćąĮąŠą╝čā) ą╝ąĄčģą░ąĮč¢ąĘą╝č¢ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą│č¢ą┤čĆąŠą│ąĄąĮą│ą░ą╗ąŠą│ąĄąĮč¢ą┤č¢ą▓ – ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą▓ ąĘą▓ąŠčĆąŠčéąĮąŠą╝čā ą┐ąŠčĆčÅą┤ą║čā: ą│č¢ą┤čĆąŠą│ąĄąĮ ą┐čĆąĖčöą┤ąĮčāčöčéčīčüčÅ ą┤ąŠ ąĮą░ą╣ą╝ąĄąĮčł ą│č¢ą┤čĆąŠą│ąĄąĮč¢ąĘąŠą▓ą░ąĮąŠą│ąŠ ą░č鹊ą╝čā ą║ą░čĆą▒ąŠąĮčā ąĘ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ ąĘą▓’čÅąĘą║ąŠą╝ (ą┐ąĄčĆąĄą║ąĖčüąĮąĖą╣ ąĄč乥ą║čé ąÜą░čĆą░čłą░). ąĀą░ą┤ąĖą║ą░ą╗čīąĮąĄ ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą│č¢ą┤čĆąŠą│ąĄąĮą│ą░ą╗ąŠą│ąĄąĮč¢ą┤č¢ą▓ ą┤ąŠ ą░ą╗ą║ąĄąĮč¢ą▓ čüą┐ąŠčüč鹥čĆč¢ą│ą░čöčéčīčüčÅ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą┐ąĄčĆąŠą║čüąĖą┤č¢ą▓ ą░ą▒ąŠ ą║ąĖčüąĮčÄ.
ąōč¢ą┐ąŠą│ą░ą╗ąŠą│ąĄąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓. ą¤čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą┤ąŠ ą░ą╗ą║ąĄąĮč¢ą▓ ą│č¢ą┐ąŠą│ą░ą╗ąŠą│ąĄąĮč¢ą┤ąĮąĖčģ ą║ąĖčüą╗ąŠčé č¢ čŚčģ ąĄčäč¢čĆč¢ą▓ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ąĘą░ ą┐čĆą░ą▓ąĖą╗ąŠą╝ ą£ą░čĆą║ąŠą▓ąĮąĖą║ąŠą▓ą░: ąĄą╗ąĄą║čéčĆąŠąĮąĄą│ą░čéąĖą▓ąĮąĖą╣ ą│č¢ą┤čĆąŠą║čüąĖą╗ ą┐čĆąĖčöą┤ąĮčāčöčéčīčüčÅ ą┤ąŠ ąĮą░ą╣ą╝ąĄąĮčł ą│č¢ą┤čĆąŠą│ąĄąĮč¢ąĘąŠą▓ą░ąĮąŠą│ąŠ ą░č鹊ą╝čā ą║ą░čĆą▒ąŠąĮčā:
H3C-CH=CH2 + HO-Cl+ ŌåÆ H3C-CHOH-CH2Cl
ąöą╗čÅ čĆąĄą░ą║čåč¢čŚ ąĮąĄ ąŠą▒ąŠą▓’čÅąĘą║ąŠą▓ąŠ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāą▓ą░čéąĖ ą│ąŠč鹊ą▓ąĖą╣ čĆąŠąĘčćąĖąĮ ą│č¢ą┐ąŠčģą╗ąŠčĆąĖčéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ. ą£ąŠąČąĮą░ ą▓ąĘčÅčéąĖ čģą╗ąŠčĆ č¢ ą▓ąŠą┤čā:
H2C=CH2 + Cl2 + H2O ŌåÆ H2CCl-CH2OH + HCl
ąōč¢ą┤čĆą░čéą░čåč¢čÅ ą░ą╗ą║ąĄąĮč¢ą▓. ąŻ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓ ą░ą╗ą║ąĄąĮąĖ ą┐čĆąĖčöą┤ąĮčāčÄčéčī ą▓ąŠą┤čā ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ čüą┐ąĖčĆčéč¢ą▓:
H2C=CH2 + H2O ŌåÆ H3C-CH2-OH
ąÆ čĆą░ąĘč¢ ą▓č鹊čĆąĖąĮąĮąĖčģ č¢ čéčĆąĄčéąĖąĮąĮąĖčģ ą░ą╗ą║ąĄąĮč¢ą▓, ą┐čĆąĖčöą┤ąĮą░ąĮąĮčÅ ą▓ąŠą┤ąĖ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ąĘą░ ą┐čĆą░ą▓ąĖą╗ąŠą╝ ą£ą░čĆą║ąŠą▓ąĮąĖą║ąŠą▓ą░.
ą¤čĆąŠčåąĄčü ą│č¢ą┤čĆą░čéą░čåč¢čŚ ą░ą╗ą║ąĄąĮč¢ą▓ ą┐čĆąŠą▓ąŠą┤čÅčéčī ą┐čĆąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆč¢ 300-350*ąĪ, čéąĖčüą║čā ąĮąĄ ąĮąĖąČč湥 9,8 ą£ą¤ą░ č¢ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆą░ – čüąĖą╗č¢ą║ą░ą│ąĄą╗čī ą┐čĆąŠčüąŠč湥ąĮąĖą╣ čüčāą╝č¢čłčłčÄ č乊čüčäą░čéąĮąŠčŚ č¢ ą▓ąŠą╗čīčäčĆą░ą╝ąŠą▓ąŠčŚ ą║ąĖčüą╗ąŠčé.
ąĀą░ąĮč¢čłąĄ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāą▓ą░ą▓čüčÅ čüčāą╗čīčäą░čéąĮąŠą║ąĖčüą╗ąŠčéąĮąĖą╣ ą╝ąĄč鹊ą┤ ą│č¢ą┤čĆą░čéą░čåč¢čŚ ą░ą╗ą║ąĄąĮč¢ą▓, čÅą║ąĖą╣ ą╝ą░čö č¢čüč鹊čéąĮč¢ ąĮąĄą┤ąŠą╗č¢ą║ąĖ (ą▓ąĄą╗ąĖą║č¢ ą▓ąĖčéčĆą░čéąĖ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ, ą║ąŠčĆąŠąĘč¢čÅ ą░ą┐ą░čĆą░čéčāčĆąĖ č¢ č¢ąĮ.). ąÉą╗ą║ąĄąĮąĖ ą┐ąŠą│ą╗ąĖąĮą░čÄčéčīčüčÅ čüčāą╗čīčäą░čéąĮąŠčÄ ą║ąĖčüą╗ąŠč鹊čÄ čéąĖą╝ ą╗ąĄą│čłąĄ, čćąĖą╝ ą▒č¢ą╗čīčłą░ ą║č¢ą╗čīą║č¢čüčéčī ąĘą░ą╝č¢čüąĮąĖą║č¢ą▓ ąĘą▓ŌĆÖčÅąĘą░ąĮč¢ ąĘ ą░č鹊ą╝ą░ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā ąĘ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ ąĘą▓’čÅąĘą║ąŠą╝ (čćąĖą╝ ą▒č¢ą╗čīčł ą┐ąŠą╗čÅčĆąĮąĖą╝ čö ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║). ą”čÄ ąĘą░ą║ąŠąĮąŠą╝č¢čĆąĮč¢čüčéčī ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą┤ą╗čÅ čĆąŠąĘą┤č¢ą╗ąĄąĮąĮčÅ ąŠą╗ąĄčäč¢ąĮč¢ą▓ čĆč¢ąĘąĮąŠčŚ ą▒čāą┤ąŠą▓ąĖ.
ą×ą║ąĖčüąĮąĄąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓. ąÉą╗ą║ąĄąĮąĖ ąŠą║ąĖčüąĮčÄčÄčéčīčüčÅ ą║ąĖčüąĮąĄą╝ ą┐ąŠą▓č¢čéčĆčÅ čéą░ č¢ąĮčłąĖą╝ąĖ ąŠą║ąĖčüąĮčÄą▓ą░čćą░ą╝ąĖ. ąØą░ą┐čĆčÅą╝ąŠą║ ąŠą║ąĖčüąĮąĄąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓ ąĘą░ą╗ąĄąČąĖčéčī čāą╝ąŠą▓ čĆąĄą░ą║čåč¢čŚ č¢ ą▓ąĖą▒ąŠčĆčā ąŠą║ąĖčüąĮčÄą▓ą░čćą░.
1. ąÉą╗ą║ąĄąĮąĖ ąĘ ą║ąĖčüąĮąĄą╝ ą┐ąŠą▓č¢čéčĆčÅ ą▒ąĄąĘ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆą░ čāčéą▓ąŠčĆčÄčÄčéčī ą│č¢ą┤čĆąŠą┐ąĄčĆąŠą║čüąĖą┤, čÅą║č¢ čĆąŠąĘą┐ą░ą┤ą░čÄčéčīčüčÅ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ čüą┐ąĖčĆčéč¢ą▓ č¢ ą║ą░čĆą▒ąŠąĮč¢ą╗čīąĮąĖčģ čüą┐ąŠą╗čāą║. ąöč¢čŚ ą║ąĖčüąĮčÄ ą┐č¢ą┤ą┤ą░čöčéčīčüčÅ ąĘą░ąĘą▓ąĖčćą░ą╣ ąĮą░ą╣ą▒č¢ą╗čīčł čĆčāčģą╗ąĖą▓ąĖą╣ ą░č鹊ą╝ ą│č¢ą┤čĆąŠą│ąĄąĮčā ąĘ čĆąŠąĘčĆąĖą▓ąŠą╝ ╬▓-ąĘą▓’čÅąĘą║čā ą┐ąŠ ą▓č¢ą┤ąĮąŠčłąĄąĮąĮčÄ ą┤ąŠ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓ŌĆÖčÅąĘą║čā:
H2C=CH-CH2-H ŌåÆ H2C=CH-CH2-O-O-H ŌåÆ …
… ŌåÆ H2C=CH-CH2-OŌĆó + R-H ŌåÆ H2C=CH-CH2OH + RŌĆó
… ŌåÆ H2C=CH-CH2-OŌĆó ŌåÆ H2C=CH-CHO + HŌĆó
2. ąÜąĖčüąĮąĄą╝ ą┐ąŠą▓č¢čéčĆčÅ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ čüčĆč¢ą▒ąĮąŠą│ąŠ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆą░ ą░ą╗ą║ąĄąĮąĖ ąŠą║ąĖčüąĮčÄčÄčéčīčüčÅ ą┤ąŠ ąĄą┐ąŠą║čüąĖą┤č¢ą▓:
2H2C=CH2 + O2 ŌåÆ 2(H2C-CH2)O
ąÉąĮą░ą╗ąŠą│č¢čćąĮąŠ ą┤č¢čÄčéčī ą│č¢ą┤čĆąŠą┐ąĄčĆąŠą║čüąĖą┤ąĖ ą░čåąĖą╗č¢ą▓ (čĆąĄą░ą║čåč¢čÅ ą¤čĆąĖą╗ąĄąČą░čöą▓ą░):
H2C=CH2 + C6H5-CO-O-O-H ŌåÆ (CH2-CH2)O + C6H5-COOH
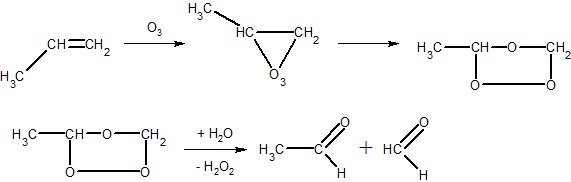
3. ąĀąŠąĘą▓ąĄą┤ąĄąĮąĖą╣ čĆąŠąĘčćąĖąĮ ą║ą░ą╗č¢ą╣ ą┐ąĄčĆą╝ą░ąĮą│ą░ąĮą░čéčā (čĆąĄą░ą║čåč¢čÅ ąÆą░ą│ąĮąĄčĆą░) ą░ą▒ąŠ ą│č¢ą┤čĆąŠą│ąĄąĮ ą┐ąĄčĆąŠą║čüąĖą┤ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓ (CrO3, OsO4 č¢ č¢ąĮ.) ąĘ ą░ą╗ą║ąĄąĮą░ą╝ąĖ čāčéą▓ąŠčĆčÄčÄčéčī ą┤č¢ąŠą╗ąĖ (ą┤ą▓ąŠą░č鹊ą╝ąĮč¢ čüą┐ąĖčĆčéąĖ). ąŚą░ ą╝č¢čüčåąĄą╝ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā ą┐čĆąĖčöą┤ąĮčāčÄčéčīčüčÅ ą┤ą▓č¢ ą│čĆčāą┐ąĖ -OH:
3H2C=CH2 + 2KMnO4 + 4H2O ŌåÆ 3CH2OH-CH2OH + 2MnO2 + 2KOH
H2C=CH2 + H2O2 ŌåÆ CH2OH + CH2OH
4. ą¤čĆąĖ ą┤č¢čŚ ą║ąŠąĮčåąĄąĮčéčĆąŠą▓ą░ąĮąĖčģ čĆąŠąĘčćąĖąĮč¢ą▓ ąŠą║ąĖčüąĮčÄą▓ą░čćč¢ą▓ (ą║ą░ą╗č¢ą╣ ą┐ąĄčĆą╝ą░ąĮą│ą░ąĮą░čé, čģčĆąŠą╝ąŠą▓ą░ ą║ąĖčüą╗ąŠčéą░, ąĮč¢čéčĆą░čéąĮą░ ą║ąĖčüą╗ąŠčéą░) ą╝ąŠą╗ąĄą║čāą╗ą░ ą░ą╗ą║ąĄąĮčā čĆąŠąĘčĆąĖą▓ą░čöčéčīčüčÅ ąĘą░ ą╝č¢čüčåąĄą╝ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā, čāčéą▓ąŠčĆčÄčÄčćąĖ ą║ąĄč鹊ąĮąĖ ą░ą▒ąŠ ą║ąĖčüą╗ąŠčéąĖ:
H3C-C(CH3)=CH-CH3 ŌåÆ H3C-CO-CH3 + H3C-COOH
H3C-CH=CH-CH2-CH3 ŌåÆ H3C-COOH + H3C-CH2-COOH
ą”čÅ čĆąĄą░ą║čåč¢čÅ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčöčéčīčüčÅ ą┤ą╗čÅ ą▓ąĖąĘąĮą░č湥ąĮąĮčÅ ą▒čāą┤ąŠą▓ąĖ ą░ą╗ą║ąĄąĮč¢ą▓, ąĘą░ čüą║ą╗ą░ą┤ąŠą╝ ą║ąĖčüą╗ąŠčé č¢ ą║ąĄč鹊ąĮą░ą╝, čēąŠ čāčéą▓ąŠčĆąĖą╗ąĖčüčÅ, ą╝ąŠąČąĮą░ ąĘčĆąŠą▒ąĖčéąĖ ą▓ąĖčüąĮąŠą▓ąŠą║ ą┐čĆąŠ ą▒čāą┤ąŠą▓čā č¢ čüą║ą╗ą░ą┤ čĆą░ą┤ąĖą║ą░ą╗č¢ą▓, ą┐ąŠą▓’čÅąĘą░ąĮąĖčģ ąĘ ą░č鹊ą╝ą░ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā ąĘ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ ąĘą▓’čÅąĘą║ąŠą╝.
5. ąÉą╗ą║ąĄąĮąĖ ąŠą║ąĖčüąĮčÄčÄčéčīčüčÅ ąŠąĘąŠąĮąŠą╝ ąĘą░ ą╝č¢čüčåąĄą╝ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ąŠąĘąŠąĮč¢ą┤č¢ą▓ (ąĮąĄčüčéč¢ą╣ą║č¢, ą▓ąĖą▒čāčģąŠą▓č¢ čüą┐ąŠą╗čāą║ąĖ), čÅą║č¢ ąĘ ą▓ąŠą┤ąŠčÄ čāčéą▓ąŠčĆčÄčÄčéčī ą│č¢ą┤čĆąŠą│ąĄąĮ ą┐ąĄčĆąŠą║čüąĖą┤ č¢ ą║ą░čĆą▒ąŠąĮč¢ą╗čīąĮč¢ čüą┐ąŠą╗čāą║ąĖ (čĆąĄą░ą║čåč¢čÅ ąŠąĘąŠąĮčāą▓ą░ąĮąĮčÅ ąōą░čĆč¢čöčüą░):
ąÉą╗čīą┤ąĄą│č¢ą┤ąĖ ą┐čĆąĖ čåčīąŠą╝čā ą╝ąŠąČčāčéčī ąŠą║ąĖčüąĮčÄą▓ą░čéąĖčüčī ą│č¢ą┤čĆąŠą│ąĄąĮ ą┐ąĄčĆąŠą║čüąĖą┤ąŠą╝ ą┤ąŠ ą║ąĖčüą╗ąŠčé.
ąÉą╗ą║č¢ą╗čāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓. ąÉą╗ą║č¢ą╗čāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓ ą░ą╗ą║ą░ąĮą░ą╝ąĖ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ č乊čüčäą░čéąĮąŠčŚ ą░ą▒ąŠ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčé:
(H3C)2C=CH2 + (H3C)3CH ŌåÆ (H3C)3CH-CH2-C(CH3)3
ąŚą░ ą┤ąŠą┐ąŠą╝ąŠą│ąŠčÄ čåč¢čöčŚ čĆąĄą░ą║čåč¢čŚ ą╝ąŠąČąĮą░ ąŠčéčĆąĖą╝čāą▓ą░čéąĖ ą░ą╗ą║ą░ąĮąĖ ąĘ č¢ąĘąŠą╝ąĄčĆąĖąĘąŠą▓ą░ąĮąŠčÄ ą▒čāą┤ąŠą▓ąŠčÄ.
ąöąĖčüą┐čĆąŠą┐ąŠčĆčåč¢ąŠąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓. ąöąĖčüą┐čĆąŠą┐ąŠčĆčåč¢ąŠąĮčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓ ą”ąĖą│ą╗ąĄčĆą░ (ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆąĖ ąŠčéčĆąĖą╝čāčÄčéčī ą▓ąĘą░čöą╝ąŠą┤č¢čöčÄ WCl6 č¢ MoCl5 ąĘ ąĄčéč¢ą╗ą░ą╗čÄą╝č¢ąĮč¢ą╣ą┤ąĖčģą╗ąŠčĆąĖą┤ąŠą╝):
2R-CH=CH-R’ Ōćä R-CH=CH=R + R’-CH=CH-R’
ą¤ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą░ą╗ą║ąĄąĮč¢ą▓. ąĀąĄą░ą║čåč¢čÅ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ – čåąĄ ą┐čĆąŠčåąĄčü čāčéą▓ąŠčĆąĄąĮąĮčÅ ą▓ąĖčüąŠą║ąŠą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠčŚ čĆąĄč湊ą▓ąĖąĮąĖ (ą┐ąŠą╗č¢ą╝ąĄčĆčā) čłą╗čÅčģąŠą╝ ąĘ’čöą┤ąĮą░ąĮąĮčÅ ąŠą┤ąĖąĮ ąĘ ąŠą┤ąĮąĖą╝ ąĘą░ ą┤ąŠą┐ąŠą╝ąŠą│ąŠčÄ ą│ąŠą╗ąŠą▓ąĮąĖčģ ą▓ą░ą╗ąĄąĮčéąĮąŠčüč鹥ą╣ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąĖčģč¢ą┤ąĮąŠčŚ ąĮąĖąĘčīą║ąŠą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠčŚ čĆąĄč湊ą▓ąĖąĮąĖ (ą╝ąŠąĮąŠą╝ąĄčĆą░).
ą¤ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą░ą╗ą║ąĄąĮč¢ą▓ ą╝ąŠąČąĄ ą▒čāčéąĖ ą▓ąĖą║ą╗ąĖą║ą░ąĮą░ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮčÅą╝, ą▓ąĖčüąŠą║ąĖą╝ čéąĖčüą║ąŠą╝, ąŠą┐čĆąŠą╝č¢ąĮąĄąĮąĮčÅą╝, ą┤č¢čöčÄ ą▓č¢ą╗čīąĮąĖčģ čĆą░ą┤ąĖą║ą░ą╗č¢ą▓ ą░ą▒ąŠ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓.
ąÆ čĆąĄą░ą║čåč¢čŚ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ą╝ąŠąČčāčéčī ą┐čĆąĖą╣ą╝ą░čéąĖ čāčćą░čüčéčī čÅą║ č¢ąĮą┤ąĖą▓č¢ą┤čāą░ą╗čīąĮč¢ čĆąĄč湊ą▓ąĖąĮąĖ, čéą░ą║ č¢ čüčāą╝č¢čłč¢ ą╝ąŠąĮąŠą╝ąĄčĆč¢ą▓ (čüąŠą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ).
ą¤ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą░ą╗ą║ąĄąĮč¢ą▓ ą▓ ąĘą░ą╗ąĄąČąĮąŠčüčéč¢ ą▓č¢ą┤ ą╝ąĄčģą░ąĮč¢ąĘą╝čā ą▒čāą▓ą░čö ą┤ą▓ąŠčģ ą▓ąĖą┤č¢ą▓:
- čĆą░ą┤ąĖą║ą░ą╗čīąĮą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ (č¢ąĮč¢čåč¢ą╣ąŠą▓ą░ąĮą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ);
- č¢ąŠąĮąĮą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ (ą║ą░čéą░ą╗č¢čéąĖčćąĮą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ)
ąĀą░ą┤ąĖą║ą░ą╗čīąĮą░ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ č¢ąĮč¢čåč¢čÄčöčéčīčüčÅ čĆąĄč湊ą▓ąĖąĮą░ą╝ąĖ, ąĘą┤ą░čéąĮąĖą╝ąĖ ą▓ čāą╝ąŠą▓ą░čģ čĆąĄą░ą║čåč¢čŚ čĆąŠąĘą┐ą░ą┤ą░čéąĖčüčÅ ąĮą░ ą▓č¢ą╗čīąĮč¢ čĆą░ą┤ąĖą║ą░ą╗ąĖ (ą┐ąĄčĆąŠą║čüąĖą┤ąĖ, ą┤č¢ą░ąĘąŠą░ą╝č¢ąĮąŠčüą┐ąŠą╗čāą║ąĖ č¢ č¢ąĮ.) ąÉ čéą░ą║ąŠąČ ą┤č¢čöčÄ č鹥ą┐ą╗ą░ č¢ čüą▓č¢čéą╗ą░. ąŚčĆąŠčüčéą░čÄčćą░ čćą░čüčéąĖąĮą║ą░ ą┐ąŠą╗č¢ą╝ąĄčĆčā ą░ąČ ą┤ąŠ ą╝ąŠą╝ąĄąĮčéčā čüčéą░ą▒č¢ą╗č¢ąĘą░čåč¢čŚ čÅą▓ą╗čÅčö čüąŠą▒ąŠčÄ ą▓č¢ą╗čīąĮąĖą╣ čĆą░ą┤ąĖą║ą░ą╗. ąĀą░ą┤ąĖą║ą░ą╗ąĖ č¢ąĮč¢čåč¢ą░č鹊čĆąĖ ą▓čģąŠą┤čÅčéčī ą┤ąŠ čüą║ą╗ą░ą┤čā ą╝ąŠą╗ąĄą║čāą╗ąĖ ą┐ąŠą╗č¢ą╝ąĄčĆčā, čāčéą▓ąŠčĆčÄčÄčćąĖ ą╣ąŠą│ąŠ ą║č¢ąĮčåąĄą▓čā ą│čĆčāą┐čā:
H2C=CH2 + RŌĆó ŌåÆ R-CH2-CH2ŌĆó + H2C=CH2 ŌåÆ R-CH2-CH2-CH2-CH2ŌĆó + H2C=CH2 ŌåÆ …
ą×ą▒čĆąĖą▓ ą╗ą░ąĮčåčÄą│ą░ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą┐čĆąĖ ąĘč¢čéą║ąĮąĄąĮąĮč¢ ą░ą▒ąŠ ąĘ ą╝ąŠą╗ąĄą║čāą╗ąŠčÄ čĆąĄą│čāą╗čÅč鹊čĆą░ čĆąŠčüčéčā ą╗ą░ąĮčåčÄą│ą░ (čÅą║ąĖą╝ ą╝ąŠąČąĄ ą▒čāčéąĖ čüą┐ąĄčåč¢ą░ą╗čīąĮąŠ ą┤ąŠą┤ą░ąĮąĖą╣ čĆąĄą░ą│ąĄąĮčé, čēąŠ ą╗ąĄą│ą║ąŠ ą▓č¢ą┤ą┤ą░čö ą░č鹊ą╝ ą│č¢ą┤čĆąŠą│ąĄąĮčā ą░ą▒ąŠ ą│ą░ą╗ąŠą│ąĄąĮčā), ą░ą▒ąŠ ąĘ ą╝ąŠą╗ąĄą║čāą╗ąŠčÄ ą╝ąŠąĮąŠą╝ąĄčĆą░.
ąåąŠąĮąĮą░ (ą║ą░čéč¢ąŠąĮąĮą░ č¢ ą░ąĮč¢ąŠąĮąĮą░) ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ąĘą░ą▓ą┤čÅą║ąĖ čāčéą▓ąŠčĆąĄąĮąĮčÄ ąĘ ą╝ąŠą╗ąĄą║čāą╗ ą╝ąŠąĮąŠą╝ąĄčĆą░ čĆąĄą░ą║čåč¢ą╣ąĮąŠąĘą┤ą░čéąĮąĖčģ č¢ąŠąĮč¢ą▓.
ąÜą░čéą░ą╗č¢ąĘą░č鹊čĆą░ą╝ąĖ ą║ą░čéč¢ąŠąĮąĮąŠčŚ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ čö ą║ąĖčüą╗ąŠčéąĖ, ą░ą╗čÄą╝č¢ąĮč¢ą╣ čģą╗ąŠčĆąĖą┤, ą▒ąŠčĆ čģą╗ąŠčĆąĖą┤ č¢ čé.ą┤. ą¤čĆąĖ ą║ą░čéą░ą╗č¢čéąĖčćąĮč¢ą╣ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆ ąĘą░ąĘą▓ąĖčćą░ą╣ čĆąĄą│ąĄąĮąĄčĆčāčö č¢ ąĮąĄ ą▓čģąŠą┤ąĖčéčī ą┤ąŠ čüą║ą╗ą░ą┤čā ą┐ąŠą╗č¢ą╝ąĄčĆčā. ą¤čĆąŠčåąĄčü čéą░ą║ąŠąČ ą╝ąŠąČąĄ ą╝ą░čéąĖ ą╗ą░ąĮčåčÄą│ąŠą▓ąĖą╣ čģą░čĆą░ą║č鹥čĆ č¢ ą▓č¢ą┤ą▒čāą▓ą░čéąĖčüčī ąĘ ą┤čāąČąĄ ą▓ąĄą╗ąĖą║ąŠčÄ čłą▓ąĖą┤ą║č¢čüčéčÄ. ąóąŠą╝čā č¢ąŠąĮąĮčā ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÄ ą┐čĆąŠą▓ąŠą┤čÅčéčī ą┐čĆąĖ ąĮąĖąĘčīą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ.
ą£ąĄčģą░ąĮč¢ąĘą╝ ą║ą░čéč¢ąŠąĮąĮąŠčŚ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ąĄčéąĖą╗ąĄąĮčā ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ AlCl3 č¢ čüą╗č¢ą┤č¢ą▓ HCl:
H2C=CH2 + HAlCl4 ŌåÆ H3C-C+H2 + AlCl4–
H3C-C+H2 + nH2C=CH2 ŌåÆ H3C-CH2-(-CH2-CH2-)+n
ą×ą▒čĆąĖą▓ ą╗ą░ąĮčåčÄą│ą░ ą╝ąŠąČąĄ čüčéą░čéąĖčüčÅ č湥čĆąĄąĘ ąĘą░čģąŠą┐ą╗ąĄąĮąĮčÅ ąĘčĆąŠčüčéą░čÄčćąĖą╝ ą┐ąŠą╗č¢ą╝ąĄčĆąĮąĖą╝ ą║ą░čéč¢ąŠąĮąŠą╝, ą░ąĮč¢ąŠąĮą░ ą░ą▒ąŠ č湥čĆąĄąĘ ą▓čéčĆą░čéčā ą┐čĆąŠč鹊ąĮčā č¢ čāčéą▓ąŠčĆąĄąĮąĮčÅ ą║č¢ąĮčåąĄą▓ąŠą│ąŠ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā.
ąÜą░čéą░ą╗č¢ąĘą░č鹊čĆąĖ ą░ąĮč¢ąŠąĮąĮąŠčŚ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ čåąĄ ą╗čāąČąĮč¢ ą╝ąĄčéą░ą╗ąĖ, ą╝ąĄčéą░ą╗ąŠąŠčĆą│ą░ąĮč¢čćąĮč¢ čüą┐ąŠą╗čāą║ąĖ, ą░ą╝č¢ą┤ąĖ ą╗čāąČąĮąĖčģ ą╝ąĄčéą░ą╗č¢ą▓ č¢ čé.ą┤.
ą£ąĄčģą░ąĮč¢ąĘą╝ ą░ąĮč¢ąŠąĮąĮąŠčŚ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ą┐č¢ą┤ ą▓ą┐ą╗ąĖą▓ąŠą╝ ą╝ąĄčéą░ą╗-ą░ą╗ą║č¢ą╗č¢ą▓:
H2C=CH2 + R-Me ŌåÆ [R-CH2-CH2]–Me+
[R-CH2-CH2]–Me+ + nH2C=CH2 ŌåÆ [R-CH2-CH2-(CH2-CH2)n]–Me+
ąÆąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčćąĖ ą░ąĮč¢ąŠąĮąĮčā ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÄ ąŠčéčĆąĖą╝čāčÄčéčī ą┐ąŠą╗č¢ąĄčéąĖą╗ąĄąĮ ąĮąĖąĘčīą║ąŠą│ąŠ čéąĖčüą║čā (ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓ R2AlCl č¢ TiCl3).
ąØą░ čĆąĄą░ą║čåč¢čÄ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ čüąĖą╗čīąĮąŠ ą▓ą┐ą╗ąĖą▓ą░čö ąĮą░čÅą▓ąĮč¢čüčéčī ą▓ ą╝ąŠąĮąŠą╝ąĄčĆč¢ ąĮąĄąĘąĮą░čćąĮąĖčģ ą┤ąŠą╝č¢čłąŠą║. ąöąĄčÅą║č¢ ą┤ąŠą╝č¢čłą║ąĖ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą▒ą░ą│ą░č鹊ą░č鹊ą╝ąĮč¢ č乥ąĮąŠą╗ąĖ, ą░čĆąŠą╝ą░čéąĖčćąĮč¢ ą░ą╝č¢ąĮąĖ, čģč¢ąĮąŠąĮąĖ, ąĘą┤ą░čéąĮč¢ ąĘą░čéčĆąĖą╝čāą▓ą░čéąĖ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÄ. ąóą░ą║č¢ čĆąĄč湊ą▓ąĖąĮąĖ ąĮą░ąĘąĖą▓ą░čÄčéčīčüčÅ č¢ąĮą│č¢ą▒č¢č鹊čĆąĖ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ (čüą┐ąŠą▓č¢ą╗čīąĮčÄą▓ą░čćč¢). ąåąĮą│č¢ą▒č¢č鹊čĆąĖ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą┐čĆąĖ ąĘą▒ąĄčĆč¢ą│ą░ąĮąĮč¢ ą╝ąŠąĮąŠą╝ąĄčĆč¢ą▓.
ąÆ čĆąĄąĘčāą╗čīčéą░čéč¢ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ ą╝ąŠąČčāčéčī čāčéą▓ąŠčĆčÄą▓ą░čéąĖčüčī čĆč¢ą┤ą║č¢ čĆąĄč湊ą▓ąĖąĮąĖ čĆč¢ąĘąĮąŠčŚ ą║ąŠąĮčüąĖčüč鹥ąĮčåč¢čŚ ą░ą▒ąŠ čéą▓ąĄčĆą┤č¢ čĆąĄč湊ą▓ąĖąĮąĖ. ąŚą╝č¢ąĮčÄčÄčćąĖ čāą╝ąŠą▓ąĖ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čŚ, ą░ čéą░ą║ąŠąČ ąĘą░čüč鹊čüąŠą▓čāčÄčćąĖ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÄ čüčāą╝č¢čłč¢ čĆč¢ąĘąĮąĖčģ čĆąĄč湊ą▓ąĖąĮ, ą╝ąŠąČąĮą░ ąŠčéčĆąĖą╝čāą▓ą░čéąĖ ą┐čĆąŠą┤čāą║čéąĖ ąĘ ąĘą░ą┤ą░ąĮąĖą╝ąĖ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéčÅą╝ąĖ.
ąÆ ą┐ąĄą▓ąĮąĖčģ čāą╝ąŠą▓ą░čģ ą┐ąŠą╗č¢ą╝ąĄčĆąĖąĘą░čåč¢čÅ ą╝ąŠąČąĄ ą▒čāčéąĖ ą┐čĆąĖą┐ąĖąĮąĄąĮą░ ąĮą░ čĆą░ąĮąĮč¢čģ čüčéą░ą┤č¢čÅčģ ą┐čĆąŠčåąĄčüčā ą▓ čĆąĄąĘčāą╗čīčéą░čéč¢ ąŠą▒čĆąĖą▓čā čĆąĄą░ą║čåč¢ą╣ąĮąŠą│ąŠ ą╗ą░ąĮčåčÄą│ą░.
ąĀąŠąĘčĆč¢ąĘąĮčÅčÄčéčī čéčĆąĖ čéąĖą┐ąĖ čéą▓ąĄčĆą┤ąĖčģ ą┐ąŠą╗č¢ą╝ąĄčĆč¢ą▓:
- ąĄą╗ą░čüč鹊ą╝ąĄčĆąĖ (ą║ą░čāčćčāą║ąĖ);
- č鹥čĆą╝ąŠą┐ą╗ą░čüčéąĖ (ąĮą░ą▒čāą▓ą░čÄčéčī ą┐ą╗ą░čüčéąĖčćąĮąŠčüčéč¢ ą┐č¢ą┤ ą┤č¢čöčÄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĖ);
- č鹥čĆą╝ąŠčĆąĄą░ą║čéąĖą▓ąĮč¢ ą┐ąŠą╗č¢ą╝ąĄčĆąĖ (ą┐čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢ ą▓čéčĆą░čćą░čÄčéčī ą┐ą╗ą░čüčéąĖčćąĮč¢čüčéčī č¢ čĆąŠąĘčćąĖąĮąĮč¢čüčéčī).
ą¤ąŠą╗č¢ą╝ąĄčĆąĖ, čēąŠ ą╝č¢čüčéčÅčéčī ą░čüąĖą╝ąĄčéčĆąĖčćąĮč¢ ą░č鹊ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā, ą╝ąŠąČčāčéčī ą▒čāčéąĖ ą┐čĆąŠčüč鹊čĆąŠą▓ąŠ ą▓ą┐ąŠčĆčÅą┤ą║ąŠą▓ą░ąĮąĖą╝ąĖ (čüč鹥čĆąĄąŠčĆąĄą│čāą╗čÅčĆąĮąĖą╝ąĖ) – čüč¢ąĮą┤č¢ąŠčéą░ą║čéąĖčćąĮč¢ ą┐ąŠą╗č¢ą╝ąĄčĆąĖ čéą░ č¢ąĘąŠčéą░ą║čéąĖčćąĮč¢ ą┐ąŠą╗č¢ą╝ąĄčĆąĖ ą░ą▒ąŠ ąĮąĄą▓ą┐ąŠčĆčÅą┤ą║ąŠą▓ą░ąĮąĖą╝ąĖ – ą░čéą░ą║čéąĖčćąĮč¢ ą┐ąŠą╗č¢ą╝ąĄčĆąĖ.
ąåąĘąŠą╝ąĄčĆąĖąĘą░čåč¢čÅ ą░ą╗ą║ąĄąĮč¢ą▓. ąŚą░ ą▓ąĖčüąŠą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ ą░ą▒ąŠ ą▓ ą┐čĆąĖčüčāčéąĮąŠčüčéč¢ ą║ą░čéą░ą╗č¢ąĘą░č鹊čĆč¢ą▓ ą░ą╗ą║ąĄąĮąĖ ąĘą┤ą░čéąĮč¢ ą┤ąŠ č¢ąĘąŠą╝ąĄčĆąĖąĘą░čåč¢čŚ. ą¤čĆąĖ čåčīąŠą╝čā ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą░ą▒ąŠ ą┐ąĄčĆąĄą╝č¢čēąĄąĮąĮčÅ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā (ąĘą░ąĘą▓ąĖčćą░ą╣ ą▓ čåąĄąĮčéčĆ ą╝ąŠą╗ąĄą║čāą╗ąĖ), ą░ą▒ąŠ ąĘą╝č¢ąĮą░ ą▒čāą┤ąŠą▓ąĖ ą║ą░čĆą▒ąŠąĮąŠą▓ąŠą│ąŠ ą╗ą░ąĮčåčÄą│ą░, ą░ą▒ąŠ ąŠą┤ąĮąŠčćą░čüąĮąŠ ąŠą▒ąĖą┤ą▓ą░ ą┐čĆąŠčåąĄčüąĖ.
ąŚą░čüč鹊čüčāą▓ą░ąĮąĮčÅ ą░ą╗ą║ąĄąĮč¢ą▓
ąĢč鹥ąĮ ą▓ ą▓ąĄą╗ąĖą║ąĖčģ ą║č¢ą╗čīą║ąŠčüčéčÅčģ ą▓ąĖą┤č¢ą╗čÅčÄčéčī ąĘ ą│ą░ąĘč¢ą▓ ą║čĆąĄą║č¢ąĮą│čā č¢ ą║ąŠą║čüčāą▓ą░ąĮąĮčÅ č¢ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą┤ą╗čÅ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą┐ąŠą╗č¢ą╝ąĄčĆč¢ą▓ (ą┐ąŠą╗č¢ąĄč鹥ąĮ, ą┐ąŠą╗č¢ą▓č¢ąĮč¢ą╗čģą╗ąŠčĆąĖą┤), čĆąŠąĘčćąĖąĮąĮąĖą║č¢ą▓ (čüą┐ąĖčĆčé, ą┤ąĖčģą╗ąŠčĆąĄčéą░ąĮ, ąĄč鹥čĆąĖ ą┤č¢ąŠą╗č¢ą▓), “ą░ąĮčéąĖčäčĆąĖąĘč¢ą▓” (čĆč¢ą┤ąĖąĮąĖ ąĘąĮąĖąČčāčÄčéčī č鹥ą╝ą┐ąĄčĆą░čéčāčĆčā ąĘą░ą╝ąĄčƹʹ░ąĮąĮčÅ ą▓ąŠą┤ąĖ), ąŠčåč鹊ą▓ąŠą│ąŠ ą░ą╗čīą┤ąĄą│č¢ą┤čā č¢ ąŠčåč鹊ą▓ąŠčŚ ą║ąĖčüą╗ąŠčéąĖ.
ą¤čĆąŠą┐ąĄąĮ ą▓ąĖą┤č¢ą╗čÅčÄčéčī ąĘ ą┐čĆąŠą╝ąĖčüą╗ąŠą▓ąĖčģ ą│ą░ąĘč¢ą▓ č¢ ąĘą░čüč鹊čüąŠą▓čāčÄčéčī ą│ąŠą╗ąŠą▓ąĮąĖą╝ čćąĖąĮąŠą╝ ą┤ą╗čÅ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą┐ąŠą╗č¢ą┐čĆąŠą┐ąĄąĮčā č¢ č¢ąĘąŠą┐čĆąŠą┐č¢ą╗ąŠą▓ąŠą│ąŠ čüą┐ąĖčĆčéčā (ą┤ą╗čÅ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą░čåąĄč鹊ąĮčā). ąÆąĖčģąŠą┤čÅčćąĖ ąĘ ą┐čĆąŠą┐ąĄąĮčā ą╝ąŠąČąĮą░ ąŠčéčĆąĖą╝ą░čéąĖ ą░ą║čĆąĖą╗ąŠąĮč¢čéčĆąĖą╗, ą│ą╗č¢čåąĄčĆąŠą╗ č¢ č乥ąĮąŠą╗.
ąæčāč鹥ąĮąĖ ąĘ ąĮąŠčĆą╝ą░ą╗čīąĮąŠčÄ ą▒čāą┤ąŠą▓ąŠčÄ ą┐ąĄčĆąĄčĆąŠą▒ą╗čÅčÄčéčīčüčÅ ąĮą░ ą┤ąĖą▓č¢ąĮč¢ą╗ (ąĮą░ą╣ą▓ą░ąČą╗ąĖą▓č¢čłąĖą╣ ą╝ąŠąĮąŠą╝ąĄčĆ čā ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓č¢ čüąĖąĮč鹥čéąĖčćąĮąŠą│ąŠ ą║ą░čāčćčāą║čā). ąśąĘąŠą▒čāč鹥ąĮ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčī ą┤ą╗čÅ čüąĖąĮč鹥ąĘčā č¢ąĘąŠą┐čĆąĄąĮčā (ą╝ąŠąĮąŠą╝ąĄčĆ čā ą▓ąĖčĆąŠą▒ąĮąĖčåčéą▓č¢ ąĖąĘąŠą┐čĆąĄąĮąŠą▓ąŠą│ąŠ ą║ą░čāčćčāą║čā), ą▓ąĖčüąŠą║ąŠąŠą║čéą░ąĮąŠą▓ąŠą│ąŠ ą┐ą░ą╗ąĖą▓ą░ (ąĖąĘąŠąŠą║čéą░ąĮą░), ą┐ąŠą╗č¢č¢ąĘąŠą▒čāč鹥ąĮčā.
ąÉą╝č¢ą╗ąĄąĮąĖ ąĘ ąĮąŠčĆą╝ą░ą╗čīąĮąŠčÄ ą▒čāą┤ąŠą▓ąŠčÄ č¢ąĘąŠą╝ąĄčĆąĖąĘčāčÄčéčīčüčÅ ą▓ č¢ąĘąŠą░ą╝č¢ą╗ąĄąĮąĖ, č¢ ąŠčüčéą░ąĮąĮč¢ ą┤ąĄą│č¢ą┤čĆčāčÄčéčīčüčÅ ą▓ č¢ąĘąŠą┐čĆąĄąĮ.
ą×ą┤ąĖąĮ ąĘ ą▓ąĖčēąĖčģ ą│ąŠą╝ąŠą╗ąŠą│č¢ą▓ ąĄčéąĖą╗ąĄąĮčā čåąĖčü-9-čéčĆąĖą║ąŠąĘąĄąĮ H3C-(CH2)12-CH=CH-(CH2)7-CH3 – čĆąĄč湊ą▓ąĖąĮą░ (č乥čĆąŠą╝ąŠąĮ), čēąŠ ą┐čĆąĖą▓ą░ą▒ą╗čÄčö čüą░ą╝čåč¢ą▓ ą┤ąŠą╝ą░čłąĮčīąŠčŚ ą╝čāčģąĖ. ąÆąŠąĮą░ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčöčéčīčüčÅ ą┤ą╗čÅ ą┐čĆąĖą┐ąĖąĮąĄąĮąĮčÅ čŚčģ čĆąŠąĘą╝ąĮąŠąČąĄąĮąĮčÅ.










