Термин валентность был введен в химию в 1853 году английским химиком-органиком Франклендом для обоснования количественных соотношений атомов элементов в химических соединениях. Развитие учения о валентности в большой степени связано с открытием Д.И. Менделеевым Периодического закона (1869 год). Им была установлена связь между валентностью элемента и его положением в Периодической системе, введено понятие о переменной валентности элементов в их соединениях с кислородом и водородом. Учение о строении атомов и молекул способствовало разработке электронной теории валентности.
Стехиометрическая валентность
Для стехиометрических расчетов, а также для составления химических формул и уравнений необходимо знание количественных соотношений атомов различных элементов, в которых они соединяются или реагируют. Такая информация передается значением стехиометрической валентности или валентностью.
Стехиометрическая валентность (валентность) элемента показывает, со сколькими атомами одновалентного элемента соединяется атом данного элемента
Одновалентными считаются все элементы, атомы которых в двухэлементных соединениях всегда связаны с одним атомом другого элемента. Примером одновалентного элемента является водород H. Поэтому считается, что стехиометрическая валентность элемента указывает на то, со сколькими атомами водорода соединен один атом рассматриваемого элемента. Так, в HCl хлор – одновалентен, в H2O кислород – двухвалентен, в NH3 азот – трехвалентен.
Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом O. Кислород как правило стехиометрически двухвалентен и по составу кислородных соединений других элементов можно определить валентность этих элементов. Считают, что все оксиды можно получить формальным замещением атомов водорода в воде на атомы других элементов. Например, из сравнения формул H2O и Na2O или H2O и CaO делают заключение об одновалентности натрия и двухвалентности кальция.
Стехиометрическая валентность (валентность) элемента определяется числом атомов водорода, которое может быть присоединено или замещено одним атомом данного элемента.
Многие элементы проявляют несколько стехиометрических валентностей, т.е. они могут образовывать с некоторым другим элементом несколько соединений разного стехиометрического состава. Для описания таких соединений в их названиях необходимо либо указывать валентность этих элементов (римской цифрой без знака “+” или “-”), либо стехиометрический состав. Для соединений металлов предпочтителен первый способ, а для соединений неметаллов – второй. Например Cu2O – оксид меди(I), CuO – оксид меди(II), SO2 – диоксид серы, SO3 – триоксид серы.
Исходя из принципа, что в химическом двухэлементном соединении валентности элементов взаимно скомпенсированы, путем несложного арифметического расчета можно определить валентность одного элемента, если известен состав соединения и валентность другого элемента. Зная, что водород одновалентен (HI), можно найти валентность остальных элементов в следующих соединениях: NaIH, BeIIH2, BIII2H6, CIVH4, NIIIH3, H2SII, HClI.
Аналогично, учитывая двухвалентность кислорода (OII), определяют валентность остальных элементов в оксидах: NaI2O, BeIIO, BIII2O3, CIVO2, NV2O5, SVIO3, ClVII2O7, CIIO, NIII2O3, SIVO2, ClI2O.
Если известны стехиометрические валентности обоих элементов в соединениях, то можно составить их химические суммарные формулы. Следует учесть, что ни сама стехиометрическая валентность, ни суммарные формулы ничего не говорят о типе химической связи в соединениях и тем более о наличии или строении молекул.
Понятие о стехиометрической валентности было введено в химию до того, как стало известно строение атома. А настоящее время установлено, что это свойство элемента тесно связано с числом внешних электронов. Для многих элементов максимальная валентность вытекает из положения этих элементов в Периодической системе.
Заряд ионов
Электрический заряд ионов (обозначаемый в формулах арабской цифрой с последующим знаком “+” или “-”) определяет, в каком соотношении эти ионы находятся в кристаллической решетке ионного соединения.
Пример. В соответствии с зарядом катионов и анионов соединения, содержащие эти ионы, имеют следующий состав:
|
Ионы |
Na+ |
Ca2+ |
Al3+ |
|
F– |
NaF |
CaF2 |
AlF3 |
|
O2- |
Na2O |
CaO |
Al2O3 |
|
N3- |
Na3N |
Ca3N2 |
AlN |
|
NO3– |
NaNO3 |
Ca(NO3)2 |
Al(NO3)3 |
|
SO42- |
Na2SO4 |
CaSO4 |
Al2(SO4)3 |
|
PO43- |
Na3PO4 |
Ca3(PO4)2 |
AlPO4 |
В старой литературе заряд ионов называли ионная валентность.
Между зарядом одноэлементных ионов и числом валентных электронов нейтральных атомов элементов имеется непосредственная связь:
положительный заряд иона равен числу электронов, отданных одним атомом элемента; отрицательный заряд иона равен числу электронов, принятых одним атомом элемента
Пример. Записи Na+, Ca2+, Al3+ означают, что атомы этих элементов потеряли (отдали) соответственно 1, 2, 3 электрона, а записи F–, O2-, N3- означают, что атомы этих элементов приобрели (приняли) соответственно 1, 2, 3 электрона.
Степень окисления элементов
Для определения состава молекулярных (SO2, NH3, CO2, H2SO4, HNO3, H2CO3 и др.) и ионных простых соединений (Na2O, Na2SO4 и др.), а также комплексных соединений введено понятие степень окисления химических элементов. При оценке степени окисления химических элементов соединения представляют расщепленными на одноатомные ионы независимо от типа связи между атомами (чисто ковалентная, ковалентная полярная, ионная).
Степень окисления элементов – это электрический заряд, который может нести атом элемента в соединении при условии, что все связи ионные.
Отсюда следует, что для одноатомных ионов значения их заряда и степени окисления элементов совпадают по числу и по знаку. Степень окисления элементов обозначают римской цифрой с предшествующим знаком “+” или “-”. Например, запись степени окисления для соединений NaCl, K2SO4, Al2O3:
Na+ICl-I или NaICl-I
K+I2S+VIO-II4 или KI2SVIO-II4
Al+III2O-II3 или AlIII2O-II3
Запись зарядов ионов для соединений NaCl, K2SO4, Al2O3:
Na+Cl– или Na1+Cl1- (обычно единичный заряд не пишут цифрой, но если цифра 1 указана, это не считается ошибкой)
K+2SO42-
Al3+2O2-3
Обратите внимание, заряд многоатомного иона относится к группе атомов (например кислотному остатку или комплексному иону), поэтому если в молекуле несколько одинаковых групп атомов, заряд группы атомов указывается до индекса обозначающего количество этих групп и только после индекса, обозначающего количество каких либо атомов в составе группы:
H+2SO42- = 2H+ + SO42- (запись SO2-4 будет не верной)
Al3+2(SO42-)3 = 2Al3+ + 3SO42-
Обычно степени окисления указывают в суммарных формулах ионных соединений, а ионные заряды – в формулах свободных ионов (существующих в газе, в растворе, в расплаве).
Степень окисления в молекулах – как определить степень окисления химических элементов в молекуле?
Для определения степени окисления элементов в соединениях, построенных из молекул, необходимо мысленно разделить молекулу на одноатомные ионы. При этом, учитывая полярность ковалентных связей, общие электронные пары следует передать полностью атомам более электроотрицательного элемента, а при наличии чисто ковалентной связи электронные пары следует разделить пополам между двумя связанными атомами. Таким путем определяют электрический заряд каждого атома элемента в соединении, т.е. степень окисления элемента.
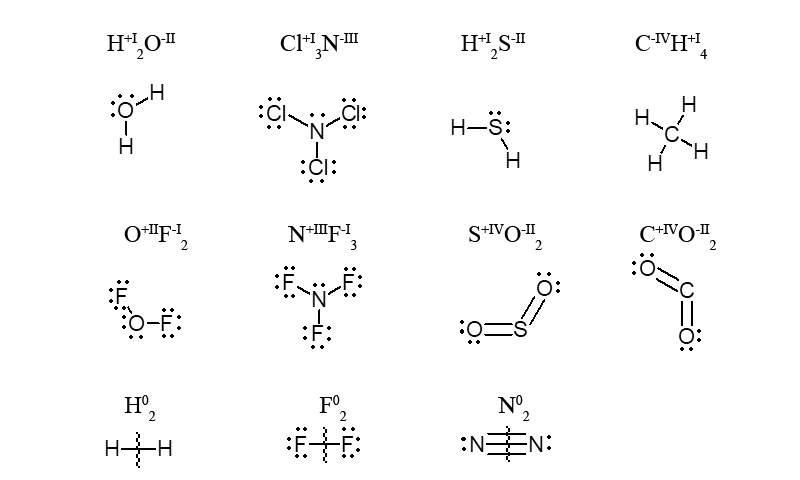
В большинстве соединений кислород как сильно электроотрицательный элемент обладает степенью окисления (-II), он оттягивает на себя обе общие пары электронов и, следовательно, приобретает на свой внешний энергетический уровень два лишних электрона (8e– вместо 6e–). Однако в OF2 степень окисления кислорода иная, а именно, равна (+II), потому, что атом фтора более электроотрицательный элемент чем кислород, он оттягивает электрон кислорода на себя. В простых веществах (H2, F2, N2) элемент их образующий имеет степень окисления, равную нулю.
В молекуле алгебраическая сумма степеней окисления элементов с учетом числа их атомов равна нулю
Пример. В молекуле нитрида хлора Cl3N общий заряд трех атомов трех атомов хлора равен (+3), а заряд одного атома азота (-3), что в сумме дает общий заряд молекулы 0.
Степень окисления в ионах
Для определения степеней окисления элементов в многоэлементных ионах, последние так же, как и молекулы, надо разделить на одноатомные ионы, используя выше приведенные указания.
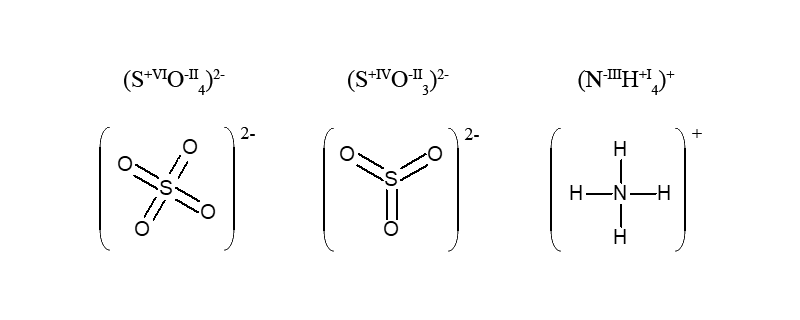
В сульфат-ионе SO42- атомы кислорода оттягивают на себя все электроны атома серы, который вместо 6e– (в нейтральном атоме) не имеет их совсем в состоянии S+VI.
В многоэлементном ионе, алгебраическая сумма степеней окисления элементов с учетом числа их атомов равна заряду иона
Пример. В катионе аммония общий заряд четырех атомов водорода равен (+4), а заряд атома азота (-3), что дает в сумме (+1), т.е. заряд иона NH4+.
В комплексных ионах степень окисления центрального атома легко установить, вычитая из заряда всего иона общий заряд лигандов. Примеры.
[Al+III(OH–)4]–; [Cu+II(NH30)4]2+; [Fe+II(CN–)6]4-
Заряд комплекса [Al+III(OH–)4]– равен (-1) и общий заряд лигандов составляет (-4), отсюда (-1) – (-4) = +3, т.е. атом алюминия в этом комплексе находится в состоянии AlIII.
Как определить степень окисления элементов в соединении с помощью арифметического расчета
Установление степеней окисления элементов по электронным формулам молекул и сложных ионов часто осложняется практическими трудностями составления самих электронных формул. Степень окисления элементов в большинстве соединений можно оценить арифметическим расчетом, если некоторым элементам заранее придать определенные значения степеней окисления.
Правила определения степени окисления элемента в соединении:
- Элемент в простом веществе имеет нулевую степень окисления;
- Все металлы в соединениях имеют положительную степень окисления;
- Бор и кремний в соединениях имеют положительные степени окисления;
- Водород в соединениях имеет степень окисления (+I);
- Кислород в соединениях имеет степень окисления (-II);
- Фтор в соединениях имеет степень окисления (-I).
Эти правила, за исключением первого и последнего имеют некоторые исключения. Так, степень окисления водорода в гидридах равна (-I), например в Na+IH-I; степень окисления кислорода в соединении OF2 составляет (+II), а в соединении H2O2 (-I).
Примеры.
H3PO4: 3 * (+1) – 4 * (-2) = +5 следовательно P+V
H2(PHO3): 2 * (+1) + 1 * (+1) – 3 * (-2) = +3 следовательно P+III
H(PH2O3): 1 * (+1) + 2 * (+1) – 2 * (-2) = +1 следовательно P+I
(распространенные значения и нераспространенные значения)
В органической химии, как правило, степенями окисления углерода не оперируют, но если необходимо, то их оценивают по тем же правилам. При этом степень окисления углерода находят для каждого атома отдельно.
Примеры.
Метан C-IVH4
Этан C-IIIH3-C-IIIH3
Пропан C-IIIH3-C-IIH2-C-IIIH3
Этанол C-IIIH3-C-IH2OH
Ацетальдегид C-IIIH3-C+IHO
Уксусная кислота C-IIIH3-C+IIIOOH
Наиболее важное применение степеней окисления элементов – это их использование при подборе стехиометрических коэффициентов в окислительно-восстановительных реакциях. Отсюда и само название – степень окисления.
Ковалентность атомов
В учении о строении атомов и молекул важнейшим теоретическим понятием является ковалентность атома (в зарубежной литературе используется термин связность атома) в молекуле.
Ковалентность атома – это число ковалентных связей, образуемых данным атомом
С точки зрения метода валентных связей, в котором все ковалентные связи рассматриваются как двухцентровые,
ковалентность атома – это число общих электронных пар, образуемых данным атомом.
Ковалентность атома – всегда целое число; для двухатомных частиц она равна кратности связи.
Примеры.
Из электронных формул таких молекул, как H2, F2, N2, следует, что атомы H и F – одновалентные, а атом N – трехвалентный. В соединениях H2O и OF2 атом O двухвалентный, а атомы H и F – одновалентные. В соединениях Cl3N и NH4+ атом N соответственно трех- и четырех-валентный, хотя степень окисления азота одна и та же N-III. В органических соединениях CH4, C2H6, C2H4, C2H2 и других атом углерода четырехвалентен, хотя степень окисления атома углерода может отличаться.
Ковалентность атома может не совпадать со значением степени окисления данного атома в соединениях
Для многоатомных частиц типа SO2, CO2, SO42-, SO32-, C6H6, в которых π-связи предпочтительнее рассматривать как многоцентровые и делокализованные, подсчет числа общих электронных пар для отдельных атомов теряет свой смысл, а число валентностей ничего не говорит о ковалентности атомов.
Условно считают, что SO2, CO2, SO32-, C6H6 атомы S и C – четырехвалентные, а в SO42- атом S – шестивалентный и относят ковалентность к степеням окисления этих атомов без учета знака. Особенно наглядно это положение (проявляемые степени окисления и ковалентность его атомов) можно проследить на примере кислородсодержащих кислот хлора:
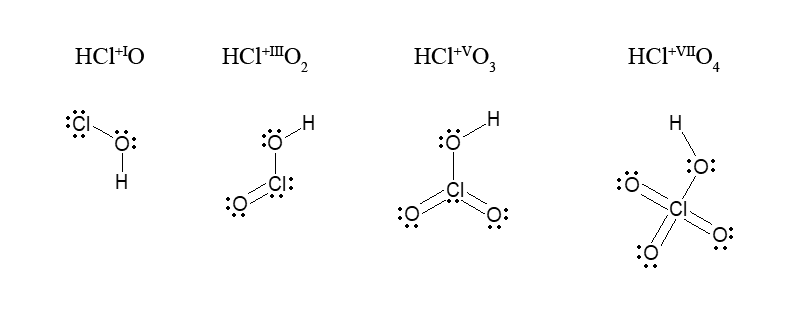
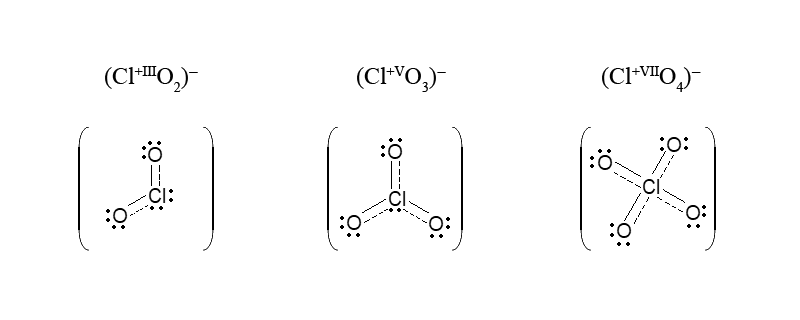
В молекуле HClO, к которой только и применимо понятие о ковалентности (отсутствуют делокализованные π-связи), степень окисления хлора (Cl+I) и ковалентность атома Cl (1) совпадают. Условно совпадают они и у кислот HClO2, HClO3, HClO4: степень окисления хлора соответственно равна +III, +V, +VII, таким же числам (3, 5, 7) соответствуют общие электронные пары. Однако при переходе от молекул этих трех кислот к их анионам электронное окружение центрального атома хлора становится иным, и ковалентность связи атома хлора повышается:
В методе молекулярных орбиталей для частиц, состоящих из двух атомов, ковалентность атомов передается порядком связи.
Порядок связи в двухатомных частицах равен полуразности между числом связывающих и числом разрыхляющих электронов
Примеры. В молекулах H2, F2, HCl порядок связи H-H, F-F, H-Cl равен 1, в молекуле O2 – 2, в молекуле N2 и CO – 3.
Порядок связи (в отличие от кратности связи) может быть и целочисленным и дробным. Во всех предыдущих примерах суммарное число валентных электронов для двух атомов было четным, потому и порядок связи оказывается целым (1, 2, 3). Однако в частице NO порядок связи равен (6 – 1) / 2 = 2,5. Для таких частиц с дробным порядком связи невозможно изобразить электронные формулы.
Формальный заряд атома
Для уточнения предельных значений эффективного заряда на атомах в молекулах введено понятие формальный заряд атома. Для оценки формального заряда атома принимают, что все связи в молекуле число ковалентные, общие электронные пары делят между связанными атомами и сравнивают число электронов связанного и свободного нейтрального атома.
Формальный заряд атома – это разность между числом валентных электронов у свободного нейтрального атома и у связанного атома при условии, что все его связи с другими атомами чисто ковалентные
Формальный заряд обозначают арабской цифрой с предшествующим знаком “+” или “-”. Сумма формальных зарядов всех атомов в молекуле равна нулю, а в многоатомном ионе – его реальному заряду.
Пример.
В молекуле CO формальный заряд атомов равен C-1O+1; для сравнения даны оценка степени окисления элементов и значения эффективных зарядов на атомах C+IIO-II; C0,02-O0,02+. В соответствии с теорией ковалентной связи формальный заряд, например, на атоме углерода изменяется от (-1) при условии чисто ковалентной связи до (+2) при условии чисто ионной связи (степень окисления – это так же условный, т.е. в определенном смысле формальный заряд). В действительности экспериментальное значение эффективного заряда на атоме углерода равно (-0,02), т.е. находится в пределах от (-1) до (+2).
Для большинства молекул оценка формальных зарядов приводит к нулевым значениям, например, H0Cl0 (H+ICl-I, H0,17+Cl0,17-), H02S0 (H+I2S-II, H0,1+2S0,1-), S0Cl02 (S+IICl02, S0,2+Cl0,1-2), в то время как в ионах атом хотя бы одного элемента формально заряжен, например в катионе аммония (N+1H04)+, (N-IIIH+I4)+.










