ąÉč鹊ą╝ąĖ ą│č¢ą┤čĆąŠą│ąĄąĮčā, čÅą║č¢ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠ ą┐ąŠą▓’čÅąĘą░ąĮč¢ ąĘ ą░č鹊ą╝ąŠą╝ ąĄą╗ąĄą╝ąĄąĮčéą░, čēąŠ ą╝ą░čö ą▒č¢ą╗čīčłčā ąĄą╗ąĄą║čéčĆąŠąĮąĄą│ą░čéąĖą▓ąĮč¢čüčéčī (ąĮą░ą╣čćą░čüčéč¢čłąĄ F, O, N, ą░ čéą░ą║ąŠąČ Cl, S, C), ąĮąĄčüčāčéčī ąĮą░ čüąŠą▒č¢ ą▓č¢ą┤ąĮąŠčüąĮąŠ ą▓ąĖčüąŠą║ąĖą╣ ąĄč乥ą║čéąĖą▓ąĮąĖą╣ ąĘą░čĆčÅą┤. ąÆąĮą░čüą╗č¢ą┤ąŠą║ čåčīąŠą│ąŠ čéą░ą║č¢ ą░č鹊ą╝ąĖ ą│č¢ą┤čĆąŠą│ąĄąĮčā ą╝ąŠąČčāčéčī ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąŠ ą▓ąĘą░čöą╝ąŠą┤č¢čÅčéąĖ ąĘ ą░č鹊ą╝ą░ą╝ąĖ ąĘą░ąĘąĮą░č湥ąĮąĖčģ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓. ąóą░ą║, ą░č鹊ą╝ H╬┤+ ąŠą┤ąĮč¢čöčŚ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą▓ąŠą┤ąĖ ąŠčĆč¢čöąĮčéčāčöčéčīčüčÅ č¢ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą▓ąĘą░čöą╝ąŠą┤č¢čö (čéą░ą║ą░ ą▓ąĘą░čöą╝ąŠą┤č¢čÅ ą┐ąŠąĘąĮą░čćą░čöčéčīčüčÅ čéčĆčīąŠą╝ą░ ą║čĆą░ą┐ą║ą░ą╝ąĖ) ąĘ ą░č鹊ą╝ąŠą╝ O╬┤- č¢ąĮčłąŠčŚ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą▓ąŠą┤ąĖ
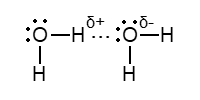
ąŻ čéą▓ąĄčĆą┤č¢ą╣ ą▓ąŠą┤č¢ (ą╗č¢ą┤) ą║ąŠąČąĮąĖą╣ ą░č鹊ą╝ O č鹥čéčĆą░ąĄą┤čĆąĖčćąĮąŠ ąŠč鹊č湥ąĮąĖą╣ č湊čéąĖčĆą╝ą░ ą░č鹊ą╝ą░ą╝ąĖ H (ą┤ą▓ą░ ąĘ ąĮąĖčģ ą┐ąŠą▓’čÅąĘą░ąĮč¢ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠ, ą┤ą▓ą░ č¢ąĮčłąĖčģ – ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąŠ); ą▓ąĖčģąŠą┤ąĖčéčī ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮą░ ą║čĆąĖčüčéą░ą╗č¢čćąĮą░ čĆąĄčłč¢čéą║ą░ ą╗čīąŠą┤čā. ąÆ čĆč¢ą┤ą║č¢ą╣ ą▓ąŠą┤č¢ ą┐čĆą░ą║čéąĖčćąĮąŠ ą▓č¢ą┤čüčāčéąĮč¢ ą▓č¢ą╗čīąĮč¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ H2O, ą▓ąŠąĮąĖ ąĘą░ čĆą░čģčāąĮąŠą║ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąŠčŚ ą▓ąĘą░čöą╝ąŠą┤č¢čŚ ąĘą░ąĘąĮą░č湥ąĮąŠą│ąŠ čéąĖą┐čā ąŠą▒ŌĆÖčöą┤ąĮčāčÄčéčīčüčÅ ą▓ ą░ą│čĆąĄą│ą░čéąĖ (H2O)n; ą┐čĆąĖ ą║č¢ą╝ąĮą░čéąĮč¢ą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆč¢ čüąĄčĆąĄą┤ąĮčö ąĘąĮą░č湥ąĮąĮčÅ n ą┤ąŠčĆč¢ą▓ąĮčÄčö 4. ą”ąĖą╝ ą┐ąŠčÅčüąĮčÄčöčéčīčüčÅ ą╝ąĄąĮčłą░ ą╗ąĄčéčÄčćč¢čüčéčī ą▓ąŠą┤ąĖ (čé. ą║ąĖą┐. +100*ąĪ), ąĮč¢ąČ čā čŚčŚ ą░ąĮą░ą╗ąŠą│č¢ą▓, ąĘąŠą║čĆąĄą╝ą░, čā ą│č¢ą┤čĆąŠą│ąĄąĮčüčāą╗čīčäč¢ą┤čā H2S (čé. ą║ąĖą┐. -60*ąĪ).
ąōč¢ą┤čĆąŠą│ąĄąĮąŠą▓ąĖą╣ ąĘą▓’čÅąĘąŠą║ – čåąĄ ąĘą▓’čÅąĘąŠą║, čēąŠ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą░č鹊ą╝ąŠą╝ H, čÅą║ąĖą╣ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ą╝č¢ąČ ą┤ą▓ąŠą╝ą░ ą░č鹊ą╝ą░ą╝ąĖ ą▒č¢ą╗čīčł ąĄą╗ąĄą║čéčĆąŠąĮąĄą│ą░čéąĖą▓ąĮčģ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓
A╬┤- – H╬┤+┬Ę┬Ę┬Ę B╬┤-
ąĢąĮąĄčĆą│č¢čÅ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠčŚ čüą║ą╗ą░ą┤ąŠą▓ąŠčŚ ą│č¢ą┤čĆąŠą│ąĄąĮąŠą▓ąŠą│ąŠ ąĘą▓’čÅąĘą║čā A-H ą╝ą░čö ąĘąĮą░č湥ąĮąĮčÅ ą▒ą╗ąĖąĘčīą║ąŠ 1000 ą║ąöąČ/ą╝ąŠą╗čī (F-H 565, O-H 459, N-H 386 ą║ąöąČ/ą╝ąŠą╗čī), ą░ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮą░ čüą║ą╗ą░ą┤ąŠą▓ą░ – ą▒ą╗ąĖąĘčīą║ąŠ 10 ą║ąöąČ/ą╝ąŠą╗čī (č鹊ą▒č鹊 ą│č¢ą┤čĆąŠą│ąĄąĮąŠą▓ąĖą╣ ąĘą▓ŌĆÖčÅąĘąŠą║ ąĮą░ą▒ą░ą│ą░č鹊 ą╝ąĄąĮčł ą╝č¢čåąĮąĖą╣ ąĮč¢ąČ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąĖą╣). ą×ą┤ąĮą░ą║ čüąĖą╗ąĖ ąÆą░ąĮ-ą┤ąĄčĆ-ąÆą░ą░ą╗čīčüą░ ąĘąĮą░čćąĮąŠ čüą╗ą░ą▒ą║č¢čłč¢ (Ōēł1 ą║ąöąČ/ą╝ąŠą╗čī), ąĮč¢ąČ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮą░ čüą║ą╗ą░ą┤ąŠą▓ą░ ą│č¢ą┤čĆąŠą│ąĄąĮąŠą▓ąŠą│ąŠ ąĘą▓’čÅąĘą║čā.
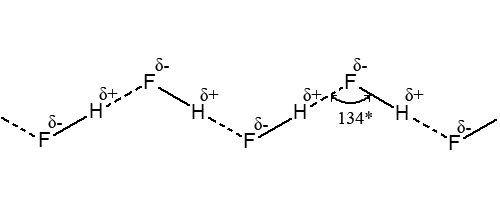
ąØą░ą┐čĆąĖą║ą╗ą░ą┤, ą░ą│čĆąĄą│ą░čåč¢čŚ ą╝ąŠą╗ąĄą║čāą╗ ąĘą░ čĆą░čģčāąĮąŠą║ ą│č¢ą┤čĆąŠą│ąĄąĮąŠą▓ąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ čā ą▓ąĖą│ą╗čÅą┤č¢ ąĘą▓ąĖą▓ąĖčüčéąĖčģ ą╗ą░ąĮčåčÄą│č¢ą▓ ą▓ čĆč¢ą┤ą║ąŠą╝čā ą│č¢ą┤čĆąŠą│ąĄąĮčäč鹊čĆąĖą┤č¢ HF
ąŻčéą▓ąŠčĆąĄąĮąĮčÅ ą│č¢ą┤čĆą░čéčā ą░ą╝ąŠąĮč¢ą░ą║čā NH3*H2O ą┐čĆąĖ čĆąŠąĘčćąĖąĮąĄąĮąĮč¢ ą░ą╝ąŠąĮč¢ą░ą║čā čā ą▓ąŠą┤č¢
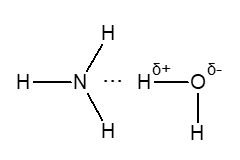
ąōč¢ą┤čĆąŠą│ąĄąĮąŠą▓č¢ ąĘą▓’čÅąĘą║ąĖ ą╝ą░čÄčéčī ą▓ąĄą╗ąĖą║ąĄ ąĘąĮą░č湥ąĮąĮčÅ ą▓ čģč¢ą╝č¢čŚ ą▒č¢ą╗ą║ą░. ą¦ąĖčüą╗ąĄąĮąĮč¢ ą┐čĆąŠčåąĄčüąĖ ąŠą▒ą╝č¢ąĮčā ą▓ ąČąĖą▓ąĖčģ ąŠčĆą│ą░ąĮč¢ąĘą╝ą░čģ ąŠą▒čāą╝ąŠą▓ą╗čÄčÄčéčīčüčÅ ą┤ąŠčüčéą░čéąĮč¢ą╝ąĖ (čģąŠčćą░ č¢ ąĮąĄą▓ąĄą╗ąĖą║ąĖą╝ąĖ) ąĘąĮą░č湥ąĮąĮčÅą╝ąĖ ąĄąĮąĄčĆą│č¢čŚ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąĖčģ čüą║ą╗ą░ą┤ąŠą▓ąĖčģ ą│č¢ą┤čĆąŠą│ąĄąĮąŠą▓ąŠą│ąŠ ąĘą▓’čÅąĘą║čā; ą▓ąŠąĮąĖ ą╗ąĄą│ą║ąŠ čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ č¢ ą╗ąĄą│ą║ąŠ čĆčāą╣ąĮčāčÄčéčīčüčÅ. ąōč¢ą┤čĆąŠą│ąĄąĮąŠą▓č¢ ąĘą▓’čÅąĘą║ąĖ, čēąŠ ą▓ąĖąĮąĖą║ą░čÄčéčī ą╝č¢ąČ čüčāčüč¢ą┤ąĮč¢ą╝ąĖ ą╗ą░ąĮčåčÄą│ąŠą▓ąĖą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ ą▓ ą┐ąŠą╗č¢ą╝ąĄčĆą░čģ, ą┐č¢ą┤ą▓ąĖčēčāčÄčéčī ą╝č¢čåąĮč¢čüčéčī ą╝ą░č鹥čĆč¢ą░ą╗č¢ą▓, ąŠčüąŠą▒ą╗ąĖą▓ąŠ čģč¢ą╝č¢čćąĮąĖčģ ą▓ąŠą╗ąŠą║ąŠąĮ.
ąĢą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮą░ ą╝ąŠą┤ąĄą╗čī čāčéą▓ąŠčĆąĄąĮąĮčÅ ą│č¢ą┤čĆąŠą│ąĄąĮąŠą▓ąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ą▓č¢čĆąĮą░ ą╗ąĖčłąĄ ą▓ ą┐ąĄčĆčłąŠą╝čā ąĮą░ą▒ą╗ąĖąČąĄąĮąĮč¢, ąŠčüą║č¢ą╗čīą║ąĖ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠ ą┤ąŠą┤ą░čéą║ąŠą▓ąĄ ąĘą▓’čÅąĘčāą▓ą░ąĮąĮčÅ ą░č鹊ą╝ą░ ą│č¢ą┤čĆąŠą│ąĄąĮčā ą┐ąŠą▓ąĖąĮąĮąŠ ą╝ą░čéąĖ čģč¢ą╝č¢čćąĮčā ą┐čĆąĖčĆąŠą┤čā. ą£ąĄč鹊ą┤ ą▓ą░ą╗ąĄąĮčéąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ąĮąĄ ą╝ąŠąČąĄ ą┐ąŠčÅčüąĮąĖčéąĖ čāčéą▓ąŠčĆąĄąĮąĮčÅ ą┤ąŠą┤ą░čéą║ąŠą▓ąŠą│ąŠ čģč¢ą╝č¢čćąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā ą░č鹊ą╝ą░ H, č鹊ą╝čā čēąŠ ą░č鹊ą╝ ą│č¢ą┤čĆąŠą│ąĄąĮčā ąŠą┤ąĮąŠą▓ą░ą╗ąĄąĮčéąĮąĖą╣. ą£ąĄč鹊ą┤ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ą▓ ą╣ąŠą│ąŠ ą▒ą░ą│ą░č鹊čåąĄąĮčéčĆąŠą▓ąŠą╝čā ą▓ą░čĆč¢ą░ąĮčéč¢ ą┤ą░čö ąĮą░čüčéčāą┐ąĮąĄ ą┐ąŠčÅčüąĮąĄąĮąĮčÅ čāčéą▓ąŠčĆąĄąĮąĮčÅ ą│č¢ą┤čĆąŠą│ąĄąĮąŠą▓ąŠą│ąŠ ąĘą▓’čÅąĘą║čā. ą¤čĆąĖ ąĘą▒ą╗ąĖąČąĄąĮąĮč¢ ą░č鹊ą╝ą░ H, ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠ ąĘą▓’čÅąĘą░ąĮąŠą│ąŠ ąĘ ą░č鹊ą╝ąŠą╝ ą▒č¢ą╗čīčł ąĄą╗ąĄą║čéčĆąŠąĮąĄą│ą░čéąĖą▓ąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéčā A╬┤- – H╬┤+, ąĘ č¢ąĮčłąĖą╝ ą░č鹊ą╝ąŠą╝ čéą░ą║ąŠąČ ą▒č¢ą╗čīčł ąĄą╗ąĄą║čéčĆąŠąĮąĄą│ą░čéąĖą▓ąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéčā B╬┤- ą▓ąĖąĮąĖą║ą░čö čéčĆąĖčåąĄąĮčéčĆąŠą▓ą░ ąĘą▓’čÅąĘčāčÄčćą░ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░ ąŠčĆą▒č¢čéą░ą╗čī, ą┐ąĄčĆąĄą▒čāą▓ą░ąĮąĮčÅ ą▓ čÅą║č¢ą╣ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ ą┐ą░čĆąĖ ą░č鹊ą╝ą░ B╬┤- ą▓ąĖą│č¢ą┤ąĮč¢čłąĄ, ąĮč¢ąČ ąĮą░ ą░č鹊ą╝ąĮč¢ą╣ ąŠčĆą▒č¢čéą░ą╗č¢ čåčīąŠą│ąŠ ąČ ą░č鹊ą╝ą░.










