ąÜąŠą▓ą░ą╗ąĄąĮčéąĮčŗąĄ Žā-čüą▓čÅąĘąĖ ą╝ąĄąČą┤čā s-ąŠčĆą▒ąĖčéą░ą╗čÅą╝ąĖ (Žās-s-čüą▓čÅąĘčī)
ąÜą▓ą░ąĮč鹊ą▓ąŠ-ą╝ąĄčģą░ąĮąĖč湥čüą║ąĖąĄ ą┐čĆąĄą┤čüčéą░ą▓ą╗ąĄąĮąĖčÅ ąŠ čüčéčĆąŠąĄąĮąĖąĖ 菹╗ąĄą║čéčĆąŠąĮąĮčŗčģ ąŠą▒ąŠą╗ąŠč湥ą║ ą░č鹊ą╝ąŠą▓ ą┐ąŠąĘą▓ąŠą╗čÅčÄčé ą║ą░č湥čüčéą▓ąĄąĮąĮąŠ ąŠą▒čŖčÅčüąĮąĖčéčī ąĖ ą║ąŠą╗ąĖč湥čüčéą▓ąĄąĮąĮąŠ čĆą░čüčćąĖčéą░čéčī ą▓ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĖąĖ čü čüąŠą▓čĆąĄą╝ąĄąĮąĮčŗą╝ čāčĆąŠą▓ąĮąĄą╝ čĆą░ąĘą▓ąĖčéąĖčÅ ą║ą▓ą░ąĮč鹊ą▓ąŠą╣ čģąĖą╝ąĖąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ.
ąĢčüą╗ąĖ ą┤čĆčāą│ ą║ ą┤čĆčāą│čā┬Ā ą┐čĆąĖą▒ą╗ąĖąČą░čÄčéčüčÅ ą┤ą▓ą░ ą░č鹊ą╝ą░, ą║ą░ąČą┤čŗą╣ ąĖąĘ ą║ąŠč鹊čĆčŗčģ ąĖą╝ąĄąĄčé ąĘą░ąĮčÅčéčāčÄ ąŠą┤ąĮąĖą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą╝ ąŠčĆą▒ąĖčéą░ą╗čī, č鹊 ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ą║ąŠą▓ą░ą╗ąĄąĮčéąĮą░čÅ čüą▓čÅąĘčī. ą¤čĆąŠčüč鹥ą╣čłąĖą╣ ą┐čĆąĖą╝ąĄčĆ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé čüąŠą▒ąŠą╣ ąŠą▒čŖąĄą┤ąĖąĮąĄąĮąĖąĄ ą┤ą▓čāčģ ą░č鹊ą╝ąŠą▓ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą▓ ą╝ąŠą╗ąĄą║čāą╗čā H2
ąĀąĖčü. ą×ą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ ą┐čĆąĖ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĖ ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą▓ąŠą┤ąŠčĆąŠą┤ą░
ą¤ąŠ ą╝ąĄč鹊ą┤čā ą▓ą░ą╗ąĄąĮčéąĮčŗčģ čüą▓čÅąĘąĄą╣ ą┐čĆąĖ čüą▒ą╗ąĖąČąĄąĮąĖąĖ ą┤ą▓čāčģ ą░č鹊ą╝ąŠą▓ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ ąĖčģ s-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, ą║ą░ąČą┤ą░čÅ ąĖąĘ ą║ąŠč鹊čĆčŗčģ čüąŠą┤ąĄčƹȹĖčé ąŠą┤ąĖąĮ 菹╗ąĄą║čéčĆąŠąĮ. ąŁč鹊čé ą┐čĆąŠčåąĄčüčü čüąŠą┐čĆąŠą▓ąŠąČą┤ą░ąĄčéčüčÅ ą▓čŗą┤ąĄą╗ąĄąĮąĖąĄą╝ 菹ĮąĄčĆą│ąĖąĖ ą┐čĆąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ąŠą▒čēąĄą╣ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą░čĆčŗ. ą¤ąŠčüą║ąŠą╗čīą║čā ą╝ąĄąČą┤čā ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗą╝ąĖ čÅą┤čĆą░ą╝ąĖ ą░č鹊ą╝ąŠą▓ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą┤ąĄą╣čüčéą▓čāčÄčé čüąĖą╗čŗ 菹╗ąĄą║čéčĆąŠčüčéą░čéąĖč湥čüą║ąŠą│ąŠ ąŠčéčéą░ą╗ą║ąĖą▓ą░ąĮąĖčÅ, č鹊, ąĮą░čćąĖąĮą░čÅ čü ąĮąĄą║ąŠč鹊čĆąŠą│ąŠ čĆą░čüčüč鹊čÅąĮąĖčÅ ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ, čŹčéąĖ čüąĖą╗čŗ ąĮą░čćąĖąĮą░čÄčé ą┐čĆąĄą┐čÅčéčüčéą▓ąŠą▓ą░čéčī ą┤ą░ą╗čīąĮąĄą╣čłąĄą╝čā čüą░ą╝ąŠą┐čĆąŠąĖąĘą▓ąŠą╗čīąĮąŠą╝čā čüą▒ą╗ąĖąČąĄąĮąĖčÄ ą░č鹊ą╝ąŠą▓. ą¦č鹊ą▒čŗ ą▓ąĮąŠą▓čī čĆą░ąĘą┤ąĄą╗ąĖčéčī ąŠą▒čĆą░ąĘąŠą▓ą░ą▓čłčāčÄčüčÅ ą╝ąŠą╗ąĄą║čāą╗čā H2 ąĮą░ ą░č鹊ą╝čŗ ą▓ąŠą┤ąŠčĆąŠą┤ą░, ąĮąĄąŠą▒čģąŠą┤ąĖą╝ąŠ ąĘą░čéčĆą░čéąĖčéčī 菹ĮąĄčĆą│ąĖčÄ (436 ą║ąöąČ/ą╝ąŠą╗čī); ąŠąĮą░ ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ čŹąĮąĄčĆą│ąĖčÅ čüą▓čÅąĘąĖ ąĖ čćąĖčüą╗ąĄąĮąĮąŠ čĆą░ą▓ąĮą░ 菹ĮąĄčĆą│ąĖąĖ, ą▓čŗą┤ąĄą╗ąĖą▓čłąĄą╣čüčÅ ą┐čĆąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ H2 (-436 ą║ąöąČ/ą╝ąŠą╗čī). ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÄ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ ąŠčéą▓ąĄčćą░ąĄčé čüąŠčüč鹊čÅąĮąĖąĄ ą╝ąŠą╗ąĄą║čāą╗čŗ H2 čü 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖą╝ ą╝ąĖąĮąĖą╝čāą╝ąŠą╝ (ą▓čŗąĖą│čĆčŗčłąĄą╝ 菹ĮąĄčĆą│ąĖąĖ) ą▓ 436 ą║ąöąČ/ą╝ąŠą╗čī. ą×ą▒ąŠą▒čēą░čÅ čŹč鹊čé čĆąĄąĘčāą╗čīčéą░čé ąĮą░ ą┐čĆąŠčåąĄčüčü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗčģ čüą▓čÅąĘąĄą╣ ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ ą┤čĆčāą│ąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓, ą╝ąŠąČąĮąŠ čāčéą▓ąĄčƹȹ┤ą░čéčī, čćč鹊
ą┐čĆąĖ ąŠą▒čŖąĄą┤ąĖąĮąĄąĮąĖąĖ ą░č鹊ą╝ąŠą▓ ą▓ ą╝ąŠą╗ąĄą║čāą╗čŗ čĆąĄą░ą╗ąĖąĘčāąĄčéčüčÅ čüąŠčüč鹊čÅąĮąĖąĄ čü 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖą╝ ą╝ąĖąĮąĖą╝čāą╝ąŠą╝.
ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ą┐čĆąŠčćąĮąŠčüčéčī ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮą░ č鹥ą╝, čćč鹊 ą┤ą╗čÅ ąĄąĄ čĆą░ąĘčĆčŗą▓ą░ ą▓čüąĄą│ą┤ą░ ąĮąĄąŠą▒čģąŠą┤ąĖą╝ą░ ąĘą░čéčĆą░čéą░ ąĮąĄą║ąŠč鹊čĆąŠą╣ 菹ĮąĄčĆą│ąĖąĖ.
ą¤ąŠ ą╝ąĄč鹊ą┤čā ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, ąĖčüčģąŠą┤čÅčēąĄą╝čā ąĖąĘ ąŠčĆą▒ąĖčéą░ą╗čīąĮąŠą╣ ą╝ąŠą┤ąĄą╗ąĖ ą░č鹊ą╝ą░, ą┐čĆąŠčåąĄčüčü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ H2 ąŠą▒čŖčÅčüąĮčÅąĄčéčüčÅ čüą╗ąĄą┤čāčÄčēąĖą╝ ąŠą▒čĆą░ąĘąŠą╝. ą×ą┤ąĮąŠą║čĆą░čéąĮąŠ ąĘą░čüąĄą╗ąĄąĮąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮąŠą╝ ąŠčĆą▒ąĖčéą░ą╗ąĖ ą┤ą▓čāčģ ą░č鹊ą╝ąŠą▓ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą┐čĆąĖ ąĖčģ ą┤ąŠčüčéą░č鹊čćąĮąŠą╝ čüą▒ą╗ąĖąČąĄąĮąĖąĖ ąĖ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĖ ą║ąŠą╝ą▒ąĖąĮąĖčĆčāčÄčéčüčÅ ą▓ ą┤ą▓ąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą▓ąĮčāčéčĆąĖ ą║ąŠč鹊čĆčŗčģ čĆą░čüą┐ąŠą╗ą░ą│ą░čÄčéčüčÅ ąŠą▒ą░ ą░č鹊ą╝ąĮčŗčģ čÅą┤čĆą░. ą×ą┤ąĮą░ ąĖąĘ čŹčéąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ (ą║ą░ą║ ą▒ąŠą╗ąĄąĄ ą▓čŗą│ąŠą┤ąĮą░čÅ ą┐ąŠ 菹ĮąĄčĆą│ąĖąĖ) ąŠą║ą░ąĘčŗą▓ą░ąĄčéčüčÅ ą┐ąŠą╗ąĮąŠčüčéčīčÄ ąĘą░ąĮčÅč鹊ą╣ ą┤ą▓čāą╝čÅ čŹą╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ (ąŠą▒čēąĄą╣ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą░čĆąŠą╣).
ąøčÄą▒čāčÄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčāčÄ ąŠčĆą▒ąĖčéą░ą╗čī ą╝ąŠąČąĮąŠ čéčĆą░ą║č鹊ą▓ą░čéčī, ą┐ąŠą┤ąŠą▒ąĮąŠ ą╗čÄą▒ąŠą╣ ą░č鹊ą╝ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą║ą░ą║ ąŠą▒čŖąĄą╝ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ą░ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ, ą│ą┤ąĄ ą▓ąĄčĆąŠčÅčéąĮąŠčüčéčī ąĮą░čģąŠąČą┤ąĄąĮąĖčÅ čŹą╗ąĄą║čéčĆąŠąĮą░ 90% ąĖ ą│ą┤ąĄ ą╝ąŠąČąĄčé čüąŠčüčĆąĄą┤ąŠčéą░čćąĖą▓ą░čéčīčüčÅ 90% 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ąŠą┤ąĮąŠą│ąŠ ąĖą╗ąĖ ą┤ą▓čāčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą▓ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ąŠčé ąĘą░ąĮčÅč鹊čüčéąĖ ą┤ą░ąĮąĮąŠą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ.

ąĀąĖčü. ąŁąĮąĄčĆą│ąĄčéąĖč湥čüą║ą░čÅ ą┤ąĖą░ą│čĆą░ą╝ą╝ą░ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ Žās-s-čüą▓čÅąĘąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ H2
ą£ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ą▓ ąŠčéą╗ąĖčćąĖąĄ ąŠčé ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, ąĮą░ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖčģ ą┤ąĖą░ą│čĆą░ą╝ą╝ą░čģ, ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčÄčé ą║čĆčāą│ąŠą▓čŗą╝ąĖ ą║ą▓ą░ąĮč鹊ą▓čŗą╝ąĖ čÅč湥ą╣ą║ą░ą╝ąĖ.
Žā-čüą▓čÅąĘčī – čŹč鹊 ą║ąŠą▓ą░ą╗ąĄąĮčéąĮą░čÅ čüą▓čÅąĘčī, ą┐čĆąĖ č乊čĆą╝ąĖčĆąŠą▓ą░ąĮąĖąĖ ą║ąŠč鹊čĆąŠą╣ ąŠą▒ąĄ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓čāčÄčēąĖąĄ ą░č鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ą┐ąĄčĆąĄą║čĆčŗą▓ą░čÄčéčüčÅ ąĖ ą║ąŠą╝ą▒ąĖąĮąĖčĆčāčÄčéčüčÅ ą▓ą┤ąŠą╗čī ąŠčüąĖ čéą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, čćč鹊 ąŠą▒čĆą░ąĘčāčÄčéčüčÅ ą▓čĆą░čēą░č鹥ą╗čīąĮąŠ čüąĖą╝ą╝ąĄčéčĆąĖčćąĮčŗąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ.
Žās-s-čüą▓čÅąĘčī – čŹč鹊 Žā-čüą▓čÅąĘčī ą▓ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ą║ąŠč鹊čĆąŠą╣ čāčćą░čüčéą▓čāčÄčé s-ą░č鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓čāčÄčēąĖčģ ą░č鹊ą╝ąŠą▓.
ą¤čĆąĖ ą║ąŠą╝ą▒ąĖąĮąĖčĆąŠą▓ą░ąĮąĖąĖ ą┤ą▓čāčģ ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą┤ą▓ąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą║ąŠč鹊čĆčŗąĄ čĆą░ąĘą╗ąĖčćą░čÄčéčüčÅ ą┐ąŠ 菹ĮąĄčĆą│ąĖąĖ. ą£ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī, ą║ąŠč鹊čĆą░čÅ ąŠą║ą░ąĘčŗą▓ą░ąĄčéčüčÅ ą▒ąŠą╗ąĄąĄ ą▓čŗą│ąŠą┤ąĮąŠą╣ ą┤ą╗čÅ čŹą╗ąĄą║čéčĆąŠąĮąŠą▓ ą┐ąŠ 菹ĮąĄčĆą│ąĖąĖ, č湥ą╝ ąĖčüčģąŠą┤ąĮčŗąĄ ą░č鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ąĖ ą▒ą╗ą░ą│ąŠą┤ą░čĆčÅ ą║ąŠč鹊čĆąŠą╣ ą░č鹊ą╝čŗ čüą▓čÅąĘčŗą▓ą░čÄčéčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čā, ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ čüą▓čÅąĘčŗą▓ą░čÄčēą░čÅ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī ąĖ ąŠą▒ąŠąĘąĮą░čćą░ąĄčéčüčÅ ą║ą░ą║ Žā. ąÆč鹊čĆą░čÅ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī, ąĖąĘ ą┤ą▓čāčģ ąŠą▒čĆą░ąĘąŠą▓ą░ą▓čłąĖčģčüčÅ, ą╝ąĄąĮąĄąĄ ą▓čŗą│ąŠą┤ąĮą░čÅ ą┐ąŠ 菹ĮąĄčĆą│ąĖąĖ, č湥ą╝ ąĖčüčģąŠą┤ąĮčŗąĄ ą░č鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ čĆą░ąĘčĆčŗčģą╗čÅčÄčēą░čÅ (ą░ąĮčéąĖčüą▓čÅąĘčŗą▓ą░čÄčēą░čÅ) ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī ąĖ ąŠą▒ąŠąĘąĮą░čćą░ąĄčéčüčÅ ą║ą░ą║ Žā*.
ąØą░ąĘą▓ą░ąĮąĖčÅ “čüą▓čÅąĘčŗą▓ą░čÄčēą░čÅ” ąĖ “čĆą░ąĘčĆčŗčģą╗čÅčÄčēą░čÅ” ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĖčüčģąŠą┤čÅčé ąĖąĘ čĆą░čüą┐čĆąĄą┤ąĄą╗ąĄąĮąĖčÅ čŹą╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ą▓ čŹčéąĖčģ ąŠą▒čŖąĄą╝ą░čģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą│ąŠ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ą░. ąĪą▓čÅąĘčŗą▓ą░čÄčēąĄą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąŠčéą▓ąĄčćą░ąĄčé ą┐ąŠą▓čŗčłąĄąĮąĮą░čÅ čŹą╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐ą╗ąŠčéąĮąŠčüčéčī ą▓ ąŠą▒ą╗ą░čüčéąĖ čüą▓čÅąĘčŗą▓ą░ąĮąĖčÅ (ą╝ąĄąČą┤čā) ą░č鹊ą╝ą░ą╝ąĖ, ą░ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĄą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ – ą┐ąŠą▓čŗčłąĄąĮąĮą░čÅ čŹą╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐ą╗ąŠčéąĮąŠčüčéčī ą▓ ąŠą▒ą╗ą░čüčéąĖ čĆą░ąĘčĆčŗčģą╗ąĄąĮąĖčÅ (ą┐ąŠ ąŠą▒ąĄ čüč鹊čĆąŠąĮčŗ ąĘą░) ą░č鹊ą╝ąĮčŗą╝ąĖ čÅą┤čĆą░ą╝ąĖ.

ąĀąĖčü. ąĀą░čüą┐čĆąĄą┤ąĄą╗ąĄąĮąĖąĄ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ą▓ čüą▓čÅąĘčŗą▓ą░čÄčēąĄą╣ ąĖ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĄą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ.
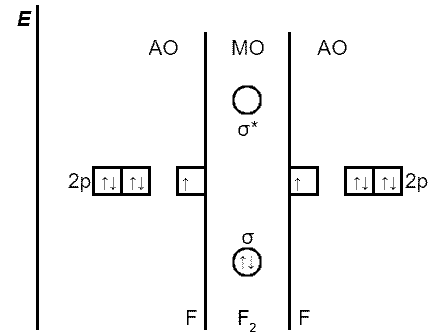
ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, 菹╗ąĄą║čéčĆąŠąĮčŗ ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ čāą║čĆąĄą┐ą╗čÅčÄčé čģąĖą╝ąĖč湥čüą║čāčÄ čüą▓čÅąĘčī, ą░ 菹╗ąĄą║čéčĆąŠąĮčŗ ąĮą░ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ ąŠčüą╗ą░ą▒ą╗čÅčÄčé (čĆą░ąĘčĆčŗčģą╗čÅčÄčé) čģąĖą╝ąĖč湥čüą║čāčÄ čüą▓čÅąĘčī. ąÆąĄčĆąŠčÅčéąĮąŠčüčéčī ą┐čĆąĄą▒čŗą▓ą░ąĮąĖčÅ čŹą╗ąĄą║čéčĆąŠąĮąŠą▓ ą▓ čüą▓čÅąĘčŗą▓ą░čÄčēąĄą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ ą▓čŗčüąŠą║ą░čÅ, ą░ ą▓ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĄą╣ – ąĮąĖąĘą║ą░čÅ, ą┐ąŠčŹč鹊ą╝čā 菹╗ąĄą║čéčĆąŠąĮčŗ ą┐čĆąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ ą▓ąĮą░čćą░ą╗ąĄ ąĘą░ąĮąĖą╝ą░čÄčé čüą▓čÅąĘčŗą▓ą░čÄčēąĖąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą░ ąĘą░č鹥ą╝ – čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ. ąØą░ą┐čĆąĖą╝ąĄčĆ, ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ H2 ąŠą▒ą░ 菹╗ąĄą║čéčĆąŠąĮą░ ąĮą░čģąŠą┤čÅčéčüčÅ ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēąĄą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą░ čĆą░ąĘčĆčŗčģą╗čÅčÄčēą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī ąŠčüčéą░ąĄčéčüčÅ ą┐čāčüč鹊ą╣, ą▒ąĄąĘ 菹╗ąĄą║čéčĆąŠąĮąŠą▓: H2 Žā1s2 Žā*1s0.
ąĪ ą┐ąŠą╝ąŠčēčīčÄ ą╝ąĄč鹊ą┤ą░ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ (ą£ą£ą×) ą╗ąĄą│ą║ąŠ ąŠą▒čŖčÅčüąĮąĖčéčī, ą┐ąŠč湥ą╝čā ą░č鹊ą╝čŗ ą│ąĄą╗ąĖčÅ ą▓ ąŠčéą╗ąĖčćąĖąĄ ąŠčé ą░č鹊ą╝ąŠą▓ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ąĖą╗ąĖ ą║ąĖčüą╗ąŠčĆąŠą┤ą░ ąĮąĄ ąŠą▒čŖąĄą┤ąĖąĮčÅčÄčéčüčÅ ą▓ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗąĄ ą╝ąŠą╗ąĄą║čāą╗čŗ He2. ąöą▓ą░ ą░č鹊ą╝ą░ ą│ąĄą╗ąĖčÅ ąĖą╝ąĄčÄčé č湥čéčŗčĆąĄ 1s-菹╗ąĄą║čéčĆąŠąĮą░; ą┐čĆąĖ ą│ąĖą┐ąŠč鹥čéąĖč湥čüą║ąŠą╝ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ He2 ą┐ąĄčĆą▓čŗąĄ ą┤ą▓ą░ 菹╗ąĄą║čéčĆąŠąĮą░ ąĘą░ą╣ą╝čāčé Žā-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą░ ą▓č鹊čĆčŗąĄ ą┤ą▓ą░ 菹╗ąĄą║čéčĆąŠąĮą░ ąĘą░ą╣ą╝čāčé Žā*-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ. ąÜą▓ą░ąĮč鹊ą▓ąŠ-ą╝ąĄčģą░ąĮąĖč湥čüą║ąĖąĄ čĆą░čüč湥čéčŗ ą┐ąŠą║ą░ąĘčŗą▓ą░čÄčé, čćč鹊 ą┐čĆąĖ čĆą░ą▓ąĮąŠą╝ čćąĖčüą╗ąĄ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģ ąĖ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ, čģąĖą╝ąĖč湥čüą║ą░čÅ čüą▓čÅąĘčī ąĮąĄ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ. ą×ą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ čéą░ą║ąĖčģ ą╝ąŠą╗ąĄą║čāą╗ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖ ąĮąĄ ą▓čŗą│ąŠą┤ąĮąŠ, ą░ čüčéą░ą▒ąĖą╗ąĖąĘąĖčĆčāčÄčēąĄąĄ ą╝ąŠą╗ąĄą║čāą╗čā ą┤ąĄą╣čüčéą▓ąĖąĄ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ ą║ąŠą╝ą┐ąĄąĮčüąĖčĆčāąĄčéčüčÅ (ą░ čćą░čüč鹊 ą┐čĆąĄą▓čŗčłą░ąĄčéčüčÅ) ą┤ąĄčüčéą░ą▒ąĖą╗ąĖąĘąĖčĆčāčÄčēąĖą╝ ą┤ąĄą╣čüčéą▓ąĖąĄą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░čģąŠą┤čÅčēąĖčģčüčÅ ąĮą░ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ. ąśą╝ąĄąĮąĮąŠ ą┐ąŠčŹč鹊ą╝čā čüčāčēąĄčüčéą▓čāčÄčé čćą░čüčéąĖčåčŗ H+, H2, H2– He2+, ąĮąŠ ąĮąĄ ąŠą▒čĆą░ąĘčāčÄčéčüčÅ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ čćą░čüčéąĖčåčŗ H22- He2.
ąÜąŠą▓ą░ą╗ąĄąĮčéąĮčŗąĄ Žā-čüą▓čÅąĘąĖ ą╝ąĄąČą┤čā p-ąŠčĆą▒ąĖčéą░ą╗čÅą╝ąĖ (Žāp-p-čüą▓čÅąĘčī)
ąÉč鹊ą╝ąĮčŗąĄ p-ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą┐ąŠą┤ąŠą▒ąĮąŠ s-ą░č鹊ą╝ąĮčŗą╝ ąŠčĆą▒ąĖčéą░ą╗čÅą╝, ą┐čĆąĖ čüą▒ą╗ąĖąČąĄąĮąĖąĖ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖčģ ą░č鹊ą╝ąŠą▓ ą╝ąŠą│čāčé ą┐ąĄčĆąĄą║čĆčŗą▓ą░čéčīčüčÅ ą▓ą┤ąŠą╗čī čüą▓ąŠąĄą╣ ąŠčüąĖ ąĖ ą║ąŠą╝ą▒ąĖąĮąĖčĆąŠą▓ą░čéčīčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ.

ąĀąĖčü. ą×ą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ Žāp-p-čüą▓čÅąĘąĖ ą┐čĆąĖ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĖ ą░č鹊ą╝ąĮčŗčģ p-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣
ąŚąĮą░ą║ąĖ “+” ąĖ “-” ą▓ąĮčāčéčĆąĖ ą│čĆą░ąĮąĖčćąĮąŠą╣ ąŠą▒ą╗ą░čüčéąĖ p-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąĮąĄ ąŠčéąĮąŠčüčÅčéčüčÅ ą║ 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╝ ąĘą░čĆčÅą┤ą░ą╝ (菹╗ąĄą║čéčĆąŠąĮčŗ ą▓čüąĄą│ą┤ą░ ąĘą░čĆčÅąČąĄąĮčŗ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠ), ą░ ąŠą▒ąŠąĘąĮą░čćą░čÄčé ą┐ąĄčĆąĄą║čĆčŗą▓ą░čÄčēąĖąĄčüčÅ ą┐ąŠą╗ąŠą▓ąĖąĮčŗ ą║ą░ąČą┤ąŠą╣ p-ą░č鹊ą╝ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ; ąŠąĮąĖ ąŠčéąĮąŠčüčÅčéčüčÅ ą║ čüąĖą╝ą╝ąĄčéčĆąĖąĖ ą▓ąŠą╗ąĮąŠą▓ąŠą╣ čäčāąĮą║čåąĖąĖ, ą╝ą░č鹥ą╝ą░čéąĖč湥čüą║ąĖ ąŠą┐ąĖčüčŗą▓ą░čÄčēąĄą╣ ą╗čÄą▒čāčÄ ą░č鹊ą╝ąĮčāčÄ ąŠčĆą▒ąĖčéą░ą╗čī ą▓ ą▓ąŠą╗ąĮąŠą▓ąŠą╣ ą╝ąĄčģą░ąĮąĖą║ąĄ ą©čĆąĄą┤ąĖąĮą│ąĄčĆą░. ąÜąŠą╝ą▒ąĖąĮąĖčĆąŠą▓ą░ąĮąĖąĄ ą┤ą▓čāčģ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą┐čĆąĖą▓ąŠą┤ąĖčé ą║ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÄ ą┤ą▓čāčģ ą▓čĆą░čēą░č鹥ą╗čīąĮąŠ-čüąĖą╝ą╝ąĄčéčĆąĖčćąĮčŗčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣: ąŠą┤ąĮąŠą╣ čüą▓čÅąĘčŗą▓ą░čÄčēąĄą╣ Žā-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗čīčÄ ąĖ ąŠą┤ąĮąŠą╣ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĄą╣ Žā*-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗čīčÄ. ą×ą▒čĆą░ąĘčāčÄčēą░čÅčüčÅ čüą▓čÅąĘčī čÅą▓ą╗čÅąĄčéčüčÅ Žāp-p-čüą▓čÅąĘčīčÄ.
ąØą░ą┐čĆąĖą╝ąĄčĆ, ą▓ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ Žāp-p-čüą▓čÅąĘąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ čäč鹊čĆą░ čāčćą░čüčéą▓čāčÄčé ą┐ąŠ ąŠą┤ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ čü p-ą┐ąŠą┤čāčĆąŠą▓ąĮčÅ ą║ą░ąČą┤ąŠą│ąŠ ą░č鹊ą╝ą░ čäč鹊čĆą░; ąŠčüčéą░ą╗čīąĮčŗąĄ p-ą░č鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ č乊čĆą╝ąĖčĆčāčÄčé ŽĆ-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ. ąŁą╗ąĄą║čéčĆąŠąĮčŗ ąĘą░ą┐ąŠą╗ąĮčÅčÄčé čüą▓čÅąĘčŗą▓ą░čÄčēčāčÄ Žā-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčāčÄ ąŠčĆą▒ąĖčéą░ą╗čī, ą║ąŠč鹊čĆą░čÅ ą┐ąŠ 菹ĮąĄčĆą│ąĖąĖ ąĮąĖąČąĄ, č湥ą╝ ąĖčüčģąŠą┤ąĮčŗąĄ p-ą░č鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ.
ąĀąĖčü. ąŁąĮąĄčĆą│ąĄčéąĖč湥čüą║ą░čÅ ą┤ąĖą░ą│čĆą░ą╝ą╝ą░ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ Žāp-p-čüą▓čÅąĘąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ F2
ą×ą▒ą░ ą░č鹊ą╝ą░ čäč鹊čĆą░ čüą▓čÅąĘčŗą▓ą░čÄčéčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čā F2:
•
• ••
F
••
•
+
• ••
F
••
•
• →
•
• ••
F
••
•
• ••
F
••
•
• |
ąÜąŠą▓ą░ą╗ąĄąĮčéąĮčŗąĄ Žā-čüą▓čÅąĘąĖ ą╝ąĄąČą┤čā s- ąĖ p-ąŠčĆą▒ąĖčéą░ą╗čÅą╝ąĖ (Žās-p-čüą▓čÅąĘčī)
ąÉč鹊ą╝ąĮčŗąĄ s- ąĖ p-ąŠčĆą▒ąĖčéą░ą╗ąĖ čéą░ą║ąČąĄ ą╝ąŠą│čāčé ą┐ąĄčĆąĄą║čĆčŗą▓ą░čéčīčüčÅ ąĖ ą║ąŠą╝ą▒ąĖąĮąĖčĆąŠą▓ą░čéčīčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ.
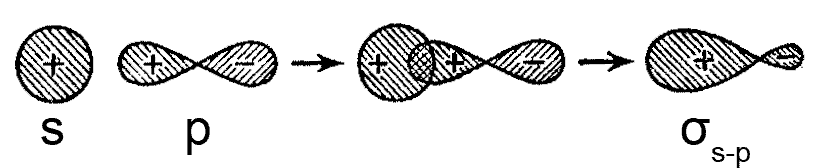
ąĀąĖčü. ą×ą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ Žās-p-čüą▓čÅąĘąĖ ą┐čĆąĖ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĖ ą░č鹊ą╝ąĮčŗčģ s- ąĖ p-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣
ą¤ąĄčĆąĄą║čĆčŗą▓ą░čÄčēą░čÅčüčÅ ą┐ąŠą╗ąŠą▓ąĖąĮą░ p-ą░č鹊ą╝ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ ą┐ąŠ ąĘąĮą░ą║čā čüąŠą▓ą┐ą░ą┤ą░ąĄčé čüąŠ čüč乥čĆąĖč湥čüą║ąĖ čüąĖą╝ą╝ąĄčéčĆąĖčćąĮąŠą╣ s-ą░č鹊ą╝ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗čīčÄ. ąÆ čĆąĄąĘčāą╗čīčéą░č鹥 ą║ąŠą╝ą▒ąĖąĮąĖčĆąŠą▓ą░ąĮąĖčÅ s- ąĖ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ č乊čĆą╝ąĖčĆčāčÄčéčüčÅ ą┤ą▓ąĄ ą▓čĆą░čēą░č鹥ą╗čīąĮąŠ-čüąĖą╝ą╝ąĄčéčĆąĖčćąĮčŗąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ: ąŠą┤ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēą░čÅ Žā-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī ąĖ ąŠą┤ąĮą░ čĆą░ąĘčĆčŗčģą╗čÅčÄčēą░čÅ Žā*-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī. ą×ą▒čĆą░ąĘčāčÄčēą░čÅčüčÅ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮą░čÅ čüą▓čÅąĘčī ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ Žās-p-čüą▓čÅąĘčī.
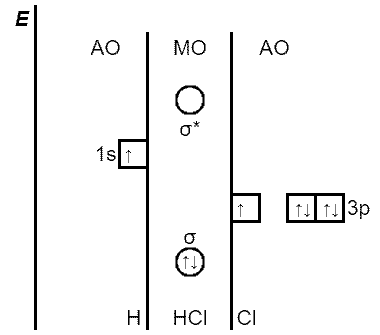
ąĀąĖčü. ąŁąĮąĄčĆą│ąĄčéąĖč湥čüą║ą░čÅ ą┤ąĖą░ą│čĆą░ą╝ą╝ą░ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ Žās-p-čüą▓čÅąĘąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ HCl
ąØą░ą┐čĆąĖą╝ąĄčĆ, ą▓ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ Žās-p-čüą▓čÅąĘąĖ ą╝ąĄąČą┤čā ą░č鹊ą╝ąŠą╝ ą▓ąŠą┤ąŠčĆąŠą┤ą░ (1s1) ąĖ ą░č鹊ą╝ąŠą╝ čģą╗ąŠčĆą░ (3s23p5), ą┐čĆąĖąĮąĖą╝ą░čÄčé čāčćą░čüčéąĖąĄ s-ą░č鹊ą╝ąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī ą▓ąŠą┤ąŠčĆąŠą┤ą░ ąĖ ąŠą┤ąĮą░ p-ą░č鹊ą╝ąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī čģą╗ąŠčĆą░, čüąŠą┤ąĄčƹȹ░čēą░čÅ ąĮąĄčüą┐ą░čĆąĄąĮąĮčŗą╣ 菹╗ąĄą║čéčĆąŠąĮ. ąźą╗ąŠčĆ – ą▒ąŠą╗ąĄąĄ 菹╗ąĄą║čéčĆąŠąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╣ 菹╗ąĄą╝ąĄąĮčé, č湥ą╝ ą▓ąŠą┤ąŠčĆąŠą┤, ą┐ąŠčŹč鹊ą╝čā p-ą┐ąŠą┤čāčĆąŠą▓ąĄąĮčī ą░č鹊ą╝ą░ čģą╗ąŠčĆą░ čĆą░čüą┐ąŠą╗ą░ą│ą░čÄčé ąĮą░ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą╣ ą┤ąĖą░ą│čĆą░ą╝ą╝ąĄ ąĮąĖąČąĄ, č湥ą╝ s-ą┐ąŠą┤čāčĆąŠą▓ąĄąĮčī ą░č鹊ą╝ą░ ą▓ąŠą┤ąŠčĆąŠą┤ą░. ąöą▓ą░ 菹╗ąĄą║čéčĆąŠąĮą░ ąĘą░ą┐ąŠą╗ąĮčÅčÄčé čüą▓čÅąĘčŗą▓ą░čÄčēčāčÄ Žā-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčāčÄ ąŠčĆą▒ąĖčéą░ą╗čī, ą║ąŠč鹊čĆą░čÅ ą┐ąŠ 菹ĮąĄčĆą│ąĖąĖ ąĮąĖąČąĄ ąĖčüčģąŠą┤ąĮčŗčģ 1s- ąĖ 3p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣. ą×ą▒ą░ ą░č鹊ą╝ą░ ąŠą▒čŖąĄą┤ąĖąĮčÅčÄčéčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čā čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░:
H
•
+
• ••
Cl
••
•
• →
H
•
• ••
Cl
••
•
• |
ąÆ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĖąĖ čü ą░č鹊ą╝ąĮąŠą╣ ą╝ąŠą┤ąĄą╗čīčÄ ąæąŠčĆą░ ą┐čĆąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ H-Cl čüąŠąĘą┤ą░ąĄčéčüčÅ ąŠą║č鹥čé ą▓ą░ą╗ąĄąĮčéąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą▓ąŠą║čĆčāą│ ą░č鹊ą╝ą░ čģą╗ąŠčĆą░, ąĮąŠ ą╗ąĖčłčī ą┤čāą▒ą╗ąĄčé 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą▓ąŠą║čĆčāą│ ą░č鹊ą╝ą░ ą▓ąŠą┤ąŠčĆąŠą┤ą░.
ąÜąŠą▓ą░ą╗ąĄąĮčéąĮčŗąĄ ŽĆ-čüą▓čÅąĘąĖ ą╝ąĄąČą┤čā p-ąŠčĆą▒ąĖčéą░ą╗čÅą╝ąĖ (ŽĆp-p-čüą▓čÅąĘčī)
ą×ą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ ą▓ąŠąĘą╝ąŠąČąĮąŠ ąĖ ą╝ąĄąČą┤čā ą┤ą▓čāą╝čÅ ą░č鹊ą╝ą░ą╝ąĖ, čüąŠą┤ąĄčƹȹ░čēąĖą╝ąĖ ą▓ą░ą╗ąĄąĮčéąĮčŗąĄ p-ą┐ąŠą┤čāčĆąŠą▓ąĮąĖ. ą¤čĆąĖ čüą▒ą╗ąĖąČąĄąĮąĖąĖ ą░č鹊ą╝ąŠą▓ ą▓ą┤ąŠą╗čī ąŠčüąĖ ąź (px-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣) ą▓ ą┐ąĄčĆą▓čāčÄ ąŠč湥čĆąĄą┤čī ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ ą╝ąĄąČą┤čā ą┤ą▓čāą╝čÅ px-ą░č鹊ą╝ąĮčŗą╝ąĖ ąŠčĆą▒ąĖčéą░ą╗čÅą╝ąĖ, ą║ąŠč鹊čĆčŗąĄ ąŠą▒čĆą░ąĘčāčÄčé Žāp-p-čüą▓čÅąĘčī. ą×ą┤ąĮą░ą║ąŠ čŹč鹊 ąĮąĄ ąĖčüą║ą╗čÄčćą░ąĄčé ą┐ąŠčüą╗ąĄą┤čāčÄčēąĄą│ąŠ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖčÅ py– pz-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąŠą▒ąŠąĖčģ ą░č鹊ą╝ąŠą▓. ąÜąŠą╝ą▒ąĖąĮąĖčĆąŠą▓ą░ąĮąĖąĄ ą┤ą▓čāčģ py-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąĖą╗ąĖ ą┤ą▓čāčģ pz-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ (čģąŠčéčÅ ąĖ ąĮąĄ ąĮą░čüč鹊ą╗čīą║ąŠ ą▓čŗą│ąŠą┤ąĮąŠąĄ ą║ą░ą║ ą┐čĆąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ Žā-čüą▓čÅąĘąĖ) ą┐čĆąĖą▓ąŠą┤ąĖčé ą║ č乊čĆą╝ąĖčĆąŠą▓ą░ąĮąĖčÄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąĖąĮąŠą│ąŠ, č湥ą╝ Žā-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą▓ąĖą┤ą░. ąŁčéąĖ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĮąĄ čÅą▓ą╗čÅčÄčéčüčÅ ą▓čĆą░čēą░č鹥ą╗čīąĮąŠ-čüąĖą╝ą╝ąĄčéčĆąĖčćąĮčŗą╝ąĖ, ąĮąŠ ą╗ąĄąČą░čé čüąĖą╝ą╝ąĄčéčĆąĖčćąĮąŠ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ą┐ą╗ąŠčüą║ąŠčüčéąĖ, ą▓ą║ą╗čÄčćą░čÄčēąĄą╣ ąŠčüąĖ ąź ąŠą▒ąŠąĖčģ ą░č鹊ą╝ąŠą▓.

ąĀąĖčü. ą×ą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ŽĆp-p-čüą▓čÅąĘąĄą╣ ąĖąĘ ą┤ą▓čāčģ pz-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąĖ ąĖąĘ ą┤ą▓čāčģ py-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣
ąóą░ą║ąĖąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĮą░ąĘčŗą▓ą░čÄčéčüčÅ čüą▓čÅąĘčŗą▓ą░čÄčēąĖą╝ąĖ ŽĆ-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗą╝ąĖ ąŠčĆą▒ąĖčéą░ą╗čÅą╝ąĖ, ą░ ąŠą▒čĆą░ąĘčāčÄčēąĖąĄčüčÅ čüą▓čÅąĘąĖ – čüąŠąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠ ŽĆp-p-čüą▓čÅąĘčÅą╝ąĖ.
ą£ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ŽĆ-čéąĖą┐ą░ ą║ąŠą╝ą▒ąĖąĮąĖčĆčāčÄčéčüčÅ ąĖąĘ p-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąŠą┤ąĖąĮą░ą║ąŠą▓ąŠą╣ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄąĮąĮąŠą╣ ąŠčĆąĖąĄąĮčéą░čåąĖąĖ (ą╗ąĖą▒ąŠ ąĖąĘ ą┤ą▓čāčģ pz-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, ą╗ąĖą▒ąŠ ąĖąĘ ą┤ą▓čāčģ py-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣). ąÜąŠą╝ą▒ąĖąĮąĖčĆąŠą▓ą░ąĮąĖąĄ čĆą░ąĘą╗ąĖčćąĮčŗčģ ą┐ąŠ ąŠčĆąĖąĄąĮčéą░čåąĖąĖ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, ąĮą░ą┐čĆąĖą╝ąĄčĆ py┬Ā+ pz┬Āą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄąĮąĮąŠ ąĮąĄą▓ąŠąĘą╝ąŠąČąĮąŠ ąĖąĘ-ąĘą░ čĆą░ąĘą╗ąĖčćąĖčÅ ąĘąĮą░ą║ąŠą▓ ą▓ąŠą╗ąĮąŠą▓ąŠą╣ čäčāąĮą║čåąĖąĖ.
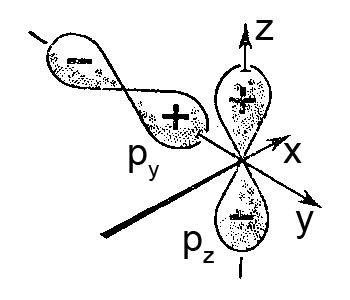
ąĀąĖčü. ąĪčģąĄą╝ą░, ąĖą╗ą╗čÄčüčéčĆąĖčĆčāčÄčēą░čÅ ąŠčéčüčāčéčüčéą▓ąĖąĄ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖčÅ ąĖ ąĮąĄą▓ąŠąĘą╝ąŠąČąĮąŠčüčéčī ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čüą▓čÅąĘąĖ ą╝ąĄąČą┤čā čĆą░ąĘą╗ąĖčćąĮčŗą╝ąĖ ą┐ąŠ ąŠčĆąĖąĄąĮčéą░čåąĖąĖ py– ąĖ pz-ąŠčĆą▒ąĖčéą░ą╗čÅą╝ąĖ
ąÆ ą┐čĆąĄą┤ąĄą╗čīąĮąŠą╝ čüą╗čāčćą░ąĄ, čé.ąĄ. ą┐čĆąĖ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĖ p-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą▓čüąĄčģ čéčĆąĄčģ ąŠčĆąĖąĄąĮčéą░čåąĖą╣, ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ąŠą┤ąĮą░ Žā-čüą▓čÅąĘčī, ąĮą░ą┐čĆąĖą╝ąĄčĆ Žā(px-px)-čüą▓čÅąĘčī, ąĖ ą┤ą▓ąĄ ŽĆ-čüą▓čÅąĘąĖ, ąĮą░ą┐čĆąĖą╝ąĄčĆ ŽĆ(py-py)-čüą▓čÅąĘčī ąĖ ŽĆ(pz-pz)-čüą▓čÅąĘčī.
ąźąĖą╝ąĖč湥čüą║ą░čÅ Žā-čüą▓čÅąĘčī – čŹč鹊 čĆąĄąĘčāą╗čīčéą░čé ą┐čĆčÅą╝ąŠą│ąŠ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖčÅ p-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, ą░ ŽĆ-čüą▓čÅąĘąĖ – čĆąĄąĘčāą╗čīčéą░čé ą▒ąŠą║ąŠą▓ąŠą│ąŠ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖčÅ p-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣
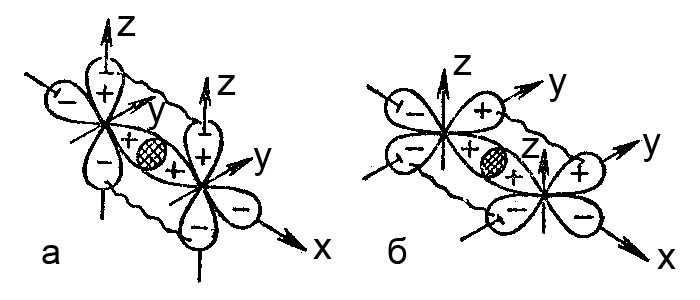
ąĀąĖčü. ą¤ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ Žā, ŽĆ-čüą▓čÅąĘąĄą╣: ą░ – ą┐čĆčÅą╝ąŠąĄ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ px-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąĖ ą▒ąŠą║ąŠą▓ąŠąĄ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ pz-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣; ą▒ – ą┐čĆčÅą╝ąŠąĄ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ px-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąĖ ą▒ąŠą║ąŠą▓ąŠąĄ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ py-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣. ą¤čĆčÅą╝ąŠąĄ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ ą┐ąŠą║ą░ąĘą░ąĮąŠ čłčéčĆąĖčģąŠą▓ą║ąŠą╣, ą▒ąŠą║ąŠą▓ąŠąĄ – ą▓ąŠą╗ąĮąĖčüč鹊ą╣ ą╗ąĖąĮąĖąĄą╣
ą¤ąŠčüą║ąŠą╗čīą║čā Žā-čüą▓čÅąĘčī ą╝ąŠąČąĄčé ąŠą▒čĆą░ąĘąŠą▓čŗą▓ą░čéčīčüčÅ ąĖ ą▒ąĄąĘ čüąŠą┐čāčéčüčéą▓čāčÄčēąĄą│ąŠ č乊čĆą╝ąĖčĆąŠą▓ą░ąĮąĖčÅ ŽĆ-čüą▓čÅąĘąĖ, ą░ ŽĆ-čüą▓čÅąĘčī, ąĮą░ąŠą▒ąŠčĆąŠčé, ąŠą▒čĆą░ąĘčāąĄčéčüčÅ, ą║ąŠą│ą┤ą░ ą┐ąĄčĆą▓ą░čÅ ą┐ą░čĆą░ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ čāąČąĄ ą▓čüčéčāą┐ąĖą╗ą░ ą▓ ą┐čĆčÅą╝ąŠąĄ ą┐ąĄčĆąĄą║čĆčŗą▓ą░ąĮąĖąĄ ąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ą╗ą░ Žā-čüą▓čÅąĘčī, č鹊 čĆą░ąĘą╗ąĖčćą░čÄčé Žā-čüąŠčüčéą░ą▓ą╗čÅčÄčēčāčÄ ąĖ ŽĆ-čüąŠčüčéą░ą▓ą╗čÅčÄčēčāčÄ (ąĖą╗ąĖ ŽĆ-čüąŠčüčéą░ą▓ą╗čÅčÄčēąĖąĄ, ąĄčüą╗ąĖ ąĖčģ ą┤ą▓ąĄ) ąĄą┤ąĖąĮąŠą╣ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ.
ąÜąŠą╝ą▒ąĖąĮąĖčĆąŠą▓ą░ąĮąĖąĄ čłąĄčüčéąĖ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą┤ą▓čāčģ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģčüčÅ ą░č鹊ą╝ąŠą▓ ą┤ą░ąĄčé čłąĄčüčéčī ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣: ąŠą┤ąĮčā čüą▓čÅąĘčŗą▓ą░čÄčēčāčÄ Žā-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčāčÄ ąŠčĆą▒ąĖčéą░ą╗čī ąĖ ąŠą┤ąĮčā čĆą░ąĘčĆčŗčģą╗čÅčÄčēčāčÄ Žā*-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčāčÄ ąŠčĆą▒ąĖčéą░ą╗čī, ą┤ą▓ąĄ čüą▓čÅąĘčŗą▓ą░čÄčēąĖąĄ ŽĆ-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĖ ą┤ą▓ąĄ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖčģ ŽĆ*-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ.
ą¤čĆąĖ ąĮą░ą╗ąĖčćąĖąĖ ą║ą░ą║ ą╝ąĖąĮąĖą╝čāą╝ čłąĄčüčéąĖ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░ ą┤ą▓čāčģ p-ą┐ąŠą┤čāčĆąŠą▓ąĮčÅčģ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģčüčÅ ą░č鹊ą╝ąŠą▓ ą▓čüąĄ čéčĆąĖ čüą▓čÅąĘčŗą▓ą░čÄčēąĖąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ (ąŠą┤ąĮą░ Žā- ąĖ ą┤ą▓ąĄ ŽĆ-) ąŠą║ą░ąČčāčéčüčÅ ąĘą░ąĮčÅčéčŗą╝ąĖ 菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ. ąØą░ą┐čĆąĖą╝ąĄčĆ, čŹč鹊 čĆąĄą░ą╗ąĖąĘčāąĄčéčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ O2 čé.ą║. 2p-ą┐ąŠą┤čāčĆąŠą▓ąĮąĖ ą░č鹊ą╝ą░ O (2s22p4) čüąŠą┤ąĄčƹȹĖčé č湥čéčŗčĆąĄ 菹╗ąĄą║čéčĆąŠąĮą░.

ąĀąĖčü. ą¤ąŠą╗ąĮą░čÅ čŹąĮąĄčĆą│ąĄčéąĖč湥čüą║ą░čÅ ą┤ąĖą░ą│čĆą░ą╝ą╝ą░ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čüą▓čÅąĘąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ O2
Žās-s-čüą▓čÅąĘčī ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ O2 ąŠčéčüčāčéčüčéą▓čāąĄčé, ą┐ąŠčüą║ąŠą╗čīą║čā Žās-s-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĖ Žā*s-s-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ą┐ąŠą╗ąĮąŠčüčéčīčÄ ąĘą░ą┐ąŠą╗ąĮąĄąĮčŗ č湥čéčŗčĆčīą╝čÅ 2s-菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ, ą║ą░ą║ ąĖ ą▓ ą│ąĖą┐ąŠč鹥čéąĖč湥čüą║ąŠą╣ ą╝ąŠą╗ąĄą║čāą╗ąĄ He2.
ąŚą░čüąĄą╗ąĄąĮąĖąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ p-菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ ąĮą░čćąĖąĮą░ąĄčéčüčÅ ą┐ąŠčüą╗ąĄ ą┐ąŠą╗ąĮąŠą│ąŠ ąĘą░ą┐ąŠą╗ąĮąĄąĮąĖčÅ Žās-s– ąĖ Žā*s-s-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣. ąÜą░ą║ ąĮąĖąĘčłą░čÅ ą┐ąŠ 菹ĮąĄčĆą│ąĖąĖ, čüąĮą░čćą░ą╗ą░ ąĘą░ą┐ąŠą╗ąĮčÅąĄčéčüčÅ ąŠą┤ąĮą░ Žāp-p-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī, ąĘą░č鹥ą╝ ą┤ą▓ąĄ ŽĆp-p-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą┐čĆąĖč湥ą╝ ą║ą░ąČą┤ą░čÅ ąĖąĘ ąĮąĖčģ ąĘą░ą┐ąŠą╗ąĮčÅąĄčéčüčÅ ą▓ąĮą░čćą░ą╗ąĄ ąŠą┤ąĮąĖą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą╝ (ą┐ąŠ ą┐čĆą░ą▓ąĖą╗čā ąźčāąĮą┤ą░), ą░ ąĘą░č鹥ą╝ ąĖ ą▓č鹊čĆčŗą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą╝ čü ą┐čĆąŠčéąĖą▓ąŠą┐ąŠą╗ąŠąČąĮčŗą╝ čüą┐ąĖąĮąŠą╝. ąśąĘ ą▓ąŠčüčīą╝ąĖ 2s-菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą┤ą▓čāčģ ą░č鹊ą╝ąŠą▓ O čĆą░ąĘą╝ąĄčēąĄąĮąĮčŗą╝ąĖ ąŠą║ą░ąĘčŗą▓ą░čÄčéčüčÅ č鹊ą╗čīą║ąŠ čłąĄčüčéčī. ą¤ąŠ ą┐čĆąĖąĮčåąĖą┐čā ą╝ąĖąĮąĖą╝čāą╝ą░ 菹ĮąĄčĆą│ąĖąĖ ąŠčüčéą░ą▓čłąĖąĄčüčÅ ą┤ą▓ą░ p-菹╗ąĄą║čéčĆąŠąĮą░ ąĘą░ąĮąĖą╝ą░čÄčé čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖąĄ ŽĆ*p-p-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗, ą║ąŠč鹊čĆčŗąĄ ąĮąĖąČąĄ ą┐ąŠ 菹ĮąĄčĆą│ąĖąĖ, č湥ą╝ Žā*p-p-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ.
ąÆ ą╝ąŠą╗ąĄą║čāą╗ąĄ N2 ąĘą░ čüč湥čé čéčĆąĄčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ p-ą┐ąŠą┤čāčĆąŠą▓ąĮčÅ ą║ą░ąČą┤ąŠą│ąŠ ą░č鹊ą╝ą░ N (2s22p3) ąŠą▒čĆą░ąĘčāąĄčéčüčÅ čéčĆąŠą╣ąĮą░čÅ Žā,ŽĆ,ŽĆ-čüą▓čÅąĘčī:
•
• •
N
•
•
+
•
•
N
•
•
• →
•
• N
≡
N
•
• |
ą×čéčüčāčéčüčéą▓ąĖąĄ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ N2 ąŠą▒čŖčÅčüąĮčÅąĄčé ą▒ąŠą╗čīčłąŠąĄ ąĘąĮą░č湥ąĮąĖąĄ 菹ĮąĄčĆą│ąĖąĖ čüą▓čÅąĘąĖ NŌēĪN ąĖ ą▓ąĄčüčīą╝ą░ ą▓čŗčüąŠą║čāčÄ čģąĖą╝ąĖč湥čüą║čāčÄ ąĖąĮąĄčĆčéąĮąŠčüčéčī ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą│ąŠ ą░ąĘąŠčéą░. ąÆ ą┐čĆąŠčéąĖą▓ąŠą┐ąŠą╗ąŠąČąĮąŠčüčéčī čŹč鹊ą╝čā ą╝ąŠą╗ąĄą║čāą╗čŗ O2 ąĖ F2 ąĖą╝ąĄčÄčé čüąŠąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠ ą┤ą▓ą░ ąĖ č湥čéčŗčĆąĄ 菹╗ąĄą║čéčĆąŠąĮą░ ąĮą░ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖčģ ŽĆ*-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ, čćč鹊 ąŠą▒čāčüą╗ą░ą▓ą╗ąĖą▓ą░ąĄčé ąĘąĮą░čćąĖč鹥ą╗čīąĮąŠ ą╝ąĄąĮčīčłčāčÄ ą┐čĆąŠčćąĮąŠčüčéčī čüą▓čÅąĘąĄą╣ O=O ąĖ F-F ąĖ ą▓čŗčüąŠą║čāčÄ čĆąĄą░ą║čåčŗąŠąĮąĮčāčÄ čüą┐ąŠčüąŠą▒ąĮąŠčüčéčī ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ą║ąĖčüą╗ąŠčĆąŠą┤ą░ ąĖ čäč鹊čĆą░.
ą×ą▒čĆą░čēą░ąĄčé ąĮą░ čüąĄą▒čÅ ą▓ąĮąĖą╝ą░ąĮąĖąĄ ąĮą░ą╗ąĖčćąĖąĄ ą┤ą▓čāčģ ąĮąĄčüą┐ą░čĆąĄąĮąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░ ŽĆ*-ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ O2. ąŁčéąĖ 菹╗ąĄą║čéčĆąŠąĮčŗ čü ą┐ą░čĆą░ą╗ą╗ąĄą╗čīąĮčŗą╝ąĖ čüą┐ąĖąĮą░ą╝ąĖ čÅą▓ą╗čÅčÄčéčüčÅ ą┐čĆąĖčćąĖąĮąŠą╣ ą┐ą░čĆą░ą╝ą░ą│ąĮąĄčéąĖąĘą╝ą░ ą║ąĖčüą╗ąŠčĆąŠą┤ą░; ą╝ąŠą╗ąĄą║čāą╗čŗ O2 ą▓čéčÅą│ąĖą▓ą░čÄčéčüčÅ ą▓ ą╝ą░ą│ąĮąĖčéąĮąŠąĄ ą┐ąŠą╗ąĄ ą▓ ąŠčéą╗ąĖčćąĖąĄ ąŠčé ą┤ąĖą░ą╝ą░ą│ąĮąĖčéąĮčŗčģ ą╝ąŠą╗ąĄą║čāą╗ (ą▒ąĄąĘ ąĮąĄčüą┐ą░čĆąĄąĮąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓) N2 ąĖ F2.
ąÜąŠą▓ą░ą╗ąĄąĮčéąĮą░čÅ čüą▓čÅąĘčī ą╝ąĄąČą┤čā ą┤ą▓čāą╝čÅ ą░č鹊ą╝ą░ą╝ąĖ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ č鹊ą│ą┤ą░, ą║ąŠą│ą┤ą░ ą┤ąĄą╣čüčéą▓ąĖąĄ čģąŠčéčÅ ą▒čŗ ąŠą┤ąĮąŠą╣ čüą▓čÅąĘčŗą▓ą░čÄčēąĄą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĮąĄ ą║ąŠą╝ą┐ąĄąĮčüąĖčĆčāąĄčéčüčÅ ą┤ąĄą╣čüčéą▓ąĖąĄą╝ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĄą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ.
ą×ą▒ąŠą▒čēą░čÅ čĆą░čüčüą╝ąŠčéčĆąĄąĮąĮčŗąĄ ą╝ąĄčģą░ąĮąĖąĘą╝čŗ č乊čĆą╝ąĖčĆąŠą▓ą░ąĮąĖčÅ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗčģ čüą▓čÅąĘąĄą╣ čü č鹊čćą║ąĖ ąĘčĆąĄąĮąĖčÅ ą╝ąĄč鹊ą┤ą░ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, ą╝ąŠąČąĮąŠ ąŠą▒ąŠą▒čēąĖčéčī čüą╗ąĄą┤čāčÄčēąĄąĄ:
- ąÆ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ ą▒ąĄčĆčāčé čāčćą░čüčéąĖąĄ ą▓čüąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ ą░č鹊ą╝ąŠą▓;
- ąÉč鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ą┐ąĄčĆąĄčüčéčĆą░ąĖą▓ą░čÄčéčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą║ąŠč鹊čĆčŗąĄ ąĖą╝ąĄčÄčé ą▒ąŠą╗ąĄąĄ čüą╗ąŠąČąĮčāčÄ č乊čĆą╝čā č湥ą╝ ą░č鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ;
- ąśąĘ ą┤ą▓čāčģ ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą┤ą▓ąĄ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ąŠą┤ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēą░čÅ, ą▓č鹊čĆą░čÅ – čĆą░ąĘčĆčŗčģą╗čÅčÄčēą░čÅ;
- ąĪčāčēąĄčüčéą▓čāąĄčé ą┤ą▓ą░ ą▓ąĖą┤ą░ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ Žā ąĮą░ ą║ąŠč鹊čĆąŠą╣ ą╝ąŠąČąĄčé ą▒čŗčéčī 2 菹╗ąĄą║čéčĆąŠąĮą░ ąĖ ŽĆ – ąĮą░ ą║ąŠč鹊čĆąŠą╣ ą╝ąŠąČąĄčé ąĮą░čģąŠą┤ąĖčéčīčüčÅ č湥čéčŗčĆąĄ 菹╗ąĄą║čéčĆąŠąĮą░.
ą¤čĆąĖąĮčåąĖą┐čŗ ąĘą░ą┐ąŠą╗ąĮąĄąĮąĖčÅ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ 菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ.
- ąØą░ąĖą╝ąĄąĮčīčłą░čÅ čŹąĮąĄčĆą│ąĖčÅ;
- ą¤čĆąĖąĮčåąĖą┐ ą¤ą░čāą╗ąĖ – ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ ąĮąĄ ą╝ąŠąČąĄčé ą▒čŗčéčī ą┤ą▓čāčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ čü č湥čéčŗčĆčīą╝čÅ ąŠą┤ąĖąĮą░ą║ąŠą▓čŗą╝ąĖ ą║ą▓ą░ąĮč鹊ą▓čŗą╝ąĖ čćąĖčüą╗ą░ą╝ąĖ;
- ą¤čĆą░ą▓ąĖą╗ąŠ ąźčāąĮą┤ą░ (ąĖą╗ąĖ ą┐čĆą░ą▓ąĖą╗ąŠ ąōčāąĮą┤ą░, ąĖą╗ąĖ ą┐čĆąĖąĮčåąĖą┐ ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮąŠą╣ ą╝čāą╗čīčéąĖą┐ą╗ąĄčéąĮąŠčüčéąĖ) – ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ (ąĖ ą░č鹊ą╝ąĮčŗąĄ) ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą┐čĆąĖąĮą░ą┤ą╗ąĄąČą░čēąĖąĄ ą║ ąŠą┤ąĮąŠą╝čā ą┐ąŠą┤čāčĆąŠą▓ąĮčÄ, ąĘą░ą┐ąŠą╗ąĮčÅčÄčéčüčÅ ą║ą░ąČą┤ą░čÅ ą▓ąĮą░čćą░ą╗ąĄ ąŠą┤ąĮąĖą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą╝, ą░ ąĘą░č鹥ą╝ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ąĖčģ ąĘą░ą┐ąŠą╗ąĮąĄąĮąĖąĄ ą▓č鹊čĆčŗą╝ąĖ 菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ.
ą¤ąŠčĆčÅą┤ąŠą║ ąĘą░ą┐ąŠą╗ąĮąĄąĮąĖčÅ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ (菹╗ąĄą║čéčĆąŠąĮąĮčŗąĄ č乊čĆą╝čāą╗čŗ ą╝ąŠą╗ąĄą║čāą╗):
Žā1s2 Žā*1s2 Žā2s2 Žā*2s2 Žā2p2 ŽĆ2p4 ŽĆ*2p4 Žā*2p2
ąöą╗čÅ ą╝ąŠą╗ąĄą║čāą╗ B2 ąĖ C2 čüąĮą░čćą░ą╗ą░ ąĘą░ą┐ąŠą╗ąĮčÅąĄčéčüčÅ ŽĆ2p ą░ ąĘą░č鹥ą╝ Žā2p.
ą¤ąŠčĆčÅą┤ąŠą║ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ – čŹč鹊 čĆą░ąĘąĮąŠčüčéčī ą╝ąĄąČą┤čā ą║ąŠą╗ąĖč湥čüčéą▓ąŠą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ ąĖ ą║ąŠą╗ąĖč湥čüčéą▓ąŠą╝ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ, ą┤ąĄą╗ąĄąĮąĮąŠąĄ ąĮą░ 2.
(n(Žā+ŽĆ) + n(Žā*+ŽĆ*))/2
ąĢčüą╗ąĖ ą┐ąŠčĆčÅą┤ąŠą║ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ ą▒ąŠą╗čīčłąĄ ąĮčāą╗čÅ – čģąĖą╝ąĖč湥čüą║ą░čÅ čüą▓čÅąĘčī ą▓ąŠąĘą╝ąŠąČąĮą░.
ąĪą╗ąĄą┤čüčéą▓ąĖčÅ ąĖąĘ č鹥ąŠčĆąĖąĖ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣:
- ąÜąŠą│ą┤ą░ ąŠčéčĆčŗą▓ą░ąĄčéčüčÅ čŹą╗ąĄą║čéčĆąŠąĮ ąŠčé čüą▓čÅąĘčŗą▓ą░čÄčēąĄą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą╝ąŠą╗ąĄą║čāą╗ą░ čüčéą░ąĮąŠą▓ąĖčéčüčÅ ą╝ąĄąĮąĄąĄ ą┐čĆąŠčćąĮąŠą╣, 菹ĮąĄčĆą│ąĖčÅ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ čāą╝ąĄąĮčīčłą░ąĄčéčüčÅ. ąÜąŠą│ą┤ą░ 菹╗ąĄą║čéąĮąŠąĮ ąŠčéčĆčŗą▓ą░ąĄčéčüčÅ ąŠčé čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĄą╣ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ, ą╝ąŠą╗ąĄą║čāą╗ą░ čüčéą░ąĮąŠą▓ąĖčéčüčÅ ą▒ąŠą╗ąĄąĄ ą┐čĆąŠčćąĮąŠą╣, ąĄąĮąĄčĆą│ąĖčÅ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ ą▓ąŠąĘčĆą░čüčéą░ąĄčé;
- ą¦ąĄą╝ ą▒ąŠą╗čīčłąĄ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ, č鹥ą╝ ą▒ąŠą╗ąĄąĄ ą┐čĆąŠčćąĮąŠą╣ ą▒čāą┤ąĄčé čģąĖą╝ąĖč湥čüą║ą░čÅ čüą▓čÅąĘčī, ą░ ą╝ąĄąČčŖčÅą┤ąĄčĆąĮąŠąĄ čĆą░čüčüč鹊čÅąĮąĖąĄ ą╝ąĄąĮčīčłąĄ;
- ą¤ąŠč鹥ąĮčåąĖą░ą╗ ąĖąŠąĮąĖąĘą░čåąĖąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ ąĘą░ą▓ąĖčüąĖčé ąŠčé č鹊ą│ąŠ, ąĮą░ ą║ą░ą║ąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ ąĮą░čģąŠą┤čÅčéčüčÅ ą▓ąĮąĄčłąĮąĖąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ. ąĢčüą╗ąĖ ą▓ąĮąĄčłąĮąĖąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ ą┐čĆąĄąĖą╝čāčēąĄčüčéą▓ąĄąĮąĮąŠ ąĮą░ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗čÅčģ, č鹊 ą┐ąŠč鹥ąĮčåąĖą░ą╗ ąĖąŠąĮąĖąĘą░čåąĖąĖ ą▒čāą┤ąĄčé ą▓čŗčüąŠą║ąĖą╝, ąĄčüą╗ąĖ ąĮą░ čĆą░ąĘčĆčŗčģą╗čÅčÄčēąĖčģ – ąĮąĖąĘą║ąĖą╝.
ąōąĖą▒čĆąĖą┤ąĖąĘą░čåąĖčÅ ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣
ąÉč鹊ą╝ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąŠą┤ąĮąŠą│ąŠ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą│ąŠ čāčĆąŠą▓ąĮčÅ, ąĮą░ą┐čĆąĖą╝ąĄčĆ s- ąĖ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, čü čĆą░ąĘą╗ąĖčćąĮąŠą╣ čüąĖą╝ą╝ąĄčéčĆąĖąĄą╣ ą▓ čüą▓ąŠą▒ąŠą┤ąĮąŠą╝ ą░č鹊ą╝ąĄ ą┐čĆąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ čü ą┤čĆčāą│ąĖą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ ą╝ąŠą│čāčé ą┐čĆąĖąŠą▒čĆąĄčéą░čéčī ąŠą┤ąĖąĮą░ą║ąŠą▓čāčÄ č乊čĆą╝čā. ąŁč鹊čé ą┐čĆąŠčåąĄčüčü ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖčÅ ą░č鹊ą╝ąĮčŗą╣ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣. ąśą┤ąĄčÄ ąŠ ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖąĖ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą▓ ą░č鹊ą╝ąĄ ą▓čŗą┤ą▓ąĖąĮčāą╗ ą░ą╝ąĄčĆąĖą║ą░ąĮčüą║ąĖą╣ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖą║ ą¤ąŠą╗ąĖąĮą│ (1931 ą│).
ą¤čāčüčéčī ą▓ ąĮąĄą║ąŠč鹊čĆąŠą╝ ą░č鹊ą╝ąĄ (čåąĄąĮčéčĆą░ą╗čīąĮąŠą╝ ą░č鹊ą╝ąĄ) ąŠą┤ąĮą░ s- ąĖ ąŠą┤ąĮą░ p-ą░č鹊ą╝ąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī ąŠą┤ąĮąŠą│ąŠ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą│ąŠ čāčĆąŠą▓ąĮčÅ čāčćą░čüčéą▓čāčÄčé ą▓ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ą┤ą▓čāčģ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗčģ čüą▓čÅąĘąĄą╣ čü ą░č鹊ą╝ą░ą╝ąĖ-ą┐ą░čĆčéąĮąĄčĆą░ą╝ąĖ. ą¤čĆąĖ čŹč鹊ą╝ ąŠčĆą▒ąĖčéą░ą╗ąĖ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ ą╝ąĄąĮčÅčÄčé čüą▓ąŠčÄ čüąĖą╝ą╝ąĄčéčĆąĖčÄ čéą░ą║, čćč鹊 ąŠą▒ąĄ čüčéą░ąĮąŠą▓čÅčéčüčÅ ąŠą┤ąĖąĮą░ą║ąŠą▓čŗą╝ąĖ ą┐ąŠ č乊čĆą╝ąĄ.

ąĀąĖčü. ąōąĖą▒čĆąĖą┤ąĖąĘą░čåąĖčÅ ąŠą┤ąĮąŠą╣ s- ąĖ ąŠą┤ąĮąŠą╣ p-ą░č鹊ą╝ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ: ą░ – ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą┤ą▓čāčģ ą│ąĖą▒čĆąĖą┤ąĮčŗčģ sp-ąŠčĆą▒ąĖčéą░ą╗ąĄą╣; ą▒ – ą│ąĄąŠą╝ąĄčéčĆąĖč湥čüą║ą░čÅ č乊čĆą╝ą░ ąŠą┤ąĮąŠą╣ ą│ąĖą▒čĆąĖą┤ąĮąŠą╣ ą░č鹊ą╝ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ; ą▓ – čāčüą╗ąŠą▓ąĮąŠąĄ ąĖąĘąŠą▒čĆą░ąČąĄąĮąĖąĄ ą│ąĖą▒čĆąĖą┤ąĮąŠą╣ ą░č鹊ą╝ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ – čüą▓čÅąĘčŗą▓ą░čÄčēąĖą╣ “ą╗ąĄą┐ąĄčüč鹊ą║”
ąóą░ą║ąĖąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĮą░ąĘčŗą▓ą░čÄčé ą│ąĖą▒čĆąĖą┤ąĮą░čÅ ą░č鹊ą╝ąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī; ąĖčģ čćą░čüč鹊 čāčüą╗ąŠą▓ąĮąŠ ąĖąĘąŠą▒čĆą░ąČą░čÄčé ą▓ ą▓ąĖą┤ąĄ čüą▓čÅąĘčŗą▓ą░čÄčēąĖčģ “ą╗ąĄą┐ąĄčüčéą║ąŠą▓”.
ą¤ąŠ čćąĖčüą╗čā čāčćą░čüčéą▓čāčÄčēąĖčģ ą▓ ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖąĖ ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ čĆą░ąĘą╗ąĖčćą░čÄčé čüą╗ąĄą┤čāčÄčēąĖąĄ, ąĮą░ąĖą▒ąŠą╗ąĄąĄ čĆą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮąĮčŗąĄ čéąĖą┐čŗ ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖąĖ:
sp-ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖčÅ ąŠą┤ąĮąŠą╣ s- ąĖ ąŠą┤ąĮąŠą╣ p-ą░č鹊ą╝ąĮąŠą╣ ąŠčĆą▒ąĖčéą░ą╗ąĖ
sp2-ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖčÅ ąŠą┤ąĮąŠą╣ s- ąĖ ą┤ą▓čāčģ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣
sp3-ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖčÅ ąŠą┤ąĮąŠą╣ s- ąĖ čéčĆąĄčģ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣
ą¦ąĖčüą╗ąŠ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą▓ čĆąĄąĘčāą╗čīčéą░č鹥 ąĖčģ ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖąĖ ąĮąĄ ąĖąĘą╝ąĄąĮčÅąĄčéčüčÅ. ąØą░ ąŠą┤ąĮąŠą╝ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą╝ čāčĆąŠą▓ąĮąĄ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ ą╝ąŠą│čāčé ąĮą░čģąŠą┤ąĖčéčīčüčÅ:
ą┤ą▓ąĄ sp-ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ąĖ ą┤ą▓ąĄ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĖ
čéčĆąĖ sp2-ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ąĖ ąŠą┤ąĮą░ p-ą░č鹊ą╝ąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī
č湥čéčŗčĆąĄ sp3-ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĖ
ąÆąĘą░ąĖą╝ąĮą░čÅ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĮąŠčüčéčī ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣, ą║ąŠč鹊čĆčŗąĄ ą▓čüąĄą│ą┤ą░ č乊čĆą╝ąĖčĆčāčÄčé Žā-čüąŠčüčéą░ą▓ą╗čÅčÄčēąĖąĄ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ (čé.ąĄ. Žā-ąĘą▓čÅąĘąĖ), čĆą░ąĘą╗ąĖčćąĮą░ ą▓ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ąŠčé ąĖčģ čćąĖčüą╗ą░.
ąĪč鹥čĆąĄąŠą╝ąĄčéčĆąĖč湥čüą║ąŠąĄ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮąĖąĄ ąŠčüąĄą╣ ą▓ą░ą╗ąĄąĮčéąĮčŗčģ ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ ą┐ąŠčüą╗ąĄ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čüą▓čÅąĘąĄą╣ čü ą░č鹊ą╝ą░ą╝ąĖ-ą┐ą░čĆčéąĮąĄčĆą░ą╝ąĖ čģą░čĆą░ą║č鹥čĆąĖąĘčāąĄčéčüčÅ čāą│ą╗ąŠą╝ ą╝ąĄąČą┤čā čüą▓čÅąĘčÅą╝ąĖ, ąĖą╗ąĖ ą▓ą░ą╗ąĄąĮčéąĮčŗą╝ čāą│ą╗ąŠą╝.
ąöą▓ąĄ sp2-ą│ąĖą▒čĆąĖą┤ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĮąĄą║ąŠč鹊čĆąŠą│ąŠ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ ą╗ąĄąČą░čé ąĮą░ ąŠą┤ąĮąŠą╣ ąŠčüąĖ ąĖ ąĖą╝ąĄčÄčé ą┐čĆąŠčéąĖą▓ąŠą┐ąŠą╗ąŠąČąĮąŠąĄ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĄ ąŠčé čÅą┤čĆą░ ą░č鹊ą╝ą░; čāą│ąŠą╗ ą╝ąĄąČą┤čā ąŠčüčÅą╝ąĖ sp-ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ čĆą░ą▓ąĄąĮ 180*.
ąóčĆąĖ sp-ą│ąĖą▒čĆąĖą┤ąĮčŗąĄ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĖą╝ąĄčÄčé ąŠčüąĖ, ą╗ąĄąČą░čēąĖąĄ ą▓ ąŠą┤ąĮąŠą╣ ą┐ą╗ąŠčüą║ąŠčüčéąĖ, ąĖ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮčŗ ą▓ ą▓ąĄčĆčłąĖąĮčŗ čĆą░ą▓ąĮąŠčüč鹊čĆąŠąĮąĮąĄą│ąŠ (ą┐čĆą░ą▓ąĖą╗čīąĮąŠą│ąŠ) čéčĆąĄčāą│ąŠą╗čīąĮąĖą║ą░; čāą│ą╗čŗ ą╝ąĄąČą┤čā ąŠčüčÅą╝ąĖ sp2-ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ čüąŠčüčéą░ą▓ą╗čÅčÄčé 120*.
ą¦ąĄčéčŗčĆąĄ sp3-ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĖą╝ąĄčÄčé ąŠčüąĖ, ą╗ąĄąČą░čēąĖąĄ ą▓ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄ ą┐ąŠą┤ čāą│ą╗ą░ą╝ąĖ 109.5*; ąŠąĮąĖ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮčŗ ą▓ ą▓ąĄčĆčłąĖąĮčŗ ą┐čĆą░ą▓ąĖą╗čīąĮąŠą│ąŠ (ąĖą┤ąĄą░ą╗čīąĮąŠą│ąŠ) č鹥čéčĆą░菹┤čĆą░.

ąĀąĖčü. ąōąĄąŠą╝ąĄčéčĆąĖč湥čüą║ą░čÅ č乊čĆą╝ą░ ą╝ąŠą╗ąĄą║čāą╗ BeH2 – ą╗ąĖąĮąĄą╣ąĮą░čÅ, AlH3 – čéčĆąĖą│ąŠąĮą░ą╗čīąĮą░čÅ, SiH4 – č鹥čéčĆą░菹┤čĆąĖč湥čüą║ą░čÅ
|
ąóąĖą┐ ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖąĖ
sp
sp2
sp3
sp3d
sp3d2
ąōąĄąŠą╝ąĄčéčĆąĖčÅ ą╝ąŠą╗ąĄą║čāą╗
ąøąĖąĮąĄą╣ąĮą░čÅ (ą┤ąĖą│ąŠąĮą░ą╗čīąĮą░čÅ)
ąóčĆąĖą│ąŠąĮą░ą╗čīąĮą░čÅ (čéčĆąĄčāą│ąŠą╗čīąĮą░čÅ)
ąóąĄčéčĆą░菹┤čĆąĖč湥čüą║ą░čÅ
ąóčĆąĖą│ąŠąĮą░ą╗čīąĮąŠ-ą▒ąĖą┐ąĖčĆą░ą╝ąĖą┤ą░ą╗čīąĮą░čÅ
ą×ą║čéą░菹┤čĆąĖč湥čüą║ą░čÅ
ąÆą░ą╗ąĄąĮčéąĮčŗąĄ čāą│ą╗čŗ
180*
120*
109.5*
90* ąĖ 120*
90*
ą¤čĆąĖą╝ąĄčĆčŗ
BeH2, CO2, C2H2, BO2–
AlH3, AlF3, SO3, CO32-, NO3–
SiH4, CCl4, NH4+, SO42-
PF5, AsF5, PCl5, SbCl5
SF6, AsF6–, IO65-, SnCl62-
|
ąÜčĆąŠą╝ąĄ sp-, sp2-, sp3-ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖąĖ ą┤ą╗čÅ čåąĄąĮčéčĆą░ą╗čīąĮčŗčģ ą░č鹊ą╝ąŠą▓ s- ąĖ p-菹╗ąĄą╝ąĄąĮč鹊ą▓ ą▓čüčéčĆąĄčćą░čÄčéčüčÅ ą┤čĆčāą│ąĖąĄ čéąĖą┐čŗ, ą▓ ą║ąŠč鹊čĆčŗčģ čāčćą░čüčéą▓čāčÄčé d-ąŠčĆą▒ąĖčéą░ą╗ąĖ č鹊ą│ąŠ ąČąĄ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą│ąŠ čāčĆąŠą▓ąĮčÅ.
ą¤čÅčéčī ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąŠą┤ąĮąŠą│ąŠ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą│ąŠ čāčĆąŠą▓ąĮčÅ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ (ą┤ą╗čÅ čŹą╗ąĄą╝ąĄąĮč鹊ą▓ čéčĆąĄčéčīąĄą│ąŠ ąĖ ą┐ąŠčüą╗ąĄą┤čāčÄčēąĖčģ ą┐ąĄčĆąĖąŠą┤ąŠą▓), čé.ąĄ. ąŠą┤ąĮą░ s-ą░č鹊ą╝ąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī, čéčĆąĖ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĖ ąŠą┤ąĮą░ d-ą░č鹊ą╝ąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī, čāčćą░čüčéą▓čāčÄčé ą▓ sp3d-ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖąĖ. ą×čüąĖ čéą░ą║ąĖčģ ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą╗ąĄąČą░čé ą▓ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄ ą┐ąŠą┤ čāą│ą╗ą░ą╝ąĖ 90* ąĖ 120*, ą┐ąŠčüą║ąŠą╗čīą║čā ąŠąĮąĖ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮčŗ ą▓ ą▓ąĄčĆčłąĖąĮčŗ čéčĆąĖą│ąŠąĮą░ą╗čīąĮąŠą╣ ą▒ąĖą┐ąĖčĆą░ą╝ąĖą┤čŗ.
ą©ąĄčüčéčī ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ąŠą┤ąĮąŠą│ąŠ 菹ĮąĄčĆą│ąĖčéąĖč湥čüą║ąŠą│ąŠ čāčĆąŠą▓ąĮčÅ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ (ą┤ą╗čÅ čŹą╗ąĄą╝ąĄąĮč鹊ą▓ čéčĆąĄčéčīąĄą│ąŠ ąĖ ą┐ąŠčüą╗ąĄą┤čāčÄčēąĖčģ ą┐ąĄčĆąĖąŠą┤ąŠą▓), čé.ąĄ. ąŠą┤ąĮą░ s-ą░č鹊ą╝ąĮą░čÅ ąŠčĆą▒ąĖčéą░ą╗čī, čéčĆąĖ p-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĖ ąĖ ą┤ą▓ąĄ d-ą░č鹊ą╝ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĖ, čāčćą░čüčéą▓čāčÄčé ą▓ sp3d2-ą│ąĖą▒čĆąĖą┤ąĖąĘą░čåąĖąĖ. ą×čüąĖ ą│ąĖą▒čĆąĖą┤ąĮčŗčģ ąŠčĆą▒ąĖčéą░ą╗ąĄą╣ ą╗ąĄąČą░čé ą▓ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄ ą┐ąŠą┤ čāą│ą╗ą░ą╝ąĖ 90* ąĖ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮčŗ ą▓ ą▓ąĄčĆčłąĖąĮčŗ ą┐čĆą░ą▓ąĖą╗čīąĮąŠą│ąŠ (ąĖą┤ąĄą░ą╗čīąĮąŠą│ąŠ) ąŠą║čéą░菹┤čĆą░.

ąĀąĖčü. ąōąĄąŠą╝ąĄčéčĆąĖč湥čüą║ą░čÅ č乊čĆą╝ą░ ą╝ąŠą╗ąĄą║čāą╗ PF5 – čéčĆąĖą│ąŠąĮą░ą╗čīąĮąŠ-ą▒ąĖčĆąĖčĆą░ą╝ąĖą┤ą░ą╗čīąĮą░čÅ (ą░) ąĖ SF6 – ąŠą║čéą░菹┤čĆąĖč湥čüą║ą░čÅ (ą▒)
ąóąĄčéčĆą░菹┤čĆąĖč湥čüą║ą░čÅ ąĖ ąŠą║čéą░菹┤čĆąĖč湥čüą║ą░čÅ č乊čĆą╝čŗ čÅą▓ą╗čÅčÄčéčüčÅ čéą░ą║ąČąĄ ąŠčüąĮąŠą▓ąĮčŗą╝ąĖ ą▓ ą│ąĄąŠą╝ąĄčéčĆąĖąĖ ą║ąŠą╝ą┐ą╗ąĄą║čüąŠą▓.










