Ковалентні σ-зв’язки між s-орбіталями (σs-s-зв’язок)
Квантово-механічні уявлення про будову електронних оболонок атомів дозволяють якісно пояснити і кількісно розрахувати відповідно до сучасного рівня розвитку квантової хімії утворення ковалентного зв’язку.
Якщо два атома наближаються один до одного, кожен з яких має зайняту одним електроном орбіталь, то між атомами виникає ковалентний зв’язок. Найпростішим прикладом утворення ковалентного зв’язку є об’єднання двох атомів гідрогену в молекулу H2.
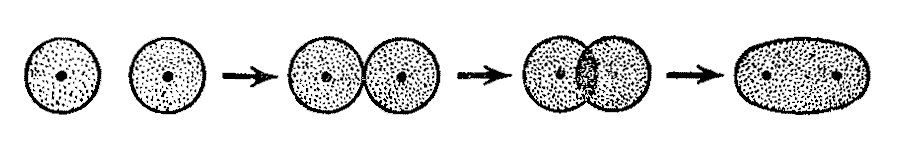
Мал. Утворення ковалентного зв’язку при перекриванні атомних орбіталей гідрогену.
Відповідно до методу валентних зв’язків при зближенні двох атомів гідрогену відбувається перекривання їх s-орбіталей, кожна з яких містить один електрон. Цей процес супроводжується виділенням енергії при утворенні загальної електронної пари. Оскільки між позитивно зарядженими ядрами атомів гідрогену діють сили електростатичного відштовхування, на певній відстані між атомами, ці сили починають перешкоджати подальшому зближенню атомів. Щоб знову розділити утворену молекулу H2 на атоми гідрогену, необхідно затратити енергію (436 кДж/моль); ця енергія називається енергія зв’язку і чисельно дорівнює енергії, що виділилася при утворенні молекули H2 (-436 кДж/моль). Таким чином, утворенню ковалентного зв’язку відповідає стан молекули H2 з енергетичним мінімумом (виграшем енергії) в 436 кДж/моль. Узагальнюючи цей результат на процес утворення ковалентних зв’язків між атомами інших елементів, можна стверджувати, що
при об’єднанні атомів в молекули реалізується стан з енергетичним мінімумом.
Таким чином, міцність ковалентного зв’язку зумовлена тим, що для її розриву завжди необхідно витратити деяку енергію.
Відповідно до методу молекулярних орбіталей, процес утворення ковалентного зв’язку в молекулі H2 пояснюється наступним чином. Орбіталі з одним електроном від двох атомів гідрогену при їх достатньому зближенні і перехрещуванні комбінуються в дві молекулярні орбіталі, всередині яких розташовуються обидва атомних ядра. Одна з цих молекулярних орбіталей (як більш енергетично вигідна) повністю зайнята двома електронами (загальної електронної парою).
Будь-яку молекулярну орбіталь можна розглядати, подібно до будь-якої атомної орбіталі, як об’єм простору в молекулі, в якому ймовірність знаходження електрона 90% і де може зосереджуватися 90% електронної щільності одного або двох електронів в залежності від зайнятості даної молекулярної орбіталі.

Мал. Енергетична діаграма утворення σs-s-зв’язку в молекулі H2
Молекулярні орбіталі на відміну від атомних орбіталей, на енергетичних діаграмах, представляють круговими квантовими комірками.
σ-зв’язок – це ковалентний зв’язок, при формуванні якого обидві взаємодіючі атомні орбіталі перекриваються і комбінуються уздовж осі таким чином, що утворюються обертально симетричні молекулярні орбіталі.
σs-s-зв’язок – це σ-зв’язок в утворенні якого беруть участь s-атомні орбіталі взаємодіючих атомів.
При комбінуванні двох атомних орбіталей утворюється дві молекулярні орбіталі, які розрізняються по енергії. Молекулярна орбіталь, яка виявляється більш вигідною для електронів по енергії, ніж вихідні атомні орбіталі, і завдяки якій атоми зв’язуються в молекулу, називається зв’язуюча молекулярна орбіталь і позначається як σ. Друга молекулярна орбіталь, з двох, що утворилися, є менш вигідною по енергії, ніж вихідні атомні орбіталі, називається розпушуюча (антизв’язуюча) молекулярна орбіталь і позначається як σ*.
Назви «зв’язуюча» і «розпушуюча» молекулярні орбіталі обгрунтовуються електронною щільністю в певних об’ємах молекулярного простору. Зв’язуючій молекулярній орбіталі відповідає підвищена електронна щільність в області зв’язування (між) атомами, а розпушуючій молекулярній орбіталі – підвищена електронна щільність в області розпушення (по обидва боки за) атомними ядрами.

Мал. Розподіл електронної щільності в зв’язуючій і розпушуючій молекулярній орбіталі.
Таким чином, електрони на зв’язуючих молекулярних орбіталях зміцнюють хімічний зв’язок, а електрони на розпушуючих молекулярних орбіталях послаблюють (розпушують) хімічний зв’язок. Імовірність перебування електронів на зв’язуючій молекулярній орбіталі висока, а на розпушуючій – низька, тому електрони при утворенні молекули спочатку займають зв’язуючі молекулярні орбіталі, а потім – розпушуючі молекулярні орбіталі. Наприклад, в молекулі H2 обидва електрони знаходяться на зв’язуючих орбіталях, а розпушуюча орбіталь залишається порожньою, без електронів: H2 σ1s2 σ*1s0.
За допомогою методу молекулярних орбіталей (ММО) легко пояснити, чому атоми гелію на відміну від атомів гідрогену або оксигену не об’єднуються в ковалентні молекули He2. Два атома гелію мають чотири 1s-електрони; при гіпотетичному утворенні молекули He2 перші два електрони займуть σ-молекулярні орбіталі, а другі два електрона займуть σ*-молекулярні орбіталі. Квантово-механічні розрахунки показують, що при однаковій кількості електронів на зв’язуючих і розпушуючих молекулярних орбіталях, хімічний зв’язок не утворюється. Утворення таких молекул енергетично не вигідно, а стабілізуюча молекулу дія електронів на зв’язуючих молекулярних орбіталях компенсується (а часто перевищується) дестабілізуючою дією електронів, що перебувають на розпушуючих молекулярних орбіталях. Саме тому існують частинки H+, H2, H2– He2+, але не утворюються молекулярні частинки H22- He2.
Ковалентні σ-зв’язки між p-орбіталями (σp-p-зв’язок)
Атомні p-орбіталі, подібно s-атомним орбіталям, при зближенні відповідних атомів можуть перекриватися уздовж своєї осі і комбінуватися в молекулярні орбіталі.

Мал. Утворення ковалентного σp-p-зв’язку при перекриванні атомних p-орбіталей
Знаки «+» і «-» всередині граничної області p-орбіталей не належать до електричних зарядів (електрони завжди заряджені негативно), а позначають половини кожної p-атомної орбіталі, які перекриваються; вони відносяться до симетрії хвильової функції, яка математично описує будь-яку атомну орбіталь в хвильовій механиці Шредінгера. Комбінування двох p-атомних орбіталей призводить до утворення двох обертально-симетричних молекулярних орбіталей: однієї зв’язуючої σ-молекулярної орбиталью і однієї розпушуючої σ*-молекулярної орбіталі. Зв’язок, який утворюється є σp-p-зв’язком.
Наприклад, в утворенні σp-p-зв’язку молекули фтору беруть участь по одній орбіталі з p-підрівня кожного атома флуору; інші p-атомні орбіталі формують π-молекулярні орбіталі. Електрони заповнюють зв’язуючу σ-молекулярну орбіталь, яка за енергією більш вигідна, ніж вихідні p-атомні орбіталі.
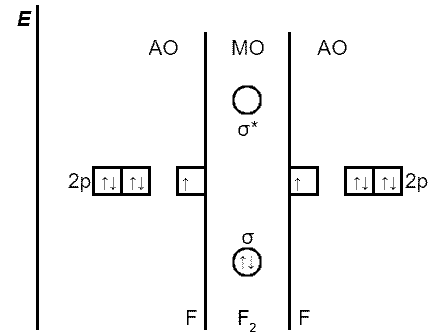
Рис. Енергетична діаграма утворення σp-p-зв’язку в молекулі F2
Обидва атома флуору зв’язуються в молекулу F2:
•
• ••
F
••
•
+
• ••
F
••
•
• →
•
• ••
F
••
•
• ••
F
••
•
• |
Ковалентні σ-зв’язки між s- і p-орбіталями (σs-p-зв’язок)
Атомні s- і p-орбіталі також можуть перекриватися і комбінуватися в молекулярні орбіталі.
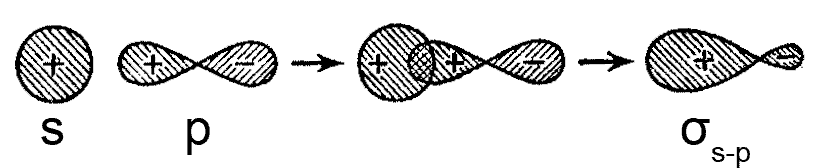
Мал. Утворення ковалентного σs-p-зв’язку при перекриванні атомних s- і p-орбіталей
Половина p-атомної орбіталі, що перекривається, за знаком збігається зі сферично симетричною s-атомною орбіталью. В результаті комбінування s- і p-атомних орбіталей формуються дві обертально-симетричні молекулярні орбіталі: одна зв’язуюча σ-молекулярна орбіталь і одна розпушуються σ*-молекулярная орбиталь. Ковалентний зв’язок, що утворився називається σs-p-зв’язок.
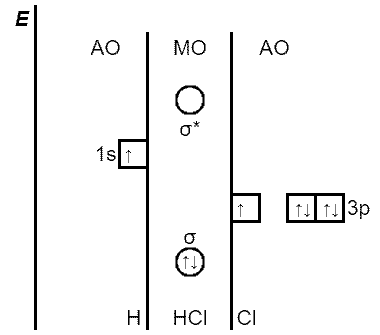
Мал. Енергетична діаграма утворення σs-p-зв’язку в молекулі HCl
Наприклад, в утворенні σs-p-зв’язку між атомом гідрогену (1s1) і атомом хлору (3s23p5), беруть участь s-атомна орбіталь гідрогену і одна p-атомна орбіталь хлору, яка містить неспарений електрон. Хлор – більш електронегативний елемент, ніж гідроген, тому p-підрівень атома хлору розташовують на енергетичній діаграмі нижче, ніж s-підрівень атома гідрогену. Два електрона заповнюють зв’язуючу σ-молекулярну орбіталь, яка по енергії нижче вихідних 1s- і 3p-атомних орбіталей. Обидва атома об’єднуються в молекулу гідроген хлориду:
H
•
+
• ••
Cl
••
•
• →
H
•
• ••
Cl
••
•
• |
Відповідно до атомної моделі Бора при утворенні ковалентного зв’язку H-Cl створюється октет валентних електронів навколо атома хлору, але лише дублет електронів навколо атома гідрогену.
Ковалентні π-зв’язки між p-орбіталями (πp-p-зв’язок)
Утворення хімічного зв’язку можливо і між двома атомами, що містять валентні p-підрівні. При зближенні атомів уздовж осі Х (px-орбіталей) в першу чергу відбувається перекривання між двома px-атомними орбиталями, які утворюють σp-p-зв’язок. Однак це не виключає подальшої взаємодії py– та pz-атомних орбіталей обох атомів. Комбінування двох py-атомних орбіталей або двох pz-атомних орбіталей (хоча і не настільки вигідне як при утворенні σ-зв’язку) призводить до формування молекулярних орбіталей іншого, ніж σ-молекулярні орбіталі, виду. Ці орбіталі не є обертально-симетричними, але лежать симетрично відносно площини, що охоплює вісі Х обох атомів.

Мал. Утворення πp-p-зв’язків з двох pz-орбіталей і з двох py-орбіталей
Такі молекулярні орбіталі називаються зв’язуючими π-молекулярними орбіталями, а зв’язок, що утворюється – відповідно πp-p-зв’язок.
Молекулярні орбіталі π-типу комбінуються з p-орбіталями однакової просторової орієнтації (або з двох pz-атомних орбіталей, або з двох py-атомних орбіталей). Комбінування різних за орієнтацією орбіталей, наприклад py + pz просторово неможливо через відмінності знаків хвильової функції.
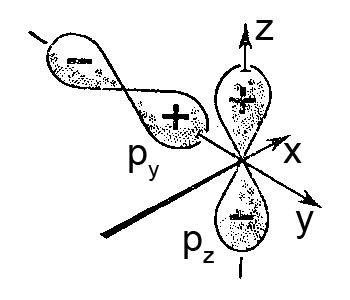
Мал. Схема, що ілюструє відсутність перекривання і неможливість утворення зв’язку між різними по орієнтації py– і pz-орбіталями
В граничному випадку, тобто при перекривання p-орбіталей всіх трьох орієнтацій, утворюється один σ-зв’язок, наприклад σ(px-px)-в’язок, і два π-зв’язки – π(py-py)-зв’язок і π(pz-pz)-зв’язок.
Хімічний σ-зв’язок – це результат прямого перекривання p-орбіталей, а π-зв’язок – результат бічного перекривання p-орбіталей
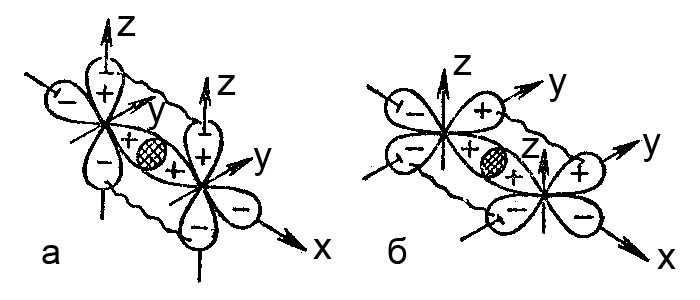
Мал. Перекриття орбіталей з утворенням σ, π-зв’язків: а – пряме перекривання px-орбіталей і бічне перекривання pz-орбіталей; б – пряме перекривання px-орбіталей і бічне перекривання py-орбіталей. Пряме перекривання показано штрихуванням, бічне – хвилястою лінією
Оскільки σ-зв’язок може утворюватися і без супутнього формування π-зв’язку, а π-зв’язок, навпаки, утворюється, коли перша пара p-атомних орбіталей вже вступила в пряме перекривання і утворила σ-зв’язок, то розрізняють σ-складову і π-складову (або π-складові, якщо їх дві) єдиного ковалентного зв’язку.
Комбінування шести p-атомних орбіталей двох зв’язуються атомів дає шість молекулярних орбіталей: одну зв’язуючу σ-молекулярну орбіталь і одну розпушують σ*-молекулярну орбіталь, дві зв’язуючі π-молекулярні орбіталі і дві розпушуючі π*-молекулярні орбіталі.
При наявності як мінімум шести електронів на двох p-підрівнях атомів що зв’язуються, всі три зв’язуючі молекулярні орбіталі (одна σ- і дві π-) будуть зайняті електронами. Наприклад, це реалізується в молекулі O2 бо 2p-підрівні атома O (2s22p4) містять чотири електрони.

Мал. Повна енергетична діаграма утворення хімічного зв’язку в молекулі O2
σs-s-зв’язок в молекулі O2 відсутній, оскільки σs-s-молекулярні орбіталі і σ*s-s-молекулярні орбіталі повністю заповнені чотирма 2s-електронами, як і в гіпотетичній молекулі He2.
Заповнення молекулярних орбіталей p-електронами починається після повного заповнення σs-s– і σ*s-s-молекулярних орбіталей. Як нижча за енергією, спочатку заповнюється одна σp-p-молекулярна орбіталь, потім дві πp-p-молекулярні орбіталі, причому кожна з них заповнюється спочатку одним електроном (за правилом Хунда), а потім другим електроном з протилежним спіном. З восьми 2s-електронів двох атомів O розміщеними будуть тільки шість. За принципом мінімуму енергії два p-електрони, що залишилися, займають розпушуючі π*p-p-молекулярні орбіталі, які є нижчими за енергією, ніж σ*p-p-молекулярні орбіталі.
У молекулі N2 за рахунок трьох електронів p-підрівнів кожного атома N(2s22p3) утворюється потрійний σ,π,π-зв’язок:
•
• •
N
•
•
+
•
•
N
•
•
• →
•
• N
≡
N
•
• |
Відсутність розпушуючих електронів в молекулі N2 пояснює велике значення енергії зв’язку N≡N і вельми високу хімічну інертність молекулярного азоту. На противагу цьому молекули O2 і F2 мають відповідно два і чотири електрони на розпушуючих π*-молекулярних орбіталях, що обумовлює значно меншу міцність зв’язків O=O та F-F і високу реакційну здатність молекулярних кисню і фтору.
Звертає на себе увагу наявність двох неспарених електронів на π*-молекулярних орбіталях в молекулі O2. Ці електрони з паралельними спинами є причиною парамагнетизму кисню; молекули O2 втягуються в магнітне поле на відміну від діамагнітних молекул (без неспарених електронів) N2 і F2.
Ковалентний зв’язок між двома атомами утворюється тоді, коли дія хоча б однієї зв’язуючої молекулярної орбіталі не компенсується дією розпушуючої молекулярної орбіталі.
Узагальнюючи розглянуті механізми формування ковалентних зв’язків з точки зору методу молекулярних орбіталей, можна узагальнити наступне:
- В утворенні хімічного зв’язку беруть участь всі електрони атомів;
- Атомні орбіталі перебудовуються в молекулярні орбіталі, які мають більш складну форму ніж атомні орбіталі;
- З двох атомних орбіталей утворюється дві молекулярні орбіталі, одна зв’язуюча, друга – розпушуюча;
- Існує два види молекулярних орбіталей σ – на якій може знаходитися 2 електрони і π – на якій може знаходитися чотири електрони.
Принципи заповнення молекулярних орбіталей електронами.
- Найменша енергія;
- Принцип Паулі – в молекулі не може бути двох електронів з чотирма однаковими квантовими числами;
- Правило Гунда (або правило Хунда, або принцип максимальної мультіплетності) – молекулярні (і атомні) орбіталі, що належать до одного підрівня, заповнюються кожна спочатку одним електроном, а потім відбувається їх заповнення другими електронами.
Порядок заповнення молекулярних орбіталей (електронні формули молекул):
σ1s2 σ*1s2 σ2s2 σ*2s2 σ2p2 π2p4 π*2p4 σ*2p2
Для молекул B2 і C2 спочатку заповнюється π2p а потім σ2p.
Порядок хімічного зв’язку – це різниця між кількістю електронів на зв’язуючих молекулярних орбіталях і кількістю електронів на розпушуючих молекулярних орбіталях, поділене на 2.
(n(σ + π) + n(σ* + π*)) / 2
Якщо порядок хімічного зв’язку більше нуля – хімічний зв’язок є можливим.
Наслідки з теорії молекулярних орбіталей:
- Коли відривається електрон від зв’язуючої молекулярної орбіталі, молекула стає менш міцною, енергія хімічного зв’язку зменшується. Коли електнон відривається від розпушуючої молекулярної орбіталі, молекула стає більш міцною, енергія хімічного зв’язку зростає;
- Чим більше в молекулі електронів на зв’язуючих молекулярних орбіталях, тим міцнішою буде хімічний зв’язок, а між’ядерна відстань меншою;
- Потенціал іонізації молекули залежить від того, на яких молекулярних орбіталях знаходяться зовнішні електрони. Якщо зовнішні електрони переважно на зв’язуючих молекулярних орбіталях, то потенціал іонізації буде високим, якщо на розпушуючих – низьким.
Гібридизація атомних орбіталей
Атомні орбіталі одного енергетичного рівня, наприклад s- і p-атомних орбіталей, з різною симетрією у вільному атомі при утворенні хімічного зв’язку з іншими атомами можуть набувати однакової форми. Цей процес називається гібридизація атомних орбіталей. Ідею про гібридизацію орбіталей в атомі висунув американський фізико-хімік Полінг (1931 рік).
Нехай в деякому атомі (центральному атомі), одна s- і одна p-атомна орбіталь одного енергетичного рівня, беруть участь в утворенні двох ковалентних зв’язків з атомами-партнерами. При цьому орбіталі центрального атома змінюють свою симетрію так, що обидві стають однаковими за формою.

Мал. Гібридизація однієї s- і однієї p-атомної орбіталі: а – утворення двох гібридних sp-орбіталей; б – геометрична форма однієї гібридної атомної орбіталі; в – умовне зображення гібридної атомної орбіталі – зв’язуюча «пелюстка»
Такі орбіталі називають гібридна атомна орбіталь; їх часто умовно зображують у вигляді зв’язуючих «пелюсток».
За кількістю атомних орбіталей, що беруть участь в гібридизації атомних орбіталей розрізняють наступні, найбільш поширені типи гібридизації:
sp-гібридизація однієї s- і однієї p-атомної орбіталі
sp2-гібридизація однієї s- і двох p-атомних орбіталей
sp3-гібридизація однієї s- і трьох p-атомних орбіталей
Число орбіталей в результаті їх гібридизації не змінюється. На одному енергетичному рівні центрального атома можуть перебувати:
дві sp-гібридних і дві p-атомних орбіталі
три sp2-гібридних і одна p-атомна орбіталь
чотири sp3-гібридних атомних орбіталі
Взаємна спрямованість гібридних орбіталей, які завжди формують σ-складові ковалентного зв’язку (тобто σ-зв’зку), різна в залежності від їх числа.
Стереометричне розташування осей валентних гібридних орбіталей центрального атома після утворення зв’язків з атомами-партнерами характеризується кутом між зв’язками, або валентним кутом.
Дві sp2-гібридні орбіталі деякого центрального атома лежать на одній осі і мають протилежний напрямок від ядра атома; кут між осями sp-гібридних орбіталей дорівнює 180*.
Три sp-гібридні орбіталі мають осі, що лежать в одній площині, і спрямовані в вершини рівностороннього (правильного) трикутника; кути між осями sp2-гібридних орбіталей складають 120*.
Чотири sp3-орбіталі мають осі, що лежать в просторі під кутами 109.5*; вони спрямовані в вершини правильного (ідеального) тетраедра.

Мал. Геометрична форма молекул BeH2 – лінійна, AlH3 – тригональна, SiH4 – тетраедрична
|
Тип гібридизації
sp
sp2
sp3
sp3d
sp3d2
Геометрія молекул
Лінійна
Трикутна
Тетраедрична
Тригонально-біпірамідальна
Октаедрична
Валентні кути
180*
120*
109.5*
90* и 120*
90*
Приклади
BeH2, CO2, C2H2, BO2–
AlH3, AlF3, SO3, CO32-, NO3–
SiH4, CCl4, NH4+, SO42-
PF5, AsF5, PCl5, SbCl5
SF6, AsF6–, IO65-, SnCl62-
|
Крім sp-, sp2-, sp3-гібридизації для центральних атомів s- і p-елементів зустрічаються інші типи, в яких беруть участь d-орбіталі того самого енергетичного рівня.
П’ять орбіталей одного енергетичного рівня центрального атома (для елементів третього і наступних періодів), тобто одна s-атомна орбіталь, три p-атомних орбіталі і одна d-атомна орбіталь, беруть участь в sp3d-гібридизації. Осі таких гібридних орбіталей розташовані в просторі під кутами 90* і 120*, оскільки вони спрямовані в вершини тригональної біпіраміди.
Шість орбіталей одного енергетичного рівня центрального атома (для елементів третього і наступних періодів), тобто одна s-атомна орбіталь, три p-атомних орбіталі і дві d-атомних орбіталі, беруть участь в sp3d2-гібридизації. Осі гібридних орбіталей розташовані в просторі під кутами 90* та спрямовані в вершини правильного (ідеального) октаедра.

Мал. Геометрична форма молекул PF5 – тригонально-бірірамідальная (а) і SF6 – октаедричні (б)
Тетраедрична і октаедрична форми є також основними в геометрії комплексних сполук.










