Существование большого числа органических соединений в значительной степени обусловлено двумя особыми свойствами атома углерода. Каждый атом углерода может образовывать четыре ковалентных связи и принимать участие в формировании общих электронных пар. Кроме того, атом углерода имеет склонность (более всех других химических элементов) образовывать гомоядерные связи, создавая так называемые углеродные цепи (замкнутые, незамкнутые, разветвленные).
В основном состоянии атом углерода C(2s22p2) имеет два неспаренных электрона, за счет которых может образовывать только две общие электронные пары. Чтобы иметь возможность принять участие в образовании четырех общих электронных пар, атом углерода должен располагать четырьмя неспаренными электронами. Такое состояние атома углерода, при котором он имеет четыре неспаренных электрона достигается переходом атома в возбужденное состояние (C*) при промотировании (переносе) одного 2s-электрона на 2p-подуровень.

В возбужденное состояние атом углерода переходит под воздействием определенного количества энергии, которое называют энергией возбуждения. Энергия возбуждения впоследствии превращается в энергию образования связей. После возбуждения 2s- и 2p-атомные орбитали углерода гибридизуются тремя различными способами: sp3-гибридизация (тетраэдрическое расположение осей четырех гибридных атомных орбиталей); sp2-гибридизация (тригональное расположение осей трех гибридных атомных орбиталей); sp-гибридизация (линейное расположение осей двух гибридных атомных обиталей).
При sp2- и sp-гибридизации только три или две атомных орбитали углерода участвуют в образовании σ-связей. Оставшиеся атомные орбитали (и электроны в них) имеют возможность формировать π-составляющие многократных связей углерод – углерод.
Кратность химической связи (с точки зрения метода валентных связей, МВС) – это число общих электронных пар, образующих химическую связь между двумя атомами.
Правильность приведенной модели образования четырех ковалентных связей (четырех σ-связей при sp3-гибридизации, трех σ- и одной π-связи при sp2-гибридизации, двух σ- и двух π-связей при sp-гибридизации) подтверждается не только составом и геометрической формой молекул соединений углерода, но и четырехвалентным состоянием атома углерода в образуемых им простых веществах, таких как алмаз, графит и др.
Примеры образования химических связей в соединениях углерода с тремя типами гибридизации орбиталей его атомов.
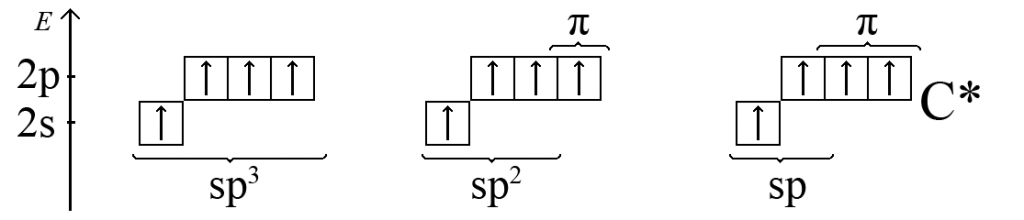
1. В молекуле метана CH4 атом углерода (sp3-гибридизация) находится в окружении четырех атомов водорода находящихся в вершинах тетраэдра. В молекуле метана присутствуют четыре σ-связи углерод – водород.
Метан это простейшее из органических соединений углерода, он не содержит связей углерод – углерод.
2. В молекуле этана C2H6 каждый атом углерода (sp3-гибридизация) так же, как и в молекуле метана CH4, находится в окружении трех атомов водорода и одного атома углерода, связанными σ-связями. Три sp3-гибридных атомных орбитали углерода перекрываются (создают соответствующие связывающие молекулярные орбитали с точки зрения ММО) с тремя 1s-атомными орбиталями водорода, а четвертая sp3-гибридная атомная орбиталь углерода образует чисто ковалентную одинарную связь C-C с другим атомом углерода в том же состоянии.
Этан представляет собой второй (после метана) член гомологического ряда алканов – насыщенных ациклических углеводородов.
Одинарная связь углерод – углерод изображается черточкой « – ».
Цепь из одинарно-связанных атомов углерода может состоять из различного числа атомов.
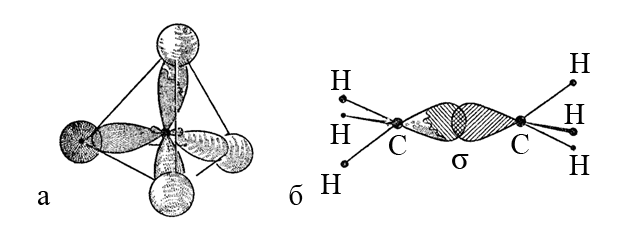
3. В молекуле этилена C2H4 атом углерода (sp2-гибридизация) находится в тригональном (треугольном) окружении, и образует две σ-связи C-H и одну σ,π-связь C=C.
Две sp2-гибридные атомные орбитали углерода перекрываются с двумя 1s-атомными орбиталями водорода, формируя две σ-связи C-H. Третья sp2-гибридная орбиталь одного атома углерода и такая же орбиталь другого атома углерода образуют σ-составляющую, а негибридные p-орбитали тех же атомов – π-составляющую двойной связи C=C.
Этилен – начальный член гомологического ряда алкенов ациклических углеводородов содержащих одну двойную связь C=C.
Разделение двойной связи на σ- и π-составляющие условно, хотя вклад σ-составляющей в общую энергию двойной связи считается более высоким, чем вклад π-составляющей. Представление о двойной связи как о сумме двух одинарных связей на практике не подтверждается и является неверным.
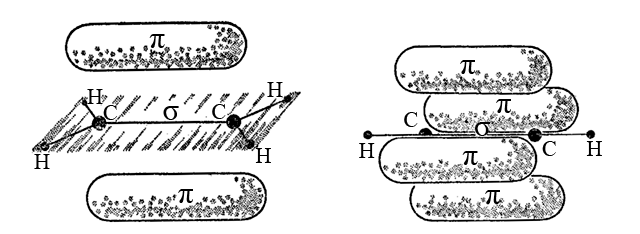
4. В молекуле ацетилена C2H2 атом углерода (sp-гибридизация) находится в линейном (дигональном) окружении и образует одну σ-связь C-H и одну σ,π,π-связь C≡C. Одна sp-гибридная атомная орбиталь углерода перекрывается с 1s-атомной орбиталью водорода и формируется σ-связь C-H. Вторая sp-гибридная орбиталь одного атома углерода и такая же орбиталь второго атома углерода образует σ-составляющую, а негибридные p-орбитали тех же атомов – две π-составляющие тройной связи C≡C.
Как и для двойной связи, разделение тройной связи на σ- и π-составляющие условно.
Энергия одинарной, двойной и тройной связи углерод-углерод в органических соединениях имеет значения 346, 602, 835 кДж/моль соответственно.
Очевидно, что двойная связь не есть энергетическая сумма двух связей C-C (602 < 2*346 = 692), а тройная связь не есть сумма трех связей C-C (835 < 3*346=1038). Прямое перекрывание орбиталей и образование σ-связи энергетически более выгодно, чем боковое перекрывание орбиталей и формирование π-связи. Это также подтверждает, что σ-составляющая двойных и тройных связей образуется в первую очередь и поэтому определяет геометрическую форму молекул, а формирование π-составляющей, если оно возможно, лишь упрочняет химическую связь и на геометрическую форму молекул не влияет.
Для органических соединений, которые обладают только одинарными σ-связями углерод-углерод, например метана и этана, характерны реакции замещения. К реакциям присоединения без разрыва связи C-C (в этане и других гомологах метана) такие вещества не способны.
Для органических соединений, которые содержат двойные (σ,π-) и тройные (σ,π,π-) связи углерод-углерод, например этилена и ацетилена, характерны реакции присоединения по месту разрыва π-составляющих кратных связей (σ-составляющая, как более устойчивая, при этом сохраняется). Реакции замещения для этих веществ также возможны.
В органических соединениях углерод может находится также в особом состоянии, называемым ароматическим состоянием. Это совершенно особый вид связывания атомов углерода в плоские циклы (замкнутые цепи), в которых все атомы цикла участвуют в образовании единой π-электронной системы.
Простейшее ароматическое соединение – бензол C6H6
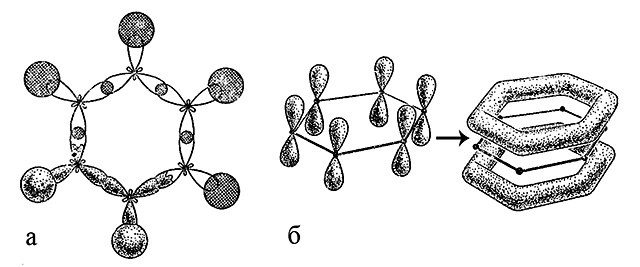
Бензол содержит шесть атомов углерода, связанных друг с другом в цикл (бензольное кольцо). Каждый атом углерода находится в sp2-гибридизации, поскольку имеет три связанных с ним соседних атома – атом H и два атома C; образуются три σ-связи – одна C-H и две C-C. У каждого атома углерода в sp2-гибридизации имеется еще одна, негибридная 2p-орбиталь с неспаренным электроном, которая может образовывать π-связь. Ось такой p-орбитали расположена перпендикулярно плоскости осей орбиталей, формирующих σ-связи. В отличие от молекулы этилена, при образовании которой π-связи формируются между двумя атомами углерода, в молекуле бензола все шесть 2p-орбиталей комбинируются вместе, образуя общую для них связывающую молекулярную π-орбиталь, а шесть электронов объединяются в π-электронный секстет.
Метод молекулярных орбиталей всегда рассматривает образование связей как обобществление электронов в объеме пространства, включающем все ядра атомов данной молекулы. Особенно это верно для образования многоцентровых π-связей. В молекуле бензола образуется шестичленная молекулярная π-система (6e– в шестицентровой π-молекулярной орбитали), определяющая свойства всех ароматических соединений.
Плотность π-электронов молекулы C6H6 делокализована по всем шести ядрам атомов углерода, т.е. по всей молекуле. Образование многоцентровых молекулярных орбиталей также особенно выгодно в энергетическом отношении, что придает устойчивость всей системе.
Для бензольного кольца характерны реакции замещения. При этом ароматическая система остается неизменной. В реакциях присоединения π-электронный секстет разрушается, из-за чего каждый электрон становится способным к образованию дополнительной σ-связи.










