Серед елементів, атоми якого не є центральними в молекулах неорганічних сполук, найбільш поширеним є атом оксиґену. Атом оксиґену O (2s22p4) має на 2p-підрівні два неспарених електрона, один з яких бере участь в утворенні σ-зв’язку, а інший – в утворенні π-зв’язку.
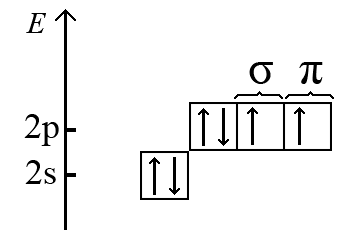
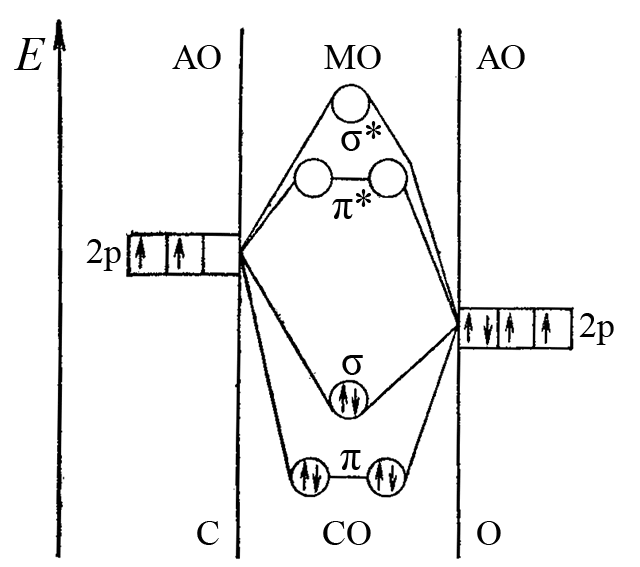
Якщо молекула містить два атоми, один з яких оксиґен, наприклад молекула CO, то σ- і π-складові зв’язку в цій молекулі є двохцентровими. За методом молекулярних орбіталей утворення потрійного зв’язку карбон-оксиґен в молекулі CO описується енергетичної діаграмою представленої на малюнку нижче.
Утворення зв’язків елемент-оксиґен в оксиґенвмісних сполуках, молекули яких складаються з трьох і більше атомів двох різних елементів, зручно розглядати, поєднуючи метод валентних зв’язків (двохцентрові σ-зв’язки і геометрія молекул) і метод молекулярних орбіталей (багатоцентрові π-зв’язки).
Наприклад, формування зв’язків в молекулі сульфур(VI) оксиду SO3 встановлюється наступним чином. Береться до уваги, що ступінь окислення центрального атома сульфуру в цій молекулі дорівнює +VI, і що його зовнішній енергетичний рівень зображується з урахуванням втрати числа електронів, яке дорівнює ступеню окислення (для атома S+VI втрата всіх його валентних електронів 3s23p4 → 3s03p0). При утворенні молекули SO3 формується потрібне число σ-зв’язків за донорно-акцепторним механізмом, при цьому атом S+VI буде акцептором електронної пари, а атоми O-II (2s22p6) – донорами.
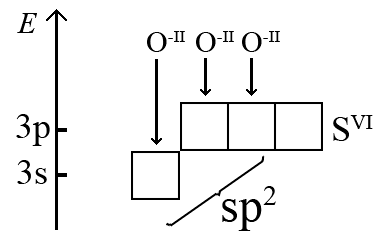
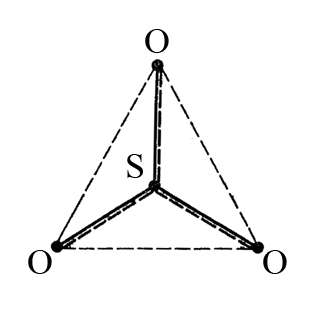
Звідси робимо висновок, що молекула сульфур(VI) оксиду має тригональну форму. Але, крім трьох σ-зв’язків сульфур-оксиґен, утворюється чотирьохцентрова π-молекулярна система, яку зображують пунктиром вздовж лінії σ-зв’язку (на малюнку наочне зображення делокалізації π-електронів).
Аналогічно встановлюється лінійна будова молекули CO2 (sp-гібридизація орбіталей атома C), а також геометрія оксиґенвмісних аніонів (кислотних залишків), наприклад карбонат-іонів CO32- (sp2-гібридизація орбіталей атома C) і сульфат-іонів SO42- (sp3-гібридизація орбіталей атома S)
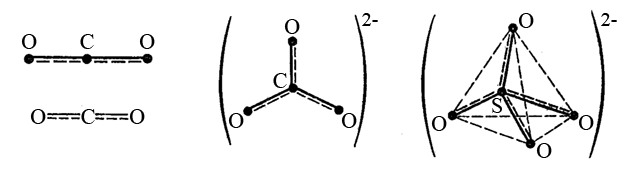
Слід звернути увагу, що не завжди вершини геометричної фігури зайняті бічними атомами. Наприклад в молекулі сульфур(IV) оксид SO2 і сульфіт-іоні SO32-. Вони містять атом S+IV (3s23p0), який на валентному енергетичному рівні містить неподілену пару електронів. Ця пара електронів займає одну з гібридних орбіталей атома S+IV (в стані sp2-гібридизації для SO2 і в стані sp3-гібридизації для SO32-). Геометричні форми цих частинок наступні:
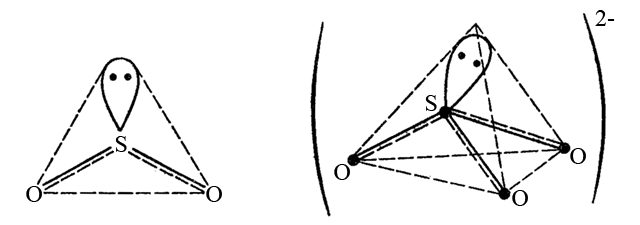
На відміну від SO3 і SO42-, що мають відповідно завершену тригональну і тетраедричну форми (всі вершини багатогранників зайняті атомами оксиґену), SO2 і SO32- мають незавершену тригональну і тетраедричну геометрію відповідно. Неподілену пари електронів на гібридних атомних орбіталях є реакційноздатними і також можуть утворювати хімічні зв’язки.










