ąÆ ąŠčĆą│ą░ąĮč¢čćąĮąĖčģ ą╝ąŠą╗ąĄą║čāą╗ą░čģ ą┐ąŠą┤ą▓č¢ą╣ąĮč¢ ąĘą▓’čÅąĘą║ąĖ C=C ą╝ąŠąČčāčéčī ą▒čāčéąĖ:
- ą║čāą╝čāą╗čīąŠą▓ą░ąĮč¢, č鹊ą▒č鹊 čéą░ą║ąĖą╝ąĖ, čÅą║č¢ čĆąŠąĘčéą░čłąŠą▓ą░ąĮč¢ ą▒ąĄąĘą┐ąŠčüąĄčĆąĄą┤ąĮčīąŠ ąŠą┤ąĖąĮ ąĘą░ ąŠą┤ąĮąĖą╝
ą┐ąĄąĮčéą░ą┤č¢čöąĮ-1,2 CH2=C=CH-CH2-CH3
- čüą┐čĆčÅąČąĄąĮč¢, č鹊ą▒č鹊 čĆąŠąĘą┤č¢ą╗ąĄąĮąĖą╝ąĖ ąŠą┤ąĮąĖą╝ ąŠą┤ąĖąĮą░čĆąĮąĖą╝ ąĘą▓’čÅąĘą║ąŠą╝
ą┐ąĄąĮčéą░ą┤č¢čöąĮ-1,3 CH2=CH-CH=CH-CH3
- č¢ąĘąŠą╗čīąŠą▓ą░ąĮč¢, č鹊ą▒č鹊 čĆąŠąĘą┤č¢ą╗ąĄąĮąĖą╝ąĖ ą┤ą▓ąŠą╝ą░ ą░ą▒ąŠ ą║č¢ą╗čīą║ąŠą╝ą░ ąŠą┤ąĖąĮą░čĆąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ
ą┐ąĄąĮčéą░ą┤č¢čöąĮ-1,4 CH2=CH-CH2-CH=CH2
ą¤ąŠčéčĆč¢ą╣ąĮč¢ ąĘą▓’čÅąĘą║ąĖ -CŌēĪC- čéą░ą║ąŠąČ ą╝ąŠąČčāčéčī ą▓ąĖčÅą▓ąĖčéąĖčüčÅ čüą┐čĆčÅąČąĄąĮąĖą╝ąĖ ą░ą▒ąŠ č¢ąĘąŠą╗čīąŠą▓ą░ąĮąĖą╝ąĖ.
ąŻ ą╝ąŠą╗ąĄą║čāą╗ą░čģ ąĘč¢ čüą┐čĆčÅąČąĄąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ ą┤č¢ą╣čüąĮąĖą╣ čĆąŠąĘą┐ąŠą┤č¢ą╗ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčŚ čēč¢ą╗čīąĮąŠčüčéč¢ čö ą┐čĆąŠą╝č¢ąČąĮąĖą╝ ą╝č¢ąČ čĆąŠąĘą┐ąŠą┤č¢ą╗ą░ą╝ąĖ ą▓ ą┤ą▓ąŠčģ ą░ą▒ąŠ ą┤ąĄą║č¢ą╗čīą║ąŠčģ ą║ą╗ą░čüąĖčćąĮąĖčģ č乊čĆą╝čāą╗ą░čģ. ą”ąĄ ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ čö ąŠčüąĮąŠą▓ąŠčÄč¢ č鹥ąŠčĆč¢čŚ ą╝ąĄąĘąŠą╝ąĄčĆč¢čŚ, čÅą║ą░ ąŠą┐ąĖčüčāčö ąĄą╗ąĄą║čéčĆąŠąĮąĮčā ą▒čāą┤ąŠą▓čā čģč¢ą╝č¢čćąĮąĖčģ čüą┐ąŠą╗čāą║ ąĘč¢ čüą┐čĆčÅąČąĄąĮąĖą╝ąĖ čģč¢ą╝č¢čćąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ.
ąĪčéą░ąĮ ą╝ąĄąĘąŠą╝ąĄčĆč¢čŚ ą╝ąŠąČą╗ąĖą▓ąĖą╣, čÅą║čēąŠ čö ąĮą░čüčéčāą┐ąĮč¢ čüčéčĆčāą║čéčāčĆąĮč¢ ą┐ąĄčĆąĄą┤čāą╝ąŠą▓ąĖ:
- ąØą░čÅą▓ąĮč¢čüčéčī čüą┐čĆčÅąČąĄąĮąĖčģ ą║čĆą░čéąĮąĖčģ, ąŠčüąŠą▒ą╗ąĖą▓ąŠ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ -C=C- ą░ą▒ąŠ ą║čĆą░čéąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ -C=G:
…-C=C-C=C…; …-C=C-C=O; …-C=C-CŌēĪN
- ąØą░čÅą▓ąĮč¢čüčéčī ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā, čüą┐čĆčÅąČąĄąĮąŠą│ąŠ ąĘ ąĄą╗ąĄą║čéčĆąŠąĮąĮąŠčÄ ą┐ą░čĆąŠčÄ ą░č鹊ą╝ą░ ą│ąĄč鹥čĆąŠąĄą╗ąĄą╝ąĄąĮčéčā
…-C=C-Cl:
ą¤čĆąŠčüč鹊čĆąŠą▓ąŠčÄ čāą╝ąŠą▓ąŠčÄ ą▓ąĖąĮąĖą║ąĮąĄąĮąĮčÅ ą╝ąĄąĘąŠą╝ąĄčĆč¢čŚ čö čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠčŚ čüąĖčüč鹥ą╝ąĖ ąĘą▓’čÅąĘą║č¢ą▓ ą▓ ąŠą┤ąĮč¢ą╣ ą┐ą╗ąŠčēąĖąĮč¢. ąĪčāčéąĮč¢čüčéčī ą╝ąĄąĘąŠą╝ąĄčĆč¢čŚ ą┐ąŠą╗čÅą│ą░čö ą▓ č鹊ą╝čā, čēąŠ ŽĆ-ąĄą╗ąĄą║čéčĆąŠąĮąĖ čüą┐čĆčÅąČąĄąĮąĖčģ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ąĮąĄ ą╝č¢ąČ ą░č鹊ą╝ą░ą╝ąĖ ą║ą░čĆą▒ąŠąĮčā ąĘ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ ąĘą▓ŌĆÖčÅąĘą║ąŠą╝, ą░ ąĮą░ ą▓č¢ą┤ą╝č¢ąĮčā ą▓č¢ą┤ Žā-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą▒č¢ą╗čīčł-ą╝ąĄąĮčł čĆč¢ą▓ąĮąŠą╝č¢čĆąĮąŠ čĆąŠąĘą┐ąŠą┤č¢ą╗ąĄąĮč¢ ą┐ąŠ ą▓čüč¢ą╣ ą╝ąĄąĘąŠą╝ąĄčĆąĮč¢ą╣ čüąĖčüč鹥ą╝č¢ ąĘą▓’čÅąĘą║č¢ą▓, č鹊ą▒č鹊 ą┤ąĄą╗ąŠą║ą░ą╗č¢ąĘąŠą▓ą░ąĮč¢. ą¤čĆąĖ čéą░ą║č¢ą╣ ą┤ąĄą╗ąŠą║ą░ą╗č¢ąĘą░čåč¢čŚ ą▓ąĖą▓č¢ą╗čīąĮčÅčöčéčīčüčÅ ąĄąĮąĄčĆą│č¢čÅ ą╝ąĄąĘąŠą╝ąĄčĆąĖąĘą░čåč¢čŚ, ą░ ąŠčéąČąĄ, ą╝ąĄąĘąŠą╝ąĄčĆąĮą░ čüąĖčüč鹥ą╝ą░ ą┐ąŠą▓ąĖąĮąĮą░ ą▒čāčéąĖ ą▒č¢ą╗čīčł čüčéč¢ą╣ą║ąŠčÄ.
ą¤čĆąĖą║ą╗ą░ą┤. ą×čéčĆąĖą╝ą░čéąĖ ąĮąĄąĮą░čüąĖč湥ąĮąĖą╣ čåąĖą║ą╗ čåąĖą║ą╗ąŠą│ąĄą║čüą░čéčĆąĖčöąĮčā, ą╝ąŠą╗ąĄą║čāą╗ąĖ čÅą║ąŠą│ąŠ ą╝č¢čüčéčÅčéčī ą║č¢ą╗čīčåąĄą▓čā čüąĖčüč鹥ą╝čā ąĘ čéčĆčīąŠą╝ą░ ąĘą▓’čÅąĘą░ąĮąĖą╝ąĖ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ (1 č¢ 3 č乊čĆą╝čāą╗ąĖ), ąĮąĄ ą▓ą┤ą░čöčéčīčüčÅ, ą▓ ą┤č¢ą╣čüąĮąŠčüčéč¢ čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ą▓č¢ą┤ąĮąŠčüąĮąŠ ą▒č¢ą╗čīčł ąĮą░čüąĖč湥ąĮąĖą╣ č¢ ą▒č¢ą╗čīčł čüčéč¢ą╣ą║ąĖą╣ ą▒ąĄąĮąĘąĄąĮ (2 č乊čĆą╝čāą╗ą░) – čĆąŠą┤ąŠąĮą░čćą░ą╗čīąĮąĖą║ ą░čĆąŠą╝ą░čéąĖčćąĮąĖčģ čüą┐ąŠą╗čāą║. ą©č¢čüčéčī ŽĆ-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ čåąĖą║ą╗ąŠą│ąĄą║čüą░čéčĆąĖčöąĮčā ą┐čĆąĖ ąĘąĮą░čćąĮąŠą╝čā ą▓ąĖą│čĆą░čłč¢ ąĄąĮąĄčĆą│č¢čŚ čĆč¢ą▓ąĮąŠą╝č¢čĆąĮąŠ čĆąŠąĘą┐ąŠą┤č¢ą╗čÅčÄčéčīčüčÅ (ą┤ąĄą╗ąŠą║ą░ą╗č¢ąĘčāčÄčéčüčÅ) ą┐ąŠ ą▓čüč¢ą╣ ą║č¢ą╗čīčåąĄą▓č¢ą╣ čüąĖčüč鹥ą╝č¢ (ąĘą▓’čÅąĘčāčÄčćč¢ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮč¢ ąŠčĆą▒č¢čéą░ą╗č¢ ŽĆ-ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčÄčéčī čüąŠą▒ąŠčÄ ą┐čĆąŠčüč鹊čĆąŠą▓ąĄ ą║č¢ą╗čīčåąĄ, čĆąŠąĘčéą░čłąŠą▓ą░ąĮąĄ ąĮą░ą┤ č¢ ą┐č¢ą┤ ą┐ą╗ąŠčēąĖąĮąŠčÄ ą╝ąŠą╗ąĄą║čāą╗ąĖ)
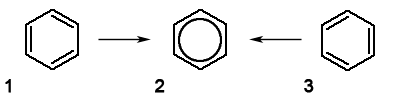
ąóą░ą║ąĖą╝ čćąĖąĮąŠą╝, ą▓ąĖąĮąĖą║ą░čö ą╝ąĄąĘąŠą╝ąĄčĆąĮą░ (ą▓ ą┤ą░ąĮąŠą╝čā ą▓ąĖą┐ą░ą┤ą║čā – ą░čĆąŠą╝ą░čéąĖčćąĮą░) čüąĖčüč鹥ą╝ą░ ąĘą▓’čÅąĘą║č¢ą▓. ąŻ čåąĖą║ą╗ąŠąŠą║čéą░č鹥čéčĆą░čöąĮč¢ (ąĘą░ą╝ą║ąĮčāčéą░ čåąĖą║ą╗č¢čćąĮą░ čüąĖčüč鹥ą╝ą░ ąĘ č湊čéąĖčĆą╝ą░ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ) ą╝ąĄąĘąŠą╝ąĄčĆč¢čŚ ą▒čāčéąĖ ąĮąĄ ą╝ąŠąČąĄ, ąŠčüą║č¢ą╗čīą║ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ ąĮąĄ čö ą┐ą╗ąŠčüą║ąŠčÄ, ą░ ą╝ą░čö ą║ąŠąĮč乊čĆą╝ą░čåč¢čÄ “ą▓ą░ąĮąĮąĖ”. ąöč¢ą╣čüąĮą░ ą▒čāą┤ąŠą▓ą░ ą▒ąĄąĮąĘąĄąĮčā (2 č乊čĆą╝čāą╗ą░) čö ą┐čĆąŠą╝č¢ąČąĮąŠčÄ ą╝č¢ąČ ą▒čāą┤ąŠą▓ąŠčÄ ą┐ąŠą║ą░ąĘą░ąĮąŠčÄ 1 č¢ 3 č乊čĆą╝čāą╗ą░ą╝ąĖ. ąŚą▓ąĖčćą░ą╣ąĮąŠ, čā ą▒ą░ą│ą░čéčīąŠčģ ą▓ąĖą┐ą░ą┤ą║ą░čģ ą╝ąŠąČąĮą░ ą║ąŠčĆąĖčüčéčāą▓ą░čéąĖčüčÅ ą║ą╗ą░čüąĖčćąĮąĖą╝ (čéčĆą░ą┤ąĖčåč¢ą╣ąĮąĖą╝) ąĘąŠą▒čĆą░ąČąĄąĮąĮčÅą╝ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą▒ąĄąĮąĘąĄąĮčā čā ą▓ąĖą│ą╗čÅą┤č¢ č乊čĆą╝čāą╗ąĖ 1 ą░ą▒ąŠ čĆč¢ą▓ąĮąŠąĘąĮą░čćąĮąŠčŚ 茹╣ č乊čĆą╝čāą╗ąĖ 3, ąĘą░ą╝č¢čüčéčī čĆąĄą░ą╗čīąĮąŠčŚ č乊čĆą╝čāą╗ąĖ 2. ąóą░ą║č¢ č乊čĆą╝čāą╗ąĖ, čÅą║ 1 č¢ 3 ą┤ą╗čÅ ą▒ąĄąĮąĘąĄąĮčā, čÅą║č¢ ą┐čĆąĖ ąĮą░ą║ą╗ą░ą┤ąĄąĮąĮč¢ ą┐čĆąĖąĘą▓ąŠą┤čÅčéčī ą┤ąŠ ą╝ąĄąĘąŠą╝ąĄčĆąĮąŠčŚ čüčéčĆčāą║čéčāčĆąĖ, ąĮą░ąĘąĖą▓ą░čÄčéčīčüčÅ ą│čĆą░ąĮąĖčćąĮč¢ č乊čĆą╝čāą╗ąĖ. ą£ąĄąĘąŠą╝ąĄčĆąĮčā čüčéčĆčāą║čéčāčĆčā ąĘą░ąĘą▓ąĖčćą░ą╣ ąĘąŠą▒čĆą░ąČčāčÄčéčī ą┤ą▓ąŠą╝ą░ ą│čĆą░ąĮąĖčćąĮąĖą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ, č湥čĆąĄąĘ ą┤ą▓ąŠčüč鹊čĆąŠąĮąĮčīčÄ čüčéčĆč¢ą╗ą║čā (Ōåö):
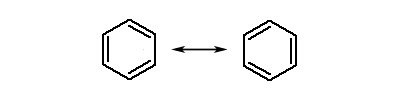
ą£ąĄąĘąŠą╝ąĄčĆąĮčā čüčéčĆč¢ą╗ą║čā (Ōåö) ąĮąĄ ą╝ąŠąČąĮą░ ąĘą░ą╝č¢ąĮčÄą▓ą░čéąĖ ąĮą░ ąĘąĮą░ą║ ąŠą▒ąŠčĆąŠčéąĮąŠčüčéč¢ (Ōćä). ąÆ ą╝ąĄąĘąŠą╝ąĄčĆąĮč¢ą╣ čüąĖčüč鹥ą╝č¢ ąĘą▓’čÅąĘą║č¢ą▓ ąĮąĄą╝ą░čö čģč¢ą╝č¢čćąĮąŠčŚ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ ą╝č¢ąČ čĆč¢ąĘąĮąĖą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ, č¢ ą╝ąĄąĘąŠą╝ąĄčĆąĮą░ čüąĖčüč鹥ą╝ą░ č¢čüąĮčāčö čéč¢ą╗čīą║ąĖ čÅą║ ąŠą┤ąĖąĮ ą▓ąĖą┤ ą╝ąŠą╗ąĄą║čāą╗, ą▒čāą┤ąŠą▓ą░ čÅą║ąĖčģ čö ąŠą┤ąĮą░ą║ąŠą▓ąŠčÄ č¢ ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ą╝č¢ąČ ąĘą░ąĘąĮą░č湥ąĮąĖą╝ąĖ ą│čĆą░ąĮąĖčćąĮąĖą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ.
ąōčĆą░ąĮąĖčćąĮč¢ č乊čĆą╝čāą╗ąĖ ą╝ąŠąČčāčéčī ą▒čāčéąĖ ąĘą░ą┐ąĖčüą░ąĮč¢ čā č乊čĆą╝č¢, čēąŠ ą▓č¢ą┤ąŠą▒čĆą░ąČą░čö ą┐ąŠą╗čÅčĆąĮč¢čüčéčī ą╝ąŠą╗ąĄą║čāą╗ąĖ. ąØą░ą┐čĆąĖą║ą╗ą░ą┤, ą┤č¢ą╣čüąĮą░ ą▒čāą┤ąŠą▓ą░ ą▓č¢ąĮč¢ą╗čģą╗ąŠčĆąĖą┤čā (č乊čĆą╝čāą╗ą░ 6) ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö ą┐ąŠą╝čāąČąĮąŠą╝čā čüčéą░ąĮčā ą╝ąŠą╗ąĄą║čāą╗ąĖ, ą╝č¢ąČ ąĮąĄą┐ąŠą╗čÅčĆąĮąŠčÄ ą│čĆą░ąĮąĖčćąĮąŠčÄ č乊čĆą╝čāą╗ąŠčÄ 4 č¢ ą┐ąŠą╗čÅčĆąĮąŠčÄ ą│čĆą░ąĮąĖčćąĮąŠčÄ č乊čĆą╝čāą╗ąŠčÄ 5:
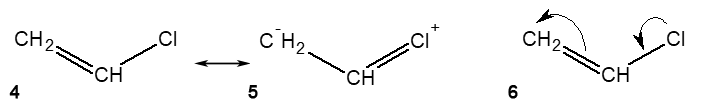
ą¤ąŠą╗čÅčĆąĮą░ ą│čĆą░ąĮąĖčćąĮą░ č乊čĆą╝čāą╗ą░ 5 ą▓č¢ąĮč¢ą╗čģą╗ąŠčĆąĖą┤čā čö ąĮą░čüą╗č¢ą┤ą║ąŠą╝ ą▓č¢ą┤ ąĮąĄą┐ąŠą╗čÅčĆąĮąŠą╣ č乊čĆą╝čāą╗ąĖ 4: ą░č鹊ą╝ čģą╗ąŠčĆčā ą┐ąĄčĆąĄą┤ą░čö ąŠą┤ąĖąĮ ąĄą╗ąĄą║čéčĆąŠąĮ ąĮą░ čüčāčüč¢ą┤ąĮč¢ą╣ ą░č鹊ą╝ ą║ą░čĆą▒ąŠąĮčā č¢ ą╣ąŠą│ąŠ ąĄą╗ąĄą║čéčĆąŠąĮąĮą░ ą┐ą░čĆą░ čüčéą░čö ąĘą▓’čÅąĘčāčÄč湊čÄ, ą┐čĆąĖ čåčīąŠą╝čā ą░č鹊ą╝ čģą╗ąŠčĆčā ąĮą░ą▒čāą▓ą░čö ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╣ ąĘą░čĆčÅą┤. ą¤ąĄčĆąĄą┤ą░čćą░ ąĄą╗ąĄą║čéčĆąŠąĮą░ (ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╣ ą╝ąĄąĘąŠą╝ąĄčĆąĮąĖą╣ ąĄč乥ą║čé) ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ č湥čĆąĄąĘ čüčāčüč¢ą┤ąĮč¢ą╣ (ąĘ ą░č鹊ą╝ąŠą╝ čģą╗ąŠčĆčā) ą░č鹊ą╝ ą║ą░čĆą▒ąŠąĮčā ą┤ąŠ ą║č¢ąĮčåąĄą▓ąŠą│ąŠ ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮčā, čÅą║ąĖą╣ ąĘą┤ąŠą▒čāą▓ą░čö ąĮąĄą│ą░čéąĖą▓ąĮąĖą╣ ąĘą░čĆčÅą┤. ąóą░ą║č¢ ąĄą╗ąĄą║čéčĆąŠąĮąĮč¢ ąĘą╝č¢čēąĄąĮąĮčÅ ą┐ąŠą║ą░ąĘą░ąĮč¢ ąĘą░ą│ąĮčāčéąĖą╝ąĖ čüčéčĆč¢ą╗ą║ą░ą╝ąĖ ą▓ čĆąĄą░ą╗čīąĮč¢ą╣ č乊čĆą╝čāą╗č¢ 6 ą┤ą╗čÅ ą▓č¢ąĮč¢ą╗čģą╗ąŠčĆąĖą┤čā.
ąÆ ą▒čāčéą░ą┤č¢čöąĮč¢-1,3 č湊čéąĖčĆąĖ ŽĆ-ąĄą╗ąĄą║čéčĆąŠąĮąĖ ąŠą▒ąŠčģ ą┐ąŠą┤ą▓č¢ą╣ąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ čĆąŠąĘą┐ąŠą┤č¢ą╗ąĄąĮč¢ ą┐ąŠ ąĘą░ą│ą░ą╗čīąĮč¢ą╣ čüą┐čĆčÅąČąĄąĮč¢ą╣ čüąĖčüč鹥ą╝č¢ ąĘą▓’čÅąĘą║č¢ą▓. ąĀąĄą░ą╗čīąĮąĖą╣ čüčéą░ąĮ ąĘą▓’čÅąĘą║č¢ą▓ ąŠą┐ąĖčüčāčöčéčīčüčÅ čéčĆčīąŠą╝ą░ ą│čĆą░ąĮąĖčćąĮąĖą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ
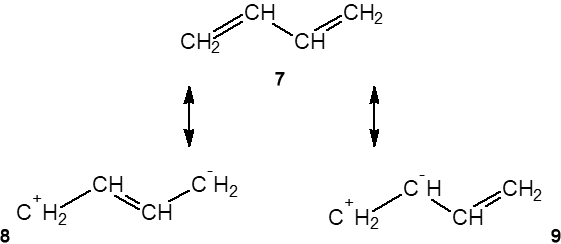
ąĘ čÅą║ąĖčģ ąĮąĄą┐ąŠą╗čÅčĆąĮą░čÅ č乊čĆą╝čāą╗ą░ 7 ą▓ą▓ą░ąČą░čöčéčīčüčÅ ą║ą╗ą░čüąĖčćąĮąĖą╝ ą│čĆą░čäč¢čćąĮąĖą╝ ąĘąŠą▒čĆą░ąČąĄąĮąĮčÅą╝ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą▒čāčéą░ą┤č¢čöąĮ-1,3.
ąöą╗čÅ ąĮč¢čéčĆąŠą│čĆčāą┐ąĖ NO2 č¢ ą║ą░čĆą▒ąŠą║čüąĖą╗ą░čé-č¢ąŠąĮčā COO– ą│čĆą░ąĮąĖčćąĮąĖą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ ą▒čāą┤čāčéčī:
ą¤čĆąĖ čģč¢ą╝č¢čćąĮąĖčģ čĆąĄą░ą║čåč¢čÅčģ ą╝ąĄąĘąŠą╝ąĄčĆąĮą░ (č鹊ą▒č鹊 ą┤č¢ą╣čüąĮą░) ą▒čāą┤ąŠą▓ą░ ą┐č¢ą┤ ą▓ą┐ą╗ąĖą▓ąŠą╝ čĆąĄą░ą│ąĄąĮčéčā-ą┐ą░čĆčéąĮąĄčĆą░ ą╝ąŠąČąĄ ąĮą░ą▒ą╗ąĖąČą░čéąĖčüčÅ ą┤ąŠ ąŠą┤ąĮč¢čöčŚ ąĘ ą│čĆą░ąĮąĖčćąĮąĖčģ č乊čĆą╝čāą╗.










