Механізми органічних реакцій – основні поняття і визначення
Хімічна реакція між двома речовинами завжди є взаємною дію обох речовин одне на одну. Наприклад, не тільки хлор діє на метан, але і метан діє на хлор, тобто хлор не просто агресивний газ, він агресивний відносно метану, і проявляється під впливом метану. Однак в органічній хімії переважно вважають, що саме хлор впливає на метан. Виходячи із цих позицій хлор називають реагентом, а метан – субстратом. Під субстратами зазвичай розуміють речовини з великими молекулами, а під реагентами – речовини з малими молекулами, тобто реагент – це речовина з більш простим складом, часто неорганічного походження. Таким чином, в органічних реакціях даний субстрат атакується деяким реагентом.
Різницю між субстратом і реагентом вдається віднайти не завжди і часто назви встановлюються довільно. Так, в реакціях етерифікації карбонову кислоту незалежно від її складу вважають субстратом, а спирт, який може виявитися складнішим за складом, ніж кислота – реагентом.
В ході реакції одні хімічні зв’язки розриваються, а інші – утворюються. Розрив ковалентних зв’язків може бути гомолітичним і гетеролітичним.
В процесі гомолітичного розриву (гомоліз) зв’язуюча електронна пара роз’єднується на неспарені електрони
A : B → A⋅ + ⋅B
в результаті утворюються вільні радикали – нейтральні частинки.
При гетеролітичному розриві (гетероліз) зв’язуюча електронна пара залишається у одного з раніше зв’язаних атомів
A : B → A+ + :B–
і утворюються іони – протилежно заряджені частинки.
Атоми, молекули, іони, а також окремі ділянки молекул можуть бути електрофільними і нуклеофільними.
Нуклеофил здатний надати електронну пару для утворення нового ковалентного зв’язку внаслідок надлишку власних електронів.
Електрофіл здатний використовувати електронну пару партнера для утворення нового ковалентного зв’язку внаслідок нестачі власних електронів.
Таким чином, електронна пара нуклеофільного агента утворює зв’язок з електрофільним партнером. Нуклеофільними реагентами можуть бути молекули з вільною неподіленою електронною парою, такі як H2O, NH3; негативні іони, наприклад OH-, Br-; атоми C з частковим негативним зарядом Cδ--Me (де Me – атом металу); сполуки з кратним зв’язками. Електрофільними реагентами можуть бути молекули, що містять атоми з незаповненою зовнішньою електронною оболонкою, такі як AlCl3, BF3; позитивні іони H+, катіони металів і ін.; атоми C з частковим позитивним зарядом C-X (де X – атом неметалу).
Залежно від механізму реакції, тобто від виду розриву ковалентного зв’язку, і від того, чи є при даній реакції (в разі гетерогенного розриву хімічного зв’язку) реагент нуклеофілом або електрофілом, органічні реакції класифікують на радикальні, нуклеофільні і електрофільні. До основних типів хімічних органічних процесів віднесені реакції заміщення (позначення S), приєднання (A) і відщеплення (E), кожна з яких може бути радикальною (позначення R), нуклеофільною (N) і електрофільною (E).
Таким чином, в органічної хімії виділяють дев’ять типових реакцій, які позначають символами S, A і E з індексами R, N і E:
|
Реакція |
Радикальна |
Нуклеофільна |
Електрофільна |
|
Заміщення |
SR |
SN |
SE |
|
Приєднання |
AR |
AN |
AE |
|
Відщеплення |
ER |
EN |
EE |
Деякі з цих типів можуть бути ще розділені на підтипи відповідно до механізму реакції, наприклад розрізняють SN1 і EN1 – реакції нуклеофільного заміщення і реакції нуклеофільного відщеплення, мають ступінчастий механізм; SN2 і EN2 – реакції нуклеофільного заміщення і відщеплення, мають одностадійний механізм.
Наведені типи органічних реакцій не завжди реалізуються в чистому вигляді, їх можна вважати модельними типами. Наприклад, між гомолітичним і гетеролітичним розривом хімічного зв’язку є перехідні форми (реагують не радикали або іони, а полярні молекули). Відомо багато реакцій, при яких нуклеофільна і електрофільна атака спрямована одночасно на дві різних ділянки молекули. Часто подібні реакції призводять до циклічного перехідного стану, коли дві, три або (рідко) більше число молекул утворюють загальний цикл (“циклоприєднання”), такий циклічний перехідний стан при зсуві електронів або стабілізується, або руйнується.
Радикальні реакції
Радикальне заміщення (SR). В реакціях цього типу реагент є радикалом. Наприклад, таким реагентом може бути радикал Cl•, який утворюється з молекули Cl2 при гомолітичному розриві зв’язку під дією ініціатора – сонячного світла:
Cl2 → Cl• + •Cl
Виникнення радикалів – це стадія ініціювання, з якої починається розвиток ланцюгової реакції. Отримані радикали Cl• при зіткненні з молекулами субстрату породжують нові радикали (розвиток ланцюга), і так процес триває до тих пір, поки два радикала з’єднаються один з одним і ланцюгова реакція припиняється (стадія обриву ланцюга).
Приклад. Процес хлорування метану CH4 відбувається в такий спосіб:
ініціювання
Cl2 → Cl• + •Cl
розвиток ланцюга
H3C-H + •Cl → H3C• + HCl
H3C• + Cl2 → H3C-Cl + •Cl …
обрив ланцюга
H3C• + •Cl → H3C-Cl
H3C• + •CH3 → H3C-CH3
Останній продукт – етан С2Н6 називається побічним продуктом цієї реакції, оскільки він отриманий без участі реагенту (хлор не входить до його складу).
Радикальне приєднання (AR). В реакціях цього типу реагент є радикалом, який утворюється в SR-реакції. Цей радикал приєднується до ненасичених сполук з утворенням нового радикала і т.д., таким чином виникає реакційний ланцюг.
Приклад. Хлорування етену здійснюється наступним чином:
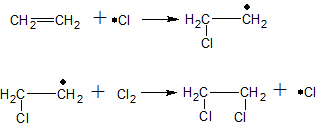
Продуктом цієї реакції є 1,2-дихлоретан.
Радикальне відщеплення (ER). В реакціях цього типу утворюються радикали у вигляді первинних фрагментів сполук карбону.
Приклад. При крекінгу (піролітичному розщепленні) вищих алканів відбувається гомолітичний розрив зв’язку C-C:
R-CH2-CH2-CH2-CH2-R’ → R-CH2-C•H2 + •CH2-CH2-R’
Короткоживучі радикали, які виникають в цьому процесі, спонтанно розпадаються і утворюють молекули алкенів і нові радикали:
R-CH2-C•H2 → R• + CH2=CH2
•CH2-CH2-R’ → R’• + CH2=CH2
Подальший перебіг реакції може проходити різними шляхами.
Нуклеофільні реакції
При нуклеофільних реакціях нуклеофільний реагент атакує електрофільний субстрат (або електрофільну ділянку субстрату):
Субстрат (електрофіл) + Реагент (нуклеофил) →
Нуклеофільне заміщення (SN). В реакціях цього типу нуклеофільний реагент витісняє атом або групу атомів з субстрату. При цьому відбувається гетеролітичний розрив зв’язку між витісненим атомом і атомом карбону, і група, що відщеплюється, забирає електронну пару, а реагент зі своєю електронною парою утворює новий хімічний зв’язок:

Приклад. Нуклеофільне заміщення здійснюється в реакції між монохлоретаном і гідроксид-іонами (вводяться з лугом):
CH3-Cδ+H2-Clδ- → CH3-CH2-OH + Cl–
За механізмом SN-реакції діляться на два види: SN1 – реакції з двохстадійним механізмом (видалення одного замісника і приєднання іншого відбуваються по черзі); SN2 – реакції з одностадійним механізмом (видалення одного замісника і приєднання іншого відбуваються одночасно).
Механізм SN1 реакцій.
На першій стадії відбувається гетеролітичний розпад субстрату з утворенням іона карбенія
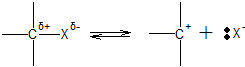
на другій стадії до іона карбенія приєднується нуклеофільна частинка

Для здійснення першої стадії потрібна енергія активації. Іон карбенія може приймати участь в інших реакціях (відщеплення катіона H+, перегрупування), що призводить до утворення ненасичених і ізомерних побічних продуктів. Відщеплення H+ – це конкуруюча EN1-реакція
Механізм SN2 реакцій.
Реакції з механізмом SN2 протікають при одночасному наближенні реагенту до субстрату і видаленні старого замісника:
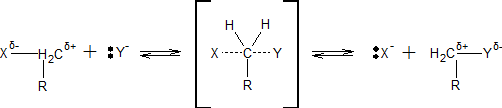
В результаті реакції SN2 відбувається інверсія конфігурації. Спочатку відхилення від замісника X атоми H і вуглеводневі залишки R (в рамках моделі тетраедра), в перехідному стані, спочатку стають перпендикулярними, а потім і прогинатися в бік X, в міру того як формується зв’язок C-Y (процес можна порівняти з вивертання парасольки на вітру):
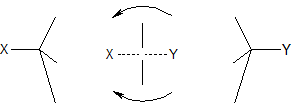
Таким чином, оптично активні D-сполуки переходять в антіподні L-сполуки (і навпаки). На відміну від реакції SN1, в реакції SN2 побічних ізомерних продуктів не утворюється, проте може також відбуватися відщеплення H в якості конкуруючої реакції EN2.
Нуклеофільне приєднання (AN). В реакціях цього типу приєднання нуклеофільного реагенту може відбуватися, якщо атом карбону набуває позитивний заряд, що реалізується рідко. В більшості випадків приєднання по подвійного зв’язку C=C відбувається або за радикальним механізмом (AR) або за механізмом електрофільного приєднання (AE), оскільки подвійний зв’язок має високу електронну щільність. Однак приєднання по подвійному зв’язку C=O альдегідів і кетонів протікає як нуклеофільна реакція (AN) завдяки тому, що висока електронегативність оксигену забезпечує створення позитивного заряду на атомі C і робить його доступним для нуклеофільної атаки.
Приклад. За механізмом нуклеофільного приєднання відбувається взаємодія гідроген ціаніду з альдегідами. Молекула HCN полярна, наближення її до також полярної групі C=O альдегіду викликає збільшення полярності молекули HCN до такої міри, що в перехідному стані іон CN- діє як нуклеофільний реагент і атакує позитивно заряджений атом C:
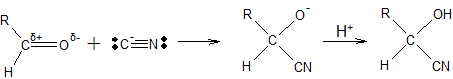
Неподілена електронна пара на атомі C від іона CN– стає зв’язуючою; одночасно кратний зв’язок C=O альдегіду перетворюється в одинарний зв’язок, і до атому оксигену в аніоні, що утворився, приєднується катіон гідрогену вихідного реагенту HCN.
Нуклеофільне відщеплення (EN). В реакціях цього типу, як і в реакціях нуклеофільного заміщення SN, відбувається утворення іона карбенія (двохстадійний механізм) або утворення перехідного стану (одностадійний механізм). Відповідно до цього розрізняють механізми EN1 і EN2. Таким чином, реакція EN конкурує з реакцією SN яка з них буде переважати, залежить від умов процесу. Так, при більш високих температурах переважно протікає реакція відщеплення.
Якщо в SN-реакції на другій стадії відбувається зв’язування нуклеофильного реагенту, то в EN-реакції внаслідок тяжіння електронів (-I-ефект), яке викликає атом C, відщеплюється катіон H+, причому головним чином від сусіднього атома C; одночасно формується кратний зв’язок між атомами карбону.
Приклад. За двостадійним механізмом EN1 здійснюється дегідрогалогенування під дією лугу:
CH3-CH2Cl → CH3-C+H2 + Cl–
CH3-C+H2 → H+ + CH2=CH2
Іони OH– і H+ об’єднуються в молекули H2O.
Електрофільні реакції
При електрофільних реакціях електрофільний реагент атакує нуклеофільний субстрат (або нуклеофільну ділянку субстрату):
Реагент (електрофіл) + Субстрат (нуклеофил) →
Електрофільне заміщення (SE). В реакціях цього типу електрофільний реагент витісняє атом або групу атомів з субстрату, причому замісник, який відходить, залишає зв’язуючу електронну пару атому карбону, і з її допомогою формується зв’язок електрофільного реагенту з субстратом:
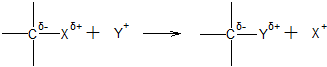
Електрофільне заміщення має суттєве значення в хімії ароматичних сполук. Процес протікає через дві стадії: спочатку утворюється π-комплекс ароматичного кільця з електрофільною частинкою, яка перетворюється в катіон аренія; реакція закінчується відщепленням гідроген-катіону (або іншого замісника). Позитивний заряд катіона аренія не відноситься до певного атома карбону, а делокалізований по всій мезомерній системі зв’язків. При утворенні катіону аренія ароматична система легко деформується, а при відщепленні іона H+ знову стабілізується.
Приклад. За механізмом електрофільного заміщення протікає каталітичне хлорування бензену.
Спочатку каталізатор (AlCl3, FeCl3) послаблює або розриває зв’язок в молекулі Cl2:
Cl-Cl + AlCl3 → Cl+-Cl–AlCl3
Cl-Cl + AlCl3 → Cl+ + AlCl4–
Потім відбувається утворення π-комплексу (перша стадія), перехід π-комплексу в катіон аренія (друга стадія) і відщеплення іона H+ (третя стадія):
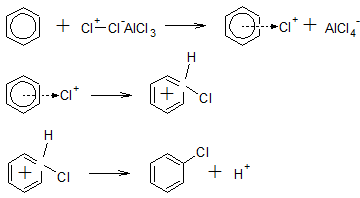
Після закінчення реакції каталізатор вивільняється
H+ + AlCl4– = HCl + AlCl3
і знову приймає участь в реакції з наступними молекулами реагенту.
Електрофільне приєднання (AE). В реакціях цього типу приєднання за участю електрофільного реагенту проходить через стадії утворення π-комплексу і іона карбенія, як і при електрофільному заміщенні, і закінчується за участю нуклеофільного реагенту. Зазвичай приєднання за подвійним зв’язком C=C протікає саме електрофільне, тому що у подвійного зв’язку висока електронна щільність, а π-електрони зв’язку достатньо рухливі.
Приклад. За механізмом електрофільного приєднання відбувається реакція гідроген хлориду з етеном. На першій стадії атом гідрогену в молекулі HCl, що несе ефективний позитивний заряд, при взаємодії з субстратом гетеролітично відщеплюється (у вигляді нона H+) і утворює з подвійним зв’язком π-комплекс. На другій стадії π-комплекс при поглинанні енергії активації перетворюється в іон карбенія, при цьому обидва електрона π-зв’язку повністю переміщуються до одного з атомів C, і на ньому утворюється новий σ-зв’язок C-H, а інший атом C отримує позитивний заряд. На третій стадії позитивний іон карбенія приєднує нуклеофільний іон Cl–, що утворюється на першій стадії.
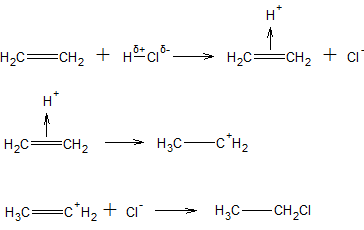
В реакції приєднання галогену (замість гідроген галогеніду) за подвійним зв’язком C=C поляризація молекули реагенту досягається дією розчинника або каталізатора (подібний приклад наведено вище при розгляді SE-реакцій); в ряді випадків поляризація може відбуватися навіть при зближенні реагенту до подвійного зв’язку субстрату. Так, молекула Br2 гетеролітично розпадається на іони Br+ і Br–; іон Br+ електрофільно починає реакцію приєднання, а іон Br– нуклеофільно закінчує її.
Електрофільне відщеплення (EE). В реакціях цього типу відщеплення відбувається за допомогою електрофільного реагенту. Для практики електрофільне відщеплення не має суттєвого значення.










