Чисто ковалентні зв’язки утворюються між атомами одного і того ж хімічного елемента, наприклад, чисто ковалентним є зв’язок хлор-хлор в молекулі Cl2. В таких молекулах розподіл електронної густини є симетричним всередині зв’язуючої молекулярної орбіталі, а максимум електронної густини припадає на середину відстані між ядрами. По-іншому розподіляється електронна густина в ковалентних зв’язках між атомами елементів, що мають різну електронегативність.
Ядро атома більш електронегативного елемента притягує електрон сильніше, ніж ядро атома менш електронегативного елемента, що може бути наслідком як відмінності зарядів ядер атомів цих елементів, так і відмінності в розмірах і ступені заповнення електронної оболонки атомів. З цієї причини розподіл електронної густини уздовж зв’язку є асиметричним, а отже, атом більш електронегативного елемента набуває негативний ефективний заряд (позначається δ-), а атом-партнер – позитивний ефективний заряд (позначається δ+). Чисельно реальні ефективні заряди на пов’язаних атомах, завжди менше, ніж їх ступінь окислення.
Наприклад, в молекулі HCl розподіл електронної густини уздовж зв’язку HCl є таким, що електричний центр негативного заряду зміщений до атому Cl, а центр позитивного заряду – до атому H. В результаті на атомах хлору і гідрогену виникають ефективні заряди Hδ+-Clδ-, а зв’язок гідроген-хлор набуває частково іонного характеру. В ковалентній молекулі HCl іонний характер зв’язку становить 17%, або полярність зв’язку дорівнює 17%.
Полярні ковалентні зв’язки – це ковалентні зв’язки між атомами, які мають певний ефективний заряд. Полярність властива більшості ковалентних зв’язків; ступінь поділу зарядів уздовж зв’язку може бути різною – від | δ | = 0 для чисто ковалентного зв’язку до | δ | = 1 для чисто іонного зв’язку.
Атоми, які утворюють полярний ковалентний зв’язок, мають ознаку іонів – електричний заряд. Їм властива також інша важлива характеристика іонів – відносна рухливість атомів. Молекули сполук з полярними зв’язками гідроген-елемент часто схильні до електролітичної дисоціації в розчині; такі речовини називають потенційними електролітами.
Перехід від іонного до чисто ковалентного зв’язку можна простежити на наступних сполуках хлору з елементами третього періоду Періодичної системи:
NaCl MgCl2 AlCl3 SiCl4 PCl3 SCl2 Cl2
В цьому ряду сполук хлору, чисто іонний зв’язок належить NaCl, а чисто ковалентний зв’язок належить Cl2. Полярність зв’язку збільшується справа наліво від Cl2 до NaCl.
Полярність ковалентного зв’язку можна оцінити за шкалою електронегативності, запропонованою і обґрунтованою американським хіміком Полінгом в 1930-х роках.
Електронегативність елемента (χ) – це міра тяжіння електронів, яке створює атом даного елемента, що бере участь в утворенні ковалентного зв’язку.
Міра полярності хімічного зв’язку – це різниця значень електронегативності елементів, атоми яких утворюють ковалентний зв’язок.
|
Гідроген фторид HF
Вода H2O
Нітроген(ІІІ) фторид NF3
Гідроген хлорид HCl
Амоніак NH3
Хлор(І) оксид Cl2O
Хлор(І) нітрид Cl3N
Хлор Cl2
χF = 4,10
χO = 3,50
χF = 4,10
χCl = 2,83
χN = 3,07
χO = 3,50
χN = 3,07
χCl = 2,83
χH = 2,10
χH = 2,10
χN = 3,07
χH = 2,10
χH = 2,10
χCl = 2,83
χCl = 2,83
χCl = 2,83
Δχ = 2,00
Δχ = 1,40
Δχ = 1,03
Δχ = 0,73
Δχ = 0,97
Δχ = 0,67
Δχ = 0,24
Δχ = 0,00
|
Чим більше значення Δχ, тим сильніший іонний характер зв’язку. В міру збільшення Δχ максимум електронної густини всередині зв’язуючі молекулярні орбіталі все більше зсуваються до атомного ядра більш електронегативного елементу. У граничному модельному випадку (це чиста абстракція, тому що не існує елемента з χ = 0) зв’язують електрони повністю переходять на електронну оболонку атома більш електронегативного елемента, і виникає чисто іонний зв’язок.
|
Δχ
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
Ступінь іонності, %
1
4
9
15
22
30
39
47
Δχ
1,8
2,0
2,2
2,4
2,6
2,8
3,0
3,2
Ступінь іонності, %
55
63
70
76
82
86
89
92
|
Полінг склав шкалу, яка дозволяє приблизно оцінити іонність одинарних ковалентних зв’язків використовуючи різницію Δχ. За цією шкалою значення Δχ = 1,7 відповідає 50% розділення зарядів, тобто такий зв’язок буде наполовину ковалентним, наполовину іонним.
Хімічний зв’язок вважається іонним, якщо різниця між значеннями електронегативності атомів, які утворили цей зв’язок, більша за 1,70.
Хімічний зв’язок вважається ковалентним полярним, якщо різниця між значеннями електронегативності атомів, які утворили цей зв’язок, має значення від 0,40 до 1,70.
Хімічний зв’язок вважається ковалентним неполярним, якщо різниця між значеннями електронегативності атомів, які утворили цей зв’язок, менше за 0,40.
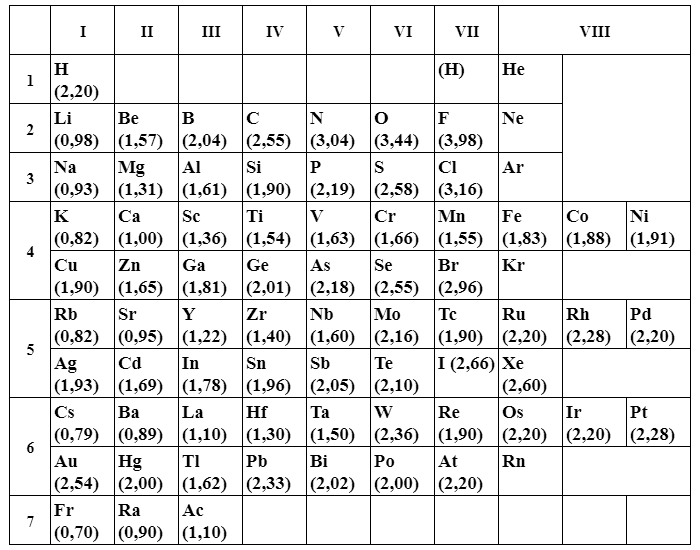
Нижче представлена сучасна шкала електронегативності елементів по Олдеру-Рохову.
|
Елемент
Ac
Ag
Al
Am
Ar
As
At
Au
B
Ba
Be
Bi
Bk
Br
C
Ca
Cd
Ce
Cf
Cl
Cm
Co
Cr
Cs
Cu
Dy
Er
Es
Eu
F
Fe
Fm
Fr
Ga
χ
1,00
1,42
1,47
1,20
3,20
2,20
1,90
1,42
2,01
0,97
1,47
1,67
1,20
2,74
2,50
1,04
1,46
1,08
1,20
2,83
1,20
1,70
1,56
0,86
1,75
1,10
1,11
1,20
1,01
4,10
1,64
1,20
0,86
1,82
Елемент
Gd
Ge
H
He
Hf
Hg
Ho
I
In
Ir
K
Kr
La
Li
Lu
Md
Mg
Mn
Mo
N
Na
Nb
Nd
Ne
Ni
(No)
Np
O
Os
P
Pa
Pb
Pd
Pm
χ
1,11
2,02
2,10
5,50
1,23
1,44
1,10
2,21
1,49
1,55
0,91
2,94
1,08
0,97
1,14
1,20
1,23
1,60
1,30
3,07
1,01
1,23
1,07
4,84
1,75
1,20
1,22
3,50
1,52
2,10
1,14
1,55
1,35
1,07
Елемент
Po
Pr
Pt
Pu
Ra
Rb
Re
Rh
Rn
Ru
S
Sb
Sc
Se
Si
Sm
Sn
Sr
Ta
Tb
Tc
Te
Th
Ti
Tl
Tm
U
V
W
Xe
Y
Yb
Zn
Zr
χ
1,76
1,07
1,44
1,22
0,97
0,89
1,46
1,45
2,06
1,42
2,60
1,82
1,20
2,48
1,74
1,07
1,72
0,99
1,33
1,10
1,36
2,01
1,11
1,32
1,44
1,11
1,22
1,45
1,40
2,40
1,11
1,06
1,66
1,22
|
Полярні молекули
Всі двоатомні двоелементні молекули Aδ+-Bδ- завжди поляризовані, оскільки хімічний зв’язок в них ковалентний полярний. Однак багатоатомні дво- і багатоелементні молекули можуть бути і полярними, і неполярними, тому що полярність всієї молекули залежить не тільки від наявності в ній полярних зв’язків, але і від геометричної форми молекул. Центри негативного і позитивного електричних зарядів найчастіше не збігаються з-за різного просторового розташування осей гібридних орбіталей центрального атома. В таких молекулах утворюється електричний диполь, який представляє собою систему з рознесених в просторі на деяку відстань зарядів, невеликих за кількістю і різних за знаком.
Полярні молекули – це молекули, що представляють собою електронні диполі.
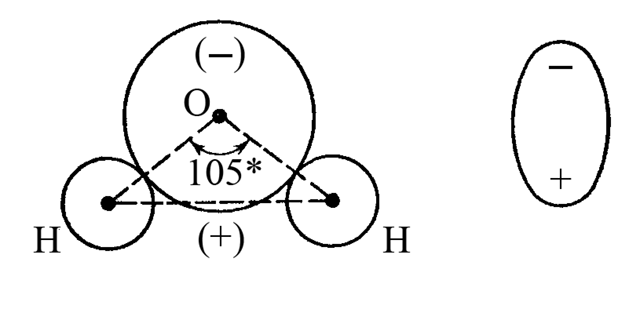
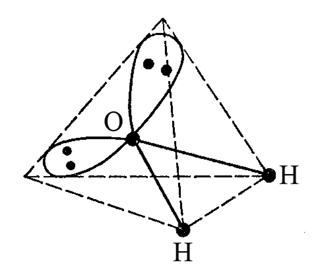
Полярної є молекула води H2O. Кожний хімічний зв’язок в молекулі води є полярним (Hδ+-Oδ-). Геометрія молекули води відповідає двічі незавершеному тетраедру. Така геометрична форма викликає поділ в просторі центрів негативного і позитивного електричних зарядів і утворення диполя молекули води
Молекула амоніаку NH3 так само полярна
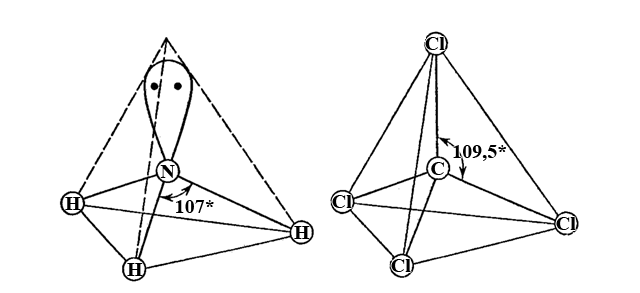
Атом N-III знаходиться в стані sp3-гібридизації і в одну з вершин спрямована неподілена пара електронів атома нітрогену (незавершений тетраедр). Навідміну від молекули амоніаку молекула карбон(IV) хлориду CCl4 неполярна; атом C+IV також має sp3-гібридизацію орбіталей, що відповідає геометрії правильного тетраедра (валентний кут 109,5*). Однак і в молекулі NH3, і в молекулі CCl4 кожний хімічний зв’язок (N-H, C-Cl) є полярним.










