Хлор Cl вперше в вільному вигляді виділено в 1774 році (Шеєле, Швеція). Поширення хлору в природі. Хлор – одинадцятий елемент за поширеністю на Землі. Зустрічається тільки в зв’язаному стані. Входить до складу багатьох мінералів, міститься у вигляді іонів Cl– в морській воді, з якої хлор переходить в соляні поклади.
Мінерали хлору: Галіт (кам’яна сіль) NaCl; карналіт KCl*MgCl2*6H2O; сильвін KCl; каїніт KCl*MgSO4*3H2O.
Фізіологічна дія хлору. Хлорид-іони Cl– життєво важливі для всіх живих організмів. Вони беруть участь у виробленні шлункового соку і регулюванні водного обміну.
Отримання хлору.
- Основний промисловий спосіб – електроліз хлоридів лужних металів або хвостових відходів соляної кислоти, одержуваних під час хлорування органічних сполук.
- Окиснення гідроген хлориду повітрям у присутності каталізаторів CuCl2, FeCl3 (процес Дікона):
4HCl + O2 = 2H2O + 2Cl2
Спосіб використовується в промисловості.
- Окиснення гідрогенхлориду калій перманганатом, манган(IV) оксидом, кальцій гіпохлоритом і ін., Наприклад:
2KMnO4 + 16HCl (конц.) = 2KCl + 2MnCl2 + 8H2O + 5Cl2
MnO2 + 4HCl (конц.) = MnCl2 + 2H2O + Cl2
Ca(ClO)2 + 4HCl (конц.) = CaCl2 + 2H2O + 2Cl2
Ці способи застосовують для отримання хлору в лабораторних умовах.
Фізіологічна дія хлору. Газоподібний хлор подразливо діє на слизову оболонку органів дихання, руйнує легені. Вдихання протягом 1-2 години повітря, що містить 0,05% Cl2, може привести до задухи і смерті. Хлор – перша бойова отруйна речовина, застосована в 1915 році державою Німеччиною в боях під містом Іпр (Бельгія).
Властивості хлору. Проста речовина Cl2 – жовто-зелений, негорючий газ з задушливим запахом, в 2,5 рази важчий за повітря. Помірно розчинний у воді (утворюється “хлорна вода“). Хлор дуже реакційноздатний, витісняє бром і йод з їхніх сполук з гідрогеном і металами; з багатьма елементами утворює хлориди. Порошкоподібні сурма, миш’як і розпечене залізо згоряють в газоподібному хлорі, наприклад:
2Fe + 3Cl2 = 2FeCl3
Сплав томпак загоряється в хлорі, а чисте золото реагує з хлором з утворенням AuCl3.
Суміші газоподібних хлору і водню вибухають при нагріванні або освітленні:
H2 + Cl2 ⇄ 2HCl
При насиченні хлором холодного розчину лугу утворюються хлориди і гіпохлорити:
2NaOH + Cl2 = NaCl + NaClO + H2O
Вуглеводні при дії Cl2 утворюють (реакції заміщення або приєднання) відповідні хлорпохідні, наприклад:
CH4 + Cl2 = CH3Cl + HCl
Скипидар загоряється в атмосфері хлору. Вологий газоподібний хлор знебарвлює багато барвників, особливо сильно на сонячному світлі; це пояснюється утворенням нестійкої гіпохлоритної кислоти і розкладанням її під дією світла на гідроген хлорид і оксиген (сильний окислювач):
Cl2 + H2O ⇄ HClO + HCl
HClO → HCl + O
Тому “хлорну воду” слід зберігати в темних склянках (краще в темряві).
Хімічні властивості хлору, і його застосування показані на схемі.
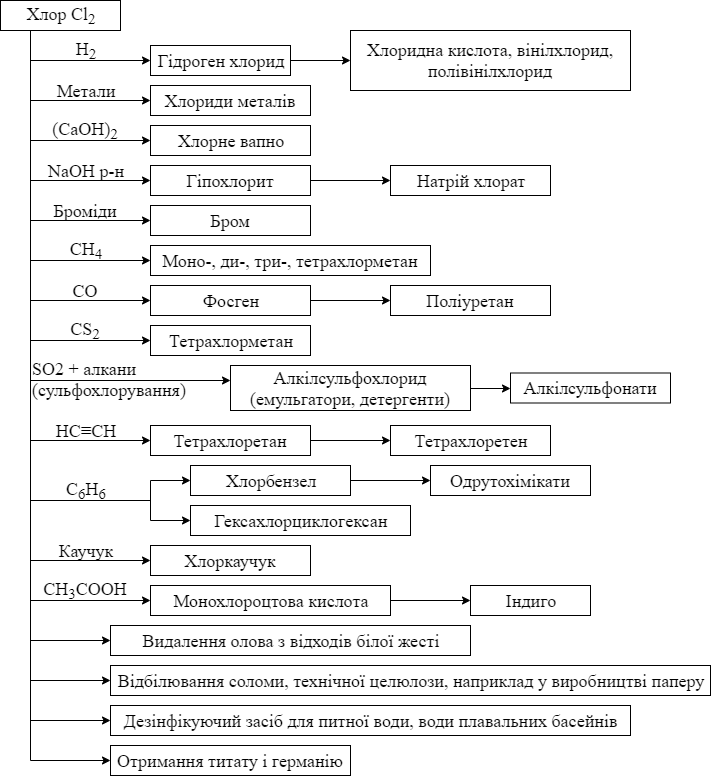
Застосування хлору. Хлор відноситься до продуктів основного хімічного виробництва. Рідкий сухий хлор перевозять в залізничних цистернах і перекачують по сталевим трубопроводам; в продаж хлор надходить в сталевих балонах з вентилями з олов’яно-цинкової бронзи.
Сполуки хлору
Гідроген хлорид HCl
Отримання гідроген хлориду HCl.
- Прямий синтез шляхом спалювання водню в хлорі:
H2 + Cl2 ⇄ 2HCl
- Взаємодія натрій хлориду з концентрованою сульфатною кислотою при помірному (реакція 1) або сильному нагріванні (реакція 2):
NaCl + H2SO4 = NaHSO4 + HCl (1)
2NaCl + H2SO4 = Na2SO4 + 2HCl (2)
- Хлорування органічних сполук, наприклад бензену; виділяється як побічний продукт:
C6H6 + Cl2 = C6H5Cl + HCl
Властивості хлору. Безбарвний газ з сильним запахом. Гігроскопічний, у вологому повітрі утворює туман. Добре розчиняється у воді; водні розчини називаються хлоридна кислота (концентрований розчин – соляна кислота). В воді гідроген хлорид повністю розпадається на іони:
HCl = H+ + Cl–; H+ + H2O = H3O+
При контакті з амоніаком утворюється амоній хлорид, тверді частинки якого в повітрі створюють білий дим:
NH3 + HCl = NH4Cl
Реагує з етіном під дією каталізатора з утворенням вінілхлориду:
HC≡CH + HCl → H2C = CHCl
Хлоридна кислота – безбарвна рідина, димить на повітрі; в продаж надходить з вмістом 38% HCl (соляна кислота). Хлоридна кислота з вмістом 0,4-0,5% HCl входить до складу шлункового соку. Окисних властивостей не має (кислота-неокисник), реагує з неблагородними металами з виділенням газоподібного водню:
2Al + 6HCl = 2AlCl3 + 2H2
2Al + 6H3O + = 2Al3+ + 3H2
При взаємодії соляної кислоти з сильними окислювачами утворюється газоподібний хлор.
Застосування гідроген хлориду HCl. Газоподібний гідроген хлорид є сировиною у виробництві соляної кислоти, хлоридів і вінілхлориду (переробляється в полівінілхлорид). Хлоридна кислота використовується при травленні металів, як паяльну рідину (Zn + HCl до припинення реакції) – паяльна кислота, для вилучення металів з руд, для отримання хлоридів і хлору.
Хлориди
Хлориди – сполуки елементів з хлором. Мінералогічні і тривіальні назви деяких хлоридів металів: NaCl – галіт, кам’яна сіль, кухонна сіль; сильвін KCl; нашатир NH4Cl; сулема, сублімат HgCl2; каломель Hg2Cl2; рожева сіль (NH4)2[SnCl6].
Більшість хлоридів металів добре розчинні у воді. Винятки: AgCl, Hg2Cl2, TlCl, PbCl2, в холодній воді вони мало розчинні.
Виявлення хлоридів. З розчинів, що містять іони Cl–, при підкисленні нітратною кислотою і додаванні розчину AgNO3 випадає білий пластівчастий осад AgCl, який поступово темніє на світлі, розчиняється в розчині амоніаку.
Оксигенвмісні кислоти хлору та їх солі
|
Кислота |
Сіль |
||
|
Формула |
Назва |
Формула |
Назва |
|
HClO4 |
Перхлоратна кислота |
MeIClO4 |
Перхлорат |
|
HClO3 |
Хлоратна кислота |
MeIClO3 |
Хлорат |
|
HClO2 |
Хлоритна кислота |
MeIClO2 |
Хлорит |
|
HClO |
Гіпохлоритна кислота |
MeIClO |
Гіпохлорит |
Перхлоратна кислота HClO4 – вибухова рідина, при помірному розведенні має маслоподібну консистенцію. Дуже нестійка. Водний розчин (72%, азеотропна суміш) кипить при 203*С. Найсильніша кислота з відоми, у водному розчині. З розчинів солей калію осаджує білий калій перхлорат KClO4, який використовується як аналітичний реактив.
Хлоратна кислота HClO3 стійка тільки у 40% водному розчині. Хлорати утворюються при продуванні газоподібного хлору через гарячий розчин лугу:
6KOH + 3Cl2 = KClO3 + 5KCl + 3H2O
Солі хлоратної кислоти – хлорати – сильні окиснювачі. Наприклад, при розтиранні суміші калій хлорату з сіркою відбувається вибух (аналогічний експеримент з фосфором небезпечний для життя!); деревна тріска, занурена в розплавлений хлорат, загоряється з інтенсивно димлячим полум’ям. При нагріванні хлорати (легше, ніж перхлорати) віддають оксиген; розкладання каталітично прискорює MnO2 (піролюзит):
2KClO3 = 2KCl + 3O2
Калій хлорат (бертолетова сіль) KClO3 використовується у виробництві сірників, вибухових речовин і піротехнічних засобів (пістони, новорічні хлопавки). Натрій хлорат NaClO3 застосовують як гербіцидний засіб для боротьби з бур’янами.
Хлоритна кислота HClO2 відома тільки в розбавленому водному розчині, дуже нестійка. Натрій хлорит NaClO2 використовують як відбілюючий засіб.
Гіпохлоритна кислота HClO існує тільки в розбавленому розчині; сама кислота і її солі (гіпохлорити) – сильні окиснювачі. Утворюється в “хлорній воді”. Натрій гіпохлорит NaClO і калій гіпохлорит KClO є діючою речовиною відбілючого лугу (лабарракова вода, жавелева вода), що утворюється при насиченні розчинів NaOH і КОН хлором при зниженій температурі, наприклад:
2KOH + Cl2 = KCl + KClO + H2O
Відбілюючий луг має запах хлоритної кислоти, яка утворюється при гідролізі хлориту (невірним є твердження, що відбілюючий луг має запах хлору). Відбілюючий луг має гарні відбілюючі, дезінфікуючими та дезактивуючі властивості; на дезактивуючій дії відбілюючого лугу базується метод знешкодження ціанід-вмісних стічних вод гальванічних цехів. Хлорне вапно (хлорка), отримується в промисловості з хлору і гашеного вапна Ca(OH)2, являє собою суміш кальцій гіпохлориту Ca(ClO)2 з CaCl2 і Ca(OH)2. Застосовують як відбілюючий і дезинфікуючий засіб. Чистий гіпохлорит Ca(ClO)2 використовується для дезактивації бойових отруйних речовин.
Оксиди хлору
Дихлор гептаоксид Cl2O7 (ангідрид перхлоратної кислоти) – безбарвна летюча маслоподібна рідина. Вибухонебезпечна! Отримують шляхом відібрання води від хлорного кислоти за допомогою P4O10:
4HClO4 + P4O10 = 2Cl2O7 + 4HPO3
Хлор діоксид ClO2 – жовтий газ з гострим характерним запахом. Вибухає при нагріванні. Отримують з калій хлорату і концентрованої сульфатної кислоти:
3KClO2 + 3H2SO4 = 3KHSO4 + HClO4 + H2O + 2ClO2
Дихлор оксид Cl2O – бурий газ. Вибухонебезпечний! Реагує з водою з утворенням гіпохлоритної кислоти:
Cl2O + H2O = 2HClO










