ąåąĘąŠą╝ąĄčĆč¢čÅ – čåąĄ č¢čüąĮčāą▓ą░ąĮąĮčÅ ą╝ąŠą╗ąĄą║čāą╗ ąĘ ąŠą┤ąĮą░ą║ąŠą▓ąĖą╝ąĖ čüčāą╝ą░čĆąĮąĖą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ (ą▒čĆčāčéč鹊-č乊čĆą╝čāą╗ąĖ), ą░ą╗ąĄ ąĘ čĆč¢ąĘąĮąŠčÄ ą▒čāą┤ąŠą▓ąŠčÄ ą░ą▒ąŠ čĆč¢ąĘąĮąĖą╝ čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅą╝ ą░č鹊ą╝č¢ą▓ ą▓ ą┐čĆąŠčüč鹊čĆč¢.
ąźč¢ą╝č¢čćąĮč¢ čéą░ čäč¢ąĘąĖčćąĮč¢ ą▓ą╗ą░čüčéąĖą▓ąŠčüčéč¢ č¢ąĘąŠą╝ąĄčĆąĮąĖčģ čĆąĄč湊ą▓ąĖąĮ čĆč¢ąĘąĮčÅčéčīčüčÅ.
ąÆąĖą┤ąĖ č¢ąĘąŠą╝ąĄčĆč¢čŚ.
ąĪčéčĆčāą║čéčāčĆąĮą░ č¢ąĘąŠą╝ąĄčĆč¢čÅ. ą”ąĄą╣ ą▓ąĖą┤ č¢ąĘąŠą╝ąĄčĆč¢čŚ ąĘčāą╝ąŠą▓ą╗ąĄąĮąĖą╣ čĆč¢ąĘąĮąĖą╝ ą▓ąĘą░čöą╝ąĮąĖą╝ čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅą╝ ą░č鹊ą╝č¢ą▓ ą▓ ą╝ąŠą╗ąĄą║čāą╗ą░čģ.
ąÆąĖą┤ąĖ čüčéčĆčāą║čéčāčĆąĮąŠčŚ č¢ąĘąŠą╝ąĄčĆč¢čŚ:
1. ąåąĘąŠą╝ąĄčĆč¢čÅ ą║ą░čĆą▒ąŠąĮąŠą▓ąŠą│ąŠ čüą║ąĄą╗ąĄčéčā, ąŠą▒čāą╝ąŠą▓ą╗ąĄąĮą░ ŌĆŗŌĆŗčĆč¢ąĘąĮąĖą╝ ą┐ąŠčĆčÅą┤ą║ąŠą╝ ąĘą▓’čÅąĘą║čā ą░č鹊ą╝č¢ą▓, čēąŠ čāčéą▓ąŠčĆčÄčÄčéčī čüą║ąĄą╗ąĄčé ą╝ąŠą╗ąĄą║čāą╗ąĖ ąŠčĆą│ą░ąĮč¢čćąĮąŠčŚ čüą┐ąŠą╗čāą║ąĖ
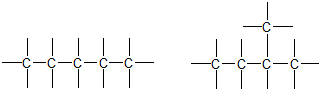
2. ąåąĘąŠą╝ąĄčĆč¢čÅ ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ, ąŠą▒čāą╝ąŠą▓ą╗ąĄąĮą░ ŌĆŗŌĆŗčĆč¢ąĘąĮąĖą╝ ą┐ąŠą╗ąŠąČąĄąĮąĮčÅą╝ ąŠą┤ąĮą░ą║ąŠą▓ąĖčģ ąĘą░ą╝č¢čüąĮąĖą║č¢ą▓ ą░ą▒ąŠ čäčāąĮą║čåč¢ąŠąĮą░ą╗čīąĮąĖčģ ą│čĆčāą┐ ą┐čĆąĖ ąŠą┤ąĮą░ą║ąŠą▓ąŠą╝čā ą║ą░čĆą▒ąŠąĮąŠą▓ąŠą╝čā ą╗ą░ąĮčåčÄą│čā
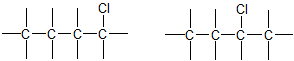
3. ąóą░čāč鹊ą╝ąĄčĆč¢čÅ (čĆą░ąĮč¢čłąĄ ąĮą░ąĘąĖą▓ą░ą╗ąĖ ą┤ąĄčüą╝ąŠčéčĆąŠą┐č¢čÅ), čēąŠ ą▓ąĖą║ą╗ąĖą║ą░čöčéčīčüčÅ ąĘą╝č¢ąĮąŠčÄ ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ ąŠą┤ąĮąŠą│ąŠ ąĘ ą░č鹊ą╝č¢ą▓ ą│č¢ą┤čĆąŠą│ąĄąĮčā, čēąŠ ą┐čĆąĖąĘą▓ąŠą┤ąĖčéčī ą┤ąŠ ą┐ąĄčĆąĄčéą▓ąŠčĆąĄąĮčī ą┤ą▓ąŠčģ čüčéčĆčāą║čéčāčĆąĮąĖčģ č¢ąĘąŠą╝ąĄčĆč¢ą▓ ąŠą┤ąĖąĮ ą▓ ąŠą┤ąĮąŠą│ąŠ. ąØą░ą┐čĆąĖą║ą╗ą░ą┤, ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą┤ąŠ ąŠą▒ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ
CH3-CO-CH2-COOC2H5 Ōćä CH3-C(OH)=CH-COOC2H5
ą░ą▒ąŠ

4. ą¤čĆąŠčüč鹊čĆąŠą▓ą░ č¢ąĘąŠą╝ąĄčĆč¢čÅ (čüč鹥čĆąĄąŠč¢ąĘąŠą╝ąĄčĆč¢čÅ). ą”ąĄą╣ ą▓ąĖą┤ č¢ąĘąŠą╝ąĄčĆč¢čŚ ąĘčāą╝ąŠą▓ą╗ąĄąĮąĖą╣ čĆč¢ąĘąĮąĖą╝ ą┐čĆąŠčüč鹊čĆąŠą▓ąĖą╝ čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅą╝ ą░č鹊ą╝č¢ą▓ ą┐čĆąĖ ąŠą┤ąĮą░ą║ąŠą▓ąŠą╝čā ą┐ąŠčĆčÅą┤ą║čā čŚčģ ąĘą▓’čÅąĘčāą▓ą░ąĮąĮčÅ.
ąØą░ą╣ą▒č¢ą╗čīčł ą┐ąŠčłąĖčĆąĄąĮč¢ ą┤ą╗čÅ ąŠčĆą│ą░ąĮč¢čćąĮąĖčģ čüą┐ąŠą╗čāą║ ą┤ą▓ą░ čéąĖą┐ąĖ čüč鹥čĆąĄąŠč¢ąĘąŠą╝ąĄčĆč¢čŚ:
- ą│ąĄąŠą╝ąĄčéčĆąĖčćąĮą░ č¢ąĘąŠą╝ąĄčĆč¢čÅ;
- ąŠą┐čéąĖčćąĮą░ č¢ąĘąŠą╝ąĄčĆč¢čÅ.
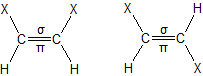
4.1. ąōąĄąŠą╝ąĄčéčĆąĖčćąĮą░ č¢ąĘąŠą╝ąĄčĆč¢čÅ (ą░ą▒ąŠ čåąĖčü-čéčĆą░ąĮčü-č¢ąĘąŠą╝ąĄčĆč¢čÅ) čģą░čĆą░ą║č鹥čĆąĮą░ ą┤ą╗čÅ ąĮąĄąĮą░čüąĖč湥ąĮąĖčģ ąŠčĆą│ą░ąĮč¢čćąĮąĖčģ čüą┐ąŠą╗čāą║. ą¤ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĘą▓’čÅąĘąŠą║ ą▓ čéą░ą║ąĖčģ čüą┐ąŠą╗čāą║ą░čģ ąĮąĄ ą┤ąŠą┐čāčüą║ą░čö ą▓č¢ą╗čīąĮąŠą│ąŠ ąŠą▒ąĄčĆčéą░ąĮąĮčÅ ąĮą░ą▓ą║ąŠą╗ąŠ ąĘą▓’čÅąĘą║čā ą║ą░čĆą▒ąŠąĮ-ą║ą░čĆą▒ąŠąĮ (ą┐čĆąĖ ąŠą┤ąĖąĮą░čĆąĮąŠą╝čā ąĘą▓’čÅąĘą║čā C-C čéą░ą║ąĄ ąŠą▒ąĄčĆčéą░ąĮąĮčÅ č¢čüąĮčāčö). čåąĖčü-ążąŠčĆą╝ą░ ą▓č¢ą┤čĆč¢ąĘąĮčÅčöčéčīčüčÅ čéąĖą╝, čēąŠ ą┤ą▓ą░ ąĘą░čüčéčāą┐ąĮąĖą║ąĖ X ą▓ ą╝ąŠą╗ąĄą║čāą╗č¢ čĆąŠąĘčéą░čłąŠą▓ą░ąĮč¢ ą┐ąŠ ąŠą┤ąĮčā čüč鹊čĆąŠąĮčā ą┐ą╗ąŠčēąĖąĮąĖ ą┐ąŠą┤ą▓č¢ą╣ąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā, ą░ ą▓ čéčĆą░ąĮčü-č乊čĆą╝č¢ ą▓ąŠąĮąĖ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ąĮą░ čĆč¢ąĘąĮąĖčģ čüč鹊čĆąŠąĮą░čģ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤:
4.2. ą×ą┐čéąĖčćąĮą░ č¢ąĘąŠą╝ąĄčĆč¢čÅ ąĘčāą╝ąŠą▓ą╗ąĄąĮą░ ŌĆŗŌĆŗąĮą░čÅą▓ąĮč¢čüčéčÄ ą░čüąĖą╝ąĄčéčĆąĖčćąĮąŠą│ąŠ ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮčā C* (čģč¢čĆą░ą╗čīąĮąĖą╣ čåąĄąĮčéčĆ), č鹊ą▒č鹊 ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮčā, ą┐ąŠą▓’čÅąĘą░ąĮąŠą│ąŠ ąĘ č湊čéąĖčĆą╝ą░ čĆč¢ąĘąĮąĖą╝ąĖ ąĘą░ą╝č¢čüąĮąĖą║ą░ą╝ąĖ. ąÆčüč¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ, čÅą║č¢ ą╝č¢čüčéčÅčéčī ą░čüąĖą╝ąĄčéčĆąĖčćąĮąĖą╣ ą░č鹊ą╝ ą║ą░čĆą▒ąŠąĮčā, ąŠą┐čéąĖčćąĮąŠ ą░ą║čéąĖą▓ąĮč¢.
ą×ą┐čéąĖčćąĮą░ ą░ą║čéąĖą▓ąĮč¢čüčéčī ą┐čĆąŠčÅą▓ą╗čÅčöčéčīčüčÅ ą▓ č鹊ą╝čā, čēąŠ čĆąŠąĘčćąĖąĮąĖ ąŠą┐čéąĖčćąĮąŠ ą░ą║čéąĖą▓ąĮąĖčģ čüą┐ąŠą╗čāą║ ąŠą▒ąĄčĆčéą░čÄčéčī ą┐ą╗ąŠčēąĖąĮčā ą┐ąŠą╗čÅčĆąĖąĘąŠą▓ą░ąĮąŠą│ąŠ čüą▓č¢čéą╗ą░.
ąĀąĄč湊ą▓ąĖąĮąĖ ąĘ ą░čüąĖą╝ąĄčéčĆąĖčćąĮąĖą╝ ą░č鹊ą╝ąŠą╝ ą║ą░čĆą▒ąŠąĮčā č¢čüąĮčāčÄčéčī čā ą▓ąĖą│ą╗čÅą┤č¢ ą┤ą▓ąŠčģ ąŠą┐čéąĖčćąĮąĖčģ (ą┤ąĘąĄčĆą║ą░ą╗čīąĮąĖčģ) č¢ąĘąŠą╝ąĄčĆč¢ą▓, ąŠą┤ąĖąĮ ąĘ čÅą║ąĖčģ ąĮą░ąĘąĖą▓ą░čöčéčīčüčÅ ą┐čĆą░ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮąĖą╣, č¢ąĮčłąĖą╣ – ą╗č¢ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮąĖą╣. ąÜąŠąĮčäč¢ą│čāčĆą░čåč¢čÄ ą┐čĆą░ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮąŠą│ąŠ č¢ąĘąŠą╝ąĄčĆčā ą┐ąŠąĘąĮą░čćą░čÄčéčī čüąĖą╝ą▓ąŠą╗ąŠą╝ D, ą░ ą╗č¢ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮąŠą│ąŠ č¢ąĘąŠą╝ąĄčĆčā – čüąĖą╝ą▓ąŠą╗ąŠą╝ L. ą×ą▒ąĖą┤ą▓ą░ ą┤ąĘąĄčĆą║ą░ą╗čīąĮąĖčģ č¢ąĘąŠą╝ąĄčĆąĖ ąĮą░ąĘąĖą▓ą░čÄčéčī čéą░ą║ąŠąČ ąŠą┐čéąĖčćąĮč¢ ą░ąĮčéąĖą┐ąŠą┤ąĖ.
ąÆč¢ą┤ąĮąĄčüąĄąĮąĮčÅ č¢ąĘąŠą╝ąĄčĆč¢ą▓ ą┤ąŠ D- ą░ą▒ąŠ L-čĆčÅą┤čā ą┐čĆąŠą▓ąŠą┤ąĖčéčīčüčÅ čłą╗čÅčģąŠą╝ ą┐ąŠčĆč¢ą▓ąĮčÅąĮąĮčÅ ąĘ ą║ąŠąĮčäč¢ą│čāčĆą░čåč¢čöčÄ ąĄčéą░ą╗ąŠąĮą░; ąĘą░ ąĄčéą░ą╗ąŠąĮ ąŠą▒čĆą░ąĮąŠ ą┐čĆą░ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮąĖą╣ (+)-ą│ą╗č¢čåąĄčĆąŠą╗ąŠą▓ąĖą╣ ą░ą╗čīą┤ąĄą│č¢ą┤ ą┤ą╗čÅ D-čĆčÅą┤čā č¢ ą╗č¢ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮąĖą╣ (-)-ą│ą╗č¢čåąĄčĆąŠą╗ąŠą▓ąĖą╣ ą░ą╗čīą┤ąĄą│č¢ą┤ ą┤ą╗čÅ L-čĆčÅą┤čā (ąĘąĮą░ą║ąĖ (+) č¢ (–) ą▓ą║ą░ąĘčāčÄčéčī ąĮą░ ąĮą░ą┐čĆčÅą╝ąŠą║ ąŠą▒ąĄčĆčéą░ąĮąĮčÅ ą┐ą╗ąŠčēąĖąĮąĖ ą┐ąŠą╗čÅčĆąĖąĘą░čåč¢čŚ čüą▓č¢čéą╗ą░):
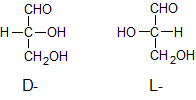
ąĪą┐ąŠą╗čāą║ąĖ ąĘ ą║ąŠąĮčäč¢ą│čāčĆą░čåč¢čöčÄ ąĄčéą░ą╗ąŠąĮą░ D-čĆčÅą┤čā ą▓č¢ą┤ąĮąŠčüčÅčéčī ą┤ąŠ čåčīąŠą│ąŠ čĆčÅą┤čā (ą░ąĮą░ą╗ąŠą│č¢čćąĮąŠ č¢ ą┤ą╗čÅ L-čĆčÅą┤čā) ąĮąĄąĘą░ą╗ąĄąČąĮąŠ ą▓č¢ą┤ ąĮą░ą┐čĆčÅą╝ą║čā ąŠą▒ąĄčĆčéą░ąĮąĮčÅ ą┐ą╗ąŠčēąĖąĮąĖ ą┐ąŠą╗čÅčĆąĖąĘą░čåč¢čŚ čüą▓č¢čéą╗ą░ čĆąŠąĘčćąĖąĮąŠą╝ ą┤ą░ąĮąŠčŚ čĆąĄč湊ą▓ąĖąĮąĖ.
ąØą░ą┐čĆąĖą║ą╗ą░ą┤, ą▓ąĖąĮąĮą░ ą║ąĖčüą╗ąŠčéą░, čēąŠ ąŠčéčĆąĖą╝čāčöčéčīčüčÅ ąĘ D(+)-ą│ą╗č¢čåąĄčĆąŠą╗ąŠą▓ąŠą│ąŠ ą░ą╗čīą┤ąĄą│č¢ą┤čā, ą▓ąĖčÅą▓ą╗čÅčöčéčīčüčÅ ą╗č¢ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮąŠčÄ, č鹊ą▒č鹊 D(-)-ą▓ąĖąĮąĮąŠčÄ ą║ąĖčüą╗ąŠč鹊čÄ.
ąĪčāą╝č¢čłč¢ čĆč¢ą▓ąĮąĖčģ ą║č¢ą╗čīą║ąŠčüč鹥ą╣ ąŠą┐čéąĖčćąĮąĖčģ ą░ąĮčéąĖą┐ąŠą┤č¢ą▓, ąĮą░ą┐čĆčÅą╝ą║ąĖ ąŠą▒ąĄčĆčéą░ąĮąĮčÅ čÅą║ąĖčģ ą▓ąĘą░čöą╝ąĮąŠ ą┐čĆąŠčéąĖą╗ąĄąČąĮč¢, ąĮą░ąĘąĖą▓ą░čÄčéčī čĆą░čåąĄą╝ą░čéąĖ. ąŚą░ąĘą▓ąĖčćą░ą╣ ą┐čĆąĖ čüąĖąĮč鹥ąĘą░čģ ąŠčéčĆąĖą╝čāčÄčéčī čĆą░čåąĄą╝ą░čéąĖ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą▓ąĖąĮąŠą│čĆą░ą┤ąĮčā, ą░ą▒ąŠ DL-ą▓ąĖąĮąĮčā ą║ąĖčüą╗ąŠčéčā, čÅą║č¢ ą╝ąŠąČąĮą░ čĆąŠąĘą┤č¢ą╗ąĖčéąĖ ąĮą░ ąŠą┐čéąĖčćąĮąŠ ą░ą║čéąĖą▓ąĮč¢ č¢ąĘąŠą╝ąĄčĆąĖ čĆč¢ąĘąĮąĖą╝ąĖ čüą┐ąŠčüąŠą▒ą░ą╝ąĖ.
ąÜč¢ą╗čīą║č¢čüčéčī ąŠą┐čéąĖčćąĮąĖčģ č¢ąĘąŠą╝ąĄčĆč¢ą▓ čā ą▓ąĖą┐ą░ą┤ą║čā ą┤ąĄą║č¢ą╗čīą║ąŠčģ ą░čüąĖą╝ąĄčéčĆąĖčćąĮąĖčģ ą░č鹊ą╝č¢ą▓ ą┤ąŠčĆč¢ą▓ąĮčÄčö 2n, n – ą║č¢ą╗čīą║č¢čüčéčī ą░čüąĖą╝ąĄčéčĆąĖčćąĮąĖčģ ą░č鹊ą╝č¢ą▓ ą║ą░čĆą▒ąŠąĮčā ą▓ ą╝ąŠą╗ąĄą║čāą╗č¢.
ąŚą░ čĆąĄą║ąŠą╝ąĄąĮą┤ą░čåč¢čÅą╝ąĖ IUPAC ąŠą┐čéąĖčćąĮč¢ ą░ąĮčéąĖą┐ąŠą┤ąĖ ą┐ąŠąĘąĮą░čćą░čÄčéčī čüąĖą╝ą▓ąŠą╗ ą╗ą░ą╝ąĖ R (ą┐čĆą░ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮč¢) č¢ S (ą╗č¢ą▓ąŠąŠą▒ąĄčĆčéą░ą╗čīąĮč¢). ą”č¢ ą┐ąŠąĘąĮą░č湥ąĮąĮčÅ ąĘą░čüąĮąŠą▓ą░ąĮč¢ ąĮąĄ ąĮą░ ą┐ąŠčĆč¢ą▓ąĮčÅąĮąĮč¢ ą▒čāą┤ąŠą▓ąĖ ąĘ ąĄčéą░ą╗ąŠąĮąŠą╝, ą░ ąĮą░ ą┐čĆą░ą▓ąĖą╗ą░čģ, čÅą║č¢ ą▓čĆą░čģąŠą▓čāčÄčéčī ą┐ąŠčüą╗č¢ą┤ąŠą▓ąĮąĄ č¢ ą┐čĆąŠčüč鹊čĆąŠą▓ąĄ čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅ č湊čéąĖčĆčīąŠčģ ąĘą░ą╝č¢čüąĮąĖą║č¢ą▓ C – ą░čüąĖą╝ąĄčéčĆąĖčćąĮąŠą│ąŠ ą░č鹊ą╝ą░ ą║ą░čĆą▒ąŠąĮčā.
ąæč¢ą╗čīčł ą┤ąŠą║ą╗ą░ą┤ąĮąŠ ą×ą┐čéąĖčćąĮą░ R-, S-ąĮąŠą╝ąĄąĮą║ą╗ą░čéčāčĆą░.
ą×ą┐čéąĖčćąĮą░ ą░ą║čéąĖą▓ąĮč¢čüčéčī ą╝ąŠąČąĄ čüą┐ąŠčüč鹥čĆč¢ą│ą░čéąĖčüčÅ č¢ č鹊ą┤č¢, ą║ąŠą╗ąĖ ą▓ ą╝ąŠą╗ąĄą║čāą╗ą░čģ čĆąĄč湊ą▓ąĖąĮąĖ ąĮąĄą╝ą░čö ą░čüąĖą╝ąĄčéčĆąĖčćąĮąĖčģ ą░č鹊ą╝č¢ą▓, ą░ą╗ąĄ ą▓ąŠąĮąĖ ą▓ čåč¢ą╗ąŠą╝čā ą░čüąĖą╝ąĄčéčĆąĖčćąĮč¢ (ąĮąĄ ą╝ą░čÄčéčī ą┐ą╗ąŠčēąĖąĮč¢ ą░ą▒ąŠ č¢ąĮčłąĖčģ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓ čüąĖą╝ąĄčéčĆč¢čŚ). ąóą░ą║ąĖą╣ ą▓ąĖą┐ą░ą┤ąŠą║ ąŠą┐čéąĖčćąĮąŠčŚ ą░ą║čéąĖą▓ąĮąŠčüčéč¢ ąĮą░ąĘąĖą▓ą░čöčéčīčüčÅ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░ ą░čüąĖą╝ąĄčéčĆč¢čÅ.










