
Каждому, вероятно, известно происхождение температурной шкалы Цельсия: за ее основу принят интервал между температурами кипения и замерзания воды, поделенный на сто равных частей – градусов.
Вода была избрана для такой цели как одно из самых распространенных на Земле веществ. Заменить ее в этом отношении могло бы множество других соединений или простых веществ, стоило только, взяв какое-то из них, определить для него две точки: плавления и парообразования, которые указывают для взятого вещества три интервала на оси температур, где оно находится в одном из трех агрегатных состояний – твердом, жидком или газообразном.
В одном из трех… Не задумывались ли вы, почему три, а не два или, скажем, пять? Чтобы ответить на этот вопрос, обратимся к теории молекулярного строения вещества.
Умозрительно можно представить себе два предельных варианта взаимодействия молекул: первый – когда они жестко связаны друг с другом, второй – когда между ними отсутствуют какие-либо связи.
–í –ø–µ—Ä–≤–æ–º —Å–ª—É—á–∞–µ –º–æ–ª–µ–∫—É–ª—ã, –∫–∞–∫ –Ω–µ—Ç—Ä—É–¥–Ω–æ –∑–∞–º–µ—Ç–∏—Ç—å, –∑–∞–Ω–∏–º–∞—é—Ç —Å—Ç—Ä–æ–≥–æ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—ã–µ –ø–æ–ª–æ–∂–µ–Ω–∏—è –≤ –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–µ –∏ –æ—Ç–Ω–æ—Å–∏—Ç–µ–ª—å–Ω–æ –º–∞–ª–æ –ø–æ–¥–≤–µ—Ä–∂–µ–Ω—ã –¥–µ–π—Å—Ç–≤–∏—é –≤–Ω–µ—à–Ω–∏—Ö —É—Å–ª–æ–≤–∏–π. –ß—Ç–æ–±—ã –∏–∑–º–µ–Ω–∏—Ç—å –ø–æ—Ä—è–¥–æ–∫ –∏—Ö —Å–æ—Ä–∞—Å–ø–æ–ª–æ–∂–µ–Ω–∏—è, –ø—Ä–∏—Ö–æ–¥–∏—Ç—Å—è –ø—Ä–∏–ª–∞–≥–∞—Ç—å –¥–æ–≤–æ–ª—å–Ω–æ –∑–Ω–∞—á–∏—Ç–µ–ª—å–Ω—ã–µ —É—Å–∏–ª–∏—è. –≠—Ç–æ –Ω–µ —á—Ç–æ –∏–Ω–æ–µ, –∫–∞–∫ —Ç–≤–µ—Ä–¥–æ–µ –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ.
–í–æ –≤—Ç–æ—Ä–æ–º —Å–ª—É—á–∞–µ –º–æ–ª–µ–∫—É–ª—ã, –æ—á–µ–≤–∏–¥–Ω–æ, –º–æ–≥—É—Ç –Ω–∞—Ö–æ–¥–∏—Ç—å—Å—è –¥—Ä—É–≥ –æ—Ç –¥—Ä—É–≥–∞ –Ω–∞ —Å–∫–æ–ª—å —É–≥–æ–¥–Ω–æ –±–æ–ª—å—à–∏—Ö —Ä–∞—Å—Å—Ç–æ—è–Ω–∏—è—Ö, –∏, —Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ, –≤ –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç–∏ –æ—Ç –≤–Ω–µ—à–Ω–∏—Ö —É—Å–ª–æ–≤–∏–π –≤–µ—â–µ—Å—Ç–≤–æ, –∏–º–∏ –æ–±—Ä–∞–∑–æ–≤–∞–Ω–Ω–æ–µ, –º–æ–∂–µ—Ç –∑–∞–Ω–∏–º–∞—Ç—å —Å–∞–º—ã–µ —Ä–∞–∑–ª–∏—á–Ω—ã–µ –æ–±—ä–µ–º—ã, –ø—Ä–∏—á–µ–º –ø–æ —Å–≤–æ–µ–º—É –∂–µ–ª–∞–Ω–∏—é –º—ã –º–æ–∂–µ–º –∏–∑–º–µ–Ω—è—Ç—å —ç—Ç–æ—Ç –æ–±—ä–µ–º –≤ —à–∏—Ä–æ–∫–∏—Ö –ø—Ä–µ–¥–µ–ª–∞—Ö. –≠—Ç–æ –Ω–µ —á—Ç–æ –∏–Ω–æ–µ, –∫–∞–∫ –≥–∞–∑–æ–æ–±—Ä–∞–∑–Ω–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ.
–í–æ–∑–º–æ–∂–µ–Ω –∏ –ø—Ä–æ–º–µ–∂—É—Ç–æ—á–Ω—ã–π –≤–∞—Ä–∏–∞–Ω—Ç, –ø—Ä–∏ –∫–æ—Ç–æ—Ä–æ–º —Å–∏–ª—ã –º–µ–∂–º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–≥–æ –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤–∏—è —Ç–∞–∫–æ–≤—ã, —á—Ç–æ –∏—Ö –æ–∫–∞–∑—ã–≤–∞–µ—Ç—Å—è –¥–æ—Å—Ç–∞—Ç–æ—á–Ω–æ –¥–ª—è —Ç–æ–≥–æ, —á—Ç–æ–±—ã –¥–µ—Ä–∂–∞—Ç—å —Å–∞–º–∏ –º–æ–ª–µ–∫—É–ª—ã –≤ –µ–¥–∏–Ω–æ–º –∞–Ω—Å–∞–º–±–ª–µ, –Ω–æ —É–∂–µ –Ω–µ —Ö–≤–∞—Ç–∞–µ—Ç –¥–ª—è —Ç–æ–≥–æ, —á—Ç–æ–±—ã –ø—Ä–∏–¥–∞—Ç—å —Ç–∞–∫–æ–º—É –∞–Ω—Å–∞–º–±–ª—é —Å—Ç—Ä–æ–≥—É—é —É–ø–æ—Ä—è–¥–æ—á–µ–Ω–Ω–æ—Å—Ç—å. –í –ø–æ–¥–æ–±–Ω–æ–º —Å–æ—Å—Ç–æ—è–Ω–∏–∏ –≤–µ—â–µ—Å—Ç–≤–æ –∑–∞–Ω–∏–º–∞–µ—Ç –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—ã–π –æ–±—ä–µ–º (–ø–æ—Å–∫–æ–ª—å–∫—É –º–æ–ª–µ–∫—É–ª—ã —Å–∫–æ–ª—å–∫–æ —É–≥–æ–¥–Ω–æ –¥–∞–ª–µ–∫–æ –¥—Ä—É–≥ –æ—Ç –¥—Ä—É–≥–∞ —Ä–∞–∑–±–µ–∂–∞—Ç—å—Å—è –Ω–µ –º–æ–≥—É—Ç), –æ–¥–Ω–∞–∫–æ –≤ —Å–∏–ª—É –∫—É–¥–∞ –±–æ–ª—å—à–µ–π, –Ω–µ–∂–µ–ª–∏ –≤ —Ç–≤–µ—Ä–¥–æ–º —Å–æ—Å—Ç–æ—è–Ω–∏–∏, –ø–æ–¥–≤–∏–∂–Ω–æ—Å—Ç–∏ –º–æ–ª–µ–∫—É–ª –æ–±—Ä–µ—Ç–∞–µ—Ç —Ç–æ–ª—å–∫–æ —Ç—É —Ñ–æ—Ä–º—É, –∫–æ—Ç–æ—Ä—É—é –ø—Ä–æ–¥–∏–∫—Ç—É—é—Ç –µ–º—É –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–µ–Ω–Ω—ã–µ –æ–≥—Ä–∞–Ω–∏—á–µ–Ω–∏—è (—Å–∫–∞–∂–µ–º, —Å—Ç–µ–Ω–∫–∏ —Å–æ—Å—É–¥–∞) –ø—Ä–µ–ø—è—Ç—Å—Ç–≤—É—é—â–∏–µ –¥–≤–∏–∂–µ–Ω–∏—é –º–æ–ª–µ–∫—É–ª. –ò –≤–µ—â–µ—Å—Ç–≤–æ –≤ —ç—Ç–æ–º —Å–ª—É—á–∞–µ –ø—Ä–∏–º–µ—Ç —Ñ–æ—Ä–º—É —Å–æ—Å—É–¥–∞, –≤ –∫–æ—Ç–æ—Ä–æ–º –Ω–∞—Ö–æ–¥–∏—Ç—Å—è. –≠—Ç–æ –Ω–µ —á—Ç–æ –∏–Ω–æ–µ, –∫–∞–∫ –∂–∏–¥–∫–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ.
–ï—Å–ª–∏ —Ä–∞—Å—Å–º–∞—Ç—Ä–∏–≤–∞—Ç—å —Å–º–µ–Ω—É –∞–≥—Ä–µ–≥–∞—Ç–Ω—ã—Ö —Å–æ—Å—Ç–æ—è–Ω–∏–π –ø–æ –º–µ—Ä–µ —Ç–æ–≥–æ, –∫–∞–∫ –ø–æ–≤—ã—à–∞–µ—Ç—Å—è —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –≤–µ—â–µ—Å—Ç–≤–∞, —Ç–æ –Ω–∞—á–∞—Ç—å, –æ—á–µ–≤–∏–¥–Ω–æ, –Ω–∞–¥–æ —Å —Ç–≤–µ—Ä–¥–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è, –≤ –∫–æ—Ç–æ—Ä–æ–º –º–µ–∂–¥—É –º–æ–ª–µ–∫—É–ª–∞–º–∏ –≤ –∏—Ö –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤–∏–∏ —Ä–µ–∞–ª–∏–∑—É–µ—Ç—Å—è –ø–æ–ª–Ω—ã–π –ø–æ—Ä—è–¥–æ–∫.
–¢–≤–µ—Ä–¥–æ–µ –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ
–ü–µ—Ä–≤—ã–π –≤–∞—Ä–∏–∞–Ω—Ç —Å–æ—Å—É—â–µ—Å—Ç–≤–æ–≤–∞–Ω–∏—è –º–æ–ª–µ–∫—É–ª –∫–∞–∫ —É–∂–µ –≥–æ–≤–æ—Ä–∏–ª–æ—Å—å, —ç—Ç–æ —Ç–∞–∫–æ–π, –ø—Ä–∏ –∫–æ—Ç–æ—Ä–æ–º, –∫–∞–∂–¥—ã–π —É—á–∞—Å—Ç–Ω–∏–∫ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–≥–æ –∞–Ω—Å–∞–º–±–ª—è –∑–∞–Ω–∏–º–∞–µ—Ç –¥–æ–≤–æ–ª—å–Ω–æ —É—Å—Ç–æ–π—á–∏–≤–æ–µ, —Ñ–∏–∫—Å–∏—Ä–æ–≤–∞–Ω–Ω–æ–µ –ø–æ–ª–æ–∂–µ–Ω–∏–µ –≤ –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–µ. –ü—Ä–∏ –¥–æ—Å—Ç–∞—Ç–æ—á–Ω–æ–º –æ—Ö–ª–∞–∂–¥–µ–Ω–∏–∏ —ç—Ç–æ–≥–æ –º–æ–∂–Ω–æ –¥–æ–±–∏—Ç—å—Å—è –¥–ª—è –ª—é–±–æ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞.
–û–∫–∞–∑—ã–≤–∞–µ—Ç—Å—è, –≤–µ—â–µ—Å—Ç–≤–∞ —Å —Ç–∞–∫–∏–º —Ç–∏–ø–æ–º –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤–∏—è –º–µ–∂–¥—É –º–æ–ª–µ–∫—É–ª–∞–º–∏ –º–æ–≥—É—Ç –±—ã—Ç—å –ø–æ–¥—Ä–∞–∑–¥–µ–ª–µ–Ω—ã –Ω–∞ –¥–≤–µ –±–æ–ª—å—à–∏–µ –≥—Ä—É–ø–ø—ã: –ø–µ—Ä–≤–∞—è – –∫–æ–≥–¥–∞, –∑–Ω–∞—è –ø–æ–ª–æ–∂–µ–Ω–∏–µ –≤ –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–µ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω–æ–π –∏ –ø—Ä–∏—Ç–æ–º –æ—Ç–Ω–æ—Å–∏—Ç–µ–ª—å–Ω–æ –Ω–µ–±–æ–ª—å—à–æ–π –≥—Ä—É–ø–ø—ã –º–æ–ª–µ–∫—É–ª (–∏–ª–∏ –∞—Ç–æ–º–æ–≤), –º–æ–∂–Ω–æ —Ç–æ—á–Ω–æ –ø—Ä–µ–¥—Å–∫–∞–∑–∞—Ç—å –∏ –ø–æ–ª–æ–∂–µ–Ω–∏–µ –¥—Ä—É–≥–∏—Ö —á–ª–µ–Ω–æ–≤ –∞–Ω—Å–∞–º–±–ª—è; –≤—Ç–æ—Ä–∞—è – –∫–æ–≥–¥–∞ –ø–æ–¥–æ–±–Ω–æ–µ –ø—Ä–µ–¥—Å–∫–∞–∑–∞–Ω–∏–µ –æ–∫–∞–∑—ã–≤–∞–µ—Ç—Å—è –Ω–µ–≤–æ–∑–º–æ–∂–Ω—ã–º.
–î–ª—è –ø–µ—Ä–≤–æ–π –≥—Ä—É–ø–ø—ã —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–æ —Ç–æ, —á—Ç–æ –ø–æ—Ä—è–¥–æ–∫ —Å–æ—Ä–∞—Å–ø–æ–ª–æ–∂–µ–Ω–∏—è –º–æ–ª–µ–∫—É–ª –∏–ª–∏ –∞—Ç–æ–º–æ–≤ –≤ –º–∞–ª–æ–º –æ–±—ä–µ–º–µ –≤–µ—â–µ—Å—Ç–≤–∞ –ø–æ—Å—Ç—É–ø–∞—Ç–µ–ª—å–Ω—ã–º –æ–±—Ä–∞–∑–æ–º —Ä–∞—Å–ø—Ä–æ—Å—Ç—Ä–∞–Ω—è–µ—Ç—Å—è –Ω–∞ –≤—Å—é –µ–≥–æ —Ç–æ–ª—â—É. –ó–¥–µ—Å—å –≥–æ—Å–ø–æ–¥—Å—Ç–≤—É–µ—Ç, –µ—Å–ª–∏ –ø—Ä–∏–±–µ–≥–Ω—É—Ç—å –∫ —Å—Ç—Ä–æ–≥–æ–º—É —Ç–µ—Ä–º–∏–Ω—É, –¥–∞–ª—å–Ω–∏–π –ø–æ—Ä—è–¥–æ–∫. –£ –≤–µ—â–µ—Å—Ç–≤ –≤—Ç–æ—Ä–æ–π –≥—Ä—É–ø–ø—ã –¥–∞–ª—å–Ω–µ–≥–æ –ø–æ—Ä—è–¥–∫–∞ –Ω–µ—Ç. –í –ø–µ—Ä–≤–æ–º —Å–ª—É—á–∞–µ –≥–æ–≤–æ—Ä—è—Ç, —á—Ç–æ –≤–µ—â–µ—Å—Ç–≤–æ –æ–±–ª–∞–¥–∞–µ—Ç —Ç–æ–π –∏–ª–∏ –∏–Ω–æ–π –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–π —Ä–µ—à–µ—Ç–∫–æ–π. –ï–µ –Ω–∞–∏–º–µ–Ω—å—à–∏–π —Ñ—Ä–∞–≥–º–µ–Ω—Ç, –ø–æ–≤—Ç–æ—Ä–µ–Ω–∏–µ–º –∫–æ—Ç–æ—Ä–æ–≥–æ –º–æ–∂–Ω–æ –æ–±—Ä–∞–∑–æ–≤–∞—Ç—å –µ–µ –≤—Å—é, –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è —è—á–µ–π–∫–æ–π —Ä–µ—à–µ—Ç–∫–∏.
Логично предположить, что вещества первого типа при переходе в твердое состояние будут принимать какие-то строго определенные формы (связанные со строением решетки) – кристаллические вещества; а вот вещества второго типа четких форм образовывать не будут и скорее всего станут выделяться в виде бесформенных масс – аморфные вещества.
Примерами кристаллических веществ могут служить поваренная соль и квасцы, кристаллизующиеся соответственно в форме квасцов и октаэдров, вещества второго типа – клей, каучук, стекло.
–ö–æ–≥–¥–∞ –º—ã –±—É–¥–µ–º –Ω–∞–≥—Ä–µ–≤–∞—Ç—å –≤–µ—â–µ—Å—Ç–≤–∞ –æ–±–æ–∏—Ö —Ç–∏–ø–æ–≤, —Ç–æ –≤ –ø–µ—Ä–≤–æ–º —Å–ª—É—á–∞–µ —Å–≤—è–∑–∏ –º–µ–∂–¥—É –º–æ–ª–µ–∫—É–ª–∞–º–∏ (–∞ —Å—Ç–∞–ª–æ –±—ã—Ç—å, –∏ –≤—Å—è –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∞—è —Ä–µ—à–µ—Ç–∫–∞) –≤ —Ä–∞–∑–Ω—ã—Ö –º–µ—Å—Ç–∞—Ö –±—É–¥—É—Ç —Ä–∞–∑—Ä—É—à–∞—Ç—å—Å—è –æ–¥–Ω–æ–≤—Ä–µ–º–µ–Ω–Ω–æ, –ø–æ—Å–∫–æ–ª—å–∫—É –æ–Ω–∏ —Å–æ–≤–µ—Ä—à–µ–Ω–Ω–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–Ω—ã, –∏ –ø–µ—Ä–µ—Ö–æ–¥ –∏–∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è –≤ –∂–∏–¥–∫–æ–µ –ø—Ä–æ–∏–∑–æ–π–¥–µ—Ç –ø—Ä–∏ —Å—Ç—Ä–æ–≥–æ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω–æ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ. –í–æ –≤—Ç–æ—Ä–æ–º —Å–ª—É—á–∞–µ –ø—Ä–∏ –∫–∞–∫–æ–π-—Ç–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ —á–∞—Å—Ç—å –º–æ–ª–µ–∫—É–ª –ø—Ä–∏–æ–±—Ä–µ—Ç–∞–µ—Ç —Å–ø–æ—Å–æ–±–Ω–æ—Å—Ç—å –∫ –±–æ–ª–µ–µ –∏–ª–∏ –º–µ–Ω–µ–µ —Å–≤–æ–±–æ–¥–Ω–æ–º—É –ø–µ—Ä–µ–º–µ—â–µ–Ω–∏—é, –¥—Ä—É–≥–∞—è –∂–µ –µ—â–µ –Ω–µ—Ç (—Å–≤—è–∑–∏-—Ç–æ –º–µ–∂–¥—É –º–æ–ª–µ–∫—É–ª–∞–º–∏ –∏–∑-–∑–∞ –æ—Ç—Å—É—Ç—Å—Ç–≤–∏—è —á–µ—Ç–∫–∏—Ö –∑–∞–∫–æ–Ω–æ–º–µ—Ä–Ω–æ—Å—Ç–µ–π –≤ –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–µ–Ω–Ω–æ–π –æ—Ä–∏–µ–Ω—Ç–∞—Ü–∏–∏ –Ω–µ—ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–Ω—ã –¥—Ä—É–≥ –¥—Ä—É–≥—É!), –∏ –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ –ø–µ—Ä–µ—Ö–æ–¥ –∏–∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è –≤ –∂–∏–¥–∫–æ–µ –æ–∫–∞–∂–µ—Ç—Å—è —Ä–∞—Å—Ç—è–Ω—É—Ç—ã–º –Ω–∞ –∫–∞–∫–æ–π-—Ç–æ –¥–∏–∞–ø–∞–∑–æ–Ω —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä. –£ –∞–º–æ—Ä—Ñ–Ω—ã—Ö —Ç–µ–ª –ø—Ä–æ—Å—Ç–æ –Ω–µ —É–¥–∞–µ—Ç—Å—è —á–µ—Ç–∫–æ —Ä–∞–∑–¥–µ–ª–∏—Ç—å –¥–≤–∞ —ç—Ç–∏—Ö –∞–≥—Ä–µ–≥–∞—Ç–Ω—ã—Ö —Å–æ—Å—Ç–æ—è–Ω–∏—è.
–°–∫–∞–∂–µ–º, –ø—Ä–∏ 1200*–° –æ–∫–æ–Ω–Ω–æ–µ —Å—Ç–µ–∫–ª–æ –ø–æ—Ö–æ–∂–µ –Ω–∞ —Å–∞—Ö–∞—Ä–Ω—ã–π —Å–∏—Ä–æ–ø, –ø—Ä–∏ 900*–° –Ω–∞—á–∏–Ω–∞–µ—Ç —Ç—è–Ω—É—Ç—å—Å—è –≤ –Ω–∏—Ç–∏, –∞ –ø—Ä–∏ 800*–° –Ω–∞–ø–æ–º–∏–Ω–∞–µ—Ç —Å–∏–ª—å–Ω–æ –∑–∞–≥—É—Å—Ç–µ–≤—à–∏–π –º–µ–¥.
–°–ª–µ–¥—É–µ—Ç –æ—Ç–º–µ—Ç–∏—Ç—å, —á—Ç–æ –Ω–µ–∫–æ—Ç–æ—Ä—ã–µ –≤–µ—â–µ—Å—Ç–≤–∞ –≤ –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç–∏ –æ—Ç —É—Å–ª–æ–≤–∏–π –ø–µ—Ä–µ—Ö–æ–¥–∞ –≤ —Ç–≤–µ—Ä–¥–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ –º–æ–≥—É—Ç –±—ã—Ç—å –ø–æ–ª—É—á–µ–Ω—ã –∫–∞–∫ –≤ —Ç–æ–º, —Ç–∞–∫ –∏ –≤ –¥—Ä—É–≥–æ–º –≤–∞—Ä–∏–∞–Ω—Ç–µ. –°–∫–∞–∂–µ–º, –¥–≤—É–æ–∫–∏—Å—å –∫—Ä–µ–º–Ω–∏—è –≤ –ø—Ä–∏—Ä–æ–¥–µ –≤—Å—Ç—Ä–µ—á–∞–µ—Ç—Å—è –≤ –≤–∏–¥–µ –∫—Ä–∞—Å–∏–≤—ã—Ö –¥—Ä—É–∑ –≥–æ—Ä–Ω–æ–≥–æ —Ö—Ä—É—Å—Ç–∞–ª—è, –æ–¥–Ω–∞–∫–æ –ø—Ä–∏ –æ—Ö–ª–∞–∂–¥–µ–Ω–∏–∏ –µ–µ —Ä–∞—Å–ø–ª–∞–≤–∞ —Å—Ä–∞–≤–Ω–∏—Ç–µ–ª—å–Ω–æ –ª–µ–≥–∫–æ –ø–æ–ª—É—á–∞–µ—Ç—Å—è –∏ –∞–º–æ—Ä—Ñ–Ω–∞—è –º–∞—Å—Å–∞, –≤ –∫–æ—Ç–æ—Ä–æ–π –Ω–µ—Ç—Ä—É–¥–Ω–æ —É–∑–Ω–∞—Ç—å —Ö–æ—Ä–æ—à–æ –≤—Å–µ–º –∏–∑–≤–µ—Å—Ç–Ω–æ–µ —Å—Ç–µ–∫–ª–æ.
–ò –≤–æ—Ç —á—Ç–æ –µ—â–µ —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–æ: –ø—Ä–∏ –ø–æ–¥–æ–±–Ω–æ–π –¥–≤–æ–π—Å—Ç–≤–µ–Ω–Ω–æ—Å—Ç–∏ –ø–ª–æ—Ç–Ω–æ—Å—Ç—å –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏—Ö –≤–µ—â–µ—Å—Ç–≤ –ø—Ä–∞–∫—Ç–∏—á–µ—Å–∫–∏ –æ–∫–∞–∑—ã–≤–∞–µ—Ç—Å—è –≤—ã—à–µ —Ç–∞–∫–æ–≤–æ–π –¥–ª—è —Ç–µ–ª –∞–º–æ—Ä—Ñ–Ω—ã—Ö. –í —á–µ–º —Ç—É—Ç –¥–µ–ª–æ? –ß—Ç–æ–±—ã —Ä–∞–∑–æ–±—Ä–∞—Ç—å—Å—è –≤ —ç—Ç–æ–º –≤–æ–ø—Ä–æ—Å–µ, –ø—Ä–∏–ø–æ–º–Ω–∏—Ç–µ, –∫–∞–∫ –≤ –ø–æ—Å–ª–µ–¥–Ω–∏–π —Ä–∞–∑ –≤—ã –Ω–∞–≤–æ–¥–∏–ª–∏ —Å—Ç—Ä–æ–≥–∏–π –ø–æ—Ä—è–¥–æ–∫ –≤ —Å–≤–æ–µ–º –∫–Ω–∏–∂–Ω–æ–º —à–∫–∞—Ñ—É. –ü–ª–æ—Ç–Ω–æ —Å–æ—Å—Ç–∞–≤–ª—è—è –∫–Ω–∏–≥–∏ –≤ —Å—Ç—Ä–æ–π–Ω—ã–µ —à–µ—Ä–µ–Ω–≥–∏, –≤—ã –¥–æ—Å—Ç–∏–≥–∞–ª–∏ –∑–Ω–∞—á–∏—Ç–µ–ª—å–Ω–æ–≥–æ –≤—ã–∏–≥—Ä—ã—à–∞ –≤ –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–µ, –Ω–µ –ø—Ä–∞–≤–¥–∞ –ª–∏? –¢–∞–∫ –∂–µ –∏ –≤ –º–∏—Ä–µ –º–æ–ª–µ–∫—É–ª: –≤ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–º –≤–µ—â–µ—Å—Ç–≤–µ –±–æ–ª–µ–µ —á–µ—Ç–∫–∞—è –∏ –≤ —Å–∏–ª—É —ç—Ç–æ–≥–æ –æ–±—ã—á–Ω–æ –∏ –±–æ–ª–µ–µ –ø–ª–æ—Ç–Ω–∞—è —É–ø–∞–∫–æ–≤–∫–∞ –º–æ–ª–µ–∫—É–ª: –æ–¥–Ω–æ –∏ —Ç–æ –∂–µ –∏—Ö –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –∑–∞–Ω–∏–º–∞–µ—Ç –º–µ–Ω—å—à–µ –º–µ—Å—Ç–∞, –∞ –≤—Å–ª–µ–¥—Å—Ç–≤–∏–µ —ç—Ç–æ–≥–æ –∏ –ø–ª–æ—Ç–Ω–æ—Å—Ç—å –≤–µ—â–µ—Å—Ç–≤–∞ –≤—ã—à–µ, —á–µ–º —Ç–æ–≥–¥–∞, –∫–æ–≥–¥–∞ –º–æ–ª–µ–∫—É–ª—ã –æ—Ä–∏–µ–Ω—Ç–∏—Ä–æ–≤–∞–Ω—ã –≤ –±–µ—Å–ø–æ—Ä—è–¥–∫–µ.
–í –∂–∏—Ç–µ–π—Å–∫–æ–π –ø—Ä–∞–∫—Ç–∏–∫–µ –≤—Å—è–∫–∏–π –∑–¥—Ä–∞–≤–æ–º—ã—Å–ª—è—â–∏–π —á–µ–ª–æ–≤–µ–∫ —Å—Ç—Ä–µ–º–∏—Ç—Å—è —É–ª–æ–∂–∏—Ç—å —Å–≤–æ–µ –∫–Ω–∏–∂–Ω–æ–µ –±–æ–≥–∞—Ç—Å—Ç–≤–æ –ø–æ–∞–∫–∫—É—Ä–∞—Ç–Ω–µ–µ. –ê–Ω–∞–ª–æ–≥–∏—á–Ω–æ–µ –ø—Ä–æ–∏—Å—Ö–æ–¥–∏—Ç –∏ —Å –º–æ–ª–µ–∫—É–ª–∞–º–∏ – –æ–Ω–∏ —Ç–∞–∫–∂–µ —Å—Ç—Ä–µ–º—è—Ç—Å—è —É–ø–æ—Ä—è–¥–æ—á–∏—Ç—å —Å–≤–æ—é –æ—Ä–∏–µ–Ω—Ç–∞—Ü–∏—é –≤ –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–µ. –ü—Ä–æ–∏—Å—Ö–æ–¥–∏—Ç —ç—Ç–æ –≤ —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤–∏–∏ —Å –æ–±—â–∏–º –∑–∞–∫–æ–Ω–æ–º —Ñ–∏–∑–∏–∫–∏, —Å–æ–≥–ª–∞—Å–Ω–æ –∫–æ—Ç–æ—Ä–æ–º—É, –±–æ–ª–µ–µ —É–ø–æ—Ä—è–¥–æ—á–µ–Ω–Ω–∞—è —Å–∏—Å—Ç–µ–º–∞ –æ–±–ª–∞–¥–∞–µ—Ç –∏ –Ω–∞–∏–º–µ–Ω—å—à–µ–π —ç–Ω–µ—Ä–≥–∏–µ–π —Å—Ä–µ–¥–∏ –≤–æ–æ–±—â–µ –≤–æ–∑–º–æ–∂–Ω—ã—Ö —Å–∏—Å—Ç–µ–º –æ—Ä–∏–µ–Ω—Ç–∞—Ü–∏–∏ –º–æ–ª–µ–∫—É–ª –¥—Ä—É–≥ –æ—Ç–Ω–æ—Å–∏—Ç–µ–ª—å–Ω–æ –¥—Ä—É–≥–∞. –¢–µ—á–µ–Ω–∏–µ –ø—Ä–∏—Ä–æ–¥–Ω—ã—Ö –ø—Ä–æ—Ü–µ—Å—Å–æ–≤ –Ω–∞–ø—Ä–∞–≤–ª–µ–Ω–æ –∫ –º–∏–Ω–∏–º—É–º—É —ç–Ω–µ—Ä–≥–∏–∏. –ü–æ—ç—Ç–æ–º—É –∞–º–æ—Ä—Ñ–Ω—ã–µ —Ç–µ–ª–∞ –≤ –±–æ–ª—å—à–∏–Ω—Å—Ç–≤–µ —Å–ª—É—á–∞–µ–≤ –ø–µ—Ä–µ—Ö–æ–¥—è—Ç —Å–æ –≤—Ä–µ–º–µ–Ω–µ–º –≤ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏–µ. –ò–Ω–æ–≥–¥–∞ —ç—Ç–æ —Å–ª—É—á–∞–µ—Ç—Å—è —Å—Ä–∞–≤–Ω–∏—Ç–µ–ª—å–Ω–æ –±—ã—Å—Ç—Ä–æ: –Ω–∞–ø—Ä–∏–º–µ—Ä, –∞–º–æ—Ä—Ñ–Ω–∞—è –ø–ª–∞—Å—Ç–∏—á–µ—Å–∫–∞—è —Å–µ—Ä–∞, –ø–æ–ª—É—á–∞–µ–º–∞—è –ø—Ä–∏ –≤–ª–∏–≤–∞–Ω–∏–∏ –∂–∏–¥–∫–æ–π —Å–µ—Ä—ã –≤ —Ö–æ–ª–æ–¥–Ω—É—é –≤–æ–¥—É –∏ –∏–º–µ—é—â–∞—è –≤–∏–¥ —Ä–µ–∑–∏–Ω–æ–ø–æ–¥–æ–±–Ω–æ–π –º–∞—Å—Å—ã, –æ–±—Ä–µ—Ç–∞–µ—Ç –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ —á–µ—Ä–µ–∑ –¥–≤–∞-—Ç—Ä–∏ —á–∞—Å–∞. –ù–æ –∏–Ω–æ–π —Ä–∞–∑ —Ç–∞–∫–æ–µ –ø—Ä–µ–≤—Ä–∞—â–µ–Ω–∏–µ —Ä–∞—Å—Ç—è–≥–∏–≤–∞–µ—Ç—Å—è –Ω–∞ –Ω–µ–æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω–æ –¥–æ–ª–≥–∏–π —Å—Ä–æ–∫. –•–æ—Ä–æ—à–∏–π —Ç–æ–º—É –ø—Ä–∏–º–µ—Ä – —Å—Ç–µ–∫–ª–æ. –ê—Ä—Ö–µ–æ–ª–æ–≥–∏ –º–æ–≥—É—Ç –ø—Ä–µ–¥—ä—è–≤–∏—Ç—å –≤–µ—Å—å–º–∞ –¥—Ä–µ–≤–Ω–∏–µ —É–∫—Ä–∞—à–µ–Ω–∏—è –∏–∑ –Ω–µ–≥–æ, —Å–æ—Ö—Ä–∞–Ω–∏–≤—à–∏–µ —Å–≤–æ–π –ø—Ä–∏–≤–ª–µ–∫–∞—Ç–µ–ª—å–Ω—ã–π –≤–∏–¥ –∏ –¥–æ–∫–∞–∑—ã–≤–∞—é—â–∏–µ —Ç–µ–º —Å–∞–º—ã–º, —á—Ç–æ –∑–∞ –∏—Å—Ç–µ–∫—à–∏–µ —Å—Ç–æ–ª–µ—Ç–∏—è —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ —Å—Ç–µ–∫–ª–∞ –æ—Å—Ç–∞–ª–∞—Å—å –Ω–µ–∏–∑–º–µ–Ω–Ω–æ–π. –ù–æ –∏–Ω–æ–≥–¥–∞ –æ—Ç —É–¥–∞—Ä–∞ –∏–ª–∏ –ø–æ–¥–æ–±–Ω—ã—Ö –≤–æ–∑–¥–µ–π—Å—Ç–≤–∏–π —Å—Ç–µ–∫–ª–æ –º—É—Ç–Ω–µ–µ—Ç, –∫–∞–∫ –≥–æ–≤–æ—Ä—è—Ç, —Ä–∞—Å—Å—Ç–µ–∫–ª–æ–≤—ã–≤–∞–µ—Ç—Å—è: –≤ –Ω–µ–º –æ–±—Ä–∞–∑—É—é—Ç—Å—è –∫—Ä–∏—Å—Ç–∞–ª–ª—ã, –±–µ—Å–ø–æ—Ä—è–¥–æ—á–Ω–æ –æ—Ä–∏–µ–Ω—Ç–∏—Ä–æ–≤–∞–Ω–Ω—ã–µ –¥—Ä—É–≥ –ø–æ –æ—Ç–Ω–æ—à–µ–Ω–∏—é –∫ –¥—Ä—É–≥—É –∏ –æ—Ç—Ç–æ–≥–æ —Ö–∞–æ—Ç–∏—á–µ—Å–∫–∏ —Ä–∞—Å—Å–µ–∏–≤–∞—é—â–∏–µ —Å–≤–µ—Ç.
–í –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç–∏ –æ—Ç —É—Å–ª–æ–≤–∏–π –∫—Ä–∏—Å—Ç–∞–ª–ª–∏–∑–∞—Ü–∏–∏ —Ä—è–¥ –≤–µ—â–µ—Å—Ç–≤ –º–æ–∂–µ—Ç –±—ã—Ç—å –≤—ã–¥–µ–ª–µ–Ω –Ω–µ –≤ –æ–¥–Ω–æ–º, –∞ –≤ –¥–≤—É—Ö –∏–ª–∏ –¥–∞–∂–µ –±–æ–ª—å—à–µ–º —á–∏—Å–ª–µ –≤–∏–¥–æ–≤. –ù–∞–ø—Ä–∏–º–µ—Ä, –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏–∑–∞—Ü–∏–∏ (114*–°) —Å–µ—Ä–∞ –≤—ã–¥–µ–ª—è–µ—Ç—Å—è –≤ –≤–∏–¥–µ –±–ª–µ–¥–Ω–æ-–∂–µ–ª—Ç—ã—Ö –∫—Ä–∏—Å—Ç–∞–ª–ª–æ–≤, –∞ –ø—Ä–∏ –æ—Ö–ª–∞–∂–¥–µ–Ω–∏–∏ –¥–æ 96*–° –æ–±—Ä–∞–∑—É—é—Ç—Å—è –∫—Ä–∏—Å—Ç–∞–ª–ª—ã —è—Ä–∫–æ-–∂–µ–ª—Ç–æ–≥–æ —Ü–≤–µ—Ç–∞ –∏ –Ω–µ—Å–∫–æ–ª—å–∫–æ –∏–Ω–æ–π —Ñ–æ—Ä–º—ã (—ç—Ç—É –∏—Ö –º–æ–¥–∏—Ñ–∏–∫–∞—Ü–∏—é –Ω–∞–∑—ã–≤–∞—é—Ç —Ä–æ–º–±–∏—á–µ—Å–∫–æ–π – –≤ –æ—Ç–ª–∏—á–∏–µ –æ—Ç –ø—Ä–µ–∂–Ω–µ–π, –∏–º–µ–Ω—É–µ–º–æ–π –º–æ–Ω–æ–∫–ª–∏–Ω–Ω–æ–π). –ï—â–µ –±–æ–ª–µ–µ –Ω–∞–≥–ª—è–¥–Ω—ã–µ –ø—Ä–∏–º–µ—Ä—ã —Ç–æ–≥–æ –∂–µ —Ä–æ–¥–∞ – –≥—Ä–∞—Ñ–∏—Ç –∏ –∞–ª–º–∞–∑. –°–ø–æ—Å–æ–±–Ω–æ—Å—Ç—å –≤–µ—â–µ—Å—Ç–≤ —Å—É—â–µ—Å—Ç–≤–æ–≤–∞—Ç—å –≤ –≤–∏–¥–µ –Ω–µ—Å–∫–æ–ª—å–∫–∏—Ö –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏—Ö —Ñ–æ—Ä–º –ø–æ–ª—É—á–∏–ª–∞ –Ω–∞–∑–≤–∞–Ω–∏–µ –ø–æ–ª–∏–º–æ—Ä—Ñ–∏–∑–º.
При перестройке кристаллической решетки нередко изменяется и окраска вещества. Это порою используется на практике при изготовлении специальных индикаторов температуры: когда она достигает определенного значения, изменившийся цвет наглядно «докладывает» об этом.
–ü—Ä–∏—á–∏–Ω–æ–π –æ–ø–∏—Å–∞–Ω–Ω–æ–≥–æ —Ä–∞–∑–Ω–æ–æ–±—Ä–∞–∑–∏—è —è–≤–ª—è–µ—Ç—Å—è —Ç–æ, —á—Ç–æ —è—á–µ–π–∫–∞ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–π —Ä–µ—à–µ—Ç–∫–∏ —É –Ω–µ–∫–æ—Ç–æ—Ä—ã—Ö –≤–µ—â–µ—Å—Ç–≤ –º–æ–∂–µ—Ç –ø—Ä–∏–Ω–∞–¥–ª–µ–∂–∞—Ç—å –∫ —Ä–∞–∑–Ω—ã–º —Ç–∏–ø–∞–º. –ö–∞–∫–æ–π –∏–∑ –Ω–∏—Ö —Ä–µ–∞–ª–∏–∑–æ–≤–∞–Ω –≤ –∫–æ–Ω–∫—Ä–µ—Ç–Ω–æ–º –æ–±—Ä–∞–∑—Ü–µ –≤–µ—â–µ—Å—Ç–≤–∞, –ª–µ–≥—á–µ –≤—Å–µ–≥–æ –æ–ø—Ä–µ–¥–µ–ª–∏—Ç—å –ø—É—Ç–µ–º —Ä–µ–Ω—Ç–≥–µ–Ω–æ—Å—Ç—Ä—É–∫—Ç—É—Ä–Ω–æ–≥–æ –∞–Ω–∞–ª–∏–∑–∞. –í—Å–µ–≥–æ —Ç–∞–∫–∏—Ö —Ç–∏–ø–æ–≤ 230. –í–ø–µ—Ä–≤—ã–µ –ø—É—Ç–µ–º —Å—Ç—Ä–æ–≥–æ–≥–æ –º–∞—Ç–µ–º–∞—Ç–∏—á–µ—Å–∫–æ–≥–æ —Ä–∞—Å—á–µ—Ç–∞ –∏—Ö —Ä–∞—Å—Å—á–∏—Ç–∞–ª –≤ 1890 –≥–æ–¥—É –∫—Ä–∏—Å—Ç–∞–ª–ª–æ–≥—Ä–∞—Ñ –ï.–°. –§–µ–¥–æ—Ä–æ–≤. –ù–µ—Å–∫–æ–ª—å–∫–æ —Ä–∞–Ω–µ–µ —Ñ—Ä–∞–Ω—Ü—É–∑—Å–∫–∏–π –∫—Ä–∏—Å—Ç–∞–ª–ª–æ–≥—Ä–∞—Ñ –û. –ë—Ä–∞–≤—ç –æ–±–Ω–∞—Ä—É–∂–∏–ª, —á—Ç–æ —Å—É—â–µ—Å—Ç–≤—É–µ—Ç –≤—Å–µ–≥–æ 14 –≤–∞—Ä–∏–∞–Ω—Ç–æ–≤ –æ—Ä–∏–µ–Ω—Ç–∞—Ü–∏–∏ –∞—Ç–æ–º–æ–≤ –≤ —É–∑–ª–∞—Ö –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–π —Ä–µ—à–µ—Ç–∫–∏. –ó–∞–º–µ—Ç–∏–º, —á—Ç–æ –æ–±–µ —ç—Ç–∏ —Ä–∞–±–æ—Ç—ã: –ø–æ—è–≤–∏–ª–∏—Å—å –Ω–∞ —Å–≤–µ—Ç –≤ —Ç–æ –≤—Ä–µ–º—è, –∫–æ–≥–¥–∞ –Ω–µ —Å—É—â–µ—Å—Ç–≤–æ–≤–∞–ª–æ –Ω–µ —Ç–æ–ª—å–∫–æ —Ä–µ–Ω—Ç–≥–µ–Ω–æ—Å—Ç—Ä—É–∫—Ç—É—Ä–Ω–æ–≥–æ –∞–Ω–∞–ª–∏–∑–∞, –Ω–æ, –±–æ–ª–µ–µ —Ç–æ–≥–æ, –∫–æ–≥–¥–∞ –º–Ω–æ–≥–∏–µ —É—á–µ–Ω—ã–µ —Å—á–∏—Ç–∞–ª–∏ —Å–æ–º–Ω–∏—Ç–µ–ª—å–Ω—ã–º, —Å–∞–º–æ —Å—É—â–µ—Å—Ç–≤–æ–≤–∞–Ω–∏–µ –∞—Ç–æ–º–æ–≤ –∏ –º–æ–ª–µ–∫—É–ª!

–°–∫–∞–∂–µ–º, –ø–æ–≤–∞—Ä–µ–Ω–Ω–∞—è —Å–æ–ª—å –∏–º–µ–µ—Ç –∫—É–±–∏—á–µ—Å–∫—É—é –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫—É—é —Ä–µ—à–µ—Ç–∫—É, –≤ –∫–æ—Ç–æ—Ä–æ–π –∏–æ–Ω—ã –Ω–∞—Ç—Ä–∏—è –∏ —Ö–ª–æ—Ä–∞ —Ä–∞—Å–ø–æ–ª–∞–≥–∞—é—Ç—Å—è –≤ –≤–µ—Ä—à–∏–Ω–∞—Ö –∫—É–±–∞. –£ –∞–ª–º–∞–∑–∞ –∞—Ç–æ–º—ã —É–≥–ª–µ—Ä–æ–¥–∞ —Å–∞–¥—è—Ç—Å—è –ø–æ –≤–µ—Ä—à–∏–Ω–∞–º —Ç–µ—Ç—Ä–∞—ç–¥—Ä–∞. –¢–µ—Ç—Ä–∞—ç–¥—Ä –∂–µ – —Ñ–∏–≥—É—Ä–∞ –∂–µ—Å—Ç–∫–∞—è, –µ–≥–æ –∫–æ–Ω—Ñ–∏–≥—É—Ä–∞—Ü–∏—é –Ω–µ –∏–∑–º–µ–Ω–∏—à—å, –Ω–µ –¥–µ—Ñ–æ—Ä–º–∏—Ä—É—è –µ–≥–æ —Ä–µ–±–µ—Ä (–≤ –æ—Ç–ª–∏—á–∏–µ, —Å–∫–∞–∂–µ–º, –æ—Ç –∫—É–±–∞, –∫–æ—Ç–æ—Ä—ã–π –º–æ–∂–µ—Ç –±—ã—Ç—å –ª–µ–≥–∫–æ –¥–µ—Ñ–æ—Ä–º–∏—Ä–æ–≤–∞–Ω –≤ –ø–∞—Ä–∞–ª–ª–µ–ª–µ–ø–∏–ø–µ–¥). –ù–µ—É–¥–∏–≤–∏—Ç–µ–ª—å–Ω–æ, —á—Ç–æ –∞–ª–º–∞–∑ —è–≤–ª—è–µ—Ç—Å—è —á–µ–º–ø–∏–æ–Ω–æ–º –ø–æ —Ç–≤–µ—Ä–¥–æ—Å—Ç–∏ –≤ –º–∏—Ä–µ –∫—Ä–∏—Å—Ç–∞–ª–ª–æ–≤. –¢–µ—Ç—Ä–∞—ç–¥—Ä–∏—á–µ—Å–∫—É—é —Å—Ç—Ä—É–∫—Ç—É—Ä—É —Ä–µ—à–µ—Ç–∫–∏ –∏–º–µ—é—Ç –º–Ω–æ–≥–∏–µ —Å–≤–µ—Ä—Ö—Ç–≤–µ—Ä–¥—ã–µ –≤–µ—â–µ—Å—Ç–≤–∞ – –±–æ—Ä–∞–∑–æ–Ω BN, –∫–∞—Ä–±–æ—Å–∏–ª–∏—Ü–∏–π SiC. –ö—Å—Ç–∞—Ç–∏ –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ –º–∏–Ω—É—Å -150*–° –∏ –Ω–∏–∂–µ —Å—É—â–µ—Å—Ç–≤—É–µ—Ç –∫—É–±–∏—á–µ—Å–∫–∏–π –ª–µ–¥, —Å–≤—è–∑–∏ –º–µ–∂–¥—É –º–æ–ª–µ–∫—É–ª–∞–º–∏ –≤–æ–¥—ã –≤ –∫–æ—Ç–æ—Ä–æ–º —Ç–æ—á—å-–≤-—Ç–æ—á—å —Ç–∞–∫–∏–µ –∂–µ, –∫–∞–∫ –∏ –º–µ–∂–¥—É –∞—Ç–æ–º–∞–º–∏ —É–≥–ª–µ—Ä–æ–¥–∞ –≤ –∞–ª–º–∞–∑–µ. –¢–∞–∫–æ–π –ª–µ–¥ –∑–Ω–∞—á–∏—Ç–µ–ª—å–Ω–æ —Ç–≤–µ—Ä–∂–µ –ª—å–¥–∞ –æ–±—ã—á–Ω–æ–≥–æ.
–ù–∞–¥–æ —Å–∫–∞–∑–∞—Ç—å, —á—Ç–æ —Å–æ—Å—Ç–∞–≤–Ω—ã–µ —ç–ª–µ–º–µ–Ω—Ç—ã –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏—Ö —Ä–µ—à–µ—Ç–æ–∫, –±—É–¥—å —Ç–æ –∞—Ç–æ–º—ã (–∫–∞–∫ –≤ –∞–ª–º–∞–∑–µ), –∏–æ–Ω—ã (–≤ –∫–≤–∞—Å—Ü–∞—Ö) –∏–ª–∏ –∂–µ –º–æ–ª–µ–∫—É–ª—ã (–≤ –≤–æ–¥–µ), –Ω–µ –∑–∞–∫—Ä–µ–ø–ª–µ–Ω—ã –Ω–∞ —Å–≤–æ–∏—Ö –º–µ—Å—Ç–∞—Ö –∞–±—Å–æ–ª—é—Ç–Ω–æ –∂–µ—Å—Ç–∫–æ, –≤—Å–µ–≥–¥–∞ –Ω–∞—Ö–æ–¥—è—Ç—Å—è –≤ –∫–æ–ª–µ–±–∞—Ç–µ–ª—å–Ω–æ–º –¥–≤–∏–∂–µ–Ω–∏–∏, –ø–æ–¥–æ–±–Ω–æ —á–∞—Å–æ–≤–æ–º—É –º–∞—è—Ç–Ω–∏–∫—É, –æ—Ç–Ω–æ—Å–∏—Ç–µ–ª—å–Ω–æ –Ω–µ–∫–∏—Ö —Å—Ä–µ–¥–Ω–∏—Ö –ø–æ–ª–æ–∂–µ–Ω–∏–π, –ø—Ä–∏—á–µ–º —ç—Ç–æ –¥–≤–∏–∂–µ–Ω–∏–µ –Ω–µ –∑–∞–º–∏—Ä–∞–µ—Ç –¥–∞–∂–µ –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ –∞–±—Å–æ–ª—é—Ç–Ω–æ–≥–æ –Ω—É–ª—è. –ï—Å—Ç–µ—Å—Ç–≤–µ–Ω–Ω–æ, —á—Ç–æ —Å –ø–æ–≤—ã—à–µ–Ω–∏–µ–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã –∞–º–ø–ª–∏—Ç—É–¥–∞ —Ç–∞–∫–∏—Ö –∫–æ–ª–µ–±–∞–Ω–∏–π —Ä–∞—Å—Ç–µ—Ç, –∞ –ø–æ—ç—Ç–æ–º—É –º–æ–∂–Ω–æ –æ–∂–∏–¥–∞—Ç—å, —á—Ç–æ –∏ –∞—Ä—Ö–∏—Ç–µ–∫—Ç—É—Ä–∞ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏—Ö —Ä–µ—à–µ—Ç–æ–∫ —Ç–æ–∂–µ –±—É–¥–µ—Ç –∏–∑–º–µ–Ω—è—Ç—å—Å—è. –û–¥–∏–Ω –∏–∑ —Ç–∞–∫–∏—Ö –ø—Ä–∏–º–µ—Ä–æ–≤ –ø—Ä–µ–¥—Å—Ç–∞–≤–ª–µ–Ω —Ä–∏—Å—É–Ω–∫–æ–º –≤–Ω–∏–∑—É.
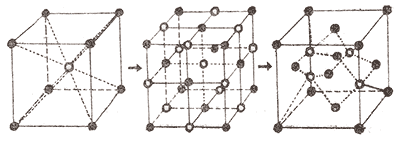
–ó–¥–µ—Å—å —Å–ª–µ–¥—É–µ—Ç —Å–∫–∞–∑–∞—Ç—å –∏ –æ —Ä–æ–ª–∏ —Ä–∞–∑–º–µ—Ä–∞ –º–æ–ª–µ–∫—É–ª –≤ –ø—Ä–æ—Ü–µ—Å—Å–µ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏–∑–∞—Ü–∏–∏. –ù–µ–±–æ–ª—å—à–∏–º –º–æ–ª–µ–∫—É–ª–∞–º, –æ—á–µ–≤–∏–¥–Ω–æ, –ª–µ–≥—á–µ –≤—ã—Å—Ç—Ä–æ–∏—Ç—å—Å—è –≤ —Å—Ç—Ä–æ–≥–∏–µ —à–µ—Ä–µ–Ω–≥–∏ – –≤ —Å–≤–æ–µ–º –¥–≤–∏–∂–µ–Ω–∏–∏ –æ–Ω–∏ –Ω–µ –º–µ—à–∞—é—Ç –¥—Ä—É–≥ –¥—Ä—É–≥—É –∏ –ø–æ—Ç–æ–º—É –ø–æ–¥–≤–∏–∂–Ω–µ–µ. –í–æ—Ç –ø–æ—á–µ–º—É –¥–ª—è –Ω–∏–∑–∫–æ–º–æ–ª–µ–∫—É–ª—è—Ä–Ω—ã—Ö —Å–æ–µ–¥–∏–Ω–µ–Ω–∏–π –∞–º–æ—Ä—Ñ–Ω–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ – –ø–æ–ª–æ–∂–µ–Ω–∏–µ –∏ –Ω–µ—Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–æ–µ –∏ –Ω–µ—É—Å—Ç–æ–π—á–∏–≤–æ–µ. –ò–Ω–æ–µ –¥–µ–ª–æ – –≤—ã—Å–æ–∫–æ–º–æ–ª–µ–∫—É–ª—è—Ä–Ω—ã–µ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏—è. –ö–æ–Ω–µ—á–Ω–æ, –∏ –∏—Ö –º–æ–ª–µ–∫—É–ª–∞–º –ø—Ä–∏—Å—É—â–∞ —Ç–µ–Ω–¥–µ–Ω—Ü–∏—è –∫ –º–∏–Ω–∏–º—É–º—É —ç–Ω–µ—Ä–≥–∏–∏, –∫ —É–ø–æ—Ä—è–¥–æ—á–µ–Ω–∏—é, –Ω–æ –æ–Ω–∏ –Ω–µ—Ä–µ–¥–∫–æ –æ–±–ª–∞–¥–∞—é—Ç —Å—Ç–æ–ª—å –ø—Ä–∏—á—É–¥–ª–∏–≤–æ –∏ —Ä–∞–∑–ª–∏—á–Ω–æ –∏–∑–æ–≥–Ω—É—Ç—ã–º–∏ —Ñ–æ—Ä–º–∞–º–∏, —á—Ç–æ –Ω–µ –≤ —Å–æ—Å—Ç–æ—è–Ω–∏–∏ –æ–±—Ä–∞–∑–æ–≤–∞—Ç—å —á–µ—Ç–∫–∏–π —Å—Ç—Ä–æ–π –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–π —Ä–µ—à–µ—Ç–∫–∏. –ù–∞–ø—Ä–∏–º–µ—Ä, –º–æ–ª–µ–∫—É–ª—ã –∫—Ä–∞—Å–Ω–æ–≥–æ —Ñ–æ—Å—Ñ–æ—Ä–∞ –∏–º–µ—é—Ç –ø–æ–ª–∏–º–µ—Ä–Ω—É—é —Å—Ç—Ä—É–∫—Ç—É—Ä—É, –∞ –±–µ–ª–æ–≥–æ – —Å–æ—Å—Ç–æ—è—Ç –≤—Å–µ–≥–æ –∏–∑ —á–µ—Ç—ã—Ä–µ—Ö –∞—Ç–æ–º–æ–≤, –æ—Ä–∏–µ–Ω—Ç–∏—Ä–æ–≤–∞–Ω–Ω—ã—Ö –ø–æ –≤–µ—Ä—à–∏–Ω–∞–º —Ç–µ—Ç—Ä–∞—ç–¥—Ä–∞. –ü–æ—ç—Ç–æ–º—É –∫—Ä–∞—Å–Ω—ã–π —Ñ–æ—Å—Ñ–æ—Ä – –∞–º–æ—Ä—Ñ–Ω–æ–µ –≤–µ—â–µ—Å—Ç–≤–æ, —Ç–æ–≥–¥–∞ –∫–∞–∫ –±–µ–ª—ã–π —Ñ–æ—Å—Ñ–æ—Ä –ª–µ–≥–∫–æ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏–∑—É–µ—Ç—Å—è.
–ñ–∏–¥–∫–æ–µ –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ
–ß–µ–º –ø—Ä–æ—á–Ω–µ–µ —Å—Ü–µ–ø–ª–µ–Ω—ã –¥—Ä—É–≥ —Å –¥—Ä—É–≥–æ–º –º–æ–ª–µ–∫—É–ª—ã (–∏–ª–∏ –∞—Ç–æ–º—ã, –∏–ª–∏ –∏–æ–Ω—ã) –≤ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–π —Ä–µ—à–µ—Ç–∫–µ, —Ç–µ–º, –æ—á–µ–≤–∏–¥–Ω–æ, —Ç—Ä—É–¥–Ω–µ–µ –ø–µ—Ä–µ–≤–µ—Å—Ç–∏ —Ç–∞–∫–æ–π –∫—Ä–∏—Å—Ç–∞–ª–ª –≤ –∂–∏–¥–∫–æ—Å—Ç—å –ø—É—Ç–µ–º –Ω–∞–≥—Ä–µ–≤–∞. –í–æ–∑—å–º–µ–º –¥–ª—è –ø—Ä–∏–º–µ—Ä–∞ –∫—Ä–∏—Å—Ç–∞–ª–ª—ã, –ø–æ—Å—Ç—Ä–æ–µ–Ω–Ω—ã–µ –∏–∑ –∏–æ–Ω–æ–≤. –°–∏–ª—ã –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤–∏—è –º–µ–∂–¥—É –Ω–∏–º–∏ –Ω–æ—Å—è—Ç —ç–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–µ—Å–∫–∏–π —Ö–∞—Ä–∞–∫—Ç–µ—Ä, —Å—Ç–∞–ª–æ –±—ã—Ç—å, –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω—ã –≤–µ–ª–∏—á–∏–Ω–µ –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤—É—é—â–∏—Ö –∑–∞—Ä—è–¥–æ–≤. –ú–æ–∂–Ω–æ –æ–∂–∏–¥–∞—Ç—å, —á—Ç–æ –ø—Ä–∏ –æ–¥–Ω–æ–º –∏ —Ç–æ–º –∂–µ —Ç–∏–ø–µ —Ä–µ—à–µ—Ç–∫–∏ –±–æ–ª–µ–µ —Ç—É–≥–æ–ø–ª–∞–≤–∫–∏–º–∏ –±—É–¥—É—Ç —Ç–µ –∏–æ–Ω–Ω—ã–µ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏—è, —É –∫–æ—Ç–æ—Ä—ã—Ö –∑–∞—Ä—è–¥—ã –∏–æ–Ω–æ–≤ –≤—ã—à–µ. –¢–∞–∫ –æ–Ω–æ –∏ –æ–∫–∞–∑—ã–≤–∞–µ—Ç—Å—è. –°–∫–∞–∂–µ–º, —Ñ—Ç–æ—Ä–∏—Å—Ç—ã–π –±–µ—Ä–∏–ª–ª–∏–π (–∑–∞—Ä—è–¥—ã –∏–æ–Ω–æ–≤ —Ñ—Ç–æ—Ä–∞ –∏ –±–µ—Ä–∏–ª–ª–∏—è —Ä–∞–≤–Ω—ã —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤–µ–Ω–Ω–æ –æ–¥–Ω–æ–º—É –∏ –¥–≤—É–º) –ø–ª–∞–≤–∏—Ç—Å—è –ø—Ä–∏ 821*–°, –∞ –¥–≤—É–æ–∫–∏—Å—å –∫—Ä–µ–º–Ω–∏—è, –æ–±—Ä–∞–∑—É—é—â–∞—è —Ä–µ—à–µ—Ç–∫—É —ç—Ç–æ–≥–æ –∂–µ —Ç–∏–ø–∞ (–∑–∞—Ä—è–¥—ã –∏–æ–Ω–æ–≤ –∫–∏—Å–ª–æ—Ä–æ–¥–∞ –∏ –∫—Ä–µ–º–Ω–∏—è – –¥–≤–∞ –∏ —á–µ—Ç—ã—Ä–µ), – —É–∂–µ –ø—Ä–∏ 1723*–°. –ö–∞–∫ –≤–∏–¥–Ω–æ, —É–≤–µ–ª–∏—á–µ–Ω–∏–µ –∑–∞—Ä—è–¥–∞ –∏–æ–Ω–æ–≤ –≤–¥–≤–æ–µ –ø—Ä–∏–≤–µ–ª–æ –∫ –ø–æ–≤—ã—à–µ–Ω–∏—é —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã –ø–ª–∞–≤–ª–µ–Ω–∏—è –±–µ–∑ –º–∞–ª–æ–≥–æ –Ω–∞ —Ç—ã—Å—è—á—É –≥—Ä–∞–¥—É—Å–æ–≤.
–≠—Ç–æ, –≤–ø—Ä–æ—á–µ–º, –ª–∏—à—å –æ–¥–∏–Ω –∏–∑ —Ñ–∞–∫—Ç–æ—Ä–æ–≤, –æ–ø—Ä–µ–¥–µ–ª—è—é—â–∏—Ö —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –ø–ª–∞–≤–ª–µ–Ω–∏—è.
–Ý–∞–∑–±–µ—Ä–µ–º—Å—è, –Ω–∞–ø—Ä–∏–º–µ—Ä, –ø–æ—á–µ–º—É –æ–Ω–∞ –ø–æ–≤—ã—à–∞–µ—Ç—Å—è –ø–æ —Ä—è–¥—É –≥–∞–ª–æ–≥–µ–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ–≤ – –æ—Ç —Ö–ª–æ—Ä–∏—Å—Ç–æ–≥–æ –≤–æ–¥–æ—Ä–æ–¥–∞ –¥–æ –π–æ–¥–∏—Å—Ç–æ–≥–æ. –í–æ- –ø–µ—Ä–≤—ã—Ö, –∑–¥–µ—Å—å –≤–æ–∑—Ä–∞—Å—Ç–∞—é—Ç —Ä–∞–∑–º–µ—Ä—ã –∞—Ç–æ–º–æ–≤ –≥–∞–ª–æ–≥–µ–Ω–æ–≤ –∏, —Å—Ç–∞–ª–æ –±—ã—Ç—å, –ø–æ—è–≤–ª—è—é—Ç—Å—è —Ä–µ–∑–µ—Ä–≤—ã –¥–ª—è —Ä–∞–∑–º–µ—â–µ–Ω–∏—è –≤–æ–∫—Ä—É–≥ —Å–µ–±—è –±–æ–ª—å—à–æ–≥–æ —á–∏—Å–ª–∞ —Å–æ—Å–µ–¥–µ–π. –ë–æ–ª—å—à–µ —Å–æ—Å–µ–¥–µ–π – –±–æ–ª—å—à–µ —Å–≤—è–∑–µ–π, –ø—Ä–æ—á–Ω–µ–µ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∞—è —Ä–µ—à–µ—Ç–∫–∞. –í–æ-–≤—Ç–æ—Ä—ã—Ö, –≤–æ–∑—Ä–∞—Å—Ç–∞–µ—Ç –∏ –ø—Ä–æ—á–Ω–æ—Å—Ç—å —Å–∞–º–∏—Ö —Å–≤—è–∑–µ–π –º–µ–∂–¥—É –≤–æ–¥–æ—Ä–æ–¥–æ–º –∏ –≥–∞–ª–æ–≥–µ–Ω–æ–º, —Å—Ç–µ–ø–µ–Ω—å –µ–µ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏. –û–±–∞ —Ñ–∞–∫—Ç–æ—Ä–∞ —Ä–∞–±–æ—Ç–∞—é—Ç –≤ –æ–¥–Ω–æ–º –Ω–∞–ø—Ä–∞–≤–ª–µ–Ω–∏–∏. –ù–æ –≤–æ—Ç —á—Ç–æ —Å—Ç—Ä–∞–Ω–Ω–æ; –æ–¥–∏–Ω –∏–∑ –≥–∞–ª–æ–≥–µ–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ–≤, —Ñ—Ç–æ—Ä–∏—Å—Ç—ã–π –≤–æ–¥–æ—Ä–æ–¥, –∏–∑ —ç—Ç–æ–≥–æ —Ä—è–¥–∞ –≤—ã–ø–∞–¥–∞–µ—Ç (—Å–º. –≥—Ä–∞—Ñ–∏–∫); –æ–Ω –ø–ª–∞–≤–∏—Ç—Å—è –ø—Ä–∏ -83*–°, –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ –Ω–µ —Ç–æ–ª—å–∫–æ –±–æ–ª–µ–µ –≤—ã—Å–æ–∫–æ–π, —á–µ–º —Ö–ª–æ—Ä–∏—Å—Ç—ã–π –≤–æ–¥–æ—Ä–æ–¥, –Ω–æ –¥–∞–∂–µ –±–æ–ª–µ–µ –≤—ã—Å–æ–∫–æ–π, —á–µ–º –±—Ä–æ–º–∏—Å—Ç—ã–π –≤–æ–¥–æ—Ä–æ–¥, —Ö–æ—Ç—è, —Å—É–¥—è –ø–æ –ø—Ä–æ–¥–æ–ª–∂–µ–Ω–∏—é –≥—Ä–∞—Ñ–∏–∫–∞, –µ–≥–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –ø–ª–∞–≤–ª–µ–Ω–∏—è –¥–æ–ª–∂–Ω–∞ –ª–µ–∂–∞—Ç—å –≥–¥–µ-—Ç–æ –º–µ–∂–¥—É -120*–° –∏ -150*–°.
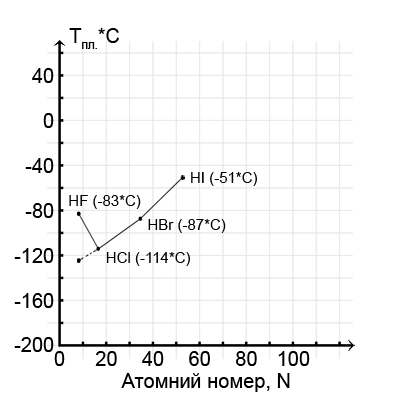
–°–µ–∫—Ä–µ—Ç —ç—Ç–æ–π –∞–Ω–æ–º–∞–ª–∏–∏ –∫—Ä–æ–µ—Ç—Å—è —É–∂–µ –≤ –æ—Å–æ–±–µ–Ω–Ω–æ—Å—Ç—è—Ö —Å–≤—è–∑–µ–π –º–µ–∂–¥—É –º–æ–ª–µ–∫—É–ª–∞–º–∏ —ç—Ç–æ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞: –æ–Ω–∏ –æ–±—ä–µ–¥–∏–Ω—è—é—Ç—Å—è –ø–æ–ø–∞—Ä–Ω–æ, —Ç–∞–∫ —á—Ç–æ –∏–æ–Ω—ã –≤–æ–¥–æ—Ä–æ–¥–∞ –æ–¥–Ω–æ–π –º–æ–ª–µ–∫—É–ª—ã –æ–±—Ä–∞–∑—É—é—Ç —Å –∏–æ–Ω–∞–º–∏ —Ñ—Ç–æ—Ä–∞ –¥—Ä—É–≥–æ–π –æ—Å–æ–±—É—é, —Ç–∞–∫ –Ω–∞–∑—ã–≤–∞–µ–º—É—é –≤–æ–¥–æ—Ä–æ–¥–Ω—É—é —Å–≤—è–∑—å. –ò–æ–Ω –≤–æ–¥–æ—Ä–æ–¥–∞ – —ç—Ç–æ –ø—Ä–æ—Å—Ç–æ-–Ω–∞–ø—Ä–æ—Å—Ç–æ –ø—Ä–æ—Ç–æ–Ω: —Å–±–ª–∏–∂–∞—è—Å—å —Å —ç–ª–µ–∫—Ç—Ä–æ–Ω–Ω–æ–π –æ–±–æ–ª–æ—á–∫–æ–π –∏–æ–Ω–∞ —Ñ—Ç–æ—Ä–∞, –æ–Ω —ç–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–µ—Å–∫–∏ –ø—Ä–∏—Ç—è–≥–∏–≤–∞–µ—Ç—Å—è –µ—é. –í–æ—Ç –∏ –ø–æ–ª—É—á–∞–µ—Ç—Å—è –¥–æ–ø–æ–ª–Ω–∏—Ç–µ–ª—å–Ω–∞—è —Å–≤—è–∑—å, –∫–æ—Ç–æ—Ä–∞—è —Å–¥–≤–∏–≥–∞–µ—Ç –∫ –±–æ–ª–µ–µ –≤—ã—Å–æ–∫–∏–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞–º –ø–µ—Ä–µ—Ö–æ–¥ –≤–µ—â–µ—Å—Ç–≤–∞ –∏–∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è –≤ –∂–∏–¥–∫–æ–µ.
–ó–∞–º–µ—Ç–∏–º, —á—Ç–æ –Ω–µ–∫–æ—Ç–æ—Ä—ã–µ —Ç–≤–µ—Ä–¥—ã–µ –≤–µ—â–µ—Å—Ç–≤–∞ –ø—Ä–∏ –ø–æ–≤—ã—à–µ–Ω–∏–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã –ø–µ—Ä–µ—Ö–æ–¥—è—Ç —Å—Ä–∞–∑—É –≤ –≥–∞–∑–æ–æ–±—Ä–∞–∑–Ω–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ, –º–∏–Ω—É—è —Å—Ç–∞–¥–∏—é –∂–∏–¥–∫–æ—Å—Ç–∏. –ù–∞–ø—Ä–∏–º–µ—Ä, –ø—Ä–∏ –Ω–æ—Ä–º–∞–ª—å–Ω–æ–º –∞—Ç–º–æ—Å—Ñ–µ—Ä–Ω–æ–º –¥–∞–≤–ª–µ–Ω–∏–∏ –π–æ–¥ –Ω–µ —É–¥–∞–µ—Ç—Å—è –ø–æ–ª—É—á–∏—Ç—å –≤ –∂–∏–¥–∫–æ–º –≤–∏–¥–µ – –æ–Ω, –Ω–µ –ø–ª–∞–≤—è—Å—å, —Å—Ä–∞–∑—É –ø—Ä–µ–≤—Ä–∞—â–∞–µ—Ç—Å—è –≤ –≥–∞–∑. –î–∞ —á—Ç–æ —Ç–∞–º –π–æ–¥ – –ø—Ä–∏–≤—ã—á–Ω—ã–µ —Å–Ω–µ–≥ –∏ –ª–µ–¥ –≤ —Ç–µ—á–µ–Ω–∏–µ –∑–∏–º—ã –∏—Å–ø–∞—Ä—è—é—Ç—Å—è –ø—Ä–∏–º–µ—Ä–Ω–æ –Ω–∞ —Ç—Ä–µ—Ç—å, –Ω–µ —Ç–∞—è. –¢–∞–∫–æ–≥–æ —Ä–æ–¥–∞ –ø–µ—Ä–µ—Ö–æ–¥ –ø–æ–ª—É—á–∏–ª –Ω–∞–∑–≤–∞–Ω–∏–µ —Å—É–±–ª–∏–º–∞—Ü–∏—è –∏–ª–∏ –≤–æ–∑–≥–æ–Ω–∫–∞.
Но вернемся к более привычному переходу из твердого состояния в жидкое. Диапазон температур, при котором вещество пребывает в виде жидкости, может быть самым различным. Например, у цианистого водорода он составляет чуть более 10*С (точка плавления -14*С, точка кипения 25*С). А вот металл галлий плавится уже на ладони (всего-то при 28*С), зато кипит при 2200*С. Столь солидный температурный интервал жидкого состояния, конечно, не остался без применения: галлий используется в жидкостных термометрах для измерения высоких температур. Почему же галлий так легкоплавок, тем более что его соседи по таблице Менделеева Ралюминий и индий Рплавятся при более высоких температурах? Не так давно удалось выяснить, что галлий образует молекулярную решетку, в узлах которой находятся молекулы Ga2, в то время как у его вышеупомянутых соседей в узлах решетки находятся либо ионы, либо атомы соответствующего металла. Прочность связей между молекулами галлия определяется только относительно слабым межмолекулярным взаимодействием, тогда как между ионами — электростатическим, между атомами — ионно-ковалентным; оба дают более прочные связи. Поэтому-то кристаллическая решетка галлия легче разрушается, нежели аналогичные у алюминия и индия.
¬Ý
Природа щедра на выдумки и предусмотрела в своих творениях еще один, весьма интересный вариант межмолекулярных связей. Вообразите длинную органическую молекулу, строение которой таково, что концевые ее группы способны лишь к очень слабеньким взаимодействиям, а боковые Рк значительно более сильным. Тогда можно будет ожидать, что при плавлении вещества из таких молекул сначала наступит такой момент, когда боковые связи будут еще достаточно прочно удерживать молекулы в едином ансамбле, а концевые связи будут разорваны. Получится нечто вроде параллельно расположенных коробок, плотно заполненных карандашами, причем сами «коробки» могут перемещаться друг относительно друга, а «карандаши» Рнет (см. рисунок).
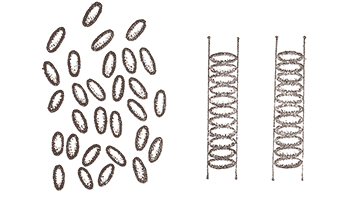
–í–µ—â–µ—Å—Ç–≤–æ –≤ —Ç–∞–∫–æ–º —Å–æ—Å—Ç–æ—è–Ω–∏–∏ –±—É–¥–µ—Ç –ø—Ä–æ—è–≤–ª—è—Ç—å –∫–∞–∫ —Å–≤–æ–π—Å—Ç–≤–∞ –∂–∏–¥–∫–æ—Å—Ç–∏, —Ç–∞–∫ –∏ –Ω–µ–∫–æ—Ç–æ—Ä—ã–µ —Å–≤–æ–π—Å—Ç–≤–∞ –∫—Ä–∏—Å—Ç–∞–ª–ª–∞ (–≤ —á–∞—Å—Ç–Ω–æ—Å—Ç–∏, –æ–±–ª–∞–¥–∞—Ç—å —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–æ–π –¥–ª—è –∂–∏–¥–∫–æ—Å—Ç–∏ —Ç–µ–∫—É—á–µ—Å—Ç—å—é –∏ —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–æ–π –¥–ª—è –∫—Ä–∏—Å—Ç–∞–ª–ª–æ–≤ –Ω–µ–æ–¥–Ω–æ—Ä–æ–¥–Ω–æ—Å—Ç—å—é —Å–≤–æ–π—Å—Ç–≤ –ø–æ —Ä–∞–∑–Ω—ã–º –Ω–∞–ø—Ä–∞–≤–ª–µ–Ω–∏—è–º – –∞–Ω–∏–∑–æ—Ç—Ä–æ–ø–∏—è). –¢–∞–∫–æ–µ –≤–µ—â–µ—Å—Ç–≤–æ –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è –∂–∏–¥–∫–∏–º –∫—Ä–∏—Å—Ç–∞–ª–ª–æ–º. –í–ø–µ—Ä–≤—ã–µ –µ–≥–æ –Ω–∞–±–ª—é–¥–∞–ª –≤ 1888 –≥. –∞–≤—Å—Ç—Ä–∏–π—Å–∫–∏–π —Ö–∏–º–∏–∫ –§. –Ý–µ–π–Ω–∏—Ç—Ü–µ—Ä –Ω–∞ –ø—Ä–∏–º–µ—Ä–µ —Ö–æ–ª–µ—Å—Ç–µ—Ä–∏–ª–±–µ–Ω–∑–æ–∞—Ç–∞. –í—ã—è—Å–Ω–∏–ª–æ—Å—å, —á—Ç–æ –ø—Ä–∏ 145*–°, –≤ –º–æ–º–µ–Ω—Ç –ø–ª–∞–≤–ª–µ–Ω–∏—è —ç—Ç–æ–≥–æ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏—è, –≤–Ω–∞—á–∞–ª–µ –æ–±—Ä–∞–∑—É–µ—Ç—Å—è –º—É—Ç–Ω–∞—è –∂–∏–¥–∫–æ—Å—Ç—å, –∫–æ—Ç–æ—Ä–∞—è –ø—Ä–æ—è–≤–ª—è–µ—Ç –≤—Å–µ –≤—ã—à–µ—É–∫–∞–∑–∞–Ω–Ω—ã–µ —Å–≤–æ–π—Å—Ç–≤–∞ –∂–∏–¥–∫–æ–≥–æ –∫—Ä–∏—Å—Ç–∞–ª–ª–∞, –∏ –ª–∏—à—å –ø—Ä–∏ 179*–°, —Ä–∞—Å–ø–ª–∞–≤ —Å—Ç–∞–Ω–æ–≤–∏—Ç—Å—è —Å–æ–≤–µ—Ä—à–µ–Ω–Ω–æ –ø—Ä–æ–∑—Ä–∞—á–Ω—ã–º –∏ –≤–µ–¥–µ—Ç —Å–µ–±—è, –∫–∞–∫ –±–æ–ª—å—à–∏–Ω—Å—Ç–≤–æ –∂–∏–¥–∫–æ—Å—Ç–µ–π.
–û–±–ª–∞—Å—Ç—å —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä, –ø—Ä–∏ –∫–æ—Ç–æ—Ä–æ–π —Ä–µ–∞–ª–∏–∑—É–µ—Ç—Å—è –∂–∏–¥–∫–æ–∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ, –ø–æ–ª—É—á–∏–ª–∞ –Ω–∞–∑–≤–∞–Ω–∏–µ –º–µ–∑–æ–ø–∞—É–∑–∞: —É —Ö–æ–ª–µ—Å—Ç–µ—Ä–∏–ª–±–µ–Ω–∑–æ–∞—Ç–∞ –æ–Ω–∞, –∫–∞–∫ –Ω–µ—Ç—Ä—É–¥–Ω–æ –≤—ã—á–∏—Å–ª–∏—Ç—å, —Å–æ—Å—Ç–∞–≤–ª—è–µ—Ç 34*–°. –ò–∑–≤–µ—Å—Ç–Ω–æ –±–æ–ª–µ–µ —Ç—Ä–µ—Ö —Ç—ã—Å—è—á –ø–æ–¥–æ–±–Ω—ã—Ö –≤–µ—â–µ—Å—Ç–≤, –ø—Ä–∏—á–µ–º —Å —Å–∞–º–æ–π —Ä–∞–∑–ª–∏—á–Ω–æ–π –º–µ–∑–æ–ø–∞—É–∑–æ–π (–æ—Ç 0,01 –¥–æ 100*–°) –∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–æ–π –ø–ª–∞–≤–ª–µ–Ω–∏—è (–æ—Ç -20* –¥–æ 400*–°).
–•–æ—Ä–æ—à–æ –∏–∑–≤–µ—Å—Ç–Ω–∞ —Å–ª–∞–±–∞—è —Å–∂–∏–º–∞–µ–º–æ—Å—Ç—å –∂–∏–¥–∫–æ—Å—Ç–µ–π. –ï—Å–ª–∏ –≤–æ–¥—É –Ω–∞–ª–∏—Ç—å –≤ –¥–æ—Å—Ç–∞—Ç–æ—á–Ω–æ –ø—Ä–æ—á–Ω—ã–π —Ü–∏–ª–∏–Ω–¥—Ä–∏—á–µ—Å–∫–∏–π —Å—Ç–∞–∫–∞–Ω –∏ —Å–∂–∏–º–∞—Ç—å –ø–æ—Ä—à–Ω–µ–º, –∂–µ–ª–∞—è —É–º–µ–Ω—å—à–∏—Ç—å –µ–≥–æ –æ–±—ä–µ–º, —Å–∫–∞–∂–µ–º, –Ω–∞ –æ–¥–Ω—É –¥–µ—Å—è—Ç—É—é, —Ç–æ –¥–ª—è —ç—Ç–æ–≥–æ –ø—Ä–∏–¥–µ—Ç—Å—è –ø—Ä–∏–ª–æ–∂–∏—Ç—å –æ–≥—Ä–æ–º–Ω–æ–µ –¥–∞–≤–ª–µ–Ω–∏–µ – –æ–∫–æ–ª–æ —á–µ—Ç—ã—Ä–µ—Ö —Ç—ã—Å—è—á –∞—Ç–º–æ—Å—Ñ–µ—Ä. –≠—Ç–æ –≤—Å–µ–≥–æ –ª–∏—à—å –≤ –¥–≤–∞ —Ä–∞–∑–∞ –º–µ–Ω—å—à–µ, —á–µ–º –≤ —Ç–æ–º —Å–ª—É—á–∞–µ, –µ—Å–ª–∏ –±—ã –≤–º–µ—Å—Ç–æ –≤–æ–¥—ã –≤ —Å—Ç–∞–∫–∞–Ω–µ –Ω–∞—Ö–æ–¥–∏–ª—Å—è –ª–µ–¥. –°–æ–≤—Å–µ–º –∏–Ω–∞—á–µ –¥–µ–ª–æ –æ–±—Å—Ç–æ—è–ª–æ –±—ã, –µ—Å–ª–∏ –≤ —Å—Ç–∞–∫–∞–Ω–µ –±—ã–ª –≤–æ–¥—è–Ω–æ–π –ø–∞—Ä –ø—Ä–∏ –Ω–æ—Ä–º–∞–ª—å–Ω–æ–º –∞—Ç–º–æ—Å—Ñ–µ—Ä–Ω–æ–º –¥–∞–≤–ª–µ–Ω–∏–∏: —Ç–æ–≥–¥–∞ –¥–ª—è —É–º–µ–Ω—å—à–µ–Ω–∏—è –µ–≥–æ –æ–±—ä–µ–º–∞ –Ω–∞ –æ–¥–Ω—É –¥–µ—Å—è—Ç—É—é –¥–∞–≤–ª–µ–Ω–∏–µ –Ω—É–∂–Ω–æ –±—ã–ª–æ –±—ã —É–≤–µ–ª–∏—á–∏—Ç—å –ø—Ä–∏–º–µ—Ä–Ω–æ –≤ —Ç–æ–π –∂–µ –º–µ—Ä–µ – –Ω–∞ –¥–µ—Å—è—Ç—å –ø—Ä–æ—Ü–µ–Ω—Ç–æ–≤.
–û–ø–∏—Å–∞–Ω–Ω—ã–π –º—ã—Å–ª–µ–Ω–Ω—ã–π —ç–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç –ø–æ–∫–∞–∑—ã–≤–∞–µ—Ç, –≤ —Å–∫–æ–ª—å —Ç–µ—Å–Ω–æ–º —Å–æ—Å–µ–¥—Å—Ç–≤–µ —Ä–∞—Å–ø–æ–ª–∞–≥–∞—é—Ç—Å—è –º–æ–ª–µ–∫—É–ª—ã –∂–∏–¥–∫–æ—Å—Ç–∏. –ë–æ–ª–µ–µ —Ç–æ–≥–æ: –±–ª–∏–∑–∫–æ–µ –æ–∫—Ä—É–∂–µ–Ω–∏–µ –∫–∞–∂–¥–æ–π –º–æ–ª–µ–∫—É–ª—ã –≤ —Ç–µ—á–µ–Ω–∏–µ –∫–∞–∫–æ–≥–æ-—Ç–æ –º–∞–ª–æ–≥–æ –ø—Ä–æ–º–µ–∂—É—Ç–∫–∞ –≤—Ä–µ–º–µ–Ω–∏ –æ–∫–∞–∑—ã–≤–∞–µ—Ç—Å—è —Å—Ç–æ–ª—å –∂–µ —É–ø–æ—Ä—è–¥–æ—á–µ–Ω–Ω—ã–º, –∫–∞–∫ –∏ –≤ —Ç–≤–µ—Ä–¥—ã—Ö —Ç–µ–ª–∞—Ö. –ú–∏–≥ – –∏ —ç—Ç–∞ —Å—Ç—Ä–æ–π–Ω–æ—Å—Ç—å —Ä–∞–∑—Ä—É—à–µ–Ω–∞, –∏ –º–æ–ª–µ–∫—É–ª–∞ –Ω–∞ –∫–∞–∫–æ–µ-—Ç–æ –≤—Ä–µ–º—è –æ–∫–∞–∑—ã–≤–∞–µ—Ç—Å—è –≤ —É–ø–æ—Ä—è–¥–æ—á–µ–Ω–Ω–æ–º –æ–∫—Ä—É–∂–µ–Ω–∏–∏ —Å–æ–≤—Å–µ–º –¥—Ä—É–≥–∏—Ö —Å–æ—Å–µ–¥–æ–∫… –¢–∞–∫–∞—è —Å–≤–æ–µ–æ–±—Ä–∞–∑–Ω–∞—è –æ—Ä–≥–∞–Ω–∏–∑–æ–≤–∞–Ω–Ω–æ—Å—Ç—å, –ø—Ä–æ—Å–ª–µ–∂–∏–≤–∞–µ–º–∞—è –≤ –Ω–µ–∫–æ—Ç–æ—Ä–æ–º –º–∞–ª–æ–º –∫–æ–ª–ª–µ–∫—Ç–∏–≤–µ –º–æ–ª–µ–∫—É–ª –Ω–∞ –Ω–µ–∫–æ—Ç–æ—Ä–æ–º –º–∞–ª–æ–º –ø—Ä–æ–º–µ–∂—É—Ç–∫–µ –≤—Ä–µ–º–µ–Ω–∏, –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è –±–ª–∏–∂–Ω–∏–º –ø–æ—Ä—è–¥–∫–æ–º¬ª –û–Ω —Ö–∞—Ä–∞–∫—Ç–µ—Ä–µ–Ω –¥–ª—è –∂–∏–¥–∫–æ—Å—Ç–µ–π, –æ–±–µ—Å–ø–µ—á–∏–≤–∞—è –∏—Ö —Ç–µ–∫—É—á–µ—Å—Ç—å. –¢–≤–µ—Ä–¥—ã–º –∞–º–æ—Ä—Ñ–Ω—ã–º —Ç–µ–ª–∞–º —Ç–∞–∫–∂–µ –ø—Ä–∏—Å—É—â –±–ª–∏–∂–Ω–∏–π –ø–æ—Ä—è–¥–æ–∫ –≤ —Å–æ—Ä–∞—Å–ø–æ–ª–æ–∂–µ–Ω–∏–∏ —á–∞—Å—Ç–∏—Ü – —Ä–∞–∑—É–º–µ–µ—Ç—Å—è, –±–æ–ª–µ–µ —É—Å—Ç–æ–π—á–∏–≤—ã–π –≤–æ –≤—Ä–µ–º–µ–Ω–∏.
–ü–æ–ª—å–∑—É—è—Å—å –Ω–æ–≤—ã–º —Ç–µ—Ä–º–∏–Ω–æ–º, –º—ã –º–æ–∂–µ–º –±–æ–ª–µ–µ —Å—Ç—Ä–æ–≥–æ –∏ –æ–±—â–µ –æ–ø—Ä–µ–¥–µ–ª–∏—Ç—å –ø–æ–Ω—è—Ç–∏–µ –∂–∏–¥–∫–æ–≥–æ –∫—Ä–∏—Å—Ç–∞–ª–ª–∞: –∫–∞–∫ –∏ –≤ –∂–∏–¥–∫–æ—Å—Ç—è—Ö, —Ä–∞—Å–ø–æ–ª–æ–∂–µ–Ω–∏–µ –µ–≥–æ –º–æ–ª–µ–∫—É–ª –ø–æ–¥—á–∏–Ω–µ–Ω–æ –ª–∏—à—å –±–ª–∏–∂–Ω–µ–º—É –ø–æ—Ä—è–¥–∫—É, –æ–¥–Ω–∞–∫–æ –≤ –æ—Ä–∏–µ–Ω—Ç–∞—Ü–∏–∏ –æ—Å–µ–π —Å–∏–º–º–µ—Ç—Ä–∏–∏ –º–æ–ª–µ–∫—É–ª –µ—Å—Ç—å –¥–∞–ª—å–Ω–∏–π –ø–æ—Ä—è–¥–æ–∫, —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω—ã–π –¥–ª—è –∫—Ä–∏—Å—Ç–∞–ª–ª–æ–≤.
–û—Ä–∏–µ–Ω—Ç–∏—Ä–æ–≤–∞—Ç—å –æ—Å–∏ –º–æ–ª–µ–∫—É–ª –º–æ–∂–Ω–æ, –Ω–∞–ø—Ä–∏–º–µ—Ä, —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–∏–º –ø–æ–ª–µ–º: –æ–Ω–æ-—Ç–æ –∏ —É–ø—Ä–∞–≤–ª—è–µ—Ç —Å–º–µ–Ω–æ–π —Ü–∏—Ñ—Ä –Ω–∞ –∂–∏–¥–∫–æ–∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏—Ö –¥–∏—Å–ø–ª–µ—è—Ö.
–°–∫–æ—Ä–æ—Å—Ç—å —Å–≤–æ–±–æ–¥–Ω–æ–≥–æ –ø–µ—Ä–µ–º–µ—â–µ–Ω–∏—è —á–∞—Å—Ç–∏—Ü –∂–∏–¥–∫–æ—Å—Ç–∏ –Ω–µ –∑–∞–≤–∏—Å–∏—Ç –æ—Ç –¥–∞–≤–ª–µ–Ω–∏—è –∏ –æ–ø—Ä–µ–¥–µ–ª—è–µ—Ç—Å—è –ª–∏—à—å —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–æ–π. –í–æ—Ç –ø–æ—á–µ–º—É, —Å–∂–∏–º–∞—è –∂–∏–¥–∫–æ—Å—Ç—å, –Ω–µ —É–¥–∞–µ—Ç—Å—è –∑–∞–∫—Ä–µ–ø–∏—Ç—å –µ–µ –º–æ–ª–µ–∫—É–ª—ã –Ω–∞ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—ã—Ö –º–µ—Å—Ç–∞—Ö –∏ —Ç–µ–º —Å–∞–º—ã–º –ø—Ä–µ–≤—Ä–∞—Ç–∏—Ç—å –µ–µ –≤ —Ç–≤–µ—Ä–¥–æ–µ —Ç–µ–ª–æ. –û–¥–Ω–æ–º—É –ª–∏—à—å –¥–∞–≤–ª–µ–Ω–∏—é –±–µ–∑ –ø–æ–º–æ—â–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã —Ç–∞–∫–∞—è –∑–∞–¥–∞—á–∞ –Ω–µ –ø–æ–¥ —Å–∏–ª—É – –≤ –µ–≥–æ —Å–∏–ª–∞—Ö –ª–∏—à—å –Ω–µ—Å–∫–æ–ª—å–∫–æ –ø–æ—Ç–µ—Å–Ω–∏—Ç—å –º–æ–ª–µ–∫—É–ª—ã, –Ω–æ –æ—Ç–Ω—é–¥—å –Ω–µ —Å–æ–±—Ä–∞—Ç—å –∏—Ö –≤ —É–ø–æ—Ä—è–¥–æ—á–µ–Ω–Ω—ã–π –∞–Ω—Å–∞–º–±–ª—å.
–û–ø—è—Ç—å –Ω–µ—Å—Ö–æ–¥—Å—Ç–≤–æ —Å –≥–∞–∑–æ–º: –µ–≥–æ –ø—Ä–∏ –¥–æ—Å—Ç–∞—Ç–æ—á–Ω–æ –Ω–∏–∑–∫–æ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ, –±–µ–∑ –∫–∞–∫–æ–≥–æ-–ª–∏–±–æ –µ–µ –¥–∞–ª—å–Ω–µ–π—à–µ–≥–æ –ø–æ–Ω–∏–∂–µ–Ω–∏—è, –æ–¥–Ω–∏–º –ª–∏—à—å –Ω–∞—Ä–∞—â–∏–≤–∞–Ω–∏–µ–º –¥–∞–≤–ª–µ–Ω–∏—è –º–æ–∂–Ω–æ –ø—Ä–µ–≤—Ä–∞—Ç–∏—Ç—å –≤ –∂–∏–¥–∫–æ—Å—Ç—å. –û—Ç–ª–∏—á–∞–µ—Ç—Å—è –≤ —ç—Ç–æ–º –æ—Ç–Ω–æ—à–µ–Ω–∏–∏ –∂–∏–¥–∫–æ—Å—Ç—å –∏ –æ—Ç —Ç–≤–µ—Ä–¥–æ–≥–æ —Ç–µ–ª–∞: –≤ –Ω–µ–º –ø–æ–¥ –¥–µ–π—Å—Ç–≤–∏–µ–º –≤—ã—Å–æ–∫–æ–≥–æ –¥–∞–≤–ª–µ–Ω–∏—è –º–æ–∂–µ—Ç –ø—Ä–æ–∏–∑–æ–π—Ç–∏ –ª–æ–º–∫–∞ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–π —Ä–µ—à–µ—Ç–∫–∏. –ù–∞–ø—Ä–∏–º–µ—Ä, –ø—Ä–∏ –¥–µ–π—Å—Ç–≤–∏–∏ –¥–∞–≤–ª–µ–Ω–∏—è –≤ –¥–µ—Å—è—Ç–∫–∏ —Ç—ã—Å—è—á –∞—Ç–º–æ—Å—Ñ–µ—Ä –æ–±—ã—á–Ω—ã–π –ª–µ–¥ –ø—Ä–∏–æ–±—Ä–µ—Ç–∞–µ—Ç —Å–ø–æ—Å–æ–±–Ω–æ—Å—Ç—å –ø–ª–∞–≤–∏—Ç—å—Å—è –ª–∏—à—å –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ 85*–° (—Ç–∞–∫ –Ω–∞–∑—ã–≤–∞–µ–º—ã–π –≥–æ—Ä—è—á–∏–π –ª–µ–¥), –∞ –º—è–≥–∫–∏–π –Ω–µ–≤–∑—Ä–∞—á–Ω—ã–π –≥—Ä–∞—Ñ–∏—Ç –ø—Ä–µ–≤—Ä–∞—â–∞–µ—Ç—Å—è –≤ —Å–≤–µ—Ä–∫–∞—é—â–∏–π –≥—Ä–∞–Ω—è–º–∏ –∞–ª–º–∞–∑.
–ó–¥–µ—Å—å —Å–∞–º–æ–µ –≤—Ä–µ–º—è –ø—Ä–æ–∏–∑–Ω–µ—Å—Ç–∏ –≤–∞–∂–Ω—ã–π —Ç–µ—Ä–º–∏–Ω: —Ñ–∞–∑–æ–≤—ã–π –ø–µ—Ä–µ—Ö–æ–¥. –ö –ø–æ–¥–æ–±–Ω—ã–º –ø–µ—Ä–µ—Ö–æ–¥–∞–º –æ—Ç–Ω–æ—Å—è—Ç—Å—è –∏ –ø–µ—Ä–µ–º–µ–Ω—ã –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è –≤–µ—â–µ—Å—Ç–≤–∞ –∏ –ø–µ—Ä–µ—Å—Ç—Ä–æ–π–∫–∏ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–π —Ä–µ—à–µ—Ç–∫–∏ —Ç–≤–µ—Ä–¥–æ–≥–æ —Ç–µ–ª–∞. –í—Å–µ —ç—Ç–æ – —Ñ–∞–∑–æ–≤—ã–µ –ø–µ—Ä–µ—Ö–æ–¥—ã –ø–µ—Ä–≤–æ–≥–æ —Ä–æ–¥–∞. –ï—Å—Ç—å –µ—â–µ –∏ —Ñ–∞–∑–æ–≤—ã–µ –ø–µ—Ä–µ—Ö–æ–¥—ã –≤—Ç–æ—Ä–æ–≥–æ —Ä–æ–¥–∞. –Ø—Ä–∫–∏–π –∏—Ö –ø—Ä–∏–º–µ—Ä, –≤ –∫–æ–Ω—Ü–µ —Ç—Ä–∏–¥—Ü–∞—Ç—ã—Ö –≥–æ–¥–æ–≤ 20 –≤–µ–∫–∞, –±—ã–ª –ø–æ–∫–∞–∑–∞–Ω –≤ —ç–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç–∞—Ö —Ñ–∏–∑–∏–∫–∞ –ü. –õ. –ö–∞–ø–∏—Ü—ã – –∂–∏–¥–∫–∏–π –≥–µ–ª–∏–π. –í —É—Å–ª–æ–≤–∏—è—Ö –Ω–æ—Ä–º–∞–ª—å–Ω–æ–≥–æ –∞—Ç–º–æ—Å—Ñ–µ—Ä–Ω–æ–≥–æ –¥–∞–≤–ª–µ–Ω–∏—è –≥–µ–ª–∏–π —Å–∂–∏–∂–∞–µ—Ç—Å—è –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ 4,3–ö (-268,8*–°). –ï—Å–ª–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –ø–æ–Ω–∏–∂–∞—Ç—å –∏ –¥–∞–ª–µ–µ, —Ç–æ –ø—Ä–∏ 2,2*–ö —Å–≤–æ–π—Å—Ç–≤–∞ –∂–∏–¥–∫–æ–≥–æ –≥–µ–ª–∏—è –≤–¥—Ä—É–≥ —Ä–µ–∑–∫–æ –º–µ–Ω—è—é—Ç—Å—è – –≤ —á–∞—Å—Ç–Ω–æ—Å—Ç–∏, –ø–æ–ª–Ω–æ—Å—Ç—å—é –∏—Å—á–µ–∑–∞–µ—Ç –≤—è–∑–∫–æ—Å—Ç—å. (–û–¥–Ω–∞–∂–¥—ã –æ—Ö–ª–∞–∂–¥–µ–Ω–Ω—ã–π –¥–æ —Ç–∞–∫–æ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã –∂–∏–¥–∫–∏–π –≥–µ–ª–∏–π –Ω–∞–ª–∏–ª–∏ –≤ —Å–æ—Å—É–¥ —Å —Ç–æ–Ω—á–∞–π—à–∏–º–∏ –º–∏–∫—Ä–æ–ø–æ—Ä–∞–º–∏, —á–µ—Ä–µ–∑ –∫–æ—Ç–æ—Ä—ã–µ –≤–æ–¥–∞ –º–æ–≥–ª–∞ –±—ã –ø—Ä–æ—Å–æ—á–∏—Ç—å—Å—è –ª–∏—à—å –∑–∞ –º–∏–ª–ª–∏–∞—Ä–¥—ã –ª–µ—Ç; –∂–∏–¥–∫–∏–π –∂–µ –≥–µ–ª–∏–π, –∫ –Ω–µ–º–∞–ª–æ–º—É —É–¥–∏–≤–ª–µ–Ω–∏—é —ç–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç–∞—Ç–æ—Ä–æ–≤, –ø—Ä–æ—Å–æ—á–∏–ª—Å—è –≤—Å–µ–≥–æ –∑–∞ –Ω–µ—Å–∫–æ–ª—å–∫–æ —Å–µ–∫—É–Ω–¥.) –¢–∞–∫ –∂–µ, —Å–∫–∞—á–∫–æ–º, –ø—Ä–∏ —ç—Ç–æ–º –º–µ–Ω—è—é—Ç—Å—è —Ç–µ–ø–ª–æ–µ–º–∫–æ—Å—Ç—å –∏ —Å–∂–∏–º–∞–µ–º–æ—Å—Ç—å –∂–∏–¥–∫–æ–≥–æ –≥–µ–ª–∏—è, –∫–æ—ç—Ñ—Ñ–∏—Ü–∏–µ–Ω—Ç –µ–≥–æ —Ç–µ–ø–ª–æ–≤–æ–≥–æ —Ä–∞—Å—à–∏—Ä–µ–Ω–∏—è. –°–∫–∞—á–∫–æ–æ–±—Ä–∞–∑–Ω–æ–µ –∏–∑–º–µ–Ω–µ–Ω–∏–µ –Ω–∞–∑–≤–∞–Ω–Ω—ã—Ö —Ö–∞—Ä–∞–∫—Ç–µ—Ä–∏—Å—Ç–∏–∫ –≤–µ—â–µ—Å—Ç–≤–∞ –∏ —Å–ª—É–∂–∏—Ç –æ—Ç–ª–∏—á–∏—Ç–µ–ª—å–Ω–æ–π –æ—Å–æ–±–µ–Ω–Ω–æ—Å—Ç—å—é —Ñ–∞–∑–æ–≤—ã—Ö –ø–µ—Ä–µ—Ö–æ–¥–æ–≤ –≤—Ç–æ—Ä–æ–≥–æ —Ä–æ–¥–∞. –ü–µ—Ä–µ—Ö–æ–¥ –∂–∏–¥–∫–æ–≥–æ –≥–µ–ª–∏—è –≤ —Å–≤–µ—Ä—Ö—Ç–µ–∫—É—á–µ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ –Ω–µ –µ–¥–∏–Ω—Å—Ç–≤–µ–Ω–Ω—ã–π –ø—Ä–∏–º–µ—Ä –ø–æ–¥–æ–±–Ω—ã—Ö –ø—Ä–µ–≤—Ä–∞—â–µ–Ω–∏–π. –ù–∞–±–ª—é–¥–∞—é—Ç—Å—è –æ–Ω–∏ –∏ –≤ —Ç–≤–µ—Ä–¥—ã—Ö —Ç–µ–ª–∞—Ö – —ç—Ç–æ, –Ω–∞–ø—Ä–∏–º–µ—Ä, –ø–µ—Ä–µ—Ö–æ–¥ –∂–µ–ª–µ–∑–∞ –∏–∑ —Ñ–µ—Ä—Ä–æ–º–∞–≥–Ω–∏—Ç–Ω–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è –≤ –ø–∞—Ä–∞–º–∞–≥–Ω–∏—Ç–Ω–æ–µ (—Å –Ω–∞–º–∞–≥–Ω–∏—á–µ–Ω–Ω—ã–º –∂–µ–ª–µ–∑–æ–º —ç—Ç–æ —Å–ª—É—á–∞–µ—Ç—Å—è –ø—Ä–∏ –Ω–∞–≥—Ä–µ–≤–µ –¥–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã 770*–°, –Ω–∞–∑—ã–≤–∞–µ–º–æ–π —Ç–æ—á–∫–∞ –ö—é—Ä–∏).
–§–∞–∑–æ–≤—ã–µ –ø–µ—Ä–µ—Ö–æ–¥—ã –≤—Ç–æ—Ä–æ–≥–æ —Ä–æ–¥–∞ –Ω–∞—Ö–æ–¥—è—Ç—Å—è –≤ –≤–µ–¥–µ–Ω–∏–∏ –∫–≤–∞–Ω—Ç–æ–≤–æ–π —Ñ–∏–∑–∏–∫–∏.
–ì–∞–∑–æ–æ–±—Ä–∞–∑–Ω–æ–µ –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ
–ï—Å–ª–∏ –≤–µ—â–µ—Å—Ç–≤–æ —Å–æ—Å—Ç–æ–∏—Ç –∏–∑ –∏–æ–Ω–æ–≤, —Ç–æ —Å —Ä–æ—Å—Ç–æ–º –∏—Ö –∑–∞—Ä—è–¥–∞ –±—É–¥–µ—Ç –ø–æ–≤—ã—à–∞—Ç—å—Å—è –∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –∫–∏–ø–µ–Ω–∏—è –≤–µ—â–µ—Å—Ç–≤–∞. –í —Å–∞–º–æ–º –¥–µ–ª–µ, –∏–æ–Ω—ã –∫–∏—Å–ª–æ—Ä–æ–¥–∞ –∏ –º–∞–≥–Ω–∏—è –∏–º–µ—é—Ç –ø—Ä–∏–º–µ—Ä–Ω–æ —Ç–µ –∂–µ —Ä–∞–∑–º–µ—Ä—ã, —á—Ç–æ –∏ –∏–æ–Ω—ã —Ñ—Ç–æ—Ä–∞ –∏ –ª–∏—Ç–∏—è, –Ω–æ –æ–±–ª–∞–¥–∞—é—Ç –≤–¥–≤–æ–µ –±–æ–ª—å—à–∏–º–∏ –∑–∞—Ä—è–¥–∞–º–∏, –∏, –∫–∞–∫ —Å–ª–µ–¥—Å—Ç–≤–∏–µ, —Ñ—Ç–æ—Ä–∏—Å—Ç—ã–π –ª–∏—Ç–∏–π –∫–∏–ø–∏—Ç –ø—Ä–∏ 1681*–°, –∞ –æ–∫–∏—Å—å –º–∞–≥–Ω–∏—è – –ø—Ä–∏ 3600*–°, –Ω–∞ –¥–≤–µ —Ç—ã—Å—è—á–∏ –≥—Ä–∞–¥—É—Å–æ–≤ –≤—ã—à–µ!
–ö–∞–∫ –∏ –≤ —Å–ª—É—á–∞–µ –ø–ª–∞–≤–ª–µ–Ω–∏—è, –ø–∞—Ä–æ–æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏–µ —Ç–∞–∫–∂–µ —Ç—Ä–µ–±—É–µ—Ç –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—ã—Ö –∑–∞—Ç—Ä–∞—Ç —ç–Ω–µ—Ä–≥–∏–∏, –∏–¥—É—â–∏—Ö –Ω–∞ —Ä–∞–∑—Ä—ã–≤ –º–µ–∂–º–æ–ª–µ–∫—É–ª—è—Ä–Ω—ã—Ö —Å–≤—è–∑–µ–π. –í —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤–∏–∏ —Å —ç—Ç–∏–º –¥–æ –ø–æ–ª–Ω–æ–≥–æ –ø–µ—Ä–µ—Ö–æ–¥–∞ –∂–∏–¥–∫–æ—Å—Ç–∏ –≤ –≥–∞–∑ –µ–µ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –Ω–µ –∏–∑–º–µ–Ω—è–µ—Ç—Å—è, –ø–æ–¥–æ–±–Ω–æ —Ç–æ–º—É, –∫–∞–∫ —ç—Ç–æ –Ω–∞–±–ª—é–¥–∞–µ—Ç—Å—è –∏ –ø—Ä–∏ –ø–µ—Ä–µ—Ö–æ–¥–µ –∏–∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è –≤ –∂–∏–¥–∫–æ–µ. –ü–æ—ç—Ç–æ–º—É –ø–µ—Ä–µ—à–µ–¥—à–µ–µ –≤ –ø–∞—Ä –≤–µ—â–µ—Å—Ç–≤–æ —Å–æ–¥–µ—Ä–∂–∏—Ç –≤ —Å–µ–±–µ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—ã–π –∏–∑–±—ã—Ç–æ–∫ —ç–Ω–µ—Ä–≥–∏–∏ –ø–æ —Å—Ä–∞–≤–Ω–µ–Ω–∏—é —Å –∂–∏–¥–∫–æ—Å—Ç—å—é —Ç–æ–π –∂–µ —Å–∞–º–æ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã (–≤–æ—Ç –ø–æ—á–µ–º—É –æ–∂–æ–≥ –≤–æ–¥—è–Ω—ã–º –ø–∞—Ä–æ–º, –∏–º–µ—é—â–∏–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É 100*–°, –≥–æ—Ä–∞–∑–¥–æ –æ–ø–∞—Å–Ω–µ–µ –æ–∂–æ–≥–∞ –≥–æ—Ä—è—á–µ–π –≤–æ–¥–æ–π —Ç–æ–π –∂–µ —Å–∞–º–æ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã).
Ну, а как ведут себя в этом отношении аморфные вещества? Уже говорилось, что их молекулы, как правило, полимерные. Термическая устойчивость таких соединений обычно ниже, нежели у низкомолекулярных веществ, и поэтому в подавляющем большинстве их молекулы не «доживают» при нагревании не то что до точки кипения, но даже и до точки плавления. Таковы, в частности, все важнейшие составляющие нашего организма Руглеводы, жиры, белки.
Если все более повышать температуру _газа, то можно будет обнаружить еще одно, так сказать, «подсостояние». Оно дало о себе знать, когда на повестку дня науки и техники встал вопрос о сжижении газов.
Как перевести газ в жидкость? Очевидно, надо снизить его температуру ниже точки кипения при данном давлении (для начала, предположим, его нормальным, атмосферным). Правда, такой путь не очень-то хорош, когда речь идет о сжижении низкокипящих веществ Ртаких, как азот, водород, углекислый газ: слишком низки температуры их кипения. Обнаружилось, что сжижить газы можно, призвав на помощь внешнее давление. Как уже говорилось, под его воздействием молекулы вещества начинают как бы «прилипать» друг к другу, образуя жидкость. Так, значит, дело лишь за давлением? Оказалось, что нет: отнюдь не все газы почему-то удавалось обратить в жидкость подобным способом. Хлор, аммиак, углекислый газ хоть и с трудом, но поддались ему, а вот кислород, азот, окись углерода, водород, гелий упорно не желали сжижаться.
–ü—Ä–∏—á–∏–Ω—É —ç—Ç–æ–≥–æ –∑–∞–≥–∞–¥–æ—á–Ω–æ–≥–æ —è–≤–ª–µ–Ω–∏—è –≤—Å–∫—Ä—ã–ª –î.–ò. –ú–µ–Ω–¥–µ–ª–µ–µ–≤. –û–Ω –≤—ã—è—Å–Ω–∏–ª, —á—Ç–æ —É –≤—Å—è–∫–æ–≥–æ –≥–∞–∑–∞, –Ω–∞—á–∏–Ω–∞—è —Å –Ω–µ–∫–æ—Ç–æ—Ä–æ–π, —Ç–∞–∫ –Ω–∞–∑—ã–≤–∞–µ–º–æ–π –∫—Ä–∏—Ç–∏—á–µ—Å–∫–æ–π, —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã, —Å–∫–æ—Ä–æ—Å—Ç—å –¥–≤–∏–∂–µ–Ω–∏—è –º–æ–ª–µ–∫—É–ª –Ω–∞—Ä–∞—Å—Ç–∞–µ—Ç –¥–æ —Ç–∞–∫–∏—Ö –≤–µ–ª–∏—á–∏–Ω, —á—Ç–æ —É–∂–µ –Ω–∏–∫–∞–∫–∏–º –¥–∞–≤–ª–µ–Ω–∏–µ–º –∏–∑–≤–Ω–µ —Å–æ–±—Ä–∞—Ç—å –∏—Ö –≤ –µ–¥–∏–Ω—ã–π –∞–Ω—Å–∞–º–±–ª—å –Ω–µ —É–¥–∞—Å—Ç—Å—è: —Ç–µ—Ö —Å–∏–ª —Å—Ü–µ–ø–ª–µ–Ω–∏—è, –∫–æ—Ç–æ—Ä—ã–µ –≤–æ–∑–Ω–∏–∫–∞—é—Ç –º–µ–∂–¥—É –º–æ–ª–µ–∫—É–ª–∞–º–∏ –∑–∞ —Å—á–µ—Ç —Ä–∞–∑–ª–∏—á–Ω—ã—Ö —Ö–∏–º–∏—á–µ—Å–∫–∏—Ö –∏ —Ñ–∏–∑–∏–∫–æ-—Ö–∏–º–∏—á–µ—Å–∫–∏—Ö —Å–≤—è–∑–µ–π, –Ω–µ —Ö–≤–∞—Ç–∏—Ç –¥–ª—è —Ç–æ–≥–æ, —á—Ç–æ–æ—ã —Å–¥–µ—Ä–∂–∞—Ç—å –º–æ–ª–µ–∫—É–ª—ã. –í—ã—à–µ —ç—Ç–æ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã –≥–∞–∑ –Ω–µ –æ–±—Ä–∞—Ç–∏—Ç—Å—è –≤ –∂–∏–¥–∫–æ—Å—Ç—å —É–∂–µ –Ω–∏ –ø—Ä–∏ –∫–∞–∫–∏—Ö –¥–∞–≤–ª–µ–Ω–∏—è—Ö. –ó–Ω–∞—á–∏—Ç, –¥–ª—è –µ–≥–æ –ø–µ—Ä–µ–≤–æ–¥–∞ –≤ –∂–∏–¥–∫–æ—Å—Ç—å, –ø–æ –∫—Ä–∞–π–Ω–µ–π –º–µ—Ä–µ, –Ω–µ–æ–±—Ö–æ–¥–∏–º–æ –æ—Ö–ª–∞–¥–∏—Ç—å –µ–≥–æ –¥–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã –Ω–∏–∂–µ –∫—Ä–∏—Ç–∏—á–µ—Å–∫–æ–π. –£ –≥–∞–∑–æ–≤, –∫–æ—Ç–æ—Ä—ã–µ –Ω–∏–∫–∞–∫ –Ω–µ –∂–µ–ª–∞–ª–∏ —Å–∂–∏–∂–∞—Ç—å—Å—è, –æ–Ω–∞ –æ–∫–∞–∑–∞–ª–∞—Å—å –æ—á–µ–Ω—å –Ω–∏–∑–∫–æ–π (-118*–° —É –∫–∏—Å–ª–æ—Ä–æ–¥–∞, -140*–° —É –æ–∫–∏—Å–∏ —É–≥–ª–µ—Ä–æ–¥–∞, -240*–° —É –≤–æ–¥–æ—Ä–æ–¥–∞; –¥–ª—è —Å—Ä–∞–≤–Ω–µ–Ω–∏—è —Å–∫–∞–∂–µ–º, —á—Ç–æ —É –≤–æ–¥—ã —ç—Ç–∞ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ —Ä–∞–≤–Ω–∞ 373*–°).
–ó–¥–µ—Å—å —É–º–µ—Å—Ç–Ω–æ —Å–∫–∞–∑–∞—Ç—å –Ω–µ—Å–∫–æ–ª—å–∫–æ —Å–ª–æ–≤ –æ–± –∏–Ω–µ—Ä—Ç–Ω—ã—Ö –≥–∞–∑–∞—Ö. –°–æ –≤—Ä–µ–º–µ–Ω–µ–º –∏—Ö –≤—Å–µ —É–¥–∞–ª–æ—Å—å –ø–µ—Ä–µ–≤–µ—Å—Ç–∏ —Å–Ω–∞—á–∞–ª–∞ –≤ –∂–∏–¥–∫–æ–µ, –∞ –ø–æ—Ç–æ–º –∏ –≤ —Ç–≤–µ—Ä–¥–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ. –û—Å—Ç–∞–≤–∞–ª–æ—Å—å, –æ–¥–Ω–∞–∫–æ, –Ω–µ–ø–æ–Ω—è—Ç–Ω—ã–º, –∑–∞ —Å—á–µ—Ç –∫–∞–∫–∏—Ö –∂–µ —Å–∏–ª —ç—Ç–∏ —Å–æ—Å—Ç–æ—è–Ω–∏—è —Ä–µ–∞–ª–∏–∑—É—é—Ç—Å—è – –≤–µ–¥—å –Ω–∏ –∏–æ–Ω–Ω—ã—Ö, –Ω–∏ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω—ã—Ö —Å–≤—è–∑–µ–π –º–µ–∂–¥—É –∞—Ç–æ–º–∞–º–∏ –∏–Ω–µ—Ä—Ç–Ω—ã—Ö –≥–∞–∑–æ–≤ –Ω–µ –≤–æ–∑–Ω–∏–∫–∞–µ—Ç. –ü—Ä–∏—Ä–æ–¥—É –ø—Ä–∏—Å—É—â–∏—Ö –∏–º —Å–∏–ª —Å—Ü–µ–ø–ª–µ–Ω–∏—è (–æ–Ω–∏ –ø–æ–ª—É—á–∏–ª–∏ –Ω–∞–∑–≤–∞–Ω–∏–µ –¥–∏—Å–ø–µ—Ä—Å–∏–æ–Ω–Ω—ã–µ —Å–∏–ª—ã) —É–¥–∞–ª–æ—Å—å –≤—ã—è—Å–Ω–∏—Ç—å –ª–∏—à—å —Å–æ–≤—Å–µ–º –Ω–µ–¥–∞–≤–Ω–æ. –û–±–Ω–∞—Ä—É–∂–∏–ª–æ—Å—å, —á—Ç–æ –≤ –¥–∞–Ω–Ω–æ–º —Å–ª—É—á–∞–µ –∞—Ç–æ–º—ã –ø–æ–ª—è—Ä–∏–∑—É—é—Ç—Å—è, –≤–Ω—É—Ç—Ä–∏ –Ω–∏—Ö –ø—Ä–æ–∏—Å—Ö–æ–¥–∏—Ç —Ä–∞–∑–¥–µ–ª–µ–Ω–∏–µ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–∏—Ö –∑–∞—Ä—è–¥–æ–≤: –≤ —Ü–µ–ª–æ–º –∫–∞–∂–¥—ã–π –∞—Ç–æ–º –æ—Å—Ç–∞–µ—Ç—Å—è –Ω–µ–π—Ç—Ä–∞–ª—å–Ω—ã–º, –Ω–æ –≤ –æ–¥–Ω–æ–π –µ–≥–æ —á–∞—Å—Ç–∏ –Ω–∞ –∫–æ—Ä–æ—Ç–∫–æ–µ –≤—Ä–µ–º—è –æ–±—Ä–∞–∑—É–µ—Ç—Å—è –∏–∑–±—ã—Ç–æ–∫ —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤, –∏ –æ–¥–Ω–∞ —á–∞—Å—Ç—å –∑–∞—Ä—è–∂–∞–µ—Ç—Å—è –æ—Ç—Ä–∏—Ü–∞—Ç–µ–ª—å–Ω–æ, –¥—Ä—É–≥–∞—è –∂–µ —á–∞—Å—Ç—å, –≥–¥–µ –≤–æ–∑–Ω–∏–∫–∞–µ—Ç –¥–µ—Ñ–∏—Ü–∏—Ç —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤, –∑–∞—Ä—è–∂–∞–µ—Ç—Å—è –ø–æ–ª–æ–∂–∏—Ç–µ–ª—å–Ω–æ. –í —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ —Ç–∞–∫–æ–π –≤–æ—Ç –ø–æ–ª—è—Ä–∏–∑–∞—Ü–∏–∏ –≤–æ–∑–Ω–∏–∫–∞—é—Ç —Å–ª–∞–±—ã–µ –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤–∏—è –º–µ–∂–¥—É –∞—Ç–æ–º–∞–º–∏ –∑–∞ —Å—á–µ—Ç –≤–∑–∞–∏–º–æ–ø—Ä–∏—Ç—è–∂–µ–Ω–∏—è –∏—Ö —á–∞—Å—Ç–µ–π, –∑–∞—Ä—è–∂–µ–Ω–Ω—ã—Ö —Ä–∞–∑–Ω–æ–∏–º–µ–Ω–Ω–æ. –•—É–¥–æ-–±–µ–¥–Ω–æ, –∞ —Ö–æ—Ç—å –∫–∞–∫–∏–µ-—Ç–æ —Å–≤—è–∑–∏ –º–µ–∂–¥—É –∞—Ç–æ–º–∞–º–∏ –ø—Ä–∏ —ç—Ç–æ–º, –æ–±–µ—Å–ø–µ—á–∏–≤–∞—é—Ç—Å—è.
–ö–æ–≥–¥–∞ –∏—Å—Å–ª–µ–¥–æ–≤–∞–ª–æ—Å—å —Å–∂–∏–∂–µ–Ω–∏–µ –∏ –∑–∞—Ç–≤–µ—Ä–¥–µ–≤–∞–Ω–∏–µ –∏–Ω–µ—Ä—Ç–Ω—ã—Ö –≥–∞–∑–æ–≤, –≤—ã—è—Å–Ω–∏–ª–∞—Å—å –∏–Ω—Ç–µ—Ä–µ—Å–Ω–∞—è –ø–æ–¥—Ä–æ–±–Ω–æ—Å—Ç—å: –∂–∏–¥–∫–∏–π –≥–µ–ª–∏–π –Ω–µ –∂–µ–ª–∞–µ—Ç –∫—Ä–∏—Å—Ç–∞–ª–ª–∏–∑–æ–≤–∞—Ç—å—Å—è –¥–∞–∂–µ –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–µ, –ø—Ä–∞–∫—Ç–∏—á–µ—Å–∫–∏ –Ω–µ–æ—Ç–ª–∏—á–∏–º–æ–π –æ—Ç –∞–±—Å–æ–ª—é—Ç–Ω–æ–≥–æ –Ω—É–ª—è: 0,0001*–ö! –ù–æ –µ—Å–ª–∏ –Ω–∞ –ø–æ–º–æ—â—å —Å—Ç–æ–ª—å –∂–µ—Å—Ç–æ–∫–æ–º—É –º–æ—Ä–æ–∑—É –ø—Ä–∏–∑–≤–∞—Ç—å –≤—ã—Å–æ–∫–æ–µ –¥–∞–≤–ª–µ–Ω–∏–µ –≤ 25 –∞—Ç–º–æ—Å—Ñ–µ—Ä –∏ –±–æ–ª–µ–µ, —Å–¥–∞–µ—Ç—Å—è –∏ –≥–µ–ª–∏–π. –°—Ç–æ–∏—Ç, –æ–¥–Ω–∞–∫–æ, —ç—Ç–æ –¥–∞–≤–ª–µ–Ω–∏–µ —Å–Ω—è—Ç—å, –∏ –≥–µ–ª–∏–π –æ–ø—è—Ç—å –≤–æ–∑–≤—Ä–∞—â–∞–µ—Ç—Å—è –≤ –∂–∏–¥–∫–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ… –°—Ç–æ–ª—å –ª—é–±–æ–ø—ã—Ç–Ω–∞—è –æ—Å–æ–±–µ–Ω–Ω–æ—Å—Ç—å —Å–≤—è–∑–∞–Ω–∞ —Å —Ç–µ–º, —á—Ç–æ –¥–∞–∂–µ –ø—Ä–∏ –∞–±—Å–æ–ª—é—Ç–Ω–æ–º –Ω—É–ª–µ –Ω–µ –ø—Ä–µ–∫—Ä–∞—â–∞—é—Ç—Å—è –¥–≤–∏–∂–µ–Ω–∏—è, —Ç–∞–∫ –Ω–∞–∑—ã–≤–∞–µ–º—ã–µ –Ω—É–ª–µ–≤—ã–µ –∫–æ–ª–µ–±–∞–Ω–∏—è –º–æ–ª–µ–∫—É–ª, –∫–æ—Ç–æ—Ä—ã–µ —Ö–æ—Ç—å –∏ —Å–ª–∞–±—ã, –Ω–æ –ø—Ä–∏ —Å–ª–∞–±—ã—Ö —Å–∏–ª–∞—Ö –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤–∏—è –º–µ–∂–¥—É –º–æ–ª–µ–∫—É–ª–∞–º–∏ –∏–Ω–µ—Ä—Ç–Ω—ã—Ö –≥–∞–∑–æ–≤ –º–æ–≥—É—Ç –≤–æ—Å–ø—Ä–µ–ø—è—Ç—Å—Ç–≤–æ–≤–∞—Ç—å —Å—Ç–∞–Ω–æ–≤–ª–µ–Ω–∏—é –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–æ–π —Ä–µ—à–µ—Ç–∫–∏.
–°–µ–π—á–∞—Å –¥–ª—è –º–Ω–æ–≥–∏—Ö –≤–µ—â–µ—Å—Ç–≤ —É–∂–µ –¥–æ—Å—Ç–∞—Ç–æ—á–Ω–æ —Ö–æ—Ä–æ—à–æ –æ—Ö–∞—Ä–∞–∫—Ç–µ—Ä–∏–∑–æ–≤–∞–Ω—ã —Ç–µ —É—Å–ª–æ–≤–∏—è, –ø—Ä–∏ –∫–æ—Ç–æ—Ä—ã—Ö –æ–Ω–æ —Å—É—â–µ—Å—Ç–≤—É–µ—Ç –≤ —Ç–æ–º –∏–ª–∏ –∏–Ω–æ–º –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–º —Å–æ—Å—Ç–æ—è–Ω–∏–∏. –°–æ–≤–æ–∫—É–ø–Ω–æ—Å—Ç—å —ç—Ç–∏—Ö —É—Å–ª–æ–≤–∏–π –º–æ–∂–µ—Ç –±—ã—Ç—å –æ—Ç–æ–±—Ä–∞–∂–µ–Ω–∞ –Ω–∞ —Ç–∞–∫ –Ω–∞–∑—ã–≤–∞–µ–º–æ–π –¥–∏–∞–≥—Ä–∞–º–º–µ –∞–≥—Ä–µ–≥–∞—Ç–Ω—ã—Ö —Å–æ—Å—Ç–æ—è–Ω–∏–π, –≥–¥–µ –ø–æ –æ—Å–∏ –∞–±—Å—Ü–∏—Å—Å –æ—Ç–∫–ª–∞–¥—ã–≤–∞–µ—Ç—Å—è –¥–∞–≤–ª–µ–Ω–∏–µ, –∞ –ø–æ –æ—Å–∏ –æ—Ä–¥–∏–Ω–∞—Ç – —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞. –ù–µ–∫–æ—Ç–æ—Ä—ã–µ –∏–∑ —ç—Ç–∏—Ö –¥–∏–∞–≥—Ä–∞–º–º –ø—Ä–∏–≤–µ–¥–µ–Ω—ã –Ω–∞ —Ä–∏—Å—É–Ω–∫–µ.
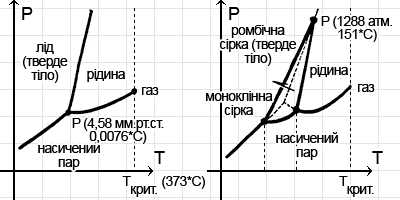
–ö–∞–∂–¥–∞—è –ø–æ—Ö–æ–∂–∞ –Ω–∞ –ø—Ä–∏—á—É–¥–ª–∏–≤–æ-–∫—Ä–∏–≤—É—é —Ä–æ–≥–∞—Ç–∫—É. –ï—Å–ª–∏ –∂–µ –æ—Ç–æ–±—Ä–∞–∂–∞—Ç—å –Ω–∞ —Ç–∞–∫–æ–π –¥–∏–∞–≥—Ä–∞–º–º–µ –≤—Å–µ –≤–æ–∑–º–æ–∂–Ω—ã–µ –∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏–µ —Ä–µ—à–µ—Ç–∫–∏, —Ä–µ–∞–ª–∏–∑—É–µ–º—ã–µ –≤ —Ç–≤–µ—Ä–¥–æ–º —Å–æ—Å—Ç–æ—è–Ω–∏–∏, —Å–µ—Ç–∫–∞ –ª–∏–Ω–∏–π —É—Å–ª–æ–∂–Ω—è–µ—Ç—Å—è.
Сера, как уже говорилось ранее, существует в виде двух модификаций – ромбической и моноклинной, и замкнутый контур на диаграмме ее состояний как раз и показывает ту область температур и давлений, в которых может существовать моноклинная сера. Весьма сложной получается диаграмма состояний воды: у льда, оказывается, известно шесть модификаций.
–ü–µ—Ä–µ—Ö–æ–¥ –∏–∑ –æ–¥–Ω–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è –≤ –¥—Ä—É–≥–æ–µ –≤ –≤–µ—â–µ—Å—Ç–≤–µ –≤—ã–∑—ã–≤–∞–µ—Ç—Å—è, –∫–∞–∫ –ø—Ä–∞–≤–∏–ª–æ, –ø–æ–≤—ã—à–µ–Ω–∏–µ–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ã. –ê —á—Ç–æ –±—É–¥–µ—Ç, –µ—Å–ª–∏, –¥–æ–≤–µ–¥—è –¥–æ –≥–∞–∑–æ–æ–±—Ä–∞–∑–Ω–æ–≥–æ —Å–æ—Å—Ç–æ—è–Ω–∏—è, –ø–æ–≤—ã—à–∞—Ç—å —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –≤–µ—â–µ—Å—Ç–≤–∞ –∏ –¥–∞–ª–µ–µ?
Чем выше температура, тем стремительнее движение частиц вещества. По мере нагрева рано или поздно молекулы во взаимных столкновениях, все более энергичных, станут распадаться на атомы, а при температурах в несколько десятков тысяч градусов атомы будут рассыпаться на ионы и электроны. Возникнет плазма, которую называют четвертым состоянием вещества…










