Натрій Na у вигляді металу вперше отриманий в 1807 році (Деві, Англія) при електролізі розплаву натрій гідроксиду за допомогою вольтова стовпа.
Поширення натрію в природі. Натрій – шостий елемент за розповсюдженням в земній корі, де він знаходиться тільки у вигляді сполук. Входить до складу мінералів, соляних пластів, живих організмів, міститься в природних водах (10,6 грам іонів Na+ в 1 дм3 морської води).
Мінерали натрію: Галіт (кам’яна сіль) NaCl; Нітронатріт (натронна або чилійська селітра) NaNO3; Криоліт Na3[AlF6]; Альбіт (натрієвий польовий шпат) Na(AlSiO3O8).
Походження і склад соляних пластів. Нерозчинні силікатні мінерали, що містять лужні елементи, наприклад група польового шпату, які знаходяться на поверхні Землі, постійно піддаються вивітрюванню – поглинають воду і утворюють глини і розчинні солі лужних елементів. Ці солі з водою річок і струмків переносяться в озера, моря і океани. Випаровування води призводить до випадання кристалів різних солей з прибережних вод і утворенню пластів.
Порядок розташування солей в пластах визначається розчинністю: найменш розчинні солі розташовані знизу (зазвичай це ангідрит CaSO4); над потужними пластами галіту NaCl можуть знаходитись деякі солі калію і магнію. Між шарами окремих солей зазвичай є шари глин і піщаників.
Видобуток природних солей. Розробку соляних пластів, зокрема кам’яної солі проводять або методом вибухового руйнування і вилучення твердої солі, або методом розчинення солі під землею, відкачуванням розсолу – концентрованого розчину солі і його випаровування.
Виявлення натрію. За інтенсивно-жовтим кольором полум’я, яке зникає якщо дивитися на полум’я через кобальтове (синє) скло.
Фізіологічна дія натрію. Натрій – життєво важливий елемент для всіх тварин і деяких рослин; іони Na+ містяться в плазмі крові і в лімфі, на відміну від іонів K+, іони натрію завжди знаходяться поза клітинами.
Отримання натрію. Електроліз розплаву NaOH або суміші NaCl + CaCl2; в якості матеріалу катода використовують або тверде залізо, або рідкий свинець (в останньому випадку натрій відокремлюють від свинцю дистиляцією).
Властивості натрію. Натрій – метал з сріблястим глянцем. М’який, ріжеться ножем. Пара натрію забарвлена в темно-червоний колір. На повітрі поверхня металу швидко покривається шаром NaOH і Na2CO3.
Натрій активно реагує з водою
2Na + 2H2O = 2NaOH + H2
Шматочки натрію під дією теплоти, що виділяється при реакції (для реакції з твердим натрієм ΔH0 = -368 кДж) розплавляються в кульки, які починають безладно рухатися по поверхні води внаслідок виділення водню. Над окремими ділянками поверхні відбувається самозаймання водню або місцеві вибухи гримучого газу (характерні клацання), особливо якщо кулька рідкого натрію прилипає до стінки судини і сильно розігрівається. При цьому можливе розбризкування розчину лугу, який утворюється під час реакції (при роботі з натрієм необхідно дотримуватися обережності, очі слід захищати запобіжними окулярами!).
Взаємодія натрію зі спиртами протікає менш інтенсивно, ніж з водою (що використовується для видалення залишків натрію):
2Na + 2C2H5OH = 2Na(C2H5O) + H2
При нагріванні на повітрі і в атмосфері хлору натрій утворює відповідно пероксид Na2O2 (Na2O в реакції з киснем утворюється в якості домішку, для отримання Na2O, Na2O2 сплавляють з Na) і хлорид натрію NaCl:
2Na + O2 = Na2O2; 2Na + Cl2 = 2NaCl
З ртуттю натрій утворює амальгаму. Натрій розчинний в рідкому аміаку.
Застосування натрію. Натрій використовується в якості наповнювача натрієвих газорозрядних ламп, як рідкий теплоносій в ядерних реакторах, осушувач звичайного ефіру і інших (безалкогольних) органічних розчинників, для отримання Na2O2, NaCl, в деяких органічних синтезах.
Сполуки натрію
Натрій хлорид NaCl
Поширеність натрій хлориду в природі. Натрій хлорид міститься в соляних пластах (галіт), природних розсолах, морській воді (в середньому 2,7%) і солоному вугіллі (більше 12%), а також в живих організмах.
Видобуток натрій хлориду
- Натрій хлорид отримують з соляних розсолів шляхом випарювання (виварювальна сіль). Найчастіше до випарювання проводять градирування – концентрування розчину, для чого в спеціальних баштах – градирнях – соляний розсіл розбризкують, при цьому частина води випаровується, а малорозчинні солі, такі як гіпс осідають. Повторюючи цю операцію кілька разів, розсіл концентрують до 20% і потім випарюють всю воду використовуючи вакуумі випарні апарати.
- Методом вибухового руйнування з соляних пластів, або розчинення під землею з наступним відкачуванням розсолу і його випарюванням.
- З морської води шляхом випаровування або охолодження (отримання самосадочної солі).
Очищення натрій хлориду. Зазвичай проводять очистку натрій хлориду від катіонів Mg2+ і Ca2+, для чого сіль обробляють розчином Na2CO3 і осаджують CaCO3 і MgCO3. Від аніонів SO42- розчин очищають обробкою Ca(OH)2 осадженням у вигляді CaSO4.
Фізіологічна дія натрій хлориду. В організмі людини (в крові і тканинах) міститься 150-300 грам NaCl, добова норма поповнення запасів натрій хлориду в організмі становить 10-15 грам. Надмірне споживання кухонної солі шкідливе для здоров’я (при хворобах нирок їжа повинна бути без солі); гостра токсична доза кухонної солі дорівнює 5 г./кг ваги людини.
У крові міститься 0,9% NaCl, таку ж концентрацію NaCl створюють в фізіологічному розчині, який використовується як тимчасова заміна плазми крові.
Властивості натрій хлориду. Білі кристали. Температура плавлення 801*С, температура кипіння 1440*С. Приблизно однаково добре розчиняються в гарячій і холодній воді (тому очищення перекристалізацією неможливе): при 20*С 35,8 г. NaCl розчиняється в 100 г. H2O, це насичений 26,4% розчин. Насичений розчин натрій хлориду закипає при 109*С. При сильному нагріванні кристали NaCl (кристалізаційна вода відсутня) з хрускотом розсипаються в результаті випаровування залишкового маточного розчину.
Кристали NaCl не гігроскопічні, але магазинна кухонна сіль (харчова) зазвичай легко злежується через наявність домішок гігроскопічного магній хлориду. Для зберігання кухонної солі її очищають від іонів Mg2+ шляхом обробки натрій ортофосфатом Na3PO4 і відділенням практично нерозчинного магній ортофосфату.
В особливих умовах, за повної відсутності води, наприклад під дією концентрованої сульфатної кислоти, з NaCl можна отримати гідроген хлорид:
NaCl + H2SO4 = NaHSO4 + HCl
Застосування натрій хлориду. У хімічній промисловості натрій хлорид використовується як вихідна речовина для отримання багатьох інших сполук натрію і хлору. Деякі з них, а також шляхи їх отримання представлені на схемі
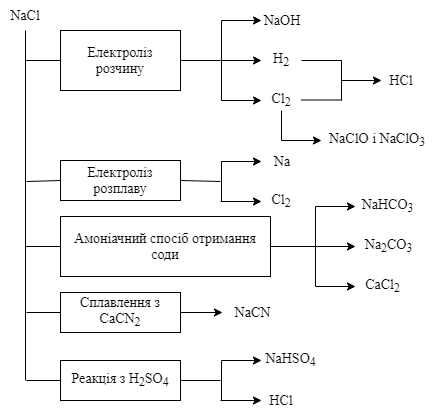
Крім того, NaCl використовується як консервуючий засіб і охолоджуючий розсіл, засіб відсолки при виробництві мила і органічних барвників, компонент глазурі, в керамічній промисловості та запобіжних вибухових сумішей, як присадка при травленні алюмінію і електролітичному нікелюванні. Охолоджуюча суміш NaCl з льодом у співвідношенні 3,5 : 1 забезпечує температуру до -21*С.
Натрій гідроксид NaOH
Тривіальні назви: їдкий натр, каустична сода, каустик; водний розчин NaOH – натрієвий луг.
Отримання натрій гідроксиду.
- Найважливіший промисловий спосіб отримання натрій гідроксиду, це електроліз натрій хлориду. Основними продуктами електролізу є NaOH і газоподібні Cl2 і H2. Процес проводять двома методами: амальгамний метод і діафрагмовий метод.
Використовуючи амальгамний (ртутний) метод отримують дуже чистий і вільний від хлору концентрований розчин натрій гідроксиду.
Через закритий електролізер, який періодично нахиляється (з розмірами, наприклад: довжина 12 метрів, ширина 1,20 метра) зі швидкістю 15 см/с проходить ртуть. Її шар на дні є катодом. В якості анодів використовують титанові пластини, покриті шаром оксидів платинових металів, занурені в гарячий (60-80*С) розчин NaCl. На аноді виділяється газоподібний хлор (2Cl– – 2e– = Cl2), який далі використовують в різних хімічних виробництвах. На ртутному катоді замість катіонів гідрогену (перенапруження водню на ртуті занадто високе) розряджаються катіони натрію (Na+ + e– = Na), розрядженню сприяє також утворення амальгами NaHgx (до 0,2% Na). Амальгамована ртуть при черговому нахилі електролізера перетікає в емності для розкладання амальгами, де амальгама в присутності графіту як каталізатора реагує з гарячою водою:
2NaHgx + 2H2O = 2NaOH + H2 + 2xHg
Ртуть повертають в електролізер.
За діафрагмовим методом одержують відносно дешевий натрій гідроксид, але він забруднений хлором.
В електролізері, що працює по діафрагмовому методу, анодний і катодний простір відокремлені один від одного пористою перегородкою – діафрагмою (наприклад, іонообмінною мембраною на основі фторопласту). Така конструкція дозволяє запобігти взаємодії лугу з газоподібним хлором, що може призвести до утворення натрій гіпохлориту замість лугу:
2NaOH + Cl2 = NaClO + NaCl + H2O
На залізному катоді розряджаються катіони H+ (2H2O + 2e– = H2 + 2OH–), а іони OH– залишаються в розчині. Таким методом отримують 12% розчин натрій гідроксиду, при випарюванні якого викристалізовується надлишковий натрій хлорид (досягти чистоти NaOH вище технічної таким методом не вдається).
- З натрій карбонату Na2CO3 шляхом обробки його в водному розчині гашеним вапном Ca(OH)2 (процес каустифікації; це старий, але дієвий спосіб):
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3
Осад кальцій карбонату відфільтровують, а фільтрат випарюють в залізних чанах, потім сухий луг переплавляють.
Властивості натрій гідроксиду. Білі гігроскопічні сильно агресивні кристали; випускаються у вигляді гранул, паличок, пластинок або лусочок. Температура плавлення 322*С, температура кипіння 1390*С. Натрій гідроксид поглинає вуглекислий газ з повітря (тому NaOH слід зберігати в герметично закритій тарі).
Натрій гідроксид добре розчиняється в воді з виділенням великої кількості теплоти і сильним розігріванням розчину (необхідно дотримуватися обережності і запобігти потраплянню в очі!). Розчин має сильнолужне середовище. Зберігають розчин NaOH в поліетиленовому посуді, оскільки він реагує зі склом.
Натрій гідроксид витісняє при нагріванні амоніак з солей амонію:
NaOH + NH4Cl = NaCl + H2O + NH3
Натрій гідроксид легко руйнує поверхню алюмінію і цинку, важче руйнує поверхню свинцю і олова, на більшість металів NaOH не діє.
Застосування натрій гідроксиду. NaOH є найважливішою сировиною в хімічній промисловості для отримання різних натрієвих солей: нітрату, нітриту, сульфіту, фосфатів, гіпохлориту або відбілювальний луг, силікатів, розчинного скла (канцелярський клей, силікатний клей), фториду, хромату, органічних солей і ін. Натрій гідроксид застосовується у виробництві целюлози з деревини при сульфатному виварюванні, штучних волокон, мила, миючих засобів, змочувачів і емульгаторів, барвників, алюміній оксиду і бокситу, фенолів з мінеральних масел. Натрій гідроксид входить до складу електролітів, призначених для вороніння (чорніння), знежирення, проведення деяких електролітичних процесів (в технології олова і цинку), травлення алюмінію, наприклад в процесі анодування алюмінію.
Натрій карбонат Na2CO3
Тривіальні назви: кальцинована сода Na2CO3; кристалічна сода Na2CO3*10H2O – натрій карбонат декагідрат, містить 63% кристалізаційної води.
Поширення натрій карбонату в природі. Натрій карбонат міститься в воді содових озер (сіль кристалізується в результаті випаровування води) і мінеральних джерел, в золі деяких морських водоростей (200 – 250 років тому соду отримували переважно з золи рослин).
Отримання натрій карбонату.
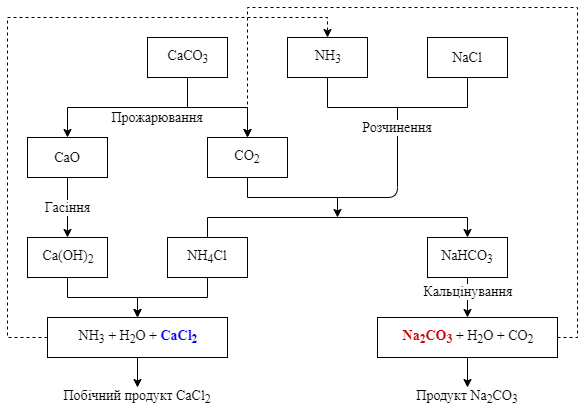
- Промисловий амоніачний спосіб (спосіб Сольве, Франція, 1863 рік). В насичений розчин натрій хлориду пропускають еквімолярні кількості газоподібних амоніаку і карбон діоксиду, тобто ніби вводять амоній гідрокарбонат NH4HCO3:
NH3 + H2O + CO2 + NaCl = NaHCO3 + NH4Cl
Осад малорозчинного натрій гідрокарбонату, який утворюється після пропускання газів, відфільтровують і кальцінують (зневоднюють) нагріванням, при цьому він переходить в натрій карбонат:
2NaHCO3 = Na2CO3 + H2O + CO2
Діоксид карбону, що утворився в процесі реакції, а також амоніак, виділений з розчину, який утворився на першій стадії процесу, по реакції
NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
повертають у виробничий цикл.
Схема аміачного способу отримання соди за методом Сольве
- Спосіб отримання соди за методом Леблана (Франція, 1791 рік) з натрій хлориду, сульфатної кислоти і вугілля (не застосовується).
Властивості натрій карбонату. Натрій карбонат являє собою білі кристали. Температура плавлення 853*С. Кристалогідрат на повітрі вивітрюється (втрачає частину кристалізаційної води), а при 32*С розплавляється. Розчинний у воді, водний розчин має лужну реакцію внаслідок гідролізу солі. При дії багатьох сильних і слабких кислот натрій карбонат розкладається з виділенням карбон діоксиду:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
Na2CO3 + 2CH3COOH = 2Na(CH3COO) + CO2 + H2O
Застосування натрій карбонату. Натрій карбонат є сировиною для отримання інших сполук натрію, для виробництва скла, мила і синтетичних мийних засобів, емалей, ультрамарину. Засіб для усунення жорсткості води, знежирення металів і десульфуризації доменного чавуну.
Натрій сульфат Na2SO4
Тривіальні назви: кальцінований сульфат Na2SO4; глауберова сіль Na2SO4*10H2O.
Поширення натрій сульфату в природі. Велике родовище натрій сульфату знаходиться в затоці Кара-Богаз-Гол (Каспійське море).
Властивості натрій сульфату. Безводний натрій сульфат кристалізується з водного розчину при температурі вище 32,4*С, нижче цієї температури виділяється кристаллогидрат Na2SO4*10H2O, який саме при 32,4*С плавиться і одночасно втрачає воду. Температура плавлення безводного натрій сульфату 884*С.
Отримання натрій сульфату.
- Взаємодія натрій хлориду з сульфатною кислотою. При сильному нагріванні реакційної суміші утворюється натрій сульфат Na2SO4, при більш помірному нагріванні (в лабораторних умовах) утворюється натрій гідросульфат NaHSO4.
- З залишкових розчинів виробництва калій хлориду, що містять іони Na+, Mg2+, Cl–, SO42-; при температурі -5*С з цих розчинів кристалізується глауберова сіль Na2SO4*10H2O.
Обидва способи використовуються в промисловості.
Застосування натрій сульфату. У виробництві віскозного волокна, скла, натрій сульфіду, ультрамарину, фармацевтичних препаратів. Використовується при сульфатному виварюванні целюлози і фарбуванні бавовняних тканин.
Натрій оксид Na2O білий гігроскопічний порошок з температурою плавлення 920*С.
Натрій пероксид Na2O2 світло-жовтий порошок. Запалює вату, папір і порошок алюмінію в присутності невеликої кількості (кілька крапель) води. У промисловості отримують спалюванням натрію в трубчастих печах що обертаються. Використовується для відбілювання тканин, а також для регенерації кисню при поглинанні вуглекислого газу:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Ця реакція застосовується в кисневих ізолюючих приладах.
Натрій сульфід Na2S*9H2O – білі кристали з запахом гідроген сульфіду внаслідок протікає реакції заміщення з участю карбон діоксиду. Розчинний у воді. Отримують спеченням натрій сульфату з вугіллям:
Na2SO4 + 4C = Na2S + 4CO
Застосовують при видаленні волосяного покриву шкіри і дубленні шкір, у виробництві сірчистих барвників і в якості флотоагенту.
Натрій сульфіт Na2SO3, натрій гідросульфіт NaHSO3, динатрій пентаоксодісульфат Na2S2O5 (стара назва метабісульфіт натрію) – білі тверді речовини. Утворюються при введенні сульфур діоксиду в розчин натрій гідроксиду або натрій карбонату. При дії сильних кислот виділяють SO2. Натрій сульфіт нижче 37*С кристалізується у вигляді гептагідрату Na2SO3*7H2O.
Na2S2O5 має незвичайну будову аніона – (O2S-SO3)2-, він містить зв’язок S-S зі ступенями окиснення сульфуру (+III) і (+V) відповідно.
Натрій тіосульфат Na2S2O3*5H2O являє собою білі кристали. При охолодженні легко утворює пересичений розчин. Отримують по реакції:
Na2CO3 + 2Na2S + 4SO2 = 3Na2S2O3 + CO2
При підкисленні розчину натрій тіосульфату утворюється колоїдний розчин сірки:
Na2S2O3 + 2HCl = 2NaCl + SO2 + S + H2O
Аргентум(I) хлорид AgCl і інші малорозчинні солі аргентуму можна перевести в розчин під дією натрій тіосульфату (утворюються тіосульфатні комплекси). На цьому ґрунтується застосування натрій тіосульфату в якості фотографічного закріплювача. Na2S2O3 використовується також у виробництві паперу при відбілюванні його хлором (як “антихлор”):
Na2S2O3 + 4Cl2 + 5H2O = Na2SO4 + H2SO4 + 8HCl
В аналітичній хімії застосовується як титрант для кількісного визначення йоду:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Натрій нітрат NaNO3 – білі, гігроскопічні, добре розчинні у воді кристали. Температура плавлення 311*С. При 380*С натрій нітрат розкладається з утворенням натрій нітриту і кисню:
2NaNO3 = 2NaNO2 + O2
При нагріванні з концентрованою сульфатною кислотою можна відігнати чисту нітратну кислоту:
2NaNO3 + H2SO4 = Na2SO4 + HNO3
У природі натрій нітрат у великих кількостях міститься в родовищах чилійської селітри, яку раніше переробляли на нітратну кислоту і гідроксид натрію. NaNO3 застосовують як складову частину добрив і вибухових речовин, а також як окислювач у виробництві скла і емалей.
Натрій нітрит NaNO2 – білі, добре розчинні у воді кристали. Температура плавлення натрій нітриту 271*С. Отруйний.
У промисловості натрій нітрит отримують по реакції нітрозних газів (суміш NO і NO2) з натрій гідроксидом. З еквімолярної суміші NO і NO2 утворюється в основному NaNO2, а при надлишку NO2 – ще й NaNO3. Навпаки, при дії сильних кислот на NaNO2 відбувається виділення нітрозних газів.
Застосовують NaNO3 у виробництві азобарвників, як компонент суміші для вороніння (NaOH + NaNO3 + NaNO2) і як засіб фарбування варених м’ясних виробів при їх підсолюванні (NaCl + 0,4% NaNO2 зберігають червоний колір вареного м’яса внаслідок утворення забарвленого аддукта NO з міоглобіном).
Натрій амід NaNH2 – білі кристали. Температура плавлення 206*С. При потраплянні на речовину води – вибухає, на повітрі поступово утворює жовті вибухові продукти окиснення. Натрій амід можна отримати з суміші Na + NH3. Застосовують натрій амід в органічному синтезі, наприклад у виробництві барвника індиго, а також для отримання натрій азиду NaN3:
NaNH2 + Na2O = NaN3 + H2O
Натрій гідрокарбонат NaHCO3 – білий, не гігроскопічний кристалічний порошок. Помірно розчинний у воді. При 300*С розкладається на натрій карбонат і карбон діоксид:
2NaHCO3 = Na2CO3 + H2O + CO2
При кімнатній температурі газоподібний CO2 можна отримати з NaHCO3 при дії кислот-неокисників. Утворюється як проміжний продукт у виробництві натрій карбонату за способом Сольве. Застосовують NaHCO3 як компонент мийних і вогнегасних засобів, штучних мінеральних вод лимонадів, як джерело CO2 в хлібопекарській промисловості (розпушувач), як лікарський препарат (для нейтралізації підвищеної кислотності шлункового соку).










