Алканы (предельные углеводороды, насыщенные углеводороды, парафины) CnH2n+2 – это соединения углерода с водородом, в молекулах которых, каждый атом углерода, с любым соседним атомом углерода образует только одну химическую связь, валентности атома углерода не затраченные на химическую связь с другими атомами углерода, образуют химическую связь с атомами водорода.
Название парафины происходит от латинского parum – мало, affinis – имеющий сродство, что указывает на химическую инертность алканов.
Алканы в природе
Алканы – главная составная часть нефти и природного газа. Некоторые растения синтезируют алканы (восковой налет на листьях некоторых растений содержит алканы).
Изомерия алканов. Номенклатура алканов.
Расположение атомов в молекулах алканов (и представителей других классов органических соединений) передается несколькими видами химических формул:
- суммарная химическая формула, например CH4, C6H14, C21H44. Суммарные формулы не передают особенностей структурного строения молекулы;
- полная структурная химическая формула – показывает все химические связи между атомами в молекуле и структурные разветвления. Такая форма записи является громоздкой и в большинстве случаев неудобна
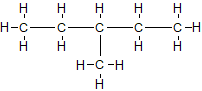
- неполная структурная формула – показывает химические связи и / или основной углеродный скелет (основные функциональные группы, в случае соединений других классов), химические связи с атомами водорода скрыты (нижним индексом указывают количество атомов водорода, или количество повторяющихся групп в скобках). Например, CH3-CH2-CH2-CH2-CH2-CH3, или CH3CH2CH2CH2CH2CH3, или CH3-(CH2)4-CH3, в случае структурных изомеров, ответвление указывают в скобках CH3-CH2-CH(CH3)-CH2-CH3. Такое, текстовое представление химической формулы позволяет понять структуру молекулы

- сокращенная структурная формула – записывается в виде химических связей между атомами углерода соединенных под некоторым углом; такая запись подразумевает, что в узлах соединений химических связей находится атом углерода, а не показанные химические связи с атомами водорода, по умолчанию, заняты химическими связями с атомами водорода. В сокращенных структурных формулах указывают функциональные группы и их атомы, кроме атомов углерода и атомов водорода. Это наиболее компактный, графический способ записи структурных формул
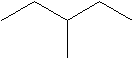
Изомерия алканов.
Углеводороды CH4, C2H6, C3H8 не имеют изомеров. Для алканов характерна структурная изомерия (изомерия углеродного скелета). Число изомеров для алкана с известным количеством атомов углерода вычислить нельзя, но можно вычислить количество изомеров, если известно количество изомеров для предыдущего члена гомологического ряда.
Номенклатура алканов.
В основе номенклатуры органических соединений лежит гомологический ряд алканов:
|
Формула |
Название |
t пл. *С |
t кип. *С |
|
CH4 |
Метан |
-182,5 |
-161,6 |
|
C2H6 |
Этан |
-183,3 |
-88,6 |
|
C3H8 |
Пропан |
-187,1 |
-42,2 |
|
C4H10 |
Бутан |
-138,3 |
-0,5 |
|
C5H12 |
Пентан |
-129,7 |
+36,0 |
|
C6H14 |
Гексан |
-94,3 |
+68,7 |
|
C7H16 |
Гептан |
-90,5 |
+98,4 |
|
C8H18 |
Октан |
-56,8 |
+125,7 |
|
C9H20 |
Нонан |
-53,7 |
+150,7 |
|
C10H22 |
Декан |
-29,7 |
+174,0 |
|
C11H24 |
Ундекан |
-25,6 |
+195,9 |
|
C12H26 |
Додекан |
-9,6 |
+216,3 |
|
C13H28 |
Тридекан |
-5,4 |
+235,4 |
|
C14H30 |
Тетрадекан |
+5,863 |
+253,52 |
|
C15H32 |
Пентадекан |
+10,0 |
+270 |
|
C16H34 |
Гексадекан |
+18,2 |
+287 |
|
C17H36 |
Гептадекан |
+22,5 |
+303 |
|
C18H38 |
Октадекан |
+27,0 |
+317 |
|
C19H40 |
Нонадекан |
+31,8 |
+330 |
|
C20H42 |
Эйкозан |
+36,4 |
+345 |
Название радикала формируется путем замены суффикса -ан (в названии алкана) на суффикс -ил. Например: метан – метил, пентан – пентил, декан – децил, эйкозан – эйкозил, и т.д.
- Нумерацию атомов углерода главной цепи всегда начинают с того конца, у которого ближе расположен один или несколько заместителей.
- При размещении различных заместителей на одинаковом расстоянии от обоих концов главной углеродной цепи, то нумерацию проводят с того конца, к которому ближе расположен заместитель название которого по алфавиту употребляют раньше.
- При установлении алфавитного порядка заместителей, множественные приставки не учитываются.
Примеры
3-метилгексан
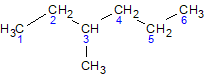
2,3,4-триметилгексан
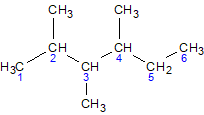
2,3,5-триметилгексан
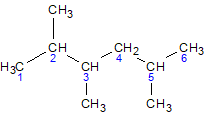
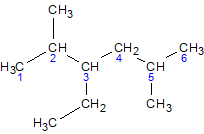
3-этил-2,5-диметилгексан
Способы получения алканов
1. Алканы с небольшим числом атомов углерода (до 11 включительно) можно выделить фракционной перегонкой природного газа или бензиновой фракции нефти, или смесей углеводородов, получаемых гидрированием угля, а также гидрированием оксида и диоксида углерода.
2. Алканы, начиная от пентана, получают каталитическим гидрированием этиленовых или более непредельных углеводородов с тем же числом углеродных атомов и таким же строением цепи (в квадратных скобках указывают катализатор):

3. Алканы получают восстановлением галогенопроизводных каталитически возбужденным водородом:
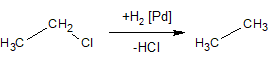
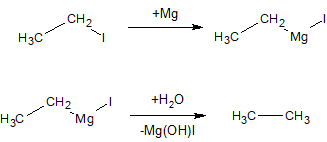
Из галогенопроизводных алканов можно получить магнийорганические соединения и затем действовать на них водой:
4. Синтез алканов из соединений с меньшим числом атомов углерода в цепи осуществляется действием натрия на галогенопроизводные (реакция Вюрца):
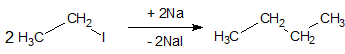
Особенностью реакции Вюрца является то, что в случае использования в качестве исходных веществ различных галогеналкилов в результате реакции получается смесь трех углеводородов:

Полученную смесь алканов необходимо разделять.
Реакция Вюрца идет с хорошими выходами только в случае использования первичных галогенопроизводных. Использование вторичных и третичных галогенопроизводных дает выход продукта всего несколько процентов. Основной побочный процесс в реакции Вюрца – отщепление галогеноводородов от исходных галогенопроизводных под влиянием карбаниона натрийорганического соединения с образованием олефинов. Вместо натрия в реакции Вюрца можно использовать и другие металлы, например литий, магний, цинк.
5. Получение алканов с использованием литийорганических соединений и солей меди (реакция Кори-Хауса). При обработке раствора галогеналкила в эфире металлическим литием получают литийорганическое соединение, которое затем при действии соли меди переводится в литийалкилкупрат. На литийалкилкупрат действуют галогеналкилом:

В случае первичных галогеналкилов выходы алканов типа R-R’ близки к 100%, в случае третичных – 30-50%.
6. Алканы можно получить электролизом солей карбоновых кислот: анионы кислот распадаются на аноде с образованием свободных радикалов, которые объединяются в молекулы более сложных предельных углеводородов (реакция Кольбе):
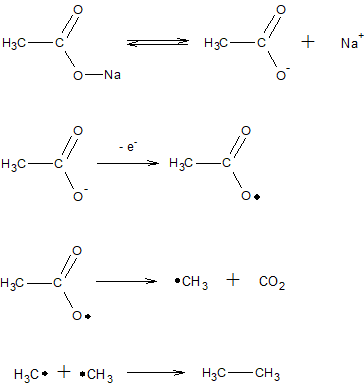
7. Алканы получают каталитическим гидрированием угля, смолы, и нефтяных фракций, с применением катализаторов WS2, MoS2 при температуре 300-500*С и давлении 10-20 МПа – процесс Бергиуса.
8. Низкотемпературным гидрированием буроугольной смолы, с применением катализаторов NiS/WS2/Al2O3 при температуре 280-380*С, и давлении 30 МПа.
9. Каталитическое гидрирование монооксида углерода (синтез Фишера-Тропша):

Синтез Фишера-Тропша проводят при температуре 160-200*С и нормальном (атмосферном) давлении. Продукт содержит около 15% пропана и бутана, 50% бензина, 28% керосина, 6% мягких парафинов и 2% церезинов, с другими катализаторами и при высоком давлении образуются олефины.
Физические свойства алканов
Температуры плавления и температуры кипения алканов приведены в таблице. Температуры кипения в гомологическом ряду алканов возрастают, причем разность температур кипения ближайших гомологов уменьшается. Изомеры с нормальной цепью кипят при более высокой температуре, чем с разветвленной цепью. Это объясняется меньшим взаимодействием между молекулами с разветвленной цепью в жидком состоянии – ответвления от главной цепи создают пространственные препятствия для сближения молекул. Алканы с разветвленной цепью имеют меньшую склонность к комплексообразованию, например с мочевиной, тиомочевиной, цеолитами, некоторыми солями металлов и др.
Температуры плавления в гомологическом ряду алканов медленно возрастают. При этом алканы образуют два ряда гомологов – четные и нечетные. Температуры плавления четных гомологов обычно выше, чем аналогично построенных нечетных. Объясняется это явление различием в расположении крайних метильных групп в молекуле; у алканов с четным числом атомов углерода, крайние метильные группы расположены по разные стороны, у алканов с нечетным числом атомов углерода крайние метильные группы расположены по одну сторону. В ряде случаев изомеры с разветвленной структурой имеют более высокие температуры плавления.
Плотность алканов вначале быстро, а затем медленно возрастает до 0,78 г./см3.
Алканы являются неполярными вещества, и трудно поляризуются, поэтому они практически нерастворимы в полярных растворителях (вода, этиловый спирт, ацетон). Алканы растворимы в неполярных растворителях (бензин, керосин и т.п.).
Химические свойства алканов
Алканы достаточно инертны. Химические превращения алканов могут происходить либо за счет отрыва атомов водорода (обычно гомолитического) с последующим замещением их другими атомами или группами. Поэтому для алканов характерны реакции расщепления и замещения.
Галогенирование алканов. Скорость галогенирования алканов резко снижается в ряду: F > Cl > Br > I; со свободным фтором галогенирование идет со взрывом (для проведения реакции фторирования алканов, фтор разбавляют азотом), возможен взрыв и в реакции с хлором
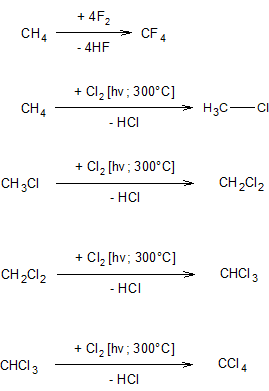
При хлорировании наиболее легко замещается водород у наименее гидрогенизированного (третичного) атома углерода.
При каталитическом хлорировании применяют такие катализаторы как: сера, иод, хлориды меди, сурьмы, олова, алюминия и др. металлов. Процесс хлорирования в присутствии катализаторов, например хлоридов некоторых металлов, может иметь цепной ионный механизм:
Cl : Cl + AlCl3 → AlCl4– + Cl+
Cl+ + H : CH3 → CH3+ + HCl
CH3+ + Cl : Cl → Cl : CH3 + Cl+ …
Фотохимическое хлорирование алканов проходит по радикальному механизму (SN):
зарождение цепи
Cl2 → Cl• + •Cl
рост цепи
H3C-H + •Cl → H3C• + HCl
H3C• + Cl2 → H3C-Cl + •Cl …
обрыв цепи
H3C• + •Cl → H3C-Cl
H3C• + •CH3 → H3C-CH3
Cl• + •Cl → Cl2
Сульфохлорирование алканов. Сульфоокисление алканов. При обычной температуре серная кислота на алканы не действует. Однако алканы легко реагируют с “супер-кислотами”, например смесью SbF5 и FSO3H, с выделением водорода и образованием карбониевых ионов. При нагревании серная кислота действует на алканы как окислитель. Концентрированная серная кислота с высшими алканами образует сульфокислоты:
R-H + H2SO4 → R-SO3H + H2O
Алканы вступают в реакцию сульфохлорирования, с образованием алкансульфохлоридов
R-H + SO2 + Cl2 → R-SO2-Cl + HCl
и реакцию сульфоокисления, с образованием алкансульфокислот
R-H + 2SO2 + O2 + H2O → R-SO2OH + H2SO4
Реакции сульфохлорирования и сульфоокисления идут на свету или в присутствии катализаторов (органические перекиси) по цепному радикальному механизму:
Cl2 → 2Cl•
R-H + Cl• → R• + HCl
R• + SO2 → R-SO2•
R-SO2• + Cl2 → R-SO2-Cl + Cl• …
Реакция сульфохлорирования алканов впервые была использована в Германии (1939 – 1940) для получения заменителей мыла.
Образующиеся при сульфохлорировании углеводородных фракций смеси хлорангидридов сульфокислот действием соды или силикатов превращаются в соли сульфокислот, которые применяют как стиральные порошки:
R-SO2-Cl + 2NaOH → R-SO2-ONa + NaCl + H2O
Сульфоокисление экономически более выгодно, чем сульфохлорирование, т.к. не расходуется хлор.
Нитрование алканов. Атомы водорода в алканах могут быть замещены нитрогруппой -NO2 (реакция нитрования):
R-H + HO-NO2 → R-NO2 + H2O
Алканы нитруются только разбавленной азотной кислотой при нагревании (М.И. Коновалов, 1888). Концентрированная азотная кислота или смесь концентрированной азотной кислоты и концентрированной серной кислоты окисляют алканы.
Наилучшие результаты реакции жидкофазного нитрования по выходу получают нитрованием алканов содержащих третичные атомы углерода.
В промышленности применяют парофазное нитрование проводят парами азотной кислоты при 250-500*С. Выбор температуры процесса зависит от длины цепи и строения углеводорода.
Побочными продуктами реакции нитрования могут быть спирты, альдегиды, кетоны, кислоты, непредельные углеводороды.
Реакцию нитрования можно проводить оксидами азота (П.П. Шорыгин).
Реакция нитрования алканов – радикальный процесс:
R-H + •NO2 → R• + HNO2
HNO2 + HNO3 → N2O4 + H2O
N2O4 ⇄ 2NO2
взаимодействие образовавшихся радикалов дают нитросоединения и эфиры азотистой кислоты:
R• + •NO2 → R-NO2
R• + •NO2 → R-O-NO
Окисление алканов. Кислород воздуха и обычные окислители (KMnO4, K2CrO4, K2Cr2O7 и др.) окисляют алканы только при высоких температурах с разрывом углеродной цепи и образованием преимущественно кислот. При этом, в значительных количествах образуется диоксид углерода.
В случае низших алканов окисление проходит сложно и неконтролируемо, что ограничивает окисление низших алканов в промышленных масштабах. Однако в промышленных масштабах получают уксусную кислоту путем окисления бутана.
Окисление высших парафинов проводят при температуре около 150*С в присутствии катализаторов (например соединений марганца). При этом получается смесь кислот с различной длиной цепи, оксикислоты, кетокислоты, сложные эфиры, спирты, кетоны и др. соединения.
При окислении алканов, в качестве промежуточных продуктов получаются органические гидроперекиси:
R• + O-O → R-O-O• + R-H → R-O-O-H + R•
Первая стадия распада любой перекиси – это диссоциация по связи O-O. Возникающие свободные кислородные радикалы либо отрывают атомы водорода от присутствующих в системе водород содержащих частиц и образуют спирты, либо распадаются по β-связи и дают альдегиды или кетоны.
Третичные гидроперекиси благодаря высокой стойкости в определенных условиях могут быть и конечными продуктами окисления. Третичные гидроперекиси расщепляются с образованием спиртов или кетонов по схеме:

Направление распада гидроперекиси вторичных алкилов зависит от условий. При низких температурах они дают преимущественно кетоны и спирты по схеме
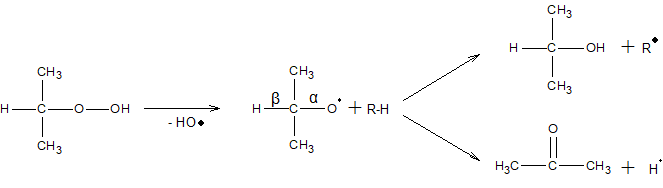
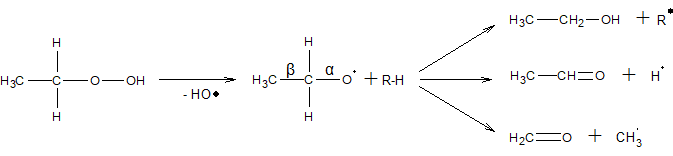
При высоких температурах образуются преимущественно альдегиды и спирты
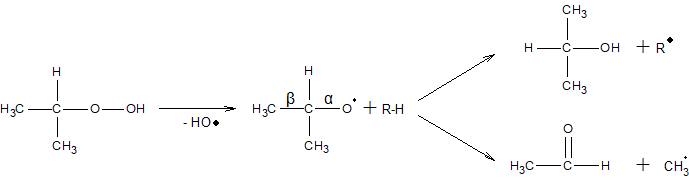
Гидроперекиси первичных алканов в этих условиях разлагаются подобным образом
Крекинг углеводородов при высоких температурах. При температурах выше 1000*С все алканы распадаются на углерод и водород. Этот процесс используется как дешевый метод получения водорода и газовой сажи. В определенных условиях удается изолировать промежуточные продукты расщепления, в частности ацетилен (крекинг метана с образованием ацетилена).
Начальная температура распада алканов зависит от их молекулярной массы и строения.
При 300-700*С алканы распадаются с образованием сложной смеси предельных, непредельных и ароматических углеводородов. Чем выше температура и больше глубина превращения, тем меньше состав этой смеси зависит от природы исходного углеводорода.
Основные химические процессы при крекинге – дегидрогенизация углеводорода и разрыв углеродной цепи. Одновременно происходят изомеризация и циклизация. Промежуточными продуктами во всех этих процессах являются свободные алифатические радикалы.
Радикал – это группа атомов, обладающая неспаренным электроном “•” и обычно существующая доли секунды.
Свободные радикалы известны с 1900 года. Свободные алифатические радикалы были обнаружены в 1929 году (опыты Панета – крекинг тетраэтилсвинца).
Химические превращения свободных радикалов.
1. Захват атома водорода с превращением в углеводород (химические реакции рассмотрены выше).
2. Распад свободных радикалов
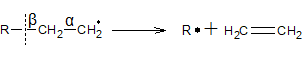
3. Диспропорционирование радикалов

4. Соединение радикалов

Распад свободных радикалов всегда идет по β-связи (вторая связь после связи с атомом, который содержит свободный электрон). Это объясняется тем, что β-связь является разрыхляющей, из-за взаимодействия ее электронов со свободным электроном. Для большинства радикалов при распаде характерно образование непредельного углеводорода из остатка с большим числом атомов углерода.
Введением в зону реакции катализаторов можно существенно изменить направление крекинга. Например, на некоторых катализаторах удается с хорошими выходами получать из предельных углеводородов олефины и диолефины – дегидрогенизация. В присутствии хлорида алюминия преимущественно протекают процессы изомеризации. На платине и некоторых других катализаторах успешно осуществляются процессы ароматизации – образования ароматических углеводородов.
Применение алканов
Ценными техническими продуктами являются газообразные низшие члены гомологического ряда алканов.
Метан CH4 – важнейший компонент природного газа, рудничного газа (образуется в каменноугольных пластах) и болотного газа (выделяется при бактериальном гниении целлюлозы). Содержание метана в полукоксовом газе, получаемом из бурого угля, составляет от 10 до 25% (об.), в светильном газе около 25%. Пределы взрываемости в смеси с O2 6-12% CH4.
Метан применяют как топливо и как исходное вещество для нефтехимических процессов. Из метана получают такие важные продукты, как ацетилен, циановодород, хлорпроизводные метана (растворители, продукты в производстве силиконов), сероуглерод и фторуглероды (хладагенты, мономеры в производстве термостойких пластмасс).
Этан C2H6 – составная часть нефтяных попутных газов; применяют в основном для получения этилена.
Пропан C3H8 получают в нефтехимических процессах (пиролиз) и в процессе Бергиуса. Применяют в качестве горючего газа (пропан-бутановые смеси). Жидкий пропан транспортируют в стальных цистернах при 20*С и под давлением 0,8 МПа (критические температура и давление пропана равны 96,81*С и 4,3 МПа).
Жидкие алканы (гомологи, жидкие при комнатной температуре) – составная часть нефти и буроугольной смолы.
Твердые алканы (парафины в узком смысле) содержатся в нефти. Горный воск, или озокерит (в очищенном виде – церезин), является смесью твердых парафинов. Применяют для изготовления свечей, для пропитки бумаги и картона, в качестве изолирующего материала. Получаемые искусственно углеводороды C10-C30 перерабатывают в мыла, моющие средства и пластификаторы.










