ąśąĘąŠą╝ąĄčĆąĖčÅ – čŹč鹊 čüčāčēąĄčüčéą▓ąŠą▓ą░ąĮąĖąĄ ą╝ąŠą╗ąĄą║čāą╗ čü ąŠą┤ąĖąĮą░ą║ąŠą▓čŗą╝ąĖ čüčāą╝ą╝ą░čĆąĮčŗą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ (ą▒čĆčāčéč鹊-č乊čĆą╝čāą╗čŗ), ąĮąŠ čü čĆą░ąĘą╗ąĖčćąĮčŗą╝ čüčéčĆąŠąĄąĮąĖąĄą╝ ąĖą╗ąĖ čĆą░ąĘą╗ąĖčćąĮčŗą╝ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮąĖąĄą╝ ą░č鹊ą╝ąŠą▓ ą▓ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄ.
ąźąĖą╝ąĖč湥čüą║ąĖąĄ ąĖ čäąĖąĘąĖč湥čüą║ąĖąĄ čüą▓ąŠą╣čüčéą▓ą░ ąĖąĘąŠą╝ąĄčĆąĮčŗčģ ą▓ąĄčēąĄčüčéą▓ čĆą░ąĘą╗ąĖčćą░čÄčéčüčÅ.
ąÆąĖą┤čŗ ąĖąĘąŠą╝ąĄčĆąĖąĖ.
ąĪčéčĆčāą║čéčāčĆąĮą░čÅ ąĖąĘąŠą╝ąĄčĆąĖčÅ. ąŁč鹊čé ą▓ąĖą┤ ąĖąĘąŠą╝ąĄčĆąĖąĖ ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮ čĆą░ąĘą╗ąĖčćąĮčŗą╝ ą▓ąĘą░ąĖą╝ąĮčŗą╝ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮąĖąĄą╝ ą░č鹊ą╝ąŠą▓ ą▓ ą╝ąŠą╗ąĄą║čāą╗ą░čģ.
ąÆąĖą┤čŗ čüčéčĆčāą║čéčāčĆąĮąŠą╣ ąĖąĘąŠą╝ąĄčĆąĖąĖ:
1. ąśąĘąŠą╝ąĄčĆąĖčÅ čāą│ą╗ąĄčĆąŠą┤ąĮąŠą│ąŠ čüą║ąĄą╗ąĄčéą░, ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąĮą░čÅ čĆą░ąĘą╗ąĖčćąĮčŗą╝ ą┐ąŠčĆčÅą┤ą║ąŠą╝ čüą▓čÅąĘąĖ ą░č鹊ą╝ąŠą▓, ąŠą▒čĆą░ąĘčāčÄčēąĖčģ čüą║ąĄą╗ąĄčé ą╝ąŠą╗ąĄą║čāą╗čŗ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą│ąŠ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ
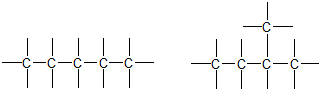
2. ąśąĘąŠą╝ąĄčĆąĖčÅ ą┐ąŠą╗ąŠąČąĄąĮąĖčÅ, ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąĮą░čÅ čĆą░ąĘą╗ąĖčćąĮčŗą╝ ą┐ąŠą╗ąŠąČąĄąĮąĖąĄą╝ ąŠą┤ąĖąĮą░ą║ąŠą▓čŗčģ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╣ ąĖą╗ąĖ čäčāąĮą║čåąĖąŠąĮą░ą╗čīąĮčŗčģ ą│čĆčāą┐ą┐ ą┐čĆąĖ ąŠą┤ąĮąŠą╣ ąĖ č鹊ą╣ ąČąĄ čāą│ą╗ąĄčĆąŠą┤ąĮąŠą╣ čåąĄą┐ąĖ
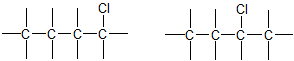
3. ąóą░čāč鹊ą╝ąĄčĆąĖčÅ (čĆą░ąĮąĄąĄ ą┤ąĄčüą╝ąŠčéčĆąŠą┐ąĖčÅ), ą▓čŗąĘčŗą▓ą░ąĄą╝ą░čÅ ąĖąĘą╝ąĄąĮąĄąĮąĖąĄą╝ ą┐ąŠą╗ąŠąČąĄąĮąĖčÅ ąŠą┤ąĮąŠą│ąŠ ąĖąĘ ą░č鹊ą╝ąŠą▓ ą▓ąŠą┤ąŠčĆąŠą┤ą░, čćč鹊 ą┐čĆąĖą▓ąŠą┤ąĖčé ą║ ą┐čĆąĄą▓čĆą░čēąĄąĮąĖčÅą╝ ą┤ą▓čāčģ čüčéčĆčāą║čéčāčĆąĮčŗčģ ąĖąĘąŠą╝ąĄčĆąŠą▓ ą┤čĆčāą│ ą▓ ą┤čĆčāą│ą░ ą┐ąŠ ąŠą▒čĆą░čéąĖą╝ąŠą╣ čĆąĄą░ą║čåąĖąĖ
CH3-CO-CH2-COOC2H5 Ōćä CH3-C(OH)=CH-COOC2H5
ąĖą╗ąĖ

4. ą¤čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄąĮąĮą░čÅ ąĖąĘąŠą╝ąĄčĆąĖčÅ (čüč鹥čĆąĄąŠąĖąĘąŠą╝ąĄčĆąĖčÅ). ąŁč鹊čé ą▓ąĖą┤ ąĖąĘąŠą╝ąĄčĆąĖąĖ ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮ čĆą░ąĘą╗ąĖčćąĮčŗą╝ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄąĮąĮčŗą╝ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮąĖąĄą╝ ą░č鹊ą╝ąŠą▓ ą┐čĆąĖ ąŠą┤ąĖąĮą░ą║ąŠą▓ąŠą╝ ą┐ąŠčĆčÅą┤ą║ąĄ ąĖčģ čüą▓čÅąĘčŗą▓ą░ąĮąĖčÅ.
ąØą░ąĖą▒ąŠą╗ąĄąĄ čĆą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮčŗ ą┤ą╗čÅ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ ą┤ą▓ą░ čéąĖą┐ą░ čüč鹥čĆąĄąŠąĖąĘąŠą╝ąĄčĆąĖąĖ:
- ą│ąĄąŠą╝ąĄčéčĆąĖč湥čüą║ą░čÅ ąĖąĘąŠą╝ąĄčĆąĖčÅ;
- ąŠą┐čéąĖč湥čüą║ą░čÅ ąĖąĘąŠą╝ąĄčĆąĖčÅ.
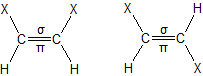
4.1. ąōąĄąŠą╝ąĄčéčĆąĖč湥čüą║ą░čÅ ąĖąĘąŠą╝ąĄčĆąĖčÅ (ąĖą╗ąĖ čåąĖčü-čéčĆą░ąĮčü-ąĖąĘąŠą╝ąĄčĆąĖčÅ) čģą░čĆą░ą║č鹥čĆąĮą░ ą┤ą╗čÅ ąĮąĄą┐čĆąĄą┤ąĄą╗čīąĮčŗčģ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣. ąöą▓ąŠą╣ąĮą░čÅ čüą▓čÅąĘčī čā čéą░ą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ ąĮąĄ ą┤ąŠą┐čāčüą║ą░ąĄčé čüą▓ąŠą▒ąŠą┤ąĮąŠą│ąŠ ą▓čĆą░čēąĄąĮąĖčÅ ą▓ąŠą║čĆčāą│ čüą▓čÅąĘąĖ čāą│ą╗ąĄčĆąŠą┤ – čāą│ą╗ąĄčĆąŠą┤ (ą┐čĆąĖ ąŠą┤ąĖąĮą░čĆąĮąŠą╣ čüą▓čÅąĘąĖ C-C čéą░ą║ąŠąĄ ą▓čĆą░čēąĄąĮąĖąĄ čüčāčēąĄčüčéą▓čāąĄčé). čåąĖčü-ążąŠčĆą╝ą░ ąŠčéą╗ąĖčćą░ąĄčéčüčÅ č鹥ą╝, čćč鹊 ą┤ą▓ą░ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅ X ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮčŗ ą┐ąŠ ąŠą┤ąĮčā čüč鹊čĆąŠąĮčā ą┐ą╗ąŠčüą║ąŠčüčéąĖ ą┤ą▓ąŠą╣ąĮąŠą╣ čüą▓čÅąĘąĖ, ą░ ą▓ čéčĆą░ąĮčü-č乊čĆą╝ąĄ ąŠąĮąĖ ąĮą░čģąŠą┤čÅčéčüčÅ ąĮą░ čĆą░ąĘąĮčŗčģ čüč鹊čĆąŠąĮą░čģ, ąĮą░ą┐čĆąĖą╝ąĄčĆ:
4.2. ą×ą┐čéąĖč湥čüą║ą░čÅ ąĖąĘąŠą╝ąĄčĆąĖčÅ ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮą░ ąĮą░ą╗ąĖčćąĖąĄą╝ ą░čüąĖą╝ą╝ąĄčéčĆąĖč湥čüą║ąŠą│ąŠ ą░č鹊ą╝ą░ čāą│ą╗ąĄčĆąŠą┤ą░ C* (čģąĖčĆą░ą╗čīąĮčŗą╣ čåąĄąĮčéčĆ), čé. ąĄ. ą░č鹊ą╝ą░ čāą│ą╗ąĄčĆąŠą┤ą░, čüą▓čÅąĘą░ąĮąĮąŠą│ąŠ čü č湥čéčŗčĆčīą╝čÅ čĆą░ąĘą╗ąĖčćąĮčŗą╝ąĖ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅą╝ąĖ. ąÆčüąĄ ą╝ąŠą╗ąĄą║čāą╗čŗ, ą║ąŠč鹊čĆčŗąĄ čüąŠą┤ąĄčƹȹ░čé ą░čüąĖą╝ą╝ąĄčéčĆąĖč湥čüą║ąĖą╣ ą░č鹊ą╝ čāą│ą╗ąĄčĆąŠą┤ą░, ąŠą┐čéąĖč湥čüą║ąĖ ą░ą║čéąĖą▓ąĮčŗ: ąĖčģ čĆą░čüčéą▓ąŠčĆčŗ ą▓čĆą░čēą░čÄčé ą┐ą╗ąŠčüą║ąŠčüčéčī ą┐ąŠą╗čÅčĆąĖąĘąŠą▓ą░ąĮąĮąŠą│ąŠ čüą▓ąĄčéą░.
ąÆąĄčēąĄčüčéą▓ą░ čü ą░čüąĖą╝ą╝ąĄčéčĆąĖč湥čüą║ąĖą╝ ą░č鹊ą╝ąŠą╝ čāą│ą╗ąĄčĆąŠą┤ą░ čüčāčēąĄčüčéą▓čāčÄčé ą▓ ą▓ąĖą┤ąĄ ą┤ą▓čāčģ ąŠą┐čéąĖč湥čüą║ąĖčģ (ąĘąĄčĆą║ą░ą╗čīąĮčŗčģ), ąĖąĘąŠą╝ąĄčĆąŠą▓, ąŠą┤ąĖąĮ ąĖąĘ ą║ąŠč鹊čĆčŗčģ ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ ą┐čĆą░ą▓ąŠą▓čĆą░čēą░čÄčēąĖą╣, ą┤čĆčāą│ąŠą╣ – ą╗ąĄą▓ąŠą▓čĆą░čēą░čÄčēąĖą╣. ąÜąŠąĮčäąĖą│čāčĆą░čåąĖčÄ ą┐čĆą░ą▓ąŠą▓čĆą░čēą░čÄčēąĄą│ąŠ ąĖąĘąŠą╝ąĄčĆą░ ąŠą▒ąŠąĘąĮą░čćą░čÄčé čüąĖą╝ą▓ąŠą╗ąŠą╝ D, ą░ ą╗ąĄą▓ąŠą▓čĆą░čēą░čÄčēąĄą│ąŠ ąĖąĘąŠą╝ąĄčĆą░ – čüąĖą╝ą▓ąŠą╗ąŠą╝ L. ą×ą▒ą░ ąĘąĄčĆą║ą░ą╗čīąĮčŗčģ ąĖąĘąŠą╝ąĄčĆą░ ąĮą░ąĘčŗą▓ą░čÄčé čéą░ą║ąČąĄ ąŠą┐čéąĖč湥čüą║ąĖąĄ ą░ąĮčéąĖą┐ąŠą┤čŗ.
ą×čéąĮąĄčüąĄąĮąĖąĄ ąĖąĘąŠą╝ąĄčĆąŠą▓ ą║ D- ąĖą╗ąĖ L-čĆčÅą┤čā ą┐čĆąŠą▓ąŠą┤ąĖčéčüčÅ ą┐čāč鹥ą╝ čüčĆą░ą▓ąĮąĄąĮąĖčÅ čü ą║ąŠąĮčäąĖą│čāčĆą░čåąĖąĄą╣ čŹčéą░ą╗ąŠąĮą░; ą▓ ą║ą░č湥čüčéą▓ąĄ čéą░ą║ąŠą▓ąŠą│ąŠ ą▓čŗą▒čĆą░ąĮ ą┐čĆą░ą▓ąŠą▓čĆą░čēą░čÄčēąĖą╣ (+) ą│ą╗ąĖčåąĄčĆąĖąĮąŠą▓čŗą╣ ą░ą╗čīą┤ąĄą│ąĖą┤ ą┤ą╗čÅ D-čĆčÅą┤ą░ ąĖ ą╗ąĄą▓ąŠą▓čĆą░čēą░čÄčēąĖą╣ (-) ą│ą╗ąĖčåąĄčĆąĖąĮąŠą▓čŗą╣ ą░ą╗čīą┤ąĄą│ąĖą┤ ą┤ą╗čÅ L-čĆčÅą┤ą░ (ąĘąĮą░ą║ąĖ (+) ąĖ (–) čāą║ą░ąĘčŗą▓ą░čÄčé ąĮą░ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖąĄ ą▓čĆą░čēąĄąĮąĖčÅ ą┐ą╗ąŠčüą║ąŠčüčéąĖ ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖąĖ čüą▓ąĄčéą░):
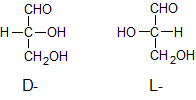
ąĪąŠąĄą┤ąĖąĮąĄąĮąĖčÅ čü ą║ąŠąĮčäąĖą│čāčĆą░čåąĖąĄą╣ čŹčéą░ą╗ąŠąĮą░ D-čĆčÅą┤ą░ ąŠčéąĮąŠčüčÅčé ą║ čŹč鹊ą╝čā čĆčÅą┤čā (ą░ąĮą░ą╗ąŠą│ąĖčćąĮąŠ ąĖ ą┤ą╗čÅ L-čĆčÅą┤ą░) ąĮąĄąĘą░ą▓ąĖčüąĖą╝ąŠ ąŠčé ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖčÅ ą▓čĆą░čēąĄąĮąĖčÅ ą┐ą╗ąŠčüą║ąŠčüčéąĖ ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖąĖ čüą▓ąĄčéą░ ą┤ą░ąĮąĮčŗą╝ ą▓ąĄčēąĄčüčéą▓ąŠą╝.
ąØą░ą┐čĆąĖą╝ąĄčĆ, ą┐ąŠą╗čāčćą░ąĄą╝ą░čÅ ąĖąĘ D(+)-ą│ą╗ąĖčåąĄčĆąĖąĮąŠą▓ąŠą│ąŠ ą░ą╗čīą┤ąĄą│ąĖą┤ą░ ą▓ąĖąĮąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ąŠą║ą░ąĘčŗą▓ą░ąĄčéčüčÅ ą╗ąĄą▓ąŠą▓čĆą░čēą░čÄčēąĄą╣, čé. ąĄ. D(-)-ą▓ąĖąĮąĮąŠą╣ ą║ąĖčüą╗ąŠč鹊ą╣.
ąĪą╝ąĄčüąĖ čĆą░ą▓ąĮčŗčģ ą║ąŠą╗ąĖč湥čüčéą▓ ąŠą┐čéąĖč湥čüą║ąĖčģ ą░ąĮčéąĖą┐ąŠą┤ąŠą▓, ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĖčÅ ą▓čĆą░čēąĄąĮąĖčÅ ą║ąŠč鹊čĆčŗčģ ą▓ąĘą░ąĖą╝ąĮąŠ ą┐čĆąŠčéąĖą▓ąŠą┐ąŠą╗ąŠąČąĮčŗ, ąĮą░ąĘčŗą▓ą░čÄčéčüčÅ čĆą░čåąĄą╝ą░čéčŗ. ą×ą▒čŗčćąĮąŠ ą┐čĆąĖ čüąĖąĮč鹥ąĘą░čģ ą┐ąŠą╗čāčćą░čÄčé čĆą░čåąĄą╝ą░čéčŗ, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą▓ąĖąĮąŠą│čĆą░ą┤ąĮčāčÄ, ąĖą╗ąĖ DL-ą▓ąĖąĮąĮčāčÄ ą║ąĖčüą╗ąŠčéčā, ą║ąŠč鹊čĆčŗąĄ ą╝ąŠąČąĮąŠ čĆą░ąĘą┤ąĄą╗ąĖčéčī ąĮą░ ąŠą┐čéąĖč湥čüą║ąĖ ą░ą║čéąĖą▓ąĮčŗąĄ ąĖąĘąŠą╝ąĄčĆčŗ čĆą░ąĘą╗ąĖčćąĮčŗą╝ąĖ čüą┐ąŠčüąŠą▒ą░ą╝ąĖ.
ą¦ąĖčüą╗ąŠ ąŠą┐čéąĖč湥čüą║ąĖčģ ąĖąĘąŠą╝ąĄčĆąŠą▓ ą▓ čüą╗čāčćą░ąĄ ąĮąĄčüą║ąŠą╗čīą║ąĖčģ ą░čüąĖą╝ą╝ąĄčéčĆąĖčćąĮčŗčģ ą░č鹊ą╝ąŠą▓ čĆą░ą▓ąĮą░ 2n, n – ą║ąŠą╗ąĖč湥čüčéą▓ąŠ ą░čüąĖą╝ą╝ąĄčéčĆąĖčćąĮčŗčģ ą░č鹊ą╝ąŠą▓ čāą│ą╗ąĄčĆąŠą┤ą░ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ.
ą¤ąŠ čĆąĄą║ąŠą╝ąĄąĮą┤ą░čåąĖčÅą╝ IUPAC ąŠą┐čéąĖč湥čüą║ąĖąĄ ą░ąĮčéąĖą┐ąŠą┤čŗ ąŠą▒ąŠąĘąĮą░čćą░čÄčé čüąĖą╝ą▓ąŠą╗ ą╗ą░ą╝ąĖ R (ą┐čĆą░ą▓ąŠą▓čĆą░čēą░čÄčēąĖą╣) ąĖ S (ą╗ąĄą▓ąŠą▓čĆą░čēą░čÄčēąĖą╣). ąŁčéąĖ ąŠą▒ąŠąĘąĮą░č湥ąĮąĖčÅ ąŠčüąĮąŠą▓ą░ąĮčŗ ąĮąĄ ąĮą░ čüčĆą░ą▓ąĮąĄąĮąĖąĖ čüčéčĆąŠąĄąĮąĖčÅ čü čŹčéą░ą╗ąŠąĮąŠą╝, ą░ ąĮą░ ą┐čĆą░ą▓ąĖą╗ą░čģ, čāčćąĖčéčŗą▓ą░čÄčēąĖčģ ą┐ąŠčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠąĄ ąĖ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄąĮąĮąŠąĄ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮąĖąĄ č湥čéčŗčĆąĄčģ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗ąĄą╣ C ą░čüąĖą╝ą╝ąĄčéčĆąĖč湥čüą║ąŠą│ąŠ ą░č鹊ą╝ą░ čāą│ą╗ąĄčĆąŠą┤ą░.
ą¤ąŠą┤čĆąŠą▒ąĮąĄąĄ ą×ą┐čéąĖč湥čüą║ą░čÅ R-, S-ąĮąŠą╝ąĄąĮą║ą╗ą░čéčāčĆą░.
ą×ą┐čéąĖč湥čüą║ą░čÅ ą░ą║čéąĖą▓ąĮąŠčüčéčī ą╝ąŠąČąĄčé ąĮą░ą▒ą╗čÄą┤ą░čéčīčüčÅ ąĖ┬Ā č鹊ą│ą┤ą░, ą║ąŠą│ą┤ą░ ą▓ ą╝ąŠą╗ąĄą║čāą╗ą░čģ ą▓ąĄčēąĄčüčéą▓ą░ ąĮąĄčé ą░čüąĖą╝ą╝ąĄčéčĆąĖč湥čüą║ąĖčģ ą░č鹊ą╝ąŠą▓, ąĮąŠ ąŠąĮąĖ ą▓ čåąĄą╗ąŠą╝ ą░čüąĖą╝ą╝ąĄčéčĆąĖčćąĮčŗ (ąĮąĄ ąĖą╝ąĄčÄčé ą┐ą╗ąŠčüą║ąŠčüčéąĖ ąĖą╗ąĖ ą┤čĆčāą│ąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓ čüąĖą╝ą╝ąĄčéčĆąĖąĖ). ąóą░ą║ąŠą╣ čüą╗čāčćą░ą╣ ąŠą┐čéąĖč湥čüą║ąŠą╣ ą░ą║čéąĖą▓ąĮąŠčüčéąĖ ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮą░čÅ ą░čüąĖą╝ą╝ąĄčéčĆąĖčÅ.










