Химические реакции заключаются во взаимодействии реагентов с образованием продуктов. Однако, не следует полагать, что направление химической реакции возможно только в одну сторону реагенты → продукты. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
Реагенты ⇄ Продукты
Все химические реакции обратимы.
Это означает, что в реакционной смеси осуществляется как взаимодействие реагентов (при этом образуются продукты), так и взаимодействие продуктов (при этом образуются реагенты). В этом смысле различие между реагентами и продуктами условное; оно определяется записью уравнения обратимой реакции: слева от знака обратимости ⇄ записывают формулы реагентов, а справа – формулы продуктов.
Пример.
В закрытой реакционной системе, содержащей первоначально ртуть и кислород, могут протекать реакции:
2Hg + O2 → 2HgO
2HgO → 2Hg + O2
Таким образом, в данной системе развивается одновременно протекающие два процесса, и суммарное уравнение обратимой реакции следует записать так:
2Hg + O2 ⇄ 2HgO
В соответствии с уравнением конкретной обратимой реакции различают прямую реакцию, протекающую по уравнению слева направо, и обратную реакцию, протекающую по уравнению справа налево.
Конкретная запись обратной реакции часто определяется также тем, какие вещества были исходными при экспериментальном проведении реакции, а какие – конечными, т.е. образовавшимися в процессе ее протекания.
Пример.
При нагревании исходного вещества карбоната магния образуются продукты разложения – оксид магния и диоксид углерода:
Прямая реакция
MgCO3 → MgO + CO2
По мере протекания этой прямой реакции в закрытой системе накапливаются конечные вещества, увеличивающееся количество которых способствует развитию обратной реакции между ними:
Обратная реакция
MgO + CO2 ← MgCO3
Следовательно, обратимый процесс термического разложения карбоната магния записывается так:
MgCO3 ⇄ MgO + CO2
Однако в качестве исходных веществ можно взять оксид магния и диоксид углерода, тогда уравнение синтеза карбоната магния следует записать так:
MgO + CO2 ⇄ MgCO3
Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением, концентрацией веществ)
Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты.
Пример.
Железо и сера при нагревании реагируют между собой с образованием сульфида железа(II), FeS при таких температурах устойчив и не практически не разлагается на железо и серу:
Fe + S → FeS
В химических реакциях, которые способны при заданных условиях протекать в обоих направлениях, не происходит взаимодействия веществ без остатка. Особенно это характерно для гомогенных реакций (реакции между газами, реакции в растворах).
Пример.
Реакция синтеза аммиака является обратимой
N2 + 3H2 ⇄ 2NH3
При 20 МПа и 400*С достигается максимальное равное 36% (по объему) содержание NH3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается.
Прямая и обратная реакции протекают одновременно в противоположных направлениях
Зависимость между прямой и обратной реакциями количественной выражается через скорость реакции. Скорость реакции зависит от числа реагирующих (т.е. соударяющихся). В первый момент протекания обратимой реакции в системе содержатся только частицы исходных веществ (например, в синтезе аммиака N2 и H2). Поэтому в первый момент протекает только прямая реакция, причем с очень высокой скоростью.
По мере протекания прямой реакции накапливается все большее число частиц конечных веществ, которые принимают участие в обратной реакции, поэтому скорость обратной реакции все больше возрастает. Одновременно снижается число частиц исходных веществ, и скорость прямой реакции все больше уменьшается. В результате в реакционной системе достигается состояние, при котором скорости прямой и обратной реакции равны.
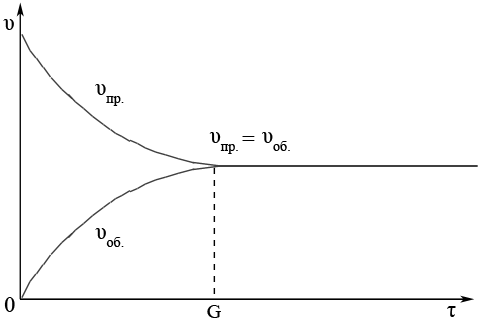
Состояние химического равновесия – это состояние реакционной системы при котором скорости прямой реакции и обратной реакции равны
При химическом равновесии обе реакции, прямая и обратная, продолжают протекать, следовательно, такое равновесие будет динамическим равновесием (или подвижным равновесием), а не статическим.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия
Соотношение концентраций веществ, участвующих в реакции (реагентов, продуктов), в состоянии равновесия отвечает положению равновесия.
Пример.
При обратимой реакции электролитической диссоциации (автопротолиза) воды лишь очень незначительная часть молекул воды вступает в эту реакцию:
H2O ⇄ H+ + OH– или H2O + H2O ⇄ H3O+ + OH–
Поэтому говорят, что положение равновесия находится в области недиссоциированных молекул H2O.
Каждая химическая реакция, проводимая в определенных условиях, имеет присущее только ей положение равновесия.
Пример.
При 400*С и 20 МПа в реакции синтеза аммиака образуется 36% (по объему) NH3, а при 500*С и 10 МПа – всего 10%.
Для одних и тех же условий соответствующее положение равновесия не зависит от того, реагенты или продукты реакции были исходными веществами.
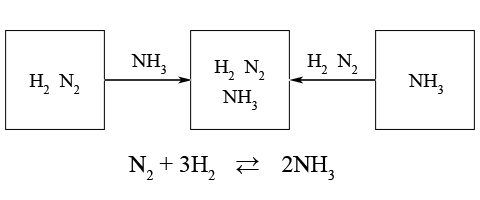
Выбор условий проведения обратимых реакций является практически важной проблемой для обеспечения эффективности химико-технологических процессов, т.е. для получения оптимального количества необходимых веществ.










