ą×ą║čüąĖą┤čŗ ą░ąĘąŠčéą░
ąÆ ąŠą║čüąĖą┤ą░čģ ą░ąĘąŠčé ąĖą╝ąĄąĄčé čüč鹥ą┐ąĄąĮąĖ ąŠą║ąĖčüą╗ąĄąĮąĖčÅ ąŠčé (+I) ą┤ąŠ (+V). ąóąŠą╗čīą║ąŠ ąŠą║čüąĖą┤čŗ N2O3 ąĖ N2O5 ą╝ąŠąČąĮąŠ čüčćąĖčéą░čéčī ą║ąĖčüą╗ąŠčéąĮčŗą╝ąĖ; ąĖąĮąŠą│ą┤ą░ NO2 ąĖ N2O4 čĆą░čüčüą╝ą░čéčĆąĖą▓ą░čÄčéčüčÅ ą║ą░ą║ ąŠą║čüąĖą┤čŗ ą┤ą▓čāčģ ą║ąĖčüą╗ąŠčé čüčĆą░ąĘčā. ąØąĖčéčĆąŠąĘąĮčŗąĄ ą│ą░ąĘčŗ čüąŠčüč鹊čÅčé ąĖąĘ NO, NO2 ąĖ N2O4.
ą×ą║čüąĖą┤ ą┤ąĖą░ąĘąŠčéą░ (ą▓ąĄčüąĄą╗čÅčēąĖą╣ ą│ą░ąĘ) N2O – ą▒ąĄčüčåą▓ąĄčéąĮčŗą╣ ą│ą░ąĘ čü ą┐čĆąĖčÅčéąĮčŗą╝, čüą╗ąĄą│ą║ą░ čüą╗ą░ą┤ą║ąŠą▓ą░čéčŗą╝ ąĘą░ą┐ą░čģąŠą╝, č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░ ą║ąĖą┐ąĄąĮąĖčÅ -88,5*ąĪ. ąŻą╝ąĄčĆąĄąĮąĮąŠ čĆą░čüčéą▓ąŠčĆąĖą╝ ą▓ ą▓ąŠą┤ąĄ. ą×ą▒čĆą░ąĘčāąĄčéčüčÅ ą┐čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ ąĮąĖčéčĆą░čéą░ ą░ą╝ą╝ąŠąĮąĖčÅ:
NH4NO3 = N2O + 2H2O
ą¤čĆąĖ ą▓ą┤čŗčģą░ąĮąĖąĖ ąŠą║čüąĖą┤ą░ ą┤ąĖą░ąĘąŠčéą░ ą▓ ą┐ąĄčĆą▓čŗą╣ ą╝ąŠą╝ąĄąĮčé ąŠąĮ ą▓čŗąĘčŗą▓ą░ąĄčé čā č湥ą╗ąŠą▓ąĄą║ą░ ą▓ąŠąĘą▒čāąČą┤ąĄąĮąĖąĄ, ą░ ąĘą░č鹥ą╝ ąŠą║ą░ąĘčŗą▓ą░ąĄčé čāčüčŗą┐ą╗čÅčÄčēąĄąĄ ą┤ąĄą╣čüčéą▓ąĖąĄ. ąÆ čüą╝ąĄčüąĖ čü ą║ąĖčüą╗ąŠčĆąŠą┤ąŠą╝ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą▓ ą╝ąĄą┤ąĖčåąĖąĮąĄ ą║ą░ą║ ąĮą░čĆą║ąŠčéąĖč湥čüą║ąŠąĄ čüčĆąĄą┤čüčéą▓ąŠ.
ą£ąŠąĮąŠąŠą║čüąĖą┤ ą░ąĘąŠčéą░ NO – ą▒ąĄčüčåą▓ąĄčéąĮčŗą╣ ą│ą░ąĘ, ą║ąŠč鹊čĆčŗą╣ ąĮą░ ą▓ąŠąĘą┤čāčģąĄ ą┐ąŠčüč鹥ą┐ąĄąĮąĮąŠ ą┐čĆąĖąŠą▒čĆąĄčéą░ąĄčé ą║ąŠčĆąĖčćąĮąĄą▓ąŠ-ą▒čāčĆčāčÄ ąŠą║čĆą░čüą║čā, ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ ą┐čĆąŠč鹥ą║ą░ąĮąĖčÅ čĆąĄą░ą║čåąĖąĖ
2NO + O2 = 2NO2
ąóąĄą╝ą┐ąĄčĆą░čéčāčĆą░ ą║ąĖą┐ąĄąĮąĖčÅ -152*ąĪ. ą¤čĆą░ą║čéąĖč湥čüą║ąĖ ąĮąĄ čĆą░čüčéą▓ąŠčĆąĖą╝ ą▓ ą▓ąŠą┤ąĄ. ą¤ąŠą╗čāčćą░čÄčé ą┐čĆąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĖ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮąŠą╣ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ čüąŠ ą╝ąĮąŠą│ąĖą╝ąĖ ą╝ąĄčéą░ą╗ą╗ą░ą╝ąĖ, ąĮą░ą┐čĆąĖą╝ąĄčĆ čü ą╝ąĄą┤čīčÄ; ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą┐čĆąĖ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą╝ čĆą░ąĘčĆčÅą┤ąĄ ą▓ ą│čĆąŠąĘąŠą▓ąŠą╣ ą░čéą╝ąŠčüč乥čĆąĄ (ą╝ąŠą╗ąĮąĖčÅ). ą£ąŠąĮąŠąŠą║čüąĖą┤ ą░ąĘąŠčéą░ čÅą▓ą╗čÅąĄčéčüčÅ ą┐čĆąŠą╝ąĄąČčāč鹊čćąĮčŗą╝ ą┐čĆąŠą┤čāą║č鹊ą╝ č鹥čģąĮąĖč湥čüą║ąŠą│ąŠ čüąĖąĮč鹥ąĘą░ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ.
ąóčĆąĖąŠą║čüąĖą┤ ą┤ąĖą░ąĘąŠčéą░ N2O3 – ą┐čĆąĖ ąĮąĖąĘą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ č鹥ą╝ąĮąŠ-čüąĖąĮčÅčÅ ąČąĖą┤ą║ąŠčüčéčī, čĆą░ąĘą╗ą░ą│ą░ąĄčéčüčÅ ą┐čĆąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĄ ą▓čŗčłąĄ 0*ąĪ ąĮą░ čüą╝ąĄčüčī NO ąĖ NO2. ąÜąĖčüą╗ąŠčéąĮčŗą╣ ąŠą║čüąĖą┤ ą┐čĆąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĖ čü ą▓ąŠą┤ąŠą╣ ąĮą░ čģąŠą╗ąŠą┤čā ąŠą▒čĆą░ąĘčāąĄčé ą░ąĘąŠčéąĖčüčéčāčÄ ą║ąĖčüą╗ąŠčéčā HNO2. ąĪ čēąĄą╗ąŠčćą░ą╝ąĖ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą┤ą░ąĄčé čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖąĄ ąĮąĖčéčĆąĖčéčŗ.
ąöąĖąŠą║čüąĖą┤ ą░ąĘąŠčéą░ NO2 – ą║čĆą░čüąĮąŠ-ą║ąŠčĆąĖčćąĮąĄą▓čŗą╣ (ą▒čāčĆčŗą╣) ą│ą░ąĘ čüąŠ čüą▓ąŠąĄąŠą▒čĆą░ąĘąĮčŗą╝ ąĘą░ą┐ą░čģąŠą╝. ąÜąŠąĮą┤ąĄąĮčüąĖčĆčāąĄčéčüčÅ ą┐čĆąĖ 21,2*C ąĖ ąĘą░čéą▓ąĄčĆą┤ąĄą▓ą░ąĄčé ą┐čĆąĖ -10,2*ąĪ (ąČąĖą┤ą║ąŠčüčéčī ąĖ ą║čĆąĖčüčéą░ą╗ą╗čŗ ą▒ąĄčüčåą▓ąĄčéąĮčŗ). ą×č湥ąĮčī čÅą┤ąŠą▓ąĖčé! ą¤čĆąĖ ą┤ą╗ąĖč鹥ą╗čīąĮąŠą╝ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖąĖ NO2 (5 – 25 čćą░čüąŠą▓) ą┐ąŠčÅą▓ą╗čÅčÄčéčüčÅ ą┐čĆąĖąĘąĮą░ą║ąĖ čéčÅąČąĄą╗ąŠą│ąŠ ąŠčéčĆą░ą▓ą╗ąĄąĮąĖčÅ, ą│ą╗ą░ą▓ąĮčŗą╝ ąŠą▒čĆą░ąĘąŠą╝ ąŠč鹥ą║ ą╗ąĄą│ą║ąĖčģ.
ą¤čĆąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĖ ą┤ąĖąŠą║čüąĖą┤ą░ ą░ąĘąŠčéą░ čü čēąĄą╗ąŠčćą░ą╝ąĖ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ čüą╝ąĄčüčī ąĮąĖčéčĆąĖč鹊ą▓ ąĖ ąĮąĖčéčĆą░č鹊ą▓ (ą┐ąŠčŹč鹊ą╝čā NO2 – ąŠą║čüąĖą┤ ą┤ą▓čāčģ ą║ąĖčüą╗ąŠčé):
2NO2 + 2KOH = KNO2 + KNO3 + H2O
ąöąĖąŠą║čüąĖą┤ ą░ąĘąŠčéą░ ą▓čģąŠą┤ąĖčé ą▓ čüąŠčüčéą░ą▓ ŌĆ£ąĮąĖčéčĆąŠąĘąĮčŗčģ ą│ą░ąĘąŠą▓ŌĆØ ą│ą░ąĘąŠą▓ąŠą╣ čüą╝ąĄčüąĖ, ą▓čŗą┤ąĄą╗čÅčÄčēąĄą╣čüčÅ ą┐čĆąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĖ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ (ą┐čĆąĖ ąĄąĄ čĆą░ąĘąĮąŠą╣ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ ą▓ čĆą░čüčéą▓ąŠčĆąĄ) čü ą╝ąĄčéą░ą╗ą╗ą░ą╝ąĖ, ą┐čĆąĖ č鹥čĆą╝ąĖč湥čüą║ąŠą╝ čĆą░ąĘą╗ąŠąČąĄąĮąĖąĖ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ ąĖ ąĮąĖčéčĆą░č鹊ą▓ čéčÅąČąĄą╗čŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓, ą┐čĆąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĖ ąĮąĖčéčĆąĖč鹊ą▓ čü čüąĖą╗čīąĮčŗą╝ąĖ ą║ąĖčüą╗ąŠčéą░ą╝ąĖ, ą░ čéą░ą║ąČąĄ ą┐čĆąĖ ą░ą▓č鹊ą│ąĄąĮąĮąŠą╣ čüą▓ą░čĆą║ąĄ ąĖą╗ąĖ ą┐čĆąĖ ą▒ą╗ąĄčüčéčÅčēąĄą╝ čéčĆą░ą▓ą╗ąĄąĮąĖąĖ ą╝ąĄą┤ąĮčŗčģ ąĖ ą╗ą░čéčāąĮąĮčŗčģ ąĖąĘą┤ąĄą╗ąĖą╣.
ą£ąŠąĮąŠą╝ąĄčĆąĮą░čÅ č乊čĆą╝ą░ ą┤ąĖąŠą║čüąĖą┤ą░ ą░ąĘąŠčéą░ (NO2) ą▓čüąĄą│ą┤ą░ ąĮą░čģąŠą┤ąĖčéčüčÅ ą▓ čĆą░ą▓ąĮąŠą▓ąĄčüąĖąĖ čü ąĄą│ąŠ ą▒ąĄčüčåą▓ąĄčéąĮčŗą╝ (ą▓ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą╝ ąĖ ąČąĖą┤ą║ąŠą╝ čüąŠčüč鹊čÅąĮąĖčÅčģ) ą┤ąĖą╝ąĄčĆąŠą╝ – č鹥čéčĆą░ąŠą║čüąĖą┤ąŠą╝ ą┤ąĖą░ąĘąŠčéą░
2NO2 Ōćä N2O4
ą¤čĆąĖ 64*ąĪ ą┐čĆąĖą╝ąĄčĆąĮąŠ ą┐ąŠą╗ąŠą▓ąĖąĮą░ N2O4 ąĮą░čģąŠą┤ąĖčéčüčÅ ą▓ ą▓ąĖą┤ąĄ NO2, ą┐čĆąĖ ą▒ąŠą╗ąĄąĄ ą▓čŗčüąŠą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ čüąŠą┤ąĄčƹȹ░ąĮąĖąĄ NO2 ąĄčēąĄ ą▒ąŠą╗ąĄąĄ čāą▓ąĄą╗ąĖčćąĖą▓ą░ąĄčéčüčÅ.
ą¤ąĄąĮčéą░ąŠą║čüąĖą┤ ą┤ąĖą░ąĘąŠčéą░ N2O5 – ą▒ąĄčüčåą▓ąĄčéąĮčŗąĄ ą▓ąĘčĆčŗą▓čćą░čéčŗąĄ ą║čĆąĖčüčéą░ą╗ą╗čŗ. ą¤ąŠą╗čāčćą░čÄčé ą┐čĆąĖ ąŠą▒ąĄąĘą▓ąŠąČąĖą▓ą░ąĮąĖąĖ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ ąĮą░ čģąŠą╗ąŠą┤čā čü ą┐ąŠą╝ąŠčēčīčÄ P4O10:
4HNO3 + P4O10 = 2N2O5 + 4HPO3
N2O5 – ą║ąĖčüą╗ąŠčéąĮčŗą╣ ąŠą║čüąĖą┤, ą▒čāčĆąĮąŠ čĆąĄą░ą│ąĖčĆčāąĄčé čü ą▓ąŠą┤ąŠą╣, ąŠą▒čĆą░ąĘčāčÅ ą░ąĘąŠčéąĮčāčÄ ą║ąĖčüą╗ąŠčéčā HNO3.
ąÉąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░. ąØąĖčéčĆą░čéčŗ
ąÉąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░
HNO3 (ąĖąĮąŠą│ą┤ą░ čāą┤ąŠą▒ąĮąĄąĄ ą┐ąĖčüą░čéčī HO-NO2); ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą┐ąŠą╗ąĮąŠčüčéčīčÄ ą┐ąĄčĆąĄčģąŠą┤ąĖčé ą▓ ąĖąŠąĮčŗ H3O+ ąĖ NO3–.
ą¤ąŠą╗čāč湥ąĮąĖąĄ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ.
- ąÜą░čéą░ą╗ąĖčéąĖč湥čüą║ąŠąĄ ąŠą║ąĖčüą╗ąĄąĮąĖąĄ ą░ą╝ą╝ąĖą░ą║ą░ (čüą┐ąŠčüąŠą▒ ą×čüčéą▓ą░ą╗čīą┤ą░, ąĖčüą┐ąŠą╗čīąĘčāąĄą╝čŗą╣ ą▓ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéąĖ čü 1915 ą│ąŠą┤ą░). ąÆ ąŠčüąĮąŠą▓ąĄ čüą┐ąŠčüąŠą▒ą░ ą╗ąĄąČą░čé čüą╗ąĄą┤čāčÄčēąĖąĄ čĆąĄą░ą║čåąĖąĖ:
4NH3 + 5O2 Ōćä 4NO + 6H2O; ╬öH0 = -904 ą║ąöąČ (čĆąĄą░ą║čåąĖčÅ 1)
2NO + O2 Ōćä 2NO2 (čĆąĄą░ą║čåąĖčÅ 2)
4NO2 + O2 + 2H2O = 4HNO3 (čĆąĄą░ą║čåąĖčÅ 3)
ąĪą╝ąĄčüčī ą░ą╝ą╝ąĖą░ą║ą░ čü ą▓ąŠąĘą┤čāčģąŠą╝ ąŠč湥ąĮčī ą▒čŗčüčéčĆąŠ ą┐čĆąŠą┐čāčüą║ą░čÄčé č湥čĆąĄąĘ ą║ą░čéą░ą╗ąĖąĘą░č鹊čĆ – ąĮą░ą│čĆąĄčéčāčÄ čüąĄčéą║čā ąĖąĘ ą┐ą╗ą░čéąĖąĮčŗ ąĖ čĆąŠą┤ąĖčÅ (2000 ąŠčéą▓ąĄčĆčüčéąĖą╣ ąĮą░ 1 čüą╝2); ą┐čĆąŠą┤ąŠą╗ąČąĖč鹥ą╗čīąĮąŠčüčéčī ą║ąŠąĮčéą░ą║čéą░ čĆąĄą░ą║čåąĖąŠąĮąĮąŠą╣ čüą╝ąĄčüąĖ čü ą║ą░čéą░ą╗ąĖąĘą░č鹊čĆąŠą╝ 0,0002 čü.
ą¤čĆąĖ 800*ąĪ ą┐čĆąŠč鹥ą║ą░ąĄčé čĆąĄą░ą║čåąĖčÅ (1). ą¤ąŠčüą╗ąĄ ąŠčģą╗ą░ąČą┤ąĄąĮąĖąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ą▓čłąĖą╣čüčÅ ąŠą║čüąĖą┤ NO ą┐ąĄčĆąĄą▓ąŠą┤ąĖčéčüčÅ ąĖąĘą▒čŗčéą║ąŠą╝ ą║ąĖčüą╗ąŠčĆąŠą┤ą░ ą▓ ą┤ąĖąŠą║čüąĖą┤ ą░ąĘąŠčéą░ NO2, čĆąĄą░ą║čåąĖčÅ (2), ąĖąĘ ą║ąŠč鹊čĆąŠą│ąŠ ą┐čĆąĖ 0,5 – 1,0 ą£ą¤ą░ ą▓ ą┐ąŠą│ą╗ąŠčéąĖč鹥ą╗čīąĮčŗčģ ą▒ą░čłąĮčÅčģ ą┐čĆąĖ ą║ąŠąĮčéą░ą║č鹥 čü ą▓ąŠą┤ąŠą╣ (ąĖą╗ąĖ čü čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮąŠą╣ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠč鹊ą╣) ą┐ąŠą╗čāčćą░čÄčé ą║ąŠąĮąĄčćąĮčŗą╣ ą┐čĆąŠą┤čāą║čé – ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮčāčÄ (60%) ą░ąĘąŠčéąĮčāčÄ ą║ąĖčüą╗ąŠčéčā, čĆąĄą░ą║čåąĖčÅ (3). ą×ą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ ą▓ čŹč鹊ą╝ ą┐čĆąŠčåąĄčüčüąĄ ą╝ąŠąČąĮąŠ ąŠč鹊ą▒čĆą░ąĘąĖčéčī čüą╗ąĄą┤čāčÄčēąĖą╝ąĖ ą┐ąŠčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ-ą┐ą░čĆą░ą╗ą╗ąĄą╗čīąĮčŗą╝ąĖ čüčéą░ą┤ąĖčÅą╝ąĖ:
3NO2 + H2O ŌåÆ 2HNO3 + NO
2NO + O2 ŌåÆ 2NO2
- ąØą░ą│čĆąĄą▓ą░ąĮąĖąĄ ąĮąĖčéčĆą░čéą░ ąĮą░čéčĆąĖčÅ čü čüąĄčĆąĮąŠą╣ ą║ąĖčüą╗ąŠč鹊ą╣:
2NaNO3 + H2SO4 = Na2SO4 + 2HNO3
ąĪčéą░čĆčŗą╣ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮčŗą╣ čüą┐ąŠčüąŠą▒, ą▓ ą║ą░č湥čüčéą▓ąĄ čüčŗčĆčīčÅ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ąĮą░čéčĆąŠąĮąĮą░čÅ čüąĄą╗ąĖčéčĆą░.
ąĪą▓ąŠą╣čüčéą▓ą░ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ. ąæąĄąĘą▓ąŠą┤ąĮą░čÅ (100%) ą░ąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé čüąŠą▒ąŠą╣ ą▒ąĄčüčåą▓ąĄčéąĮčāčÄ čüąĖą╗čīąĮąŠ ą┐ą░čģąĮčāčēčāčÄ ąČąĖą┤ą║ąŠčüčéčī, č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░ ą║ąĖą┐ąĄąĮąĖčÅ 86*ąĪ (菹║čüčéčĆą░ą┐ąŠą╗ąĖčĆąŠą▓ą░ąĮąĮąŠąĄ ąĘąĮą░č湥ąĮąĖąĄ). ą¤čĆąĖ čģčĆą░ąĮąĄąĮąĖąĖ ąĮą░ čüą▓ąĄčéčā ą║ąĖčüą╗ąŠčéą░ ą┐ąŠčüč鹥ą┐ąĄąĮąĮąŠ ąŠą║čĆą░čłąĖą▓ą░ąĄčéčüčÅ ą▓ ą║čĆą░čüąĮąŠ-ą║ąŠčĆąĖčćąĮąĄą▓čŗą╣ (ą▒čāčĆčŗą╣) čåą▓ąĄčé ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ čĆą░ąĘą╗ąŠąČąĄąĮąĖčÅ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ą▓čŗčüčłąĖčģ ąŠą║čüąĖą┤ąŠą▓ ą░ąĘąŠčéą░ (ą▓ č鹊ą╝ čćąĖčüą╗ąĄ ąŠą║čĆą░čłąĄąĮąĮąŠą│ąŠ NO2). ąÆčŗą┐čāčüą║ą░ąĄą╝ą░čÅ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéčīčÄ (60-68%) ą░ąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ą║ąĖą┐ąĖčé ą┐čĆąĖ 122*ąĪ (ą░ąĘąĄąŠčéčĆąŠą┐ąĮą░čÅ čüą╝ąĄčüčī čü ą▓ąŠą┤ąŠą╣). ąÜąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮą░čÅ ą░ąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░, čüąŠą┤ąĄčƹȹ░čēą░čÅ ąĘąĮą░čćąĖč鹥ą╗čīąĮčŗąĄ ą║ąŠą╗ąĖč湥čüčéą▓ą░ ą╝ąŠą╗ąĄą║čāą╗ HNO3, ą┤ąĄą╣čüčéą▓čāąĄčé ą║ą░ą║ čüąĖą╗čīąĮčŗą╣ ąŠą║ąĖčüą╗ąĖč鹥ą╗čī, ąĮąŠ ą┐ąŠ ą╝ąĄčĆąĄ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĖčÅ ąĄąĄ ą▓ąŠą┤ąŠą╣, ąŠą▒čĆą░ąĘčāčÄčēąĄą╣čüčÅ ą┐čĆąĖ čĆąĄą░ą║čåąĖąĖ, ąŠą║ąĖčüą╗ąĖč鹥ą╗čīąĮą░čÅ ą░ą║čéąĖą▓ąĮąŠčüčéčī ą║ąĖčüą╗ąŠčéčŗ čüąĮąĖąČą░ąĄčéčüčÅ. ą¤čĆąŠą┤čāą║č鹊ą╝ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖčÅ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ čÅą▓ą╗čÅčÄčéčüčÅ ąĮąĖčéčĆąŠąĘąĮčŗąĄ ą│ą░ąĘčŗ. ąÆ ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠč鹥 ą╗ąĄą│ą║ąŠ ąŠą║ąĖčüą╗čÅčÄčéčüčÅ čüąŠą╗ąŠą╝ą░, ą┤čĆąĄą▓ąĄčüąĖąĮą░, č乊čüč乊čĆ ąĖ ą╝ąĮąŠą│ąĖąĄ ą╝ąĄčéą░ą╗ą╗čŗ, ą▓ č鹊ą╝ čćąĖčüą╗ąĄ čéą░ą║ąĖąĄ ą║ą░ą║ ą╝ąĄą┤čī, čĆčéčāčéčī ąĖ čüąĄčĆąĄą▒čĆąŠ, ąĮą░ą┐čĆąĖą╝ąĄčĆ:
Cu + 4HNO3 (ą║ąŠąĮčå.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (čĆą░ąĘą▒.) = 3Cu(NO3)2 + 2NO + 4H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
ąÉąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ąĮąĄ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓čāąĄčé čü ąĘąŠą╗ąŠč鹊ą╝ ąĖ ą┐ą╗ą░čéąĖąĮąŠą╣, ą║ąŠč鹊čĆčŗąĄ ą╝ąŠą│čāčé ą▒čŗčéčī ą┐ąĄčĆąĄą▓ąĄą┤ąĄąĮčŗ ą▓ čĆą░čüčéą▓ąŠčĆ č鹊ą╗čīą║ąŠ ą┐čĆąĖ ąŠą▒čĆą░ą▒ąŠčéą║ąĄ čåą░čĆčüą║ąŠą╣ ą▓ąŠą┤ą║ąŠą╣ – čüą╝ąĄčüčīčÄ ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮčŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ HCl ąĖ HNO3 ą▓ ąŠą▒čŖąĄą╝ąĮąŠą╝ ąŠčéąĮąŠčłąĄąĮąĖąĖ 3 : 1. ąöąĄą╣čüčéą▓ąĖąĄ čåą░čĆčüą║ąŠą╣ ą▓ąŠą┤ą║ąĖ ąŠą▒čŖčÅčüąĮčÅąĄčéčüčÅ č鹥ą╝, čćč鹊 ą░ąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ąŠą║ąĖčüą╗čÅąĄčé čģą╗ąŠčĆąĖą┤ąĮčāčÄ ą║ąĖčüą╗ąŠčéčā čü ą▓čŗą┤ąĄą╗ąĄąĮąĖąĄą╝ čüą▓ąŠą▒ąŠą┤ąĮąŠą│ąŠ čģą╗ąŠčĆą░ ąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ čģą╗ąŠčĆąŠą║čüąĖą┤ą░ ą░ąĘąŠčéą░(III), ąĖą╗ąĖ čģą╗ąŠčĆąĖą┤ą░ ąĮąĖčéčĆąŠąĘąĖą╗ą░, NOCl:
HNO3 + 3HCl = Cl2 + 2H2O + NOCl
ąźą╗ąŠčĆąĖą┤ ąĮąĖčéčĆąŠąĘąĖą╗ą░ čÅą▓ą╗čÅąĄčéčüčÅ ą┐čĆąŠą╝ąĄąČčāč鹊čćąĮčŗą╝ ą┐čĆąŠą┤čāą║č鹊ą╝ čĆąĄą░ą║čåąĖąĖ ąĖ čĆą░ąĘą╗ą░ą│ą░ąĄčéčüčÅ:
2NOCl = 2NO + Cl2
ąźą╗ąŠčĆ ą▓ ą╝ąŠą╝ąĄąĮčé ą▓čŗą┤ąĄą╗ąĄąĮąĖčÅ čüąŠčüč鹊ąĖčé ąĖąĘ ą░č鹊ą╝ąŠą▓, čćč鹊 ąĖ ąŠą▒čāčüą╗ąŠą▓ą╗ąĖą▓ą░ąĄčé ą▓čŗčüąŠą║čāčÄ ąŠą║ąĖčüą╗ąĖč鹥ą╗čīąĮčāčÄ čüą┐ąŠčüąŠą▒ąĮąŠčüčéčī čåą░čĆčüą║ąŠą╣ ą▓ąŠą┤ą║ąĖ:
Au + HNO3 + 3HCl = AuCl3 + NO + 2H2O
3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO + 8H2O
ąØąĄą║ąŠč鹊čĆčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ ąĮąĄ čĆąĄą░ą│ąĖčĆčāčÄčé čü ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠč鹊ą╣ ąĖąĘ-ąĘą░ ąĖčģ ą┐ą░čüčüąĖą▓ąĖčĆąŠą▓ą░ąĮąĖčÅ – ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čāčüč鹊ą╣čćąĖą▓ąŠą╣ ąŠą║čüąĖą┤ąĮąŠą╣ ą┐ą╗ąĄąĮą║ąĖ. ąóą░ą║, ą░ą╗čÄą╝ąĖąĮąĖą╣ ąĖ ąČąĄą╗ąĄąĘąŠ čāčüč鹊ą╣čćąĖą▓čŗ ą║ ą┤ąĄą╣čüčéą▓ąĖčÄ čģąŠą╗ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ HNO3, a čģčĆąŠą╝ – čéą░ą║ąČąĄ ą║ ą┤ąĄą╣čüčéą▓ąĖčÄ ą│ąŠčĆčÅč湥ą│ąŠ čĆą░čüčéą▓ąŠčĆą░ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ. ąÆ čüąĖą╗čīąĮąŠ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮąŠą╣ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠč鹥 čāąČąĄ ąĮąĄčé ą╝ąŠą╗ąĄą║čāą╗ (čüčāčēąĄčüčéą▓čāčÄčé č鹊ą╗čīą║ąŠ ąĖąŠąĮčŗ H3O+ ąĖ NO3–), ą┐ąŠčŹč鹊ą╝čā čéą░ą║ą░čÅ HNO3 čāąČąĄ ąĮąĄ ą┐ąĄčĆąĄą▓ąŠą┤ąĖčé ą▓ čĆą░čüčéą▓ąŠčĆ ą╝ąĄą┤čī ąĖ ą┤čĆčāą│ąĖąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ. ąĀą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮą░čÅ ą░ąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ čĆąĄą░ą│ąĖčĆčāąĄčé čü ą╝ąĄčéą░ą╗ą╗ą░ą╝ąĖ, čüč鹊čÅčēąĖą╝ąĖ ą╗ąĄą▓ąĄąĄ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą▓ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╝ čĆčÅą┤čā ąĮą░ą┐čĆčÅąČąĄąĮąĖą╣ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ N2O.
4Mg + 10HNO3 (čĆą░ąĘą▒.) = 4Mg(NO3)2 + N2O + 5H2O
ą×č湥ąĮčī čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮą░čÅ ą░ąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ čĆąĄą░ą│ąĖčĆčāąĄčé čü ą░ą║čéąĖą▓ąĮčŗą╝ąĖ ą╝ąĄčéą░ą╗ą╗ą░ą╝ąĖ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ąĮąĖčéčĆą░čéą░ ą░ą╝ą╝ąŠąĮąĖčÅ:
4Zn + 10HNO3 (ąŠč湥ąĮčī čĆą░ąĘą▒.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
ąÜąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮą░čÅ ą░ąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ą┤ąĄą╣čüčéą▓čāąĄčé ąĮą░ čāą│ą╗ąĄą▓ąŠą┤ąŠčĆąŠą┤čŗ, ąŠčüąŠą▒ąĄąĮąĮąŠ ą░čĆąŠą╝ą░čéąĖč湥čüą║ąĖąĄ, ąĖ ąŠą▒čĆą░ąĘčāąĄčé ą╗ąĖą▒ąŠ ąĮąĖčéčĆąŠčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ (čüąŠą┤ąĄčƹȹ░čé ąĮąĖčéčĆąŠą│čĆčāą┐ą┐čā -NO2), ą╗ąĖą▒ąŠ čüą╗ąŠąČąĮčŗąĄ čŹčäąĖčĆčŗ – ąĮąĖčéčĆą░čéčŗ (čüąŠą┤ąĄčƹȹ░čé ąĮąĖčéčĆą░čéąĮčāčÄ ą│čĆčāą┐ą┐čā -ONO2). ą×ą▒čŗčćąĮąŠ ą┤ą╗čÅ ąĮąĖčéčĆąŠą▓ą░ąĮąĖčÅ čāą│ą╗ąĄą▓ąŠą┤ąŠčĆąŠą┤ąŠą▓ ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ąĮąĖčéčĆčāčÄčēą░čÅ čüą╝ąĄčüčī – ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮčŗąĄ HNO3 ąĖ H2SO4. ą×ą║čĆą░čłąĖą▓ą░ąĮąĖąĄ ą▒ąĄą╗ą║ąŠą▓čŗčģ č鹥ą╗, ą▓ čćą░čüčéąĮąŠčüčéąĖ ą║ąŠąČąĖ, ą▓ ąČąĄą╗čéčŗą╣ čåą▓ąĄčé ą┐čĆąĖ ąĖčģ ą║ąŠąĮčéą░ą║č鹥 čü ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠč鹊ą╣ – ą║čüą░ąĮč鹊ą┐čĆąŠč鹥ąĖąĮąŠą▓ą░čÅ čĆąĄą░ą║čåąĖčÅ – čéą░ą║ąČąĄ čÅą▓ą╗čÅąĄčéčüčÅ ą┐čĆąŠčåąĄčüčüąŠą╝ ąĮąĖčéčĆąŠą▓ą░ąĮąĖčÅ.
ą×ą▒ąĮą░čĆčāąČąĄąĮąĖąĄ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ.
- ą¤čĆąĖ ąĮąĄą╣čéčĆą░ą╗ąĖąĘą░čåąĖąĖ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠč鹊ą╣ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą│ąŠ ąŠčüąĮąŠą▓ą░ąĮąĖčÅ – ąĮąĖčéčĆąŠąĮą░ – ą▓čŗą┐ą░ą┤ą░ąĄčé ą▒ąĄą╗čŗą╣ ąŠčüą░ą┤ąŠą║.
- ąĀą░čüčéą▓ąŠčĆ, čüąŠą┤ąĄčƹȹ░čēąĖą╣ ąĖąŠąĮčŗ NO3– ąĖ Fe2+, ąĮą░ą╗ąĖą▓ą░čÄčé ąĮą░ čüą╗ąŠą╣ ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ H2SO4; ą▓ ą╝ąĄčüč鹥 čüąŠą┐čĆąĖą║ąŠčüąĮąŠą▓ąĄąĮąĖčÅ ąČąĖą┤ą║ąŠčüč鹥ą╣ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą▒čāčĆąŠąĄ ą║ąŠą╗čīčåąŠ, čāą║ą░ąĘčŗą▓ą░čÄčēąĄąĄ ąĮą░ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą║ąŠą╝ą┐ą╗ąĄą║čüą░ [Fe(NO)(H2O)5]2+ – ą║ą░čéąĖąŠąĮ ą┐ąĄąĮčéą░ą░ą║ą▓ą░ąĮąĖčéčĆąŠąĘąĖą╗ąĖą╣ąČąĄą╗ąĄąĘą░(II).
ą¤čĆąĖą╝ąĄąĮąĄąĮąĖąĄ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ. ąÉąĘąŠčéąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ – ąŠą┤ąĖąĮ ąĖąĘ ąŠčüąĮąŠą▓ąĮčŗčģ ą┐čĆąŠą┤čāą║č鹊ą▓ ą╝ąĮąŠą│ąŠč鹊ąĮąĮą░ąČąĮąŠą╣ čģąĖą╝ąĖč湥čüą║ąŠą╣ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéąĖ. ą¤čĆąĖą▒ą╗ąĖąĘąĖč鹥ą╗čīąĮąŠ 75% HNO3, ą┐ąŠą╗čāčćą░ąĄą╝ąŠą╣ ą▓ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠčüčéąĖ, ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą┤ą╗čÅ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ą░ čāą┤ąŠą▒čĆąĄąĮąĖą╣, 15% – ą┤ą╗čÅ ą┐čĆąŠąĖąĘą▓ąŠą┤čüčéą▓ą░ ą▓ąĘčĆčŗą▓čćą░čéčŗčģ ą▓ąĄčēąĄčüčéą▓ ąĖ 10% – ą┤ą╗čÅ ą┤čĆčāą│ąĖčģ čåąĄą╗ąĄą╣. ą×čüąĮąŠą▓ąĮčŗąĄ čģąĖą╝ąĖč湥čüą║ąĖąĄ ą┐čĆąŠą┤čāą║čéčŗ, ą┐čĆąŠąĖąĘą▓ąŠą┤ąĖą╝čŗąĄ čü ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĄą╝ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ, ą┐čāčéąĖ ąĖčģ ą┐ąŠą╗čāč湥ąĮąĖčÅ ąĖ ąŠą▒ą╗ą░čüčéąĖ ą┐čĆąĖą╝ąĄąĮąĄąĮąĖčÅ ą┐ąŠą║ą░ąĘą░ąĮčŗ ąĮą░ čüčģąĄą╝ąĄ.
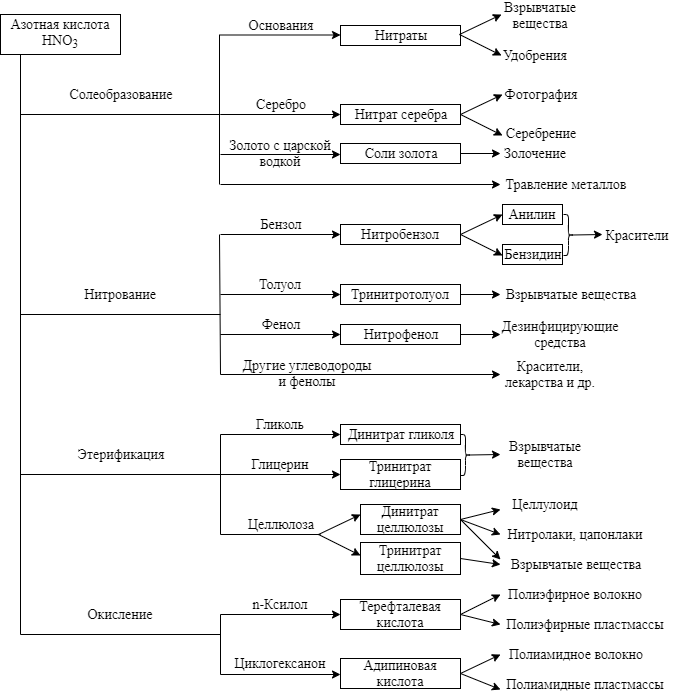
ąØąĖčéčĆą░čéčŗ
ąĪąŠą╗ąĖ ąĖ čŹčäąĖčĆčŗ ą░ąĘąŠčéąĮąŠą╣ ą║ąĖčüą╗ąŠčéčŗ ąĮą░ąĘčŗą▓ą░čÄčéčüčÅ ąĮąĖčéčĆą░čéą░ą╝ąĖ. ąóčĆąĖą▓ąĖą░ą╗čīąĮčŗąĄ ąĮą░ąĘą▓ą░ąĮąĖčÅ ąĮąĄą║ąŠč鹊čĆčŗčģ ąĮąĖčéčĆą░č鹊ą▓: KNO3 – ą║ą░ą╗ąĖą╣ąĮą░čÅ (ąĖąĮą┤ąĖą╣čüą║ą░čÅ) čüąĄą╗ąĖčéčĆą░; NaNO3 – ąĮą░čéčĆąŠąĮąĮą░čÅ (čćąĖą╗ąĖą╣čüą║ą░čÅ) čüąĄą╗ąĖčéčĆą░; NH4NO3 – ą░ą╝ą╝ąŠąĮąĖą╣ąĮą░čÅ čüąĄą╗ąĖčéčĆą░; Ca(NO3)2 – ąĖąĘą▓ąĄčüčéą║ąŠą▓ą░čÅ (ąĮąŠčĆą▓ąĄąČčüą║ą░čÅ) čüąĄą╗ąĖčéčĆą░; Ba(NO3)2 – ą▒ą░čĆąĖč鹊ą▓ą░ čüąĄą╗ąĖčéčĆą░; AgNO3 – ą░ą┤čüą║ąĖą╣ ą║ą░ą╝ąĄąĮčī (ą╗čÅą┐ąĖčü).
ąØąĖčéčĆą░čéčŗ ą▓čüąĄčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓ čģąŠčĆąŠčłąŠ čĆą░čüčéą▓ąŠčĆąĖą╝čŗ ą▓ ą▓ąŠą┤ąĄ. ą¤čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ ąĮąĖčéčĆą░čéčŗ čĆą░ąĘą╗ą░ą│ą░čÄčéčüčÅ, ą┐čĆąŠą┤čāą║čéčŗ čĆą░ąĘą╗ąŠąČąĄąĮąĖčÅ ąĘą░ą▓ąĖčüčÅčé ąŠčé ą┐čĆąĖčĆąŠą┤čŗ ąĮąĖčéčĆą░čéą░:
- ąØąĖčéčĆą░čéčŗ čēąĄą╗ąŠčćąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓ čĆą░ąĘą╗ą░ą│ą░čÄčéčüčÅ ąĮą░ ąĮąĖčéčĆąĖčé ąĖ ą║ąĖčüą╗ąŠčĆąŠą┤:
KNO3 = KNO2 + O2
- ąØąĖčéčĆą░čéčŗ ąŠčüčéą░ą╗čīąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓ čĆą░ąĘą╗ą░ą│ą░čÄčéčüčÅ ąĮą░ ąŠą║čüąĖą┤ ą╝ąĄčéą░ą╗ą╗ą░ (ąĖą╗ąĖ ą╝ąĄčéą░ą╗ą╗ ą▓ čüą▓ąŠą▒ąŠą┤ąĮąŠą╝ ą▓ąĖą┤ąĄ, ąĄčüą╗ąĖ ąŠą║čüąĖą┤ č鹥čĆą╝ąĖč湥čüą║ąĖ ąĮąĄčāčüč鹊ą╣čćąĖą▓), ą┤ąĖąŠą║čüąĖą┤ ą░ąĘąŠčéą░ ąĖ ą║ąĖčüą╗ąŠčĆąŠą┤:
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
- ąØąĖčéčĆą░čé ą░ą╝ą╝ąŠąĮąĖčÅ čĆą░ąĘą╗ą░ą│ą░ąĄčéčüčÅ ąĮą░ ąŠą║čüąĖą┤ ą┤ąĖą░ąĘąŠčéą░ ąĖ ą▓ąŠą┤čā:
NH4NO3 = N2O + 2H2O










