ą£ąĄčģą░ąĮąĖąĘą╝čŗ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖą╣ – ąŠčüąĮąŠą▓ąĮčŗąĄ ą┐ąŠąĮčÅčéąĖčÅ ąĖ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĖčÅ
ąźąĖą╝ąĖč湥čüą║ą░čÅ čĆąĄą░ą║čåąĖčÅ ą╝ąĄąČą┤čā ą┤ą▓čāą╝čÅ ą▓ąĄčēąĄčüčéą▓ą░ą╝ąĖ ą▓čüąĄą│ą┤ą░ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅąĄčé čüąŠą▒ąŠą╣ ą▓ąĘą░ąĖą╝ąĮąŠąĄ ą┤ąĄą╣čüčéą▓ąĖąĄ čŹčéąĖčģ ą▓ąĄčēąĄčüčéą▓ ą┤čĆčāą│ ąĮą░ ą┤čĆčāą│ą░. ąóą░ą║, ąĮąĄ č鹊ą╗čīą║ąŠ čģą╗ąŠčĆ ą┤ąĄą╣čüčéą▓čāąĄčé ąĮą░ ą╝ąĄčéą░ąĮ, ąĮąŠ ąĖ ą╝ąĄčéą░ąĮ ąĮą░ čģą╗ąŠčĆ, čé. ąĄ. čģą╗ąŠčĆ ąĮąĄ ą┐čĆąŠčüč鹊 ą░ą│čĆąĄčüčüąĖą▓ąĮčŗą╣ ą│ą░ąĘ, ąĮąŠ ąŠąĮ čüčéą░ąĮąŠą▓ąĖčéčüčÅ ą░ą│čĆąĄčüčüąĖą▓ąĮčŗą╝ ą┐ąŠą┤ ą┤ąĄą╣čüčéą▓ąĖąĄą╝ ą╝ąĄčéą░ąĮą░. ą×ą┤ąĮą░ą║ąŠ ą▓ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ čģąĖą╝ąĖąĖ ą┐čĆąĄą┤ą┐ąŠčćčéąĖč鹥ą╗čīąĮąŠ čüčćąĖčéą░čÄčé, čćč鹊 čģą╗ąŠčĆ ą▓ąŠąĘą┤ąĄą╣čüčéą▓čāąĄčé ąĮą░ ą╝ąĄčéą░ąĮ. ąśčüčģąŠą┤čÅ ąĖąĘ čŹčéąĖčģ ą┐ąŠąĘąĖčåąĖą╣ čģą╗ąŠčĆ ąĮą░ąĘčŗą▓ą░čÄčé čĆąĄą░ą│ąĄąĮč鹊ą╝, ą░ ą╝ąĄčéą░ąĮ – čüčāą▒čüčéčĆą░č鹊ą╝. ą¤ąŠą┤ čüčāą▒čüčéčĆą░čéą░ą╝ąĖ ąŠą▒čŗčćąĮąŠ ą┐ąŠąĮąĖą╝ą░čÄčé ą▓ąĄčēąĄčüčéą▓ą░ čü ą▒ąŠą╗čīčłąĖą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ, ą░ ą┐ąŠą┤ čĆąĄą░ą│ąĄąĮčéą░ą╝ąĖ – ą▓ąĄčēąĄčüčéą▓ą░ čü ą╝ą░ą╗čŗą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ, čé. ąĄ. čĆąĄą░ą│ąĄąĮčé – čŹč鹊 ą▓ąĄčēąĄčüčéą▓ąŠ čü ą▒ąŠą╗ąĄąĄ ą┐čĆąŠčüčéčŗą╝ čüąŠčüčéą░ą▓ąŠą╝, čćą░čüč鹊 ąĮąĄąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą│ąŠ ą┐čĆąŠąĖčüčģąŠąČą┤ąĄąĮąĖčÅ. ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ą▓ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖčÅčģ ą┤ą░ąĮąĮčŗą╣ čüčāą▒čüčéčĆą░čé ą░čéą░ą║čāąĄčéčüčÅ ąĮąĄą║ąŠč鹊čĆčŗą╝ čĆąĄą░ą│ąĄąĮč鹊ą╝.
ąĀą░ąĘą╗ąĖčćąĖąĄ ą╝ąĄąČą┤čā čüčāą▒čüčéčĆą░č鹊ą╝ ąĖ čĆąĄą░ą│ąĄąĮč鹊ą╝ čāą┤ą░ąĄčéčüčÅ ą┐čĆąŠą▓ąĄčüčéąĖ ą┤ą░ą╗ąĄą║ąŠ ąĮąĄ ą▓čüąĄą│ą┤ą░ ąĖ čćą░čüč鹊 čāčüčéą░ąĮą░ą▓ą╗ąĖą▓ą░ąĄčéčüčÅ ą┐čĆąŠąĖąĘą▓ąŠą╗čīąĮąŠ. ąóą░ą║, ą▓ čĆąĄą░ą║čåąĖčÅčģ čŹč鹥čĆąĖčäąĖą║ą░čåąĖąĖ ą║ą░čĆą▒ąŠąĮąŠą▓čāčÄ ą║ąĖčüą╗ąŠčéčā ąĮąĄąĘą░ą▓ąĖčüąĖą╝ąŠ ąŠčé ąĄąĄ čüąŠčüčéą░ą▓ą░ ą┐čĆąĖąĮąĖą╝ą░čÄčé ąĘą░ čüčāą▒čüčéčĆą░čé, ą░ čüą┐ąĖčĆčé, ą║ąŠč鹊čĆčŗą╣ ą╝ąŠąČąĄčé ąŠą║ą░ąĘą░čéčīčüčÅ ą▒ąŠą╗ąĄąĄ čüą╗ąŠąČąĮčŗą╝ ą┐ąŠ čüąŠčüčéą░ą▓čā, č湥ą╝ ą║ąĖčüą╗ąŠčéą░, – ąĘą░ čĆąĄą░ą│ąĄąĮčé.
ąÆ čģąŠą┤ąĄ čĆąĄą░ą║čåąĖąĖ ąŠą┤ąĮąĖ čģąĖą╝ąĖč湥čüą║ąĖąĄ čüą▓čÅąĘąĖ čĆą░ąĘčĆčŗą▓ą░čÄčéčüčÅ, ą░ ą┤čĆčāą│ąĖąĄ – ąŠą▒čĆą░ąĘčāčÄčéčüčÅ. ąĀą░ąĘčĆčŗą▓ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗčģ čüą▓čÅąĘąĄą╣ ą╝ąŠąČąĄčé ą▒čŗčéčī ą│ąŠą╝ąŠą╗ąĖčéąĖč湥čüą║ąĖą╝ ąĖ ą│ąĄč鹥čĆąŠą╗ąĖčéąĖč湥čüą║ąĖą╝.
ą¤čĆąĖ ą│ąŠą╝ąŠą╗ąĖčéąĖč湥čüą║ąŠą╝ čĆą░ąĘčĆčŗą▓ąĄ (ą│ąŠą╝ąŠą╗ąĖąĘ) čüą▓čÅąĘčŗą▓ą░čÄčēą░čÅ čŹą╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐ą░čĆą░ čĆą░ąĘčŖąĄą┤ąĖąĮčÅąĄčéčüčÅ ąĮą░ ąĮąĄčüą┐ą░čĆąĄąĮąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ
A : B ŌåÆ AŌŗģ + ŌŗģB
ą▓ čĆąĄąĘčāą╗čīčéą░č鹥 ąŠą▒čĆą░ąĘčāčÄčéčüčÅ čüą▓ąŠą▒ąŠą┤ąĮčŗąĄ čĆą░ą┤ąĖą║ą░ą╗čŗ – ąĮąĄą╣čéčĆą░ą╗čīąĮčŗąĄ čćą░čüčéąĖčåčŗ.
ą¤čĆąĖ ą│ąĄč鹥čĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╝ čĆą░ąĘčĆčŗą▓ąĄ (ą│ąĄč鹥čĆąŠą╗ąĖąĘ) čüą▓čÅąĘčŗą▓ą░čÄčēą░čÅ čŹą╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐ą░čĆą░ ąŠčüčéą░ąĄčéčüčÅ čā ąŠą┤ąĮąŠą│ąŠ ąĖąĘ čĆą░ąĮąĄąĄ čüą▓čÅąĘą░ąĮąĮčŗčģ ą░č鹊ą╝ąŠą▓
A : B ŌåÆ A+ + :B–
ąĖ ąŠą▒čĆą░ąĘčāčÄčéčüčÅ ąĖąŠąĮčŗ – ą┐čĆąŠčéąĖą▓ąŠą┐ąŠą╗ąŠąČąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗąĄ čćą░čüčéąĖčåčŗ.
ąÉč鹊ą╝čŗ, ą╝ąŠą╗ąĄą║čāą╗čŗ, ąĖąŠąĮčŗ, ą░ čéą░ą║ąČąĄ ąŠčéą┤ąĄą╗čīąĮčŗąĄ čāčćą░čüčéą║ąĖ ą╝ąŠą╗ąĄą║čāą╗ ą╝ąŠą│čāčé ąŠą▒ą╗ą░ą┤ą░čéčī 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠčüčéčīčÄ ąĖ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠčüčéčīčÄ.
ąØčāą║ą╗ąĄąŠčäąĖą╗ čüą┐ąŠčüąŠą▒ąĄąĮ ą┐čĆąĄą┤ąŠčüčéą░ą▓ąĖčéčī 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą░čĆčā ą┤ą╗čÅ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ąĮąŠą▓ąŠą╣ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ ąĖąĘą▒čŗčéą║ą░ čüąŠą▒čüčéą▓ąĄąĮąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓.
ąŁą╗ąĄą║čéčĆąŠčäąĖą╗ čüą┐ąŠčüąŠą▒ąĄąĮ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░čéčī 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą░čĆčā ą┐ą░čĆčéąĮąĄčĆą░ ą┤ą╗čÅ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ąĮąŠą▓ąŠą╣ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ ąĮąĄą┤ąŠčüčéą░čéą║ą░ čüąŠą▒čüčéą▓ąĄąĮąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓.
ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, 菹╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐ą░čĆą░ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą│ąŠ ą░ą│ąĄąĮčéą░ ąŠą▒čĆą░ąĘčāąĄčé čüą▓čÅąĘčī čü 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗą╝ ą┐ą░čĆčéąĮąĄčĆąŠą╝. ąÆ ą║ą░č湥čüčéą▓ąĄ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗčģ čĆąĄą░ą│ąĄąĮč鹊ą▓ ą╝ąŠą│čāčé ą▓čŗčüčéčāą┐ą░čéčī ą╝ąŠą╗ąĄą║čāą╗čŗ čüąŠ čüą▓ąŠą▒ąŠą┤ąĮąŠą╣ ąĮąĄą┐ąŠą┤ąĄą╗ąĄąĮąĮąŠą╣ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą░čĆąŠą╣, čéą░ą║ąĖąĄ ą║ą░ą║ H2O, NH3; ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗąĄ ąĖąŠąĮčŗ, ąĮą░ą┐čĆąĖą╝ąĄčĆ OH–, Br–; ą░č鹊ą╝čŗ C čü čćą░čüčéąĖčćąĮčŗą╝ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ ąĘą░čĆčÅą┤ąŠą╝ C╬┤--Me (ą│ą┤ąĄ Me – ą░č鹊ą╝ ą╝ąĄčéą░ą╗ą╗ą░); čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ čü ą║čĆą░čéąĮčŗą╝ąĖ čüą▓čÅąĘčÅą╝ąĖ. ąÜ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗą╝ čĆąĄą░ą│ąĄąĮčéą░ą╝ ąŠčéąĮąŠčüčÅčéčüčÅ ą╝ąŠą╗ąĄą║čāą╗čŗ, čüąŠą┤ąĄčƹȹ░čēąĖąĄ ą░č鹊ą╝čŗ čü ąĮąĄąĘą░ą┐ąŠą╗ąĮąĄąĮąĮąŠą╣ ą▓ąĮąĄčłąĮąĄą╣ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ąŠą▒ąŠą╗ąŠčćą║ąŠą╣, čéą░ą║ąĖąĄ ą║ą░ą║ AlCl3, BF3; ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗąĄ ąĖąŠąĮčŗ H+, ą║ą░čéąĖąŠąĮčŗ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąĖ ą┤čĆ.; ą░č鹊ą╝čŗ C čü čćą░čüčéąĖčćąĮčŗą╝ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ ąĘą░čĆčÅą┤ąŠą╝ C-X (ą│ą┤ąĄ X – ą░č鹊ą╝ ąĮąĄą╝ąĄčéą░ą╗ą╗ą░).
ąÆ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ąŠčé ą╝ąĄčģą░ąĮąĖąĘą╝ą░ čĆąĄą░ą║čåąĖąĖ, čé.ąĄ. ąŠčé ą▓ąĖą┤ą░ čĆą░ąĘčĆčŗą▓ą░ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ, ąĖ ąŠčé č鹊ą│ąŠ, čÅą▓ą╗čÅąĄčéčüčÅ ą┐čĆąĖ ą┤ą░ąĮąĮąŠą╣ čĆąĄą░ą║čåąĖąĖ (ą▓ čüą╗čāčćą░ąĄ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮąŠą│ąŠ čĆą░ąĘčĆčŗą▓ą░ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ) čĆąĄą░ą│ąĄąĮčé ąĮčāą║ą╗ąĄąŠčäąĖą╗ąŠą╝ ąĖą╗ąĖ 菹╗ąĄą║čéčĆąŠčäąĖą╗ąŠą╝, ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖąĄ čĆąĄą░ą║čåąĖąĖ ą║ą╗ą░čüčüąĖčäąĖčåąĖčĆčāčÄčé ąĮą░ čĆą░ą┤ąĖą║ą░ą╗čīąĮčŗąĄ, ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗąĄ ąĖ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗąĄ. ąÜ ąŠčüąĮąŠą▓ąĮčŗą╝ čéąĖą┐ą░ą╝ čģąĖą╝ąĖč湥čüą║ąĖčģ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ ąŠčéąĮąĄčüąĄąĮčŗ čĆąĄą░ą║čåąĖąĖ ąĘą░ą╝ąĄčēąĄąĮąĖčÅ (ąŠą▒ąŠąĘąĮą░č湥ąĮąĖąĄ S), ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ (A) ąĖ ąŠčéčēąĄą┐ą╗ąĄąĮąĖčÅ (E), ą║ą░ąČą┤ą░čÅ ąĖąĘ ą║ąŠč鹊čĆčŗčģ ą╝ąŠąČąĄčé ą▒čŗčéčī čĆą░ą┤ąĖą║ą░ą╗čīąĮąŠą╣ (ąŠą▒ąŠąĘąĮą░č湥ąĮąĖąĄ R), ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą╣ (N) ąĖ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą╣ (E).
ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ą▓ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ čģąĖą╝ąĖąĖ ą▓čŗą┤ąĄą╗čÅčÄčé ą┤ąĄą▓čÅčéčī čéąĖą┐ąŠą▓čŗčģ čĆąĄą░ą║čåąĖą╣, ąŠą▒ąŠąĘąĮą░čćą░ąĄą╝čŗčģ čüąĖą╝ą▓ąŠą╗ą░ą╝ąĖ S, A ąĖ E čü ąĖąĮą┤ąĄą║čüą░ą╝ąĖ R, N ąĖ E:┬Ā
|
ąĀąĄą░ą║čåąĖčÅ |
ąĀą░ą┤ąĖą║ą░ą╗čīąĮą░čÅ |
ąØčāą║ą╗ąĄąŠčäąĖą╗čīąĮą░čÅ |
ąŁą╗ąĄą║čéčĆąŠčäąĖą╗čīąĮą░čÅ |
|
ąŚą░ą╝ąĄčēąĄąĮąĖčÅ |
SR |
SN |
SE |
|
ą¤čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ |
AR |
AN |
AE |
|
ą×čéčēąĄą┐ą╗ąĄąĮąĖčÅ |
ER |
EN |
EE |
ąØąĄą║ąŠč鹊čĆčŗąĄ ąĖąĘ čŹčéąĖčģ čéąĖą┐ąŠą▓ ą╝ąŠą│čāčé ą▒čŗčéčī ąĄčēąĄ čĆą░ąĘą┤ąĄą╗ąĄąĮčŗ ąĮą░ ą┐ąŠą┤čéąĖą┐čŗ ą┐ąŠ ą▓ąĖą┤čā ą╝ąĄčģą░ąĮąĖąĘą╝ą░ čĆąĄą░ą║čåąĖąĖ, ąĮą░ą┐čĆąĖą╝ąĄčĆ čĆą░ąĘą╗ąĖčćą░čÄčé SN1 ąĖ EN1 – čĆąĄą░ą║čåąĖąĖ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą│ąŠ ąĘą░ą╝ąĄčēąĄąĮąĖčÅ ąĖ ąŠčéčēąĄą┐ą╗ąĄąĮąĖčÅ, ąĖą╝ąĄčÄčēąĖąĄ čüčéčāą┐ąĄąĮčćą░čéčŗą╣ ą╝ąĄčģą░ąĮąĖąĘą╝; SN2 ąĖ EN2 – čĆąĄą░ą║čåąĖąĖ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą│ąŠ ąĘą░ą╝ąĄčēąĄąĮąĖčÅ ąĖ ąŠčéčēąĄą┐ą╗ąĄąĮąĖčÅ, ąĖą╝ąĄčÄčēąĖąĄ ąŠą┤ąĮąŠčüčéą░ą┤ąĖą╣ąĮčŗą╣ ą╝ąĄčģą░ąĮąĖąĘą╝.
ą¤čĆąĖą▓ąĄą┤ąĄąĮąĮčŗąĄ čéąĖą┐čŗ ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖą╣ ąĮąĄ ą▓čüąĄą│ą┤ą░ čĆąĄą░ą╗ąĖąĘčāčÄčéčüčÅ ą▓ čćąĖčüč鹊ą╝ ą▓ąĖą┤ąĄ, ąĖčģ ą╝ąŠąČąĮąŠ čüčćąĖčéą░čéčī ą╝ąŠą┤ąĄą╗čīąĮčŗą╝ąĖ čéąĖą┐ą░ą╝ąĖ. ąóą░ą║, čāąČąĄ ą╝ąĄąČą┤čā ą│ąŠą╝ąŠą╗ąĖčéąĖč湥čüą║ąĖą╝ ąĖ ą│ąĄč鹥čĆąŠą╗ąĖčéąĖč湥čüą║ąĖą╝ čĆą░ąĘčĆčŗą▓ąŠą╝ čģąĖą╝ąĖč湥čüą║ąŠą╣ čüą▓čÅąĘąĖ ąĖą╝ąĄčÄčéčüčÅ ą┐ąĄčĆąĄčģąŠą┤ąĮčŗąĄ č乊čĆą╝čŗ (čĆąĄą░ą│ąĖčĆčāčÄčé ąĮąĄ čĆą░ą┤ąĖą║ą░ą╗čŗ ąĖą╗ąĖ ąĖąŠąĮčŗ, ą░ ą┐ąŠą╗čÅčĆąĮčŗąĄ ą╝ąŠą╗ąĄą║čāą╗čŗ). ąśąĘą▓ąĄčüčéąĮąŠ ą╝ąĮąŠą│ąŠ čĆąĄą░ą║čåąĖą╣, ą┐čĆąĖ ą║ąŠč鹊čĆčŗčģ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮą░čÅ ąĖ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮą░čÅ ą░čéą░ą║ą░ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮą░ ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ ąĮą░ ą┤ą▓ą░ čĆą░ąĘąĮčŗčģ čāčćą░čüčéą║ą░ ą╝ąŠą╗ąĄą║čāą╗čŗ. ą¦ą░čüč鹊 ą┐ąŠą┤ąŠą▒ąĮčŗąĄ čĆąĄą░ą║čåąĖąĖ ą┐čĆąĖą▓ąŠą┤čÅčé ą║ čåąĖą║ą╗ąĖč湥čüą║ąŠą╝čā ą┐ąĄčĆąĄčģąŠą┤ąĮąŠą╝čā čüąŠčüč鹊čÅąĮąĖčÄ, ą║ąŠą│ą┤ą░ ą┤ą▓ąĄ, čéčĆąĖ ąĖą╗ąĖ (čĆąĄą┤ą║ąŠ) ą▒ąŠą╗čīčłąĄąĄ čćąĖčüą╗ąŠ ą╝ąŠą╗ąĄą║čāą╗ ąŠą▒čĆą░ąĘčāčÄčé ąŠą▒čēąĖą╣ čåąĖą║ą╗ (čéą░ą║ ąĮą░ąĘčŗą▓ą░ąĄą╝ąŠąĄ ŌĆ£čåąĖą║ą╗ąŠą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄŌĆØ), čéą░ą║ąŠąĄ čåąĖą║ą╗ąĖč湥čüą║ąŠąĄ ą┐ąĄčĆąĄčģąŠą┤ąĮąŠąĄ čüąŠčüč鹊čÅąĮąĖąĄ ą┐čĆąĖ čüą╝ąĄčēąĄąĮąĖąĖ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą╗ąĖą▒ąŠ čüčéą░ą▒ąĖą╗ąĖąĘąĖčĆčāąĄčéčüčÅ, ą╗ąĖą▒ąŠ čĆą░ąĘčĆčāčłą░ąĄčéčüčÅ.
ąĀą░ą┤ąĖą║ą░ą╗čīąĮčŗąĄ čĆąĄą░ą║čåąĖąĖ
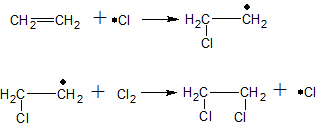
ąĀą░ą┤ąĖą║ą░ą╗čīąĮąŠąĄ ąĘą░ą╝ąĄčēąĄąĮąĖąĄ (SR). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░ čĆąĄą░ą│ąĄąĮčé čÅą▓ą╗čÅąĄčéčüčÅ čĆą░ą┤ąĖą║ą░ą╗ąŠą╝. ąØą░ą┐čĆąĖą╝ąĄčĆ, čéą░ą║ąĖą╝ čĆąĄą░ą│ąĄąĮč鹊ą╝ ą╝ąŠąČąĄčé ą▒čŗčéčī čĆą░ą┤ąĖą║ą░ą╗ ClŌĆó, ą║ąŠč鹊čĆčŗą╣ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ąĖąĘ ą╝ąŠą╗ąĄą║čāą╗čŗ Cl2 ą┐čĆąĖ ą│ąŠą╝ąŠą╗ąĖčéąĖč湥čüą║ąŠą╝ čĆą░ąĘčĆčŗą▓ąĄ čüą▓čÅąĘąĖ ą┐ąŠą┤ ą┤ąĄą╣čüčéą▓ąĖąĄą╝ ąĖąĮąĖčåąĖą░č鹊čĆą░ – čüąŠą╗ąĮąĄčćąĮąŠą│ąŠ čüą▓ąĄčéą░:
Cl2 ŌåÆ ClŌĆó + ŌĆóCl
ąÆąŠąĘąĮąĖą║ąĮąŠą▓ąĄąĮąĖąĄ čĆą░ą┤ąĖą║ą░ą╗ąŠą▓ – čŹč鹊 čüčéą░ą┤ąĖčÅ ąĖąĮąĖčåąĖąĖčĆąŠą▓ą░ąĮąĖčÅ, čü ą║ąŠč鹊čĆąŠą╣ ąĮą░čćąĖąĮą░ąĄčéčüčÅ čĆą░ąĘą▓ąĖčéąĖąĄ čåąĄą┐ąĮąŠą╣ čĆąĄą░ą║čåąĖąĖ. ą¤ąŠą╗čāč湥ąĮąĮčŗąĄ čĆą░ą┤ąĖą║ą░ą╗čŗ ClŌĆó ą┐čĆąĖ čüąŠčāą┤ą░čĆąĄąĮąĖąĖ čü ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ čüčāą▒čüčéčĆą░čéą░ ą┐ąŠčĆąŠąČą┤ą░čÄčé ąĮąŠą▓čŗąĄ čĆą░ą┤ąĖą║ą░ą╗čŗ (čĆą░ąĘą▓ąĖčéąĖąĄ čåąĄą┐ąĖ), ąĖ čéą░ą║ ą┐čĆąŠčåąĄčüčü ą┐čĆąŠą┤ąŠą╗ąČą░ąĄčéčüčÅ ą┤ąŠ č鹥čģ ą┐ąŠčĆ, ą┐ąŠą║ą░ ą┤ą▓ą░ čĆą░ą┤ąĖą║ą░ą╗ą░ čüąŠąĄą┤ąĖąĮčÅčéčüčÅ ą┤čĆčāą│ čü ą┤čĆčāą│ąŠą╝ ąĖ čåąĄą┐ąĮą░čÅ čĆąĄą░ą║čåąĖčÅ ą┐čĆąĄą║čĆą░čéąĖčéčüčÅ (čüčéą░ą┤ąĖčÅ ąŠą▒čĆčŗą▓ą░ čåąĄą┐ąĖ).
ą¤čĆąĖą╝ąĄčĆ. ą¤čĆąŠčåąĄčüčü čģą╗ąŠčĆąĖčĆąŠą▓ą░ąĮąĖčÅ ą╝ąĄčéą░ąĮą░ CH4 ą┐čĆąŠč鹥ą║ą░ąĄčé čüą╗ąĄą┤čāčÄčēąĖą╝ ąŠą▒čĆą░ąĘąŠą╝:
ąĖąĮąĖčåąĖąĖčĆąŠą▓ą░ąĮąĖąĄ
Cl2 ŌåÆ ClŌĆó + ŌĆóCl
čĆą░ąĘą▓ąĖčéąĖąĄ čåąĄą┐ąĖ
H3C-H + ŌĆóCl ŌåÆ H3CŌĆó + HCl
H3CŌĆó + Cl2 ŌåÆ H3C-Cl + ŌĆóCl ŌĆ”┬Ā
ąŠą▒čĆčŗą▓ čåąĄą┐ąĖ
H3CŌĆó + ŌĆóCl ŌåÆ H3C-Cl
H3CŌĆó + ŌĆóCH3 ŌåÆ H3C-CH3
ą¤ąŠčüą╗ąĄą┤ąĮąĖą╣ ą┐čĆąŠą┤čāą║čé – čŹčéą░ąĮ ąĪ2ąØ6 ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ ą┐ąŠą▒ąŠčćąĮčŗą╝ ą┐čĆąŠą┤čāą║č鹊ą╝ čŹč鹊ą╣ čĆąĄą░ą║čåąĖąĖ, ą┐ąŠčüą║ąŠą╗čīą║čā ąŠąĮ ą┐ąŠą╗čāč湥ąĮ ą║ą░ą║ ą▒čŗ ą▒ąĄąĘ čāčćą░čüčéąĖčÅ čĆąĄą░ą│ąĄąĮčéą░ (čģą╗ąŠčĆ ąĮąĄ ą▓čģąŠą┤ąĖčé ą▓ ąĄą│ąŠ čüąŠčüčéą░ą▓).
ąĀą░ą┤ąĖą║ą░ą╗čīąĮąŠąĄ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ (AR). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░ čĆąĄą░ą│ąĄąĮčé čÅą▓ą╗čÅąĄčéčüčÅ čĆą░ą┤ąĖą║ą░ą╗ąŠą╝, ą║ąŠč鹊čĆčŗą╣ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą▓ SR-čĆąĄą░ą║čåąĖąĖ. ąŁč鹊čé čĆą░ą┤ąĖą║ą░ą╗ ą┐čĆąĖčüąŠąĄą┤ąĖąĮčÅąĄčéčüčÅ ą║ ąĮąĄą┐čĆąĄą┤ąĄą╗čīąĮąŠą╝čā čüąŠąĄą┤ąĖąĮąĄąĮąĖčÄ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ąĮąŠą▓ąŠą│ąŠ čĆą░ą┤ąĖą║ą░ą╗ą░ ąĖ čé.ą┤., čéą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝ ą▓ąŠąĘąĮąĖą║ą░ąĄčé čĆąĄą░ą║čåąĖąŠąĮąĮą░čÅ čåąĄą┐čī.
ą¤čĆąĖą╝ąĄčĆ. ąźą╗ąŠčĆąĖčĆąŠą▓ą░ąĮąĖąĄ čŹčéąĖą╗ąĄąĮą░ ąŠčüčāčēąĄčüčéą▓ą╗čÅąĄčéčüčÅ čüą╗ąĄą┤čāčÄčēąĖą╝ ąŠą▒čĆą░ąĘąŠą╝:
ą¤čĆąŠą┤čāą║č鹊ą╝ čŹč鹊ą╣ čĆąĄą░ą║čåąĖąĖ čÅą▓ą╗čÅąĄčéčüčÅ 1,2-ą┤ąĖčģą╗ąŠčĆčŹčéą░ąĮ.
ąĀą░ą┤ąĖą║ą░ą╗čīąĮąŠąĄ ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄ (ER). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░ ąŠą▒čĆą░ąĘčāčÄčéčüčÅ čĆą░ą┤ąĖą║ą░ą╗čŗ ą▓ ą▓ąĖą┤ąĄ ą┐ąĄčĆą▓ąĖčćąĮčŗčģ čäčĆą░ą│ą╝ąĄąĮč鹊ą▓ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ čāą│ą╗ąĄčĆąŠą┤ą░.
ą¤čĆąĖą╝ąĄčĆ. ą¤čĆąĖ ą║čĆąĄą║ąĖąĮą│ąĄ (ą┐ąĖčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╝ čĆą░čüčēąĄą┐ą╗ąĄąĮąĖąĖ) ą▓čŗčüčłąĖčģ ą░ą╗ą║ą░ąĮąŠą▓ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą│ąŠą╝ąŠą╗ąĖčéąĖč湥čüą║ąĖą╣ čĆą░ąĘčĆčŗą▓ čüą▓čÅąĘąĖ C-C:
R-CH2-CH2-CH2-CH2-R’ ŌåÆ R-CH2-CŌĆóH2 + ŌĆóCH2-CH2-R’
ąÆąŠąĘąĮąĖą║ą░čÄčēąĖąĄ ą║ąŠčĆąŠčéą║ąŠąČąĖą▓čāčēąĖąĄ čĆą░ą┤ąĖą║ą░ą╗čŗ čüą┐ąŠąĮčéą░ąĮąĮąŠ čĆą░čüą┐ą░ą┤ą░čÄčéčüčÅ, ą┤ą░ą▓ą░čÅ ą╝ąŠą╗ąĄą║čāą╗čŗ ą░ą╗ą║ąĄąĮąŠą▓ ąĖ ąĮąŠą▓čŗąĄ čĆą░ą┤ąĖą║ą░ą╗čŗ:
R-CH2-CŌĆóH2 ŌåÆ RŌĆó + CH2=CH2
ŌĆóCH2-CH2-R’ ŌåÆ R’ŌĆó + CH2=CH2
ąöą░ą╗čīąĮąĄą╣čłąĄąĄ ą┐čĆąŠč鹥ą║ą░ąĮąĖąĄ čĆąĄą░ą║čåąĖąĖ ą╝ąŠąČąĄčé ą┐čĆąŠčģąŠą┤ąĖčéčī čĆą░ąĘą╗ąĖčćąĮčŗą╝ąĖ ą┐čāčéčÅą╝ąĖ.
ąØčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗąĄ čĆąĄą░ą║čåąĖąĖ
ą¤čĆąĖ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗčģ čĆąĄą░ą║čåąĖčÅčģ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗą╣ čĆąĄą░ą│ąĄąĮčé ą░čéą░ą║čāąĄčé 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗą╣ čüčāą▒čüčéčĆą░čé (ąĖą╗ąĖ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗą╣ čāčćą░čüč鹊ą║ čüčāą▒čüčéčĆą░čéą░):
ąĪčāą▒čüčéčĆą░čé (菹╗ąĄą║čéčĆąŠčäąĖą╗) + ąĀąĄą░ą│ąĄąĮčé (ąĮčāą║ą╗ąĄąŠčäąĖą╗) ŌåÆ┬Ā
ąØčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠąĄ ąĘą░ą╝ąĄčēąĄąĮąĖąĄ (SN). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗą╣ čĆąĄą░ą│ąĄąĮčé ą▓čŗč鹥čüąĮčÅąĄčé ą░č鹊ą╝ ąĖą╗ąĖ ą│čĆčāą┐ą┐čā ą░č鹊ą╝ąŠą▓ ąĖąĘ čüčāą▒čüčéčĆą░čéą░. ą¤čĆąĖ čŹč鹊ą╝ čĆą░ąĘčĆčŗą▓ čüą▓čÅąĘąĖ ą╝ąĄąČą┤čā ą▓čŗč鹥čüąĮąĄąĮąĮčŗą╝ ą░č鹊ą╝ąŠą╝ ąĖ ą░č鹊ą╝ąŠą╝ čāą│ą╗ąĄčĆąŠą┤ą░ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą│ąĄč鹥čĆąŠą╗ąĖčéąĖč湥čüą║ąĖ, ąĖ ąŠčéčēąĄą┐ą╗čÅąĄą╝ą░čÅ ą│čĆčāą┐ą┐ą░ čāąĮąŠčüąĖčé 菹╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą░čĆčā, ą░ čĆąĄą░ą│ąĄąĮčé čüąŠ čüą▓ąŠąĄą╣ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą░čĆąŠą╣ ąŠą▒čĆą░ąĘčāąĄčé ąĮąŠą▓čāčÄ čģąĖą╝ąĖč湥čüą║čāčÄ čüą▓čÅąĘčī:

ą¤čĆąĖą╝ąĄčĆ. ąØčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠąĄ ąĘą░ą╝ąĄčēąĄąĮąĖąĄ ąŠčüčāčēąĄčüčéą▓ą╗čÅąĄčéčüčÅ ą▓ čĆąĄą░ą║čåąĖąĖ ą╝ąĄąČą┤čā ą╝ąŠąĮąŠčģą╗ąŠčĆčŹčéą░ąĮąŠą╝ ąĖ ą│ąĖą┤čĆąŠą║čüąĖą┤-ąĖąŠąĮą░ą╝ąĖ (ą▓ą▓ąŠą┤čÅčéčüčÅ čü čēąĄą╗ąŠčćčīčÄ):
CH3-C╬┤+H2-Cl╬┤- ŌåÆ CH3-CH2-OH + Cl–
ą¤ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝čā SN-čĆąĄą░ą║čåąĖąĖ ą┤ąĄą╗čÅčéčüčÅ ąĮą░ ą┤ą▓ą░ ą▓ąĖą┤ą░: SN1 – čĆąĄą░ą║čåąĖąĖ čü ą┤ą▓čāčģčüčéą░ą┤ąĖą╣ąĮčŗą╝ ą╝ąĄčģą░ąĮąĖąĘą╝ąŠą╝ (čāą┤ą░ą╗ąĄąĮąĖąĄ ąŠą┤ąĮąŠą│ąŠ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅ ąĖ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ ą┤čĆčāą│ąŠą│ąŠ ą┐čĆąŠąĖčüčģąŠą┤čÅčé ą┐ąŠąŠč湥čĆąĄą┤ąĮąŠ); SN2 – čĆąĄą░ą║čåąĖąĖ čü ąŠą┤ąĮąŠčüčéą░ą┤ąĖą╣ąĮčŗą╝ ą╝ąĄčģą░ąĮąĖąĘą╝ąŠą╝ (čāą┤ą░ą╗ąĄąĮąĖąĄ ąŠą┤ąĮąŠą│ąŠ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅ ąĖ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ ą┤čĆčāą│ąŠą│ąŠ ą┐čĆąŠąĖčüčģąŠą┤čÅčé ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ).
ą£ąĄčģą░ąĮąĖąĘą╝ SN1 čĆąĄą░ą║čåąĖą╣.
ąØą░ ą┐ąĄčĆą▓ąŠą╣ čüčéą░ą┤ąĖąĖ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą│ąĄč鹥čĆąŠą╗ąĖčéąĖč湥čüą║ąĖą╣ čĆą░čüą┐ą░ą┤ čüčāą▒čüčéčĆą░čéą░ čü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄą╝ ąĖąŠąĮą░ ą║ą░čĆą▒ąĄąĮąĖčÅ
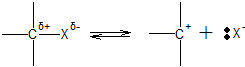
ąĮą░ ą▓č鹊čĆąŠą╣ čüčéą░ą┤ąĖąĖ ą║ ąĖąŠąĮčā ą║ą░čĆą▒ąĄąĮąĖčÅ ą┐čĆąĖčüąŠąĄą┤ąĖąĮčÅąĄčéčüčÅ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮą░čÅ čćą░čüčéąĖčåą░

ąöą╗čÅ ąŠčüčāčēąĄčüčéą▓ą╗ąĄąĮąĖčÅ ą┐ąĄčĆą▓ąŠą╣ čüčéą░ą┤ąĖąĖ čéčĆąĄą▒čāąĄčéčüčÅ čŹąĮąĄčĆą│ąĖčÅ ą░ą║čéąĖą▓ą░čåąĖąĖ. ąśąŠąĮ ą║ą░čĆą▒ąĄąĮąĖčÅ ą╝ąŠąČąĄčé čéą░ą║ąČąĄ ą▓čüčéčāą┐ą░čéčī ą▓ ą┤čĆčāą│ąĖąĄ čĆąĄą░ą║čåąĖąĖ (ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄ ą║ą░čéąĖąŠąĮą░ H+, ą┐ąĄčĆąĄą│čĆčāą┐ą┐ąĖčĆąŠą▓ą║ą░), čćč鹊 ą┐čĆąĖą▓ąŠą┤ąĖčé ą║ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÄ ąĮąĄą┐čĆąĄą┤ąĄą╗čīąĮčŗčģ ąĖ ąĖąĘąŠą╝ąĄčĆąĮčŗčģ ą┐ąŠą▒ąŠčćąĮčŗčģ ą┐čĆąŠą┤čāą║č鹊ą▓. ą×čéčēąĄą┐ą╗ąĄąĮąĖąĄ H+ – čŹč鹊 ą║ąŠąĮą║čāčĆąĖčĆčāčÄčēą░čÅ EN1-čĆąĄą░ą║čåąĖčÅ
ą£ąĄčģą░ąĮąĖąĘą╝ SN2 čĆąĄą░ą║čåąĖą╣.
ąĀąĄą░ą║čåąĖąĖ čü ą╝ąĄčģą░ąĮąĖąĘą╝ąŠą╝ SN2 ą┐čĆąŠč鹥ą║ą░čÄčé ą┐čĆąĖ ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠą╝ ą┐čĆąĖą▒ą╗ąĖąČąĄąĮąĖąĖ čĆąĄą░ą│ąĄąĮčéą░ ą║ čüčāą▒čüčéčĆą░čéčā ąĖ čāą┤ą░ą╗ąĄąĮąĖąĖ čüčéą░čĆąŠą│ąŠ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅ:
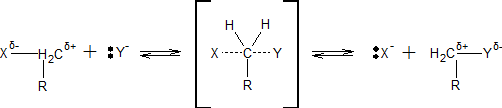
ąÆ čĆąĄąĘčāą╗čīčéą░č鹥 čĆąĄą░ą║čåąĖąĖ SN2 ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ąĖąĮą▓ąĄčĆčüąĖčÅ ą║ąŠąĮčäąĖą│čāčĆą░čåąĖąĖ (ąŠą▒čĆą░čēąĄąĮąĖąĄ). ą¤ąĄčĆą▓ąŠąĮą░čćą░ą╗čīąĮąŠ ąŠčéą║ą╗ąŠąĮąĄąĮąĮčŗąĄ ąŠčé ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅ X ą░č鹊ą╝čŗ H ąĖ čāą│ą╗ąĄą▓ąŠą┤ąŠčĆąŠą┤ąĮčŗąĄ ąŠčüčéą░čéą║ąĖ R (ą▓ čĆą░ą╝ą║ą░čģ č鹥čéčĆą░菹┤čĆąĖč湥čüą║ąŠą╣ ą╝ąŠą┤ąĄą╗ąĖ) ą▓ ą┐ąĄčĆąĄčģąŠą┤ąĮąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ ąŠą║ą░ąĘčŗą▓ą░čÄčéčüčÅ čüąĮą░čćą░ą╗ą░ ą┐ąĄčĆą┐ąĄąĮą┤ąĖą║čāą╗čÅčĆąĮčŗą╝ąĖ, ą░ ąĘą░č鹥ą╝ ąĖ ą┐čĆąŠą│ąĖą▒ą░čÄčēąĖą╝ąĖčüčÅ ą▓ čüč鹊čĆąŠąĮčā X, ą┐ąŠ ą╝ąĄčĆąĄ č鹊ą│ąŠ ą║ą░ą║ č乊čĆą╝ąĖčĆčāąĄčéčüčÅ čüą▓čÅąĘčī C-Y (ą┐čĆąŠčåąĄčüčü ą╝ąŠąČąĮąŠ čüčĆą░ą▓ąĮąĖčéčī čü ą▓čŗą▓ąŠčĆą░čćąĖą▓ą░ąĮąĖąĄą╝ ąĘąŠąĮčéąĖą║ą░ ąĮą░ ą▓ąĄčéčĆčā):
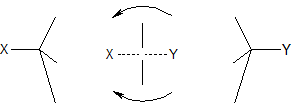
ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ąŠą┐čéąĖč湥čüą║ąĖ ą░ą║čéąĖą▓ąĮčŗąĄ D-čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ą┐ąĄčĆąĄčģąŠą┤čÅčé ą▓ ą░ąĮčéąĖą┐ąŠą┤ąĮčŗąĄ L-čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ (ąĖ ąĮą░ąŠą▒ąŠčĆąŠčé). ąÆ ąŠčéą╗ąĖčćąĖąĄ ąŠčé čĆąĄą░ą║čåąĖąĖ ą┐ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝čā SN1, ą▓ čĆąĄą░ą║čåąĖąĖ SN2 ą┐ąŠą▒ąŠčćąĮčŗčģ ąĖąĘąŠą╝ąĄčĆąĮčŗčģ ą┐čĆąŠą┤čāą║č鹊ą▓ ąĮąĄ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ, ąŠą┤ąĮą░ą║ąŠ ą╝ąŠąČąĄčé čéą░ą║ąČąĄ ą┐čĆąŠąĖčüčģąŠą┤ąĖčéčī ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄ H ą▓ ą║ą░č湥čüčéą▓ąĄ ą║ąŠąĮą║čāčĆąĖčĆčāčÄčēąĄą╣ čĆąĄą░ą║čåąĖąĖ EN2.
ąØčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠąĄ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ (AN). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░ ą╝ąŠąČąĄčé ą┐čĆąŠąĖčüčģąŠą┤ąĖčéčī, ąĄčüą╗ąĖ ą░č鹊ą╝ čāą│ą╗ąĄčĆąŠą┤ą░ ą┐čĆąĖąŠą▒čĆąĄčéą░ąĄčé ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤, čćč鹊 čĆąĄą░ą╗ąĖąĘčāąĄčéčüčÅ čĆąĄą┤ą║ąŠ. ą¤ąŠčćčéąĖ ą▓čüąĄą│ą┤ą░ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ ą┐ąŠ ą┤ą▓ąŠą╣ąĮąŠą╣ čüą▓čÅąĘąĖ C=C ą┐čĆąŠč鹥ą║ą░ąĄčé ąĖą╗ąĖ ą┐ąŠ čĆą░ą┤ąĖą║ą░ą╗čīąĮąŠą╝čā ą╝ąĄčģą░ąĮąĖąĘą╝čā (AR) ąĖą╗ąĖ ą┐ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝čā 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą│ąŠ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ (AE), ą┐ąŠčüą║ąŠą╗čīą║čā ą┤ą▓ąŠą╣ąĮą░čÅ čüą▓čÅąĘčī ąŠą▒ą╗ą░ą┤ą░ąĄčé ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ą▓čŗčüąŠą║ąŠą╣ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéčīčÄ. ą×ą┤ąĮą░ą║ąŠ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ ą┐ąŠ ą┤ą▓ąŠą╣ąĮąŠą╣ čüą▓čÅąĘąĖ C=O ą░ą╗čīą┤ąĄą│ąĖą┤ąŠą▓ ąĖ ą║ąĄč鹊ąĮąŠą▓ ą┐čĆąŠč鹥ą║ą░ąĄčé ą║ą░ą║ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮą░čÅ čĆąĄą░ą║čåąĖčÅ (AN) ą▒ą╗ą░ą│ąŠą┤ą░čĆčÅ č鹊ą╝čā, čćč鹊 ą▓čŗčüąŠą║ą░čÅ čŹą╗ąĄą║čéčĆąŠąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠčüčéčī ą║ąĖčüą╗ąŠčĆąŠą┤ą░ ąŠą▒ąĄčüą┐ąĄčćąĖą▓ą░ąĄčé čüąŠąĘą┤ą░ąĮąĖąĄ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠą│ąŠ ąĘą░čĆčÅą┤ą░ ąĮą░ ą░č鹊ą╝ąĄ C ąĖ ą┤ąĄą╗ą░ąĄčé ąĄą│ąŠ ą┤ąŠčüčéčāą┐ąĮčŗą╝ ą┤ą╗čÅ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą╣ ą░čéą░ą║ąĖ.
ą¤čĆąĖą╝ąĄčĆ. ą¤ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝čā ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą│ąŠ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĄ čåąĖą░ąĮąŠą▓ąŠą┤ąŠčĆąŠą┤ą░ čü ą░ą╗čīą┤ąĄą│ąĖą┤ą░ą╝ąĖ. ą£ąŠą╗ąĄą║čāą╗ą░ HCN ą┐ąŠą╗čÅčĆąĮą░, ą┐čĆąĖą▒ą╗ąĖąČąĄąĮąĖąĄ ąĄąĄ ą║ čéą░ą║ąČąĄ ą┐ąŠą╗čÅčĆąĮąŠą╣ ą│čĆčāą┐ą┐ąĄ C=O ą░ą╗čīą┤ąĄą│ąĖą┤ą░ ą▓čŗąĘčŗą▓ą░ąĄčé čāą▓ąĄą╗ąĖč湥ąĮąĖąĄ ą┐ąŠą╗čÅčĆąĮąŠčüčéąĖ ą╝ąŠą╗ąĄą║čāą╗čŗ HCN ą┤ąŠ čéą░ą║ąŠą╣ čüč鹥ą┐ąĄąĮąĖ, čćč鹊 ą▓ ą┐ąĄčĆąĄčģąŠą┤ąĮąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ ąĖąŠąĮ CN– ą┤ąĄą╣čüčéą▓čāąĄčé ą║ą░ą║ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗą╣ čĆąĄą░ą│ąĄąĮčé ąĖ ą░čéą░ą║čāąĄčé ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗą╣ ą░č鹊ą╝ C:
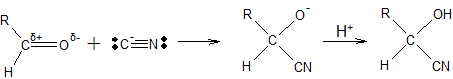
ąØąĄą┐ąŠą┤ąĄą╗ąĄąĮąĮą░čÅ čŹą╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐ą░čĆą░ ąĮą░ ą░č鹊ą╝ąĄ C ąĖąŠąĮą░ CN– čüčéą░ąĮąŠą▓ąĖčéčüčÅ čüą▓čÅąĘčŗą▓ą░čÄčēąĄą╣; ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ ą║čĆą░čéąĮą░čÅ čüą▓čÅąĘčī C=O ą░ą╗čīą┤ąĄą│ąĖą┤ą░ ą┐čĆąĄą▓čĆą░čēą░ąĄčéčüčÅ ą▓ ąŠą┤ąĖąĮą░čĆąĮčāčÄ, ąĖ ą║ ą░č鹊ą╝čā ą║ąĖčüą╗ąŠčĆąŠą┤ą░ ą▓ ąŠą▒čĆą░ąĘąŠą▓ą░ą▓čłąĄą╝čüčÅ ą░ąĮąĖąŠąĮąĄ ą┐čĆąĖčüąŠąĄą┤ąĖąĮčÅąĄčéčüčÅ ą║ą░čéąĖąŠąĮ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ąĖčüčģąŠą┤ąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░ HCN.
ąØčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠąĄ ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄ (EN). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░, ą║ą░ą║ ąĖ ą▓ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą╝ ąĘą░ą╝ąĄčēąĄąĮąĖąĖ SN, ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ąĖąŠąĮą░ ą║ą░čĆą▒ąĄąĮąĖčÅ (ą┤ą▓čāčģčüčéą░ą┤ąĖą╣ąĮčŗą╣ ą╝ąĄčģą░ąĮąĖąĘą╝) ąĖą╗ąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ą┐ąĄčĆąĄčģąŠą┤ąĮąŠą│ąŠ čüąŠčüč鹊čÅąĮąĖčÅ (ąŠą┤ąĮąŠčüčéą░ą┤ąĖą╣ąĮčŗą╣ ą╝ąĄčģą░ąĮąĖąĘą╝). ąÆ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĖąĖ čü čŹčéąĖą╝ čĆą░ąĘą╗ąĖčćą░čÄčé ą╝ąĄčģą░ąĮąĖąĘą╝čŗ EN1 ąĖ EN2. ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, čĆąĄą░ą║čåąĖčÅ EN ą║ąŠąĮą║čāčĆąĖčĆčāąĄčé čü čĆąĄą░ą║čåąĖąĄą╣ SN ą║ą░ą║ą░čÅ ąĖąĘ ąĮąĖčģ ą▒čāą┤ąĄčé ą┐čĆąĄąŠą▒ą╗ą░ą┤ą░čéčī, ąĘą░ą▓ąĖčüąĖčé ąŠčé čāčüą╗ąŠą▓ąĖą╣ ą┐čĆąŠčåąĄčüčüą░. ąóą░ą║, ą┐čĆąĖ ą▒ąŠą╗ąĄąĄ ą▓čŗčüąŠą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░čģ ą┐čĆąĄąĖą╝čāčēąĄčüčéą▓ąĄąĮąĮąŠ ą┐čĆąŠč鹥ą║ą░ąĄčé čĆąĄą░ą║čåąĖčÅ ąŠčéčēąĄą┐ą╗ąĄąĮąĖčÅ.
ąĢčüą╗ąĖ ą▓ SN-čĆąĄą░ą║čåąĖąĖ ąĮą░ ą▓č鹊čĆąŠą╣ čüčéą░ą┤ąĖąĖ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé čüą▓čÅąĘčŗą▓ą░ąĮąĖąĄ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░, č鹊 ą▓ EN-čĆąĄą░ą║čåąĖąĖ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ ą┐čĆąĖčéčÅąČąĄąĮąĖčÅ čŹą╗ąĄą║čéčĆąŠąĮąŠą▓ (-I-čŹčäč乥ą║čé), ą║ąŠč鹊čĆąŠąĄ ą▓čŗąĘčŗą▓ą░ąĄčé ą░č鹊ą╝ C, ąŠčéčēąĄą┐ą╗čÅąĄčéčüčÅ ą║ą░čéąĖąŠąĮ H+, ą┐čĆąĖč湥ą╝ ą│ą╗ą░ą▓ąĮčŗą╝ ąŠą▒čĆą░ąĘąŠą╝ ąŠčé čüąŠčüąĄą┤ąĮąĄą│ąŠ ą░č鹊ą╝ą░ C; ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ č乊čĆą╝ąĖčĆčāąĄčéčüčÅ ą║čĆą░čéąĮą░čÅ čüą▓čÅąĘčī ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ čāą│ą╗ąĄčĆąŠą┤ą░.
ą¤čĆąĖą╝ąĄčĆ. ą¤ąŠ ą┤ą▓čāčģčüčéą░ą┤ąĖą╣ąĮąŠą╝čā ą╝ąĄčģą░ąĮąĖąĘą╝čā EN1 ąŠčüčāčēąĄčüčéą▓ą╗čÅąĄčéčüčÅ ą┤ąĄą│ąĖą┤čĆąŠą│ą░ą╗ąŠą│ąĄąĮąĖčĆąŠą▓ą░ąĮąĖąĄ ą┐ąŠą┤ ą┤ąĄą╣čüčéą▓ąĖąĄą╝ čēąĄą╗ąŠčćąĖ:
CH3-CH2Cl ŌåÆ CH3-C+H2 + Cl–
CH3-C+H2 ŌåÆ H+ + CH2=CH2
ąśąŠąĮčŗ OH– ąĖ H+ ąŠą▒čŖąĄą┤ąĖąĮčÅčÄčéčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čŗ H2O.
ąŁą╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗąĄ čĆąĄą░ą║čåąĖąĖ
ą¤čĆąĖ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗčģ čĆąĄą░ą║čåąĖčÅčģ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗą╣ čĆąĄą░ą│ąĄąĮčé ą░čéą░ą║čāąĄčé ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗą╣ čüčāą▒čüčéčĆą░čé (ąĖą╗ąĖ ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗą╣ čāčćą░čüč鹊ą║ čüčāą▒čüčéčĆą░čéą░):
ąĀąĄą░ą│ąĄąĮčé (菹╗ąĄą║čéčĆąŠčäąĖą╗) + ąĪčāą▒čüčéčĆą░čé (ąĮčāą║ą╗ąĄąŠčäąĖą╗) ŌåÆ
ąŁą╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠąĄ ąĘą░ą╝ąĄčēąĄąĮąĖąĄ (SE). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮčŗą╣ čĆąĄą░ą│ąĄąĮčé ą▓čŗč鹥čüąĮčÅąĄčé ą░č鹊ą╝ ąĖą╗ąĖ ą│čĆčāą┐ą┐čā ą░č鹊ą╝ąŠą▓ ąĖąĘ čüčāą▒čüčéčĆą░čéą░, ą┐čĆąĖč湥ą╝ čāčģąŠą┤čÅčēąĖą╣ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čī ąŠčüčéą░ą▓ą╗čÅąĄčé čüą▓čÅąĘčŗą▓ą░čÄčēčāčÄ čŹą╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐ą░čĆčā ą░č鹊ą╝čā čāą│ą╗ąĄčĆąŠą┤ą░, ąĖ čü ąĄąĄ ą┐ąŠą╝ąŠčēčīčÄ č乊čĆą╝ąĖčĆčāąĄčéčüčÅ čüą▓čÅąĘčī 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░ čü čüčāą▒čüčéčĆą░č鹊ą╝:
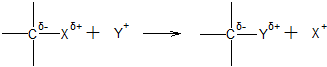
ąŁą╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠąĄ ąĘą░ą╝ąĄčēąĄąĮąĖąĄ ąĖą╝ąĄąĄčé ąŠčüąŠą▒ąŠąĄ ąĘąĮą░č湥ąĮąĖąĄ ą▓ čģąĖą╝ąĖąĖ ą░čĆąŠą╝ą░čéąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣. ą¤čĆąŠčåąĄčüčü ą┐čĆąŠč鹥ą║ą░ąĄčé č湥čĆąĄąĘ ą┤ą▓ąĄ čüčéą░ą┤ąĖąĖ: čüąĮą░čćą░ą╗ą░ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ŽĆ-ą║ąŠą╝ą┐ą╗ąĄą║čü ą░čĆąŠą╝ą░čéąĖč湥čüą║ąŠą│ąŠ ą║ąŠą╗čīčåą░ čü 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą╣ čćą░čüčéąĖčåąĄą╣, ą║ąŠč鹊čĆčŗą╣ ą┐čĆąĄą▓čĆą░čēą░ąĄčéčüčÅ ą▓ ą║ą░čéąĖąŠąĮ ą░čĆąĄąĮąĖčÅ; čĆąĄą░ą║čåąĖčÅ ąĘą░ą║ą░ąĮčćąĖą▓ą░ąĄčéčüčÅ ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄą╝ ą║ą░čéąĖąŠąĮą░ ą▓ąŠą┤ąŠčĆąŠą┤ą░ (ąĖą╗ąĖ ą┤čĆčāą│ąŠą│ąŠ ąĘą░ą╝ąĄčüčéąĖč鹥ą╗čÅ). ą¤ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤ ą║ą░čéąĖąŠąĮą░ ą░čĆąĄąĮąĖčÅ ąĮąĄ ąŠčéąĮąŠčüąĖčéčüčÅ ą║ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĮąŠą╝čā ą░č鹊ą╝čā čāą│ą╗ąĄčĆąŠą┤ą░, ą░ ą┤ąĄą╗ąŠą║ą░ą╗ąĖąĘąŠą▓ą░ąĮ ą┐ąŠ ą▓čüąĄą╣ ą╝ąĄąĘąŠą╝ąĄčĆąĮąŠą╣ čüąĖčüč鹥ą╝ąĄ čüą▓čÅąĘąĄą╣. ą¤čĆąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ą║ą░čéąĖąŠąĮą░ ą░čĆąĄąĮąĖčÅ ą░čĆąŠą╝ą░čéąĖč湥čüą║ą░čÅ čüąĖčüč鹥ą╝ą░ ą╗ąĄą│ą║ąŠ ą┤ąĄč乊čĆą╝ąĖčĆčāąĄčéčüčÅ, ą░ ą┐čĆąĖ ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĖ ąĖąŠąĮą░ H+ čüąĮąŠą▓ą░ čüčéą░ą▒ąĖą╗ąĖąĘąĖčĆčāąĄčéčüčÅ.
ą¤čĆąĖą╝ąĄčĆ. ą¤ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝čā 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą│ąŠ ąĘą░ą╝ąĄčēąĄąĮąĖčÅ ą┐čĆąŠč鹥ą║ą░ąĄčé ą║ą░čéą░ą╗ąĖčéąĖč湥čüą║ąŠąĄ čģą╗ąŠčĆąĖčĆąŠą▓ą░ąĮąĖąĄ ą▒ąĄąĮąĘąŠą╗ą░.
ąĪąĮą░čćą░ą╗ą░ ą║ą░čéą░ą╗ąĖąĘą░č鹊čĆ (AlCl3, FeCl3) ąŠčüą╗ą░ą▒ą╗čÅąĄčé ąĖą╗ąĖ čĆą░ąĘčĆčŗą▓ą░ąĄčé čüą▓čÅąĘčī ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ Cl2:
Cl-Cl + AlCl3 ŌåÆ Cl+-Cl–AlCl3
Cl-Cl + AlCl3 ŌåÆ Cl+ + AlCl4–
ąŚą░č鹥ą╝ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ŽĆ-ą║ąŠą╝ą┐ą╗ąĄą║čüą░ (ą┐ąĄčĆą▓ą░čÅ čüčéą░ą┤ąĖčÅ), ą┐ąĄčĆąĄčģąŠą┤ ŽĆ-ą║ąŠą╝ą┐ą╗ąĄą║čüą░ ą▓ ą║ą░čéąĖąŠąĮ ą░čĆąĄąĮąĖčÅ (ą▓č鹊čĆą░čÅ čüčéą░ą┤ąĖčÅ) ąĖ ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄ ąĖąŠąĮą░ H+ (čéčĆąĄčéčīčÅ čüčéą░ą┤ąĖčÅ):
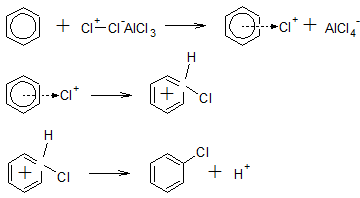
ą¤ąŠ ąŠą║ąŠąĮčćą░ąĮąĖąĖ čĆąĄą░ą║čåąĖąĖ ą║ą░čéą░ą╗ąĖąĘą░č鹊čĆ ą▓čŗčüą▓ąŠą▒ąŠąČą┤ą░ąĄčéčüčÅ
H+ + AlCl4– = HCl + AlCl3
ąĖ čüąĮąŠą▓ą░ ą▓čüčéčāą┐ą░ąĄčé ą▓ čĆąĄą░ą║čåąĖčÄ čüąŠ čüą╗ąĄą┤čāčÄčēąĖą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ čĆąĄą░ą│ąĄąĮčéą░.
ąŁą╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠąĄ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ (AE). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ čü čāčćą░čüčéąĖąĄą╝ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░ ą┐čĆąŠčģąŠą┤ąĖčé č湥čĆąĄąĘ čüčéą░ą┤ąĖąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ŽĆ-ą║ąŠą╝ą┐ą╗ąĄą║čüą░ ąĖ ąĖąŠąĮą░ ą║ą░čĆą▒ąĄąĮąĖčÅ, ą║ą░ą║ ąĖ ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą╝ ąĘą░ą╝ąĄčēąĄąĮąĖąĖ, ąĖ ąĘą░ą║ą░ąĮčćąĖą▓ą░ąĄčéčüčÅ čü čāčćą░čüčéąĖąĄą╝ ąĮčāą║ą╗ąĄąŠčäąĖą╗čŗčÄą│ąŠ čĆąĄą░ą│ąĄąĮčéą░. ą×ą▒čŗčćąĮąŠ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ ą┐ąŠ ą┤ą▓ąŠą╣ąĮąŠą╣ čüą▓čÅąĘąĖ C=C ą┐čĆąŠč鹥ą║ą░ąĄčé ąĖą╝ąĄąĮąĮąŠ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠ, čé.ą║. čā ą┤ą▓ąŠą╣ąĮąŠą╣ čüą▓čÅąĘąĖ ą▓čŗčüąŠą║ą░čÅ čŹą╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐ą╗ąŠčéąĮąŠčüčéčī, ą░ ŽĆ-菹╗ąĄą║čéčĆąŠąĮčŗ čüą▓čÅąĘąĖ ą┤ąŠčüčéą░č鹊čćąĮąŠ ą┐ąŠą┤ą▓ąĖąČąĮčŗ.
ą¤čĆąĖą╝ąĄčĆ. ą¤ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝čā 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą│ąŠ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé čĆąĄą░ą║čåąĖčÅ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░ čü čŹčéąĖą╗ąĄąĮąŠą╝. ąØą░ ą┐ąĄčĆą▓ąŠą╣ čüčéą░ą┤ąĖąĖ ą░č鹊ą╝ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ HCl, ąĮąĄčüčāčēąĖą╣ čŹčäč乥ą║čéąĖą▓ąĮčŗą╣ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤, ą┐čĆąĖ ą▓ąĘą░ąĖą╝ąŠą┤ąĄą╣čüčéą▓ąĖąĖ čü čüčāą▒čüčéčĆą░č鹊ą╝ ąŠčéčēąĄą┐ą╗čÅąĄčéčüčÅ ą│ąĄč鹥čĆąŠą╗ąĖčéąĖč湥čüą║ąĖ (ą▓ ą▓ąĖą┤ąĄ ąĮąŠąĮą░ H+) ąĖ ąŠą▒čĆą░ąĘčāąĄčé čü ą┤ą▓ąŠą╣ąĮąŠą╣ čüą▓čÅąĘčīčÄ ŽĆ-ą║ąŠą╝ą┐ą╗ąĄą║čü. ąØą░ ą▓č鹊čĆąŠą╣ čüčéą░ą┤ąĖąĖ ŽĆ-ą║ąŠą╝ą┐ą╗ąĄą║čü ą┐čĆąĖ ą┐ąŠą│ą╗ąŠčēąĄąĮąĖąĖ 菹ĮąĄčĆą│ąĖąĖ ą░ą║čéąĖą▓ą░čåąĖąĖ ą┐čĆąĄąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą▓ ąĖąŠąĮ ą║ą░čĆą▒ąĄąĮąĖčÅ, ą┐čĆąĖ čŹč鹊ą╝ ąŠą▒ą░ 菹╗ąĄą║čéčĆąŠąĮą░ ŽĆ-čüą▓čÅąĘąĖ ą┐ąŠą╗ąĮąŠčüčéčīčÄ ą┐ąĄčĆąĄą╝ąĄčēą░čÄčéčüčÅ ą║ ąŠą┤ąĮąŠą╝čā ąĖąĘ ą░č鹊ą╝ąŠą▓ C, ąĖ ąĮą░ ąĮąĄą╝ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ąĮąŠą▓ą░čÅ Žā-čüą▓čÅąĘčī C-H, ą░ ą┤čĆčāą│ąŠą╣ ą░č鹊ą╝ C ą┐ąŠą╗čāčćą░ąĄčé ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤. ąØą░ čéčĆąĄčéčīąĄą╣ čüčéą░ą┤ąĖąĖ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĖąŠąĮ ą║ą░čĆą▒ąĄąĮąĖčÅ ą┐čĆąĖčüąŠąĄą┤ąĖąĮčÅąĄčé ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮčŗą╣ ąĖąŠąĮ Cl–, ąŠą▒čĆą░ąĘčāčÄčēąĖą╣čüčÅ ąĮą░ ą┐ąĄčĆą▓ąŠą╣ čüčéą░ą┤ąĖąĖ.
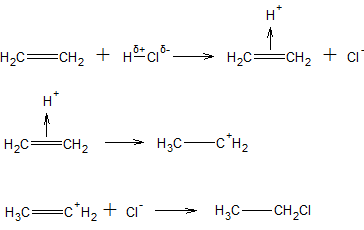
ąÆ čĆąĄą░ą║čåąĖąĖ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ą│ą░ą╗ąŠą│ąĄąĮą░ (ą▓ą╝ąĄčüč鹊 ą│ą░ą╗ąŠą│ąĄąĮąŠą▓ąŠą┤ąŠčĆąŠą┤ą░) ą┐ąŠ ą┤ą▓ąŠą╣ąĮąŠą╣ čüą▓čÅąĘąĖ C=C ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖčÅ ą╝ąŠą╗ąĄą║čāą╗čŗ čĆąĄą░ą│ąĄąĮčéą░ ą┤ąŠčüčéąĖą│ą░ąĄčéčüčÅ ą┤ąĄą╣čüčéą▓ąĖąĄą╝ čĆą░čüčéą▓ąŠčĆąĖč鹥ą╗čÅ ąĖą╗ąĖ ą║ą░čéą░ą╗ąĖąĘą░č鹊čĆą░ (čéą░ą║ąŠą╣ ą┐čĆąĖą╝ąĄčĆ ą┐čĆąĖą▓ąĄą┤ąĄąĮ ą▓čŗčłąĄ ą┐čĆąĖ čĆą░čüčüą╝ąŠčéčĆąĄąĮąĖąĖ SE-čĆąĄą░ą║čåąĖą╣); ą▓ čĆčÅą┤ąĄ čüą╗čāčćą░ąĄą▓ ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖčÅ ą╝ąŠąČąĄčé ąŠčüčāčēąĄčüčéą▓ą╗čÅčéčīčüčÅ ą┤ąŠčüčéą░č鹊čćąĮąŠ ą┐čĆąŠčüč鹊 ą┐čĆąĖ čüą▒ą╗ąĖąČąĄąĮąĖąĖ čĆąĄą░ą│ąĄąĮčéą░ ą║ ą┤ą▓ąŠą╣ąĮąŠą╣ čüą▓čÅąĘąĖ čüčāą▒čüčéčĆą░čéą░. ąóą░ą║, ą╝ąŠą╗ąĄą║čāą╗ą░ Br2 ą│ąĄč鹥čĆąŠą╗ąĖčéąĖč湥čüą║ąĖ čĆą░čüą┐ą░ą┤ą░ąĄčéčüčÅ ąĮą░ ąĖąŠąĮčŗ Br+ ąĖ Br–; ąĖąŠąĮ Br+ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠ ąĮą░čćąĖąĮą░ąĄčé čĆąĄą░ą║čåąĖčÄ ą┐čĆąĖčüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ, ą░ ąĖąŠąĮ Br– ąĮčāą║ą╗ąĄąŠčäąĖą╗čīąĮąŠ ąĘą░ą║ą░ąĮčćąĖą▓ą░ąĄčé ąĄąĄ.
ąŁą╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠąĄ ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄ (EE). ąÆ čĆąĄą░ą║čåąĖčÅčģ čŹč鹊ą│ąŠ čéąĖą┐ą░ ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄ ą┐čĆąŠą▓ąŠą┤ąĖčéčüčÅ čü ą┐ąŠą╝ąŠčēčīčÄ čŹą╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠą│ąŠ čĆąĄą░ą│ąĄąĮčéą░. ąöą╗čÅ ą┐čĆą░ą║čéąĖą║ąĖ 菹╗ąĄą║čéčĆąŠčäąĖą╗čīąĮąŠąĄ ąŠčéčēąĄą┐ą╗ąĄąĮąĖąĄ ąĖą╝ąĄąĄčé ą▓ąĄčüčīą╝ą░ ą╝ą░ą╗ąŠąĄ ąĘąĮą░č湥ąĮąĖąĄ.










