ąśąŠąĮąĮčŗąĄ čĆąĄą░ą║čåąĖąĖ, ą║ą░ą║ čüą╗ąĄą┤čāąĄčé ąĖąĘ ąĖčģ ąĮą░ąĘą▓ą░ąĮąĖčÅ, ą┐čĆąŠč鹥ą║ą░čÄčé ą┐čĆąĖ čāčćą░čüčéąĖąĖ ąĖąŠąĮąŠą▓, ą┐čĆąĖč湥ą╝ čéą░ą║ąĖąĄ ąĖąŠąĮčŗ ą┤ąŠą╗ąČąĮčŗ ą▒čŗčéčī ą▒ąŠą╗ąĄąĄ ąĖą╗ąĖ ą╝ąĄąĮąĄąĄ ą┐ąŠą┤ą▓ąĖąČąĮčŗą╝ąĖ. ąśąŠąĮąĮčŗąĄ čĆąĄą░ą║čåąĖąĖ ąĮąĄ ą╝ąŠą│čāčé ą┐čĆąŠč鹥ą║ą░čéčī ą╝ąĄąČą┤čā čüą▓čÅąĘą░ąĮąĮčŗą╝ąĖ ąĖąŠąĮą░ą╝ąĖ, ą║ąŠč鹊čĆčŗąĄ ąĮą░čģąŠą┤čÅčéčüčÅ ą▓ čāąĘą╗ą░čģ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĖ ąĖąŠąĮąĮčŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣. ąĪą▓ąŠą▒ąŠą┤ąĮčŗąĄ, čé. ąĄ. ą┤ąŠčüčéą░č鹊čćąĮąŠ ą┐ąŠą┤ą▓ąĖąČąĮčŗąĄ ąĖąŠąĮčŗ ąĮąĄąŠą▒čģąŠą┤ąĖą╝čŗąĄ ą┤ą╗čÅ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĖąĄ ąĖąŠąĮąĮčŗčģ čĆąĄą░ą║čåąĖą╣, ą┐ąŠčÅą▓ą╗čÅčÄčéčüčÅ č鹊ą╗čīą║ąŠ ą▓ čĆą░čüą┐ą╗ą░ą▓ą░čģ ąĖą╗ąĖ ą▓ čĆą░čüčéą▓ąŠčĆą░čģ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╣ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ čĆą░čüą┐ą╗ą░ą▓ą╗ąĄąĮąĮčŗčģ ąĖą╗ąĖ čĆą░čüčéą▓ąŠčĆąĄąĮąĮčŗčģ ą▓ąĄčēąĄčüčéą▓.
ąŁą╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ą░čÅ ą┤ąĖčüčüąŠčåąĖą░čåąĖčÅ ŌĆō čŹč鹊 čĆą░čüą┐ą░ą┤ ą▓ąĄčēąĄčüčéą▓ ą▓ čĆą░čüą┐ą╗ą░ą▓ąĄ ąĖą╗ąĖ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąĮą░ čüą▓ąŠą▒ąŠą┤ąĮčŗąĄ čüąŠčüčéą░ą▓ą╗čÅčÄčēąĖąĄ ąĖčģ ąĖąŠąĮčŗ.
ą¤čĆąĖą╝ąĄčĆ.
ąźą╗ąŠčĆąĖą┤ ąĮą░čéčĆąĖčÅ ą▓ čĆąĄąĘčāą╗čīčéą░č鹥 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╣ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ ąĖ ą▓ čĆą░čüą┐ą╗ą░ą▓ąĄ, ąĖ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąŠą▒čĆą░ąĘčāąĄčé ą║ą░čéąĖąŠąĮčŗ ąĮą░čéčĆąĖčÅ ąĖ čģą╗ąŠčĆąĖą┤-ąĖąŠąĮčŗ:
NaCl Ōćä Na+ + Cl–
ąĪąŠąĄą┤ąĖąĮąĄąĮąĖąĄ čü ą┐čĆąĄąĖą╝čāčēąĄčüčéą▓ąĄąĮąĮąŠ ąĖąŠąĮąĮčŗą╝ąĖ čüą▓čÅąĘčÅą╝ąĖ, čéą░ą║ąĖąĄ, ą║ą░ą║ čüąŠą╗ąĖ, ą▓ čéą▓ąĄčĆą┤ąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčÄčé čüąŠą▒ąŠą╣ ą║čĆąĖčüčéą░ą╗ą╗čŗ, ą▓ čāąĘą╗ą░čģ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĖ ą║ąŠč鹊čĆčŗčģ ąĮą░čģąŠą┤čÅčéčüčÅ čüą▓čÅąĘą░ąĮąĮčŗąĄ ą╝ąĄąČą┤čā čüąŠą▒ąŠą╣ ąĖąŠąĮčŗ. ą¤čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ ąĖąŠąĮąĮčŗčģ ą║čĆąĖčüčéą░ą╗ą╗ąŠą▓ ą║ ą║ąŠč鹊čĆčŗą╝ ąŠčéąĮąŠčüąĖčéčüčÅ čģą╗ąŠčĆąĖą┤ ąĮą░čéčĆąĖčÅ čŹąĮąĄčĆą│ąĖčÅ ą║ąŠą╗ąĄą▒ą░ąĮąĖčÅ ąĖąŠąĮąŠą▓ ą▓ čāąĘą╗ą░čģ čĆąĄčłąĄčéą║ąĖ ą▓ąŠąĘčĆą░čüčéą░ąĄčé ą┤ąŠ č鹥čģ ą┐ąŠčĆ, ą┐ąŠą║ą░ ąĮąĄ ą▒čāą┤čāčé ą┐čĆąĄąŠą┤ąŠą╗ąĄąĮčŗ 菹╗ąĄą║čéčĆąŠčüčéą░čéąĖč湥čüą║ąĖąĄ čüąĖą╗čŗ ą┐čĆąĖčéčÅąČąĄąĮąĖčÅ, ąŠą▒ąĄčüą┐ąĄčćąĖą▓ą░čÄčēąĖąĄ čāčüč鹊ą╣čćąĖą▓ąŠčüčéčī ąĖąŠąĮąĮąŠą╣ čĆąĄčłąĄčéą║ąĖ. ąÆ čĆąĄąĘčāą╗čīčéą░č鹥 ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ą░čÅ čĆąĄčłąĄčéą║ą░ čĆą░ąĘčĆčāčłą░ąĄčéčüčÅ, ą▓ąĄčēąĄčüčéą▓ąŠ ą┐ą╗ą░ą▓ąĖčéčüčÅ (čüčéą░ąĮąŠą▓ąĖčéčüčÅ ąČąĖą┤ą║ąĖą╝), ą░ ą▓čŗčüą▓ąŠą▒ąŠąČą┤ą░čÄčēąĖąĄčüčÅ ąĖąŠąĮčŗ ą┐čĆąĖąŠą▒čĆąĄčéą░čÄčé ą┐ąŠą┤ą▓ąĖąČąĮąŠčüčéčī. ą×ą▒čĆą░ąĘčāčÄčēąĖą╣čüčÅ čĆą░čüą┐ą╗ą░ą▓ ą┐čĆąŠą▓ąŠą┤ąĖčé 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ č鹊ą║ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ ą┐čĆąĖčüčāčéčüčéą▓ąĖčÅ čüą▓ąŠą▒ąŠą┤ąĮčŗčģ ąĘą░čĆčÅąČąĄąĮąĮčŗčģ ąĖąŠąĮąŠą▓, ąĖąŠąĮčŗ ą╝ąŠą│čāčé čāčćą░čüčéą▓ąŠą▓ą░čéčī ą▓ ąĖąŠąĮąĮčŗčģ čĆąĄą░ą║čåąĖčÅčģ.
ą£ąĄčģą░ąĮąĖąĘą╝ ą┐čĆąŠčåąĄčüčüą░ ą┐ąŠčÅą▓ą╗ąĄąĮąĖčÅ čüą▓ąŠą▒ąŠą┤ąĮčŗčģ ąĖąŠąĮąŠą▓ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąĮąĄčüą║ąŠą╗čīą║ąŠ ąĖąĮąŠą╣, čćč鹊 ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąŠ ą┤čĆčāą│ąŠą╣ ą┐čĆąĖčćąĖąĮąŠą╣ čĆą░ąĘčĆčŗą▓ą░ čüą▓čÅąĘąĄą╣ ą▓ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĄ ąĖąŠąĮąĮčŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣. ąĀą░ąĘčĆčāčłąĄąĮąĖąĄ ąĖąŠąĮąŠą▓ čĆąĄčłąĄčéą║ąĖ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą┐ąŠą┤ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖąĄą╝ čĆą░čüčéą▓ąŠčĆąĖč鹥ą╗čÅ, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą▓ąŠą┤čŗ. ą¤ąŠą╗čÅčĆąĮčŗąĄ ą╝ąŠą╗ąĄą║čāą╗čŗ ą▓ąŠą┤čŗ ąĮą░čüč鹊ą╗čīą║ąŠ čüąĮąĖąČą░čÄčé čüąĖą╗čŗ 菹╗ąĄą║čéčĆąŠčüčéą░čéąĖč湥čüą║ąŠą│ąŠ ą┐čĆąĖčéčÅąČąĄąĮąĖčÅ ą╝ąĄąČą┤čā ąĖąŠąĮą░ą╝ąĖ ą▓ čĆąĄčłąĄčéą║ąĄ (ą┐čĆąĖą╝ąĄčĆąĮąŠ ą▓ 80 čĆą░ąĘ), čćč鹊 ąĖąŠąĮčŗ čüčéą░ąĮąŠą▓čÅčéčüčÅ čüą▓ąŠą▒ąŠą┤ąĮčŗą╝ąĖ ąĖ ą┐ąĄčĆąĄčģąŠą┤čÅčé ą▓ čĆą░čüčéą▓ąŠčĆ. ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, ą┐čĆąŠčåąĄčüčü čĆą░čüčéą▓ąŠčĆąĄąĮąĖąĖ ą▓ ą▓ąŠą┤ąĄ ąĖąŠąĮąĮčŗčģ ą▓ąĄčēąĄčüčéą▓ ąŠą▒čÅąĘą░č鹥ą╗čīąĮąŠ čüąŠą┐čĆąŠą▓ąŠąČą┤ą░ąĄčéčüčÅ čĆą░čüą┐ą░ą┤ąŠą╝ ąĮą░ čüąŠčüčéą░ą▓ą╗čÅčÄčēąĖąĄ ąĖčģ ąĖąŠąĮčŗ. ą¤ąŠą╗čāčćą░čÄčēąĖąĄčüčÅ čĆą░čüčéą▓ąŠčĆčŗ čéą░ą║ąČąĄ ąŠą▒ą╗ą░ą┤ą░čÄčé 菹╗ąĄą║čéčĆąŠą┐čĆąŠą▓ąŠą┤ąĮąŠčüčéčīčÄ.
ąóąĄąŠčĆąĖčÅ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╣ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ čéą░ą║ąČąĄ ąĮą░ąĘčŗą▓ą░ąĄą╝ą░čÅ ąĖąŠąĮąĮą░čÅ č鹥ąŠčĆąĖčÅ ą▒čŗą╗ą░ čüąŠąĘą┤ą░ąĮą░ ą▓ 1884ŌĆō1887 ą│ąŠą┤čā čłą▓ąĄą┤čüą║ąĖą╝ čģąĖą╝ąĖą║ąŠą╝ ąĪą▓ą░ąĮč鹥 ąÉčĆčĆąĄąĮąĖčāčüąŠą╝. ąŁč鹊 ą║ą╗ą░čüčüąĖč湥čüą║ą░čÅ č鹥ąŠčĆąĖčÅ ą┐ąŠąĘą▓ąŠą╗ąĖą╗ą░ ąŠą▒čŖčÅčüąĮąĖčéčī ą║ą░ą║ 菹╗ąĄą║čéčĆąŠą┐čĆąŠą▓ąŠą┤ąĮąŠčüčéčī čĆą░čüą┐ą╗ą░ą▓ąŠą▓ ąĖ čĆą░čüčéą▓ąŠčĆąŠą▓ čéą░ą║ ąĖ ą┐čĆąŠč鹥ą║ą░ąĮąĖąĄ čģąĖą╝ąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖą╣ ą╝ąĄąČą┤čā čĆą░čüą┐ą╗ą░ą▓ą╗ąĄąĮąĮčŗą╝ąĖ ąĖ čĆą░čüčéą▓ąŠčĆąĄąĮąĮčŗą╝ąĖ ą▓ąĄčēąĄčüčéą▓ą░ą╝ąĖ.
ąĀą░čüą┐ą░ą┤ ąĮą░ ąĖąŠąĮčŗ ą▓ąŠąĘą╝ąŠąČąĄąĮ čéą░ą║ąČąĄ ą┤ą╗čÅ ą╝ąĮąŠą│ąĖčģ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗčģ ą▓ąĄčēąĄčüčéą▓, čéą░ą║ąĖčģ ą║ą░ą║ HCl (ą│ą░ąĘ) ąĖą╗ąĖ HNO3 (ąČąĖą┤ą║ąŠčüčéčī). ąŁčéąĖ ą▓ąĄčēąĄčüčéą▓ą░ ą┐čĆąĖ čĆą░čüčéą▓ąŠčĆąĄąĮąĖąĖ ą▓ ą▓ąŠą┤ąĄ, čģąŠčéčÅ ąŠąĮąĖ ąĖ ą┐ąŠčüčéčĆąŠąĄąĮčŗ ąĖąĘ ąĖąŠąĮąŠą▓, 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąĖ ą┤ąĖčüčüąŠčåąĖąĖčĆčāčÄčé čü čĆą░ąĘčĆčŗą▓ąŠą╝ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą╣ čüą▓čÅąĘąĖ (H-Cl ąĖą╗ąĖ H-O):
HCl Ōćä H+ + Cl–; HNO3 Ōćä H+ + NO3–
ąŁą╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║čāčÄ ą┤ąĖčüčüąŠčåąĖą░čåąĖčÄ ą▓ąĄčēąĄčüčéą▓ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ą▓čŗąĘčŗą▓ą░ąĄčé ąĮąĄ č鹊ą╗čīą║ąŠ ą▓ąŠą┤ą░, ąĮąŠ ąĖ ąĮąĄą▓ąŠą┤ąĮčŗąĄ ą┐ąŠą╗čÅčĆąĮčŗąĄ čĆą░čüčéą▓ąŠčĆąĖč鹥ą╗ąĖ, čéą░ą║ąĖąĄ ą║ą░ą║ ąČąĖą┤ą║ąĖą╣ ą░ą╝ą╝ąĖą░ą║ ąĖ ąČąĖą┤ą║ąĖą╣ ą┤ąĖąŠą║čüąĖą┤ čüąĄčĆčŗ. ą×ą┤ąĮą░ą║ąŠ ąĖą╝ąĄąĮąĮąŠ ą┤ą╗čÅ ą▓ąŠą┤čŗ čüą▓ąŠą╣čüčéą▓ą░ ąŠčüą╗ą░ą▒ą╗čÅčéčī 菹╗ąĄą║čéčĆąŠčüčéą░čéąĖč湥čüą║ąŠąĄ ą┐čĆąĖčéčÅąČąĄąĮąĖąĄ ą╝ąĄąČą┤čā ąĖąŠąĮą░ą╝ąĖ ą▓ čĆąĄčłąĄčéą║ąĄ ą▓čŗčĆą░ąČąĄąĮąŠ ąŠčüąŠą▒ąĄąĮąĮąŠ čÅčĆą║ąŠ. ą£ąĄčĆąŠą╣ čŹč鹊ą│ąŠ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖčÅ čĆą░čüčéą▓ąŠčĆąĖč鹥ą╗čÅ čÅą▓ą╗čÅąĄčéčüčÅ ąĄą│ąŠ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮą░čÅ ą┤ąĖ菹╗ąĄą║čéčĆąĖč湥čüą║ą░čÅ ą┐čĆąŠąĮąĖčåą░ąĄą╝ąŠčüčéčī, ąĘąĮą░č湥ąĮąĖąĄ ą║ąŠč鹊čĆąŠą╣ ą┤ą╗čÅ ą▓ąŠą┤čŗ ą▓ąĄčüčīą╝ą░ ą▓čŗčüąŠą║ąŠ.
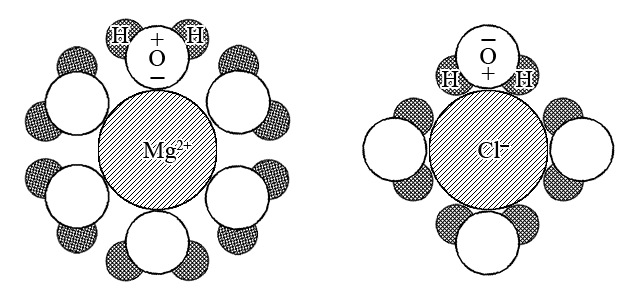
ąĪą▓ąŠą▒ąŠą┤ąĮčŗąĄ ąĖąŠąĮčŗ, ąŠą║ą░ąĘą░ą▓čłąĖąĄčüčÅ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╣ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ čĆą░čüčéą▓ąŠčĆąĄąĮąĮąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░, ąŠą║čĆčāąČą░čÄčéčüčÅ ą┐ąŠą╗čÅčĆąĮčŗą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ ą▓ąŠą┤čŗ: ą▓ąŠą║čĆčāą│ ąĖąŠąĮąŠą▓ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ą┐ąŠčÅą▓ą╗čÅąĄčéčüčÅ ą│ąĖą┤čĆą░čéąĮą░čÅ ąŠą▒ąŠą╗ąŠčćą║ą░ ą▓ čüą╗čāčćą░ąĄ ą┤čĆčāą│ąĖčģ čĆą░čüčéą▓ąŠčĆąĖč鹥ą╗ąĄą╣ čüąŠą╗čīą▓ą░čéąĮą░čÅ ąŠą▒ąŠą╗ąŠčćą║ą░.
ąōąĖą┤čĆą░čéą░čåąĖčÅ – čŹč鹊 ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ąŠą▒ąŠą╗ąŠčćą║ąĖ ąĖąĘ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤čŗ ą▓ąŠą║čĆčāą│ ąĖąŠąĮą░, ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąĮąŠąĄ 菹╗ąĄą║čéčĆąŠčüčéą░čéąĖč湥čüą║ąĖą╝ ą┐čĆąĖčéčÅąČąĄąĮąĖąĄą╝ ą┤ąĖą┐ąŠą╗ąĄą╣ ą▓ąŠą┤čŗ ą║ ąĖąŠąĮčā.
ąĪąŠą╗čīą▓ą░čéą░čåąĖčÅ – čŹč鹊 ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ąŠą▒ąŠą╗ąŠčćą║ąĖ ąĖąĘ ą╝ąŠą╗ąĄą║čāą╗ čĆą░čüčéą▓ąŠčĆąĖč鹥ą╗čÅ ą▓ąŠą║čĆčāą│ ąĖąŠąĮą░, ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąĮąŠąĄ 菹╗ąĄą║čéčĆąŠčüčéą░čéąĖč湥čüą║ąĖą╝ ą┐čĆąĖčéčÅąČąĄąĮąĖąĄą╝ ą┤ąĖą┐ąŠą╗ąĄą╣ ą╝ąŠą╗ąĄą║čāą╗ čĆą░čüčéą▓ąŠčĆąĖč鹥ą╗čÅ ą║ ąĖąŠąĮčā.
ąĢčüč鹥čüčéą▓ąĄąĮąĮąŠ, čćč鹊 ą▓ąŠą║čĆčāą│ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗčģ ąĖąŠąĮąŠą▓, ą╝ąŠą╗ąĄą║čāą╗čŗ ą▓ąŠą┤čŗ ąŠčĆąĖąĄąĮčéąĖčĆąŠą▓ą░ąĮčŗ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╝ąĖ ą║ąŠąĮčåą░ą╝ąĖ ą┤ąĖą┐ąŠą╗ąĄą╣, ą░ ą▓ąŠą║čĆčāą│ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗčģ ąĖąŠąĮąŠą▓ ŌĆō ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ąĖ ą║ąŠąĮčåą░ą╝ąĖ ą┤ąĖą┐ąŠą╗ąĄą╣.
ąÜą░čéąĖąŠąĮčŗ ąĖ ą░ąĮąĖąŠąĮčŗ
ąĢčüą╗ąĖ č湥čĆąĄąĘ čĆą░čüčéą▓ąŠčĆ ąĖą╗ąĖ čĆą░čüą┐ą╗ą░ą▓, čüąŠą┤ąĄčƹȹ░čēąĖą╣ ą┤ąŠčüčéą░č鹊čćąĮąŠ ą┐ąŠą┤ą▓ąĖąČąĮčŗąĄ ąĖąŠąĮčŗ, ą┐čĆąŠč鹥ą║ą░ąĄčé ą┐ąŠčüč鹊čÅąĮąĮčŗą╣ 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ č鹊ą║ (ą┐čĆąĖ ą┐ąŠą│čĆčāąČąĄąĮąĖąĖ ą▓ čĆą░čüčéą▓ąŠčĆ ąĖą╗ąĖ čĆą░čüą┐ą╗ą░ą▓ ą┤ą▓čāčģ 菹╗ąĄą║čéčĆąŠą┤ąŠą▓), č鹊 ąĖąŠąĮčŗ ąĮą░čćąĖąĮą░čÄčé ą┤ą▓ąĖą│ą░čéčīčüčÅ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĮčŗą╝ ąŠą▒čĆą░ąĘąŠą╝. ąÆ ąŠčéčüčāčéčüčéą▓ąĖąĄ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ ą┐ąŠą╗čÅ (菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░) ąĖąŠąĮčŗ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąĖą╗ąĖ čĆą░čüą┐ą╗ą░ą▓ąĄ ą┤ą▓ąĖą│ą░čÄčéčüčÅ čģą░ąŠčéąĖč湥čüą║ąĖ.

ąÆčüą╗ąĄą┤čüčéą▓ąĖąĄ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖčÅ čŹą╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ ą┐ąŠą╗čÅ ąĖąŠąĮčŗ ą┐ąĄčĆąĄą╝ąĄčēą░čÄčéčüčÅ ą║ č鹊ą╝čā 菹╗ąĄą║čéčĆąŠą┤čā, ą║ąŠč鹊čĆčŗą╣ ąŠą▒ą╗ą░ą┤ą░ąĄčé ą┐čĆąŠčéąĖą▓ąŠą┐ąŠą╗ąŠąČąĮčŗą╝ ąĖą╝ ą┐ąŠ ąĘąĮą░ą║čā ąĘą░čĆčÅą┤ąŠą╝.
ą¤ąŠ ąĮą░ąĘą▓ą░ąĮąĖčÄ čŹą╗ąĄą║čéčĆąŠą┤ą░, ą║ ą║ąŠč鹊čĆąŠą╝čā ą┐ąĄčĆąĄą╝ąĄčēą░čÄčéčüčÅ ąĖąŠąĮčŗ, čüčéčĆąŠąĖčéčüčÅ ąĮą░ąĘą▓ą░ąĮąĖąĄ ąĖąŠąĮąŠą▓.
ąÜą░č鹊ą┤ – čŹč鹊 ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗą╣ 菹╗ąĄą║čéčĆąŠą┤; ąÜą░čéąĖąŠąĮčŗ – čŹč鹊 ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗąĄ ąĖąŠąĮčŗ.
ąÉąĮąŠą┤ – čŹč鹊 ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗą╣ 菹╗ąĄą║čéčĆąŠą┤; ąÉąĮąĖąŠąĮčŗ – čŹč鹊 ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗąĄ ąĖąŠąĮčŗ.
ąÜą░čéąĖąŠąĮčŗ ąĮąĄčüčāčé ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤ ąĖ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠ, ą┐ąĄčĆąĄą╝ąĄčēą░čÄčéčüčÅ ą║ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮąŠą╝čā ą║ą░č鹊ą┤čā; ą░ąĮąĖąŠąĮčŗ ąĮąĄčüčāčé ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčŗą╣ ąĘą░čĆčÅą┤ ąĖ ą┐ąĄčĆąĄą╝ąĄčēą░čÄčéčüčÅ ą║ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮąŠą╝čā ą░ąĮąŠą┤čā.
ąÜ čĆą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮąĮčŗą╝ ą║ą░čéąĖąŠąĮą░ą╝ ąŠčéąĮąŠčüčÅčéčüčÅ: ąĖąŠąĮčŗ ą╝ąĄčéą░ą╗ą╗ąŠą▓ (Na+, Ca2+, Al3+, Cu2+, Ag+, Au+ ąĖ ą┤čĆ.); ąĖąŠąĮ ą▓ąŠą┤ąŠčĆąŠą┤ą░ H+ (č鹊čćąĮąĄąĄ, H3O+), čüą╗ąŠąČąĮčŗąĄ ąĖąŠąĮčŗ čéąĖą┐ą░ ą║ą░čéąĖąŠąĮą░ ą░ą╝ą╝ąŠąĮąĖčÅ NH4+.
ąÜ čĆą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮąĮčŗą╝ ą░ąĮąĖąŠąĮą░ą╝ ąŠčéąĮąŠčüčÅčéčüčÅ ą▓čüąĄ ą║ąĖčüą╗ąŠčéąĮčŗąĄ ąŠčüčéą░čéą║ąĖ (Cl–, SO42-, NO3– ąĖ ą┤čĆ.), ą│ąĖą┤čĆąŠą║čüąĖą┤-ąĖąŠąĮ OH–.
ąÆ č乊čĆą╝čāą╗ą░čģ ąĮąĄąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ č乊čĆą╝čāą╗čā ą║ą░čéąĖąŠąĮąŠą▓ čāą║ą░ąĘčŗą▓ą░čÄčé čüą╗ąĄą▓ą░, ą░ č乊čĆą╝čāą╗čā ą░ąĮąĖąŠąĮąŠą▓ čüą┐čĆą░ą▓ą░.
ąØą░ą┐čĆąĖą╝ąĄčĆ: NaCl – Na+ – ą║ą░čéąĖąŠąĮ; Cl– – ą░ąĮąĖąŠąĮ.
ąÆ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą▓čüąĄ ąĖąŠąĮčŗ ą│ąĖą┤čĆą░čéąĖčĆąŠą▓ą░ąĮčŗ ąĮąĄą║ąŠč鹊čĆčŗą╝ čćąĖčüą╗ąŠą╝ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤čŗ, ąĮą░ą┐čĆąĖą╝ąĄčĆ, Na+*nH2O, SO42-*nH2O, H+*nH2O ąĖą╗ąĖ H3O+*(h-1)H2O. ą¦č鹊ą▒čŗ ąĮąĄ čāčüą╗ąŠąČąĮčÅčéčī ąĘą░ą┐ąĖčüčī čāčĆą░ą▓ąĮąĄąĮąĖą╣ čģąĖą╝ąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖą╣ čü čāčćą░čüčéąĖąĄą╝ ąĖąŠąĮąŠą▓ ą▓ čĆą░čüčéą▓ąŠčĆąĄ, ąŠą▒čŗčćąĮąŠ ą│ąĖą┤čĆą░čéąĮą░čÅ ąŠą▒ąŠą╗ąŠčćą║ą░ ąĮąĄ čāą║ą░ąĘčŗą▓ą░ąĄčéčüčÅ (ą║čĆąŠą╝ąĄ ąŠčüąŠą▒čŗčģ čüą╗čāčćą░ąĄą▓); ąĘą░ą┐ąĖčüąĖ Na+, SO42-, H+ ą┐ąŠą┤čĆą░ąĘčāą╝ąĄą▓ą░čÄčé, čćč鹊 čŹčéąĖ ąĖąŠąĮčŗ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ą│ąĖą┤čĆą░čéąĖčĆąŠą▓ą░ąĮčŗ.
ąŁą╗ąĄą║čéčĆąŠą╗ąĖčéčŗ ąĖ ąĮąĄčŹą╗ąĄą║čéčĆąŠą╗ąĖčéčŗ
ą¤ąŠ čüą┐ąŠčüąŠą▒ąĮąŠčüčéąĖ ą▓ąĄčēąĄčüčéą▓ čĆą░čüą┐ą░ą┤ą░čéčīčüčÅ ąĖą╗ąĖ ąĮąĄ čĆą░čüą┐ą░ą┤ą░čéčīčüčÅ ą▓ čĆą░čüą┐ą╗ą░ą▓ąĄ ąĖą╗ąĖ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąĮą░ ą║ą░čéąĖąŠąĮčŗ ąĖ ą░ąĮąĖąŠąĮčŗ čĆą░ąĘą╗ąĖčćą░čÄčé 菹╗ąĄą║čéčĆąŠą╗ąĖčéčŗ ąĖ ąĮąĄčŹą╗ąĄą║čéčĆąŠą╗ąĖčéčŗ.
ąŁą╗ąĄą║čéčĆąŠą╗ąĖčéčŗ – čŹč鹊 ą▓ąĄčēąĄčüčéą▓ą░, ą║ąŠč鹊čĆčŗąĄ ą┐ąŠą┤ą▓ąĄčĆą│ą░čÄčéčüčÅ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╣ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ, ąĖ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ č湥ą│ąŠ ąĖčģ čĆą░čüą┐ą╗ą░ą▓čŗ ąĖą╗ąĖ čĆą░čüčéą▓ąŠčĆčŗ ą┐čĆąŠą▓ąŠą┤čÅčé 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ č鹊ą║.
ąÜ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ą╝ ą┐čĆąĖąĮą░ą┤ą╗ąĄąČą░čé ą▓čüąĄ čüąŠą╗ąĖ, ą░ čéą░ą║ąČąĄ ą║ąĖčüą╗ąŠčéąĮčŗąĄ, ąŠčüąĮąŠą▓ąĮčŗąĄ ąĖ ą░ą╝č乊č鹥čĆąĮčŗąĄ ą│ąĖą┤čĆąŠą║čüąĖą┤čŗ.
ąĪą╗ąĄą┤čāąĄčé čĆą░ąĘą╗ąĖčćą░čéčī ąĖčüčéąĖąĮąĮčŗąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖčéčŗ (ąĮą░čüč鹊čÅčēąĖąĄ) ąĖ ą┐ąŠč鹥ąĮčåąĖą░ą╗čīąĮčŗąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖčéčŗ.
ąśčüčéąĖąĮąĮčŗąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖčéčŗ ąĮą░čģąŠą┤čÅčéčüčÅ ą▓ ą▓ąĖą┤ąĄ ąĖąŠąĮąŠą▓ čāąČąĄ ą▓ ąĖąĮą┤ąĖą▓ąĖą┤čāą░ą╗čīąĮąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ, čé.ąĄ. ą┤ąŠ č鹊ą│ąŠ, ą║ą░ą║ ąŠąĮąĖ ą▒čāą┤čāčé čĆą░čüą┐ą╗ą░ą▓ą╗ąĄąĮčŗ ąĖą╗ąĖ ą┐ąĄčĆąĄą▓ąĄą┤ąĄąĮčŗ ą▓ čĆą░čüčéą▓ąŠčĆ. ąÜ ąĖčüčéąĖąĮąĮčŗą╝ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ą╝ ąŠčéąĮąŠčüčÅčéčüčÅ ą▓čüąĄ čéąĖą┐ąĖčćąĮčŗąĄ čüąŠą╗ąĖ, ąĮą░ą┐čĆąĖą╝ąĄčĆ, NaNO3, K2SO4, CaCl2 ąĖ ą┤čĆ., ą║ąŠč鹊čĆčŗąĄ ą▓ čéą▓ąĄčĆą┤ąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ ąŠą▒čĆą░ąĘčāčÄčé ąĖąŠąĮąĮčāčÄ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║čāčÄ čĆąĄčłąĄčéą║čā.
ą¤ąŠč鹥ąĮčåąĖą░ą╗čīąĮčŗąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖčéčŗ ą▓ ąĖąĮą┤ąĖą▓ąĖą┤čāą░ą╗čīąĮąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ ąĖąŠąĮąŠą▓ ąĮąĄ čüąŠą┤ąĄčƹȹ░čé, ąĮąŠ ąŠą▒čĆą░ąĘčāčÄčé ąĖčģ ą┐čĆąĖ ą┐ąĄčĆąĄčģąŠą┤ąĄ ą▓ąĄčēąĄčüčéą▓ą░ ą▓ čĆą░čüčéą▓ąŠčĆ. ąÜ ą┐ąŠč鹥ąĮčåąĖą░ą╗čīąĮčŗą╝ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ą╝ ąŠčéąĮąŠčüčÅčéčüčÅ ą▓ąĄčēąĄčüčéą▓ą░, čüąŠčüč鹊čÅčēąĖąĄ ąĖąĘ ą╝ąŠą╗ąĄą║čāą╗ čü čüąĖą╗čīąĮąŠ ą┐ąŠą╗čÅčĆąĮčŗą╝ąĖ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗą╝ąĖ čüą▓čÅąĘčÅą╝ąĖ. ąÆ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ čéą░ą║ąĖąĄ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗąĄ čüą▓čÅąĘąĖ ą┐ąŠą┤ ą▓ą╗ąĖčÅąĮąĖąĄą╝ ą┐ąŠą╗čÅčĆąĮčŗčģ ą╝ąŠą╗ąĄą║čāą╗ čĆą░čüčéą▓ąŠčĆąĖč鹥ą╗čÅ čĆą░ąĘčĆčŗą▓ą░čÄčéčüčÅ, ą╗ąĖą▒ąŠ čā ą▓čüąĄčģ ą╝ąŠą╗ąĄą║čāą╗, ą╗ąĖą▒ąŠ čā ąĮąĄą║ąŠč鹊čĆąŠą╣ ąĖčģ čćą░čüčéąĖ.
ą¤čĆąĖą╝ąĄčĆ.
ą¤čĆąĖ čĆą░čüčéą▓ąŠčĆąĄąĮąĖąĖ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą│ąŠ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░ ą▓ ą▓ąŠą┤ąĄ čüąĖą╗čīąĮąŠ ą┐ąŠą╗čÅčĆąĮčŗąĄ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗąĄ čüą▓čÅąĘąĖ H-Cl čĆą░ąĘčĆčŗą▓ą░čÄčéčüčÅ, ąĖ ąŠą▒čĆą░ąĘčāčÄčéčüčÅ ą║ą░čéąĖąŠąĮčŗ ą▓ąŠą┤ąŠčĆąŠą┤ą░ H+ (H3O+) ąĖ čģą╗ąŠčĆąĖą┤ ąĖąŠąĮčŗ Cl–:
HCl Ōćä H+ + Cl–; H+ + H2O = H3O+
ąÆąŠą┤ąĮčŗą╣ čĆą░čüčéą▓ąŠčĆ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ą░ ąĖąĘ-ąĘą░ ąĮą░ą╗ąĖčćąĖčÅ ą║ą░čéąĖąŠąĮąŠą▓ H+ ąĖą╝ąĄąĄčé ą║ąĖčüą╗ąŠčéąĮčāčÄ čĆąĄą░ą║čåąĖčÄ, ą┐ąŠčŹč鹊ą╝čā čĆą░čüčéą▓ąŠčĆ ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ąĮą░čÅ ą║ąĖčüą╗ąŠčéą░ ąĖą╗ąĖ čüąŠą╗čÅąĮą░čÅ ą║ąĖčüą╗ąŠčéą░.
ąÆąĄčēąĄčüčéą▓ą░, ą┐ąŠčüčéčĆąŠąĄąĮąĮčŗąĄ ąĖąĘ ą╝ąŠą╗ąĄą║čāą╗ čü ąĮąĄą┐ąŠą╗čÅčĆąĮčŗą╝ąĖ ąĖą╗ąĖ čüą╗ą░ą▒ąŠ ą┐ąŠą╗čÅčĆąĮčŗą╝ąĖ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗą╝ąĖ čüą▓čÅąĘčÅą╝ąĖ, ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ąĮąĄ ą┤ąĖčüčüąŠčåąĖąĖčĆčāčÄčé ąĮą░ ąĖąŠąĮčŗ, ą░ ąŠčüčéą░čÄčéčüčÅ ą▓ ąĮąĄą╝ ą▓ ą▓ąĖą┤ąĄ ą│ąĖą┤čĆą░čéąĖčĆąŠą▓ą░ąĮąĮčŗčģ ą╝ąŠą╗ąĄą║čāą╗. ąśčģ ąĮą░ąĘčŗą▓ą░čÄčé ąĮąĄčŹą╗ąĄą║čéčĆąŠą╗ąĖčéčŗ.
ąØąĄčŹą╗ąĄą║čéčĆąŠą╗ąĖčéčŗ – čŹč鹊 ą▓ąĄčēąĄčüčéą▓ą░, ą║ąŠč鹊čĆčŗąĄ ąĮąĄ ą┐ąŠą┤ą▓ąĄčĆą│ą░čÄčéčüčÅ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╣ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ, ąĖ ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ č湥ą│ąŠ ąĖčģ čĆą░čüą┐ą╗ą░ą▓čŗ ąĖ čĆą░čüčéą▓ąŠčĆčŗ ąĮąĄ ą┐čĆąŠą▓ąŠą┤čÅčé 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ č鹊ą║.
ąÜ ąĮąĄčŹą╗ąĄą║čéčĆąŠą╗ąĖčéą░ą╝ ąŠčéąĮąŠčüąĖčéčüčÅ ą▒ąŠą╗čīčłą░čÅ čćą░čüčéčī ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą┤ąĖčŹčéąĖą╗ąŠą▓čŗą╣ čŹčäąĖčĆ, ą▒ąĄąĮąĘąŠą╗, ą│ą╗čÄą║ąŠąĘą░, ą║čĆą░čģą╝ą░ą╗, čüą░čģą░čĆąŠąĘą░ (ąŠą▒čŗčćąĮčŗą╣ čüą░čģą░čĆ), čŹčéąĖą╗ąŠą▓čŗą╣ čüą┐ąĖčĆčé. ąśčüą║ą╗čÄč湥ąĮąĖąĄ čüąŠčüčéą░ą▓ą╗čÅčÄčé ąŠčĆą│ą░ąĮąĖč湥čüą║ąĖąĄ ą║ąĖčüą╗ąŠčéčŗ ąĖ ąŠčüąĮąŠą▓ą░ąĮąĖčÅ, ąĖ ąĖčģ čüąŠą╗ąĖ.
ą£ąĄąČą┤čā 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ ą╝ąĄčéą░ą╗ą╗ąŠą▓ (ą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąĖ ą┐ąĄčĆą▓ąŠą│ąŠ čĆąŠą┤ą░), ąĖ čĆą░čüą┐ą╗ą░ą▓ąŠą▓ ąĖą╗ąĖ čĆą░čüčéą▓ąŠčĆąŠą▓ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ (ą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąĖ ą▓č鹊čĆąŠą│ąŠ čĆąŠą┤ą░) ąĖą╝ąĄčÄčéčüčÅ čüčāčēąĄčüčéą▓ąĄąĮąĮčŗąĄ čĆą░ąĘą╗ąĖčćąĖčÅ.
|
ąĪą▓ąŠą╣čüčéą▓ąŠ |
ą£ąĄčéą░ą╗ |
ąĀą░čüčéą▓ąŠčĆ/čĆą░čüą┐ą╗ą░ą▓ |
|
ąØąŠčüąĖč鹥ą╗ąĖ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ ąĘą░čĆčÅą┤ą░ |
ąŁą╗ąĄą║čéčĆąŠąĮčŗ |
ąśąŠąĮčŗ |
|
ąŁą╗ąĄą║čéčĆąŠą┐čĆąŠą▓ąŠą┤ąĮąŠčüčéčī |
ą×čéą╗ąĖčćąĮą░čÅ |
ąØąĄąĘąĮą░čćąĖč鹥ą╗čīąĮą░čÅ |
|
ąśąĘą╝ąĄąĮąĄąĮąĖąĄ 菹╗ąĄą║čéčĆąŠą┐čĆąŠą▓ąŠą┤ąĮąŠčüčéąĖ ą┐čĆąĖ ą┐ąŠą▓čŗčłąĄąĮąĖąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ |
ąŻą╝ąĄąĮčīčłą░ąĄčéčüčÅ |
ąŻą▓ąĄą╗ąĖčćąĖą▓ą░ąĄčéčüčÅ |
|
ą¤čĆąĄą▓čĆą░čēąĄąĮąĖąĄ ą▓ąĄčēąĄčüčéą▓ą░ ą┐čĆąĖ ą┐čĆąŠč鹥ą║ą░ąĮąĖąĖ ąĄą╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░ |
ąØąĄčé |
ąĀą░ąĘą╗ą░ą│ą░ąĄčéčüčÅ |
ąŻčĆą░ą▓ąĮąĄąĮąĖčÅ čŹą╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą╣ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ
ąöą╗čÅ čüąŠčüčéą░ą▓ą╗ąĄąĮąĖčÅ čāčĆą░ą▓ąĮąĄąĮąĖą╣ ąĖąŠąĮąĮčŗčģ čĆąĄą░ą║čåąĖą╣, ą┐čĆąŠč鹥ą║ą░čÄčēąĖčģ ą▓ čĆą░čüčéą▓ąŠčĆąĄ, ąĮąĄąŠą▒čģąŠą┤ąĖą╝ąŠ čāą╝ąĄčéčī ąĘą░ą┐ąĖčüčŗą▓ą░čéčī čāčĆą░ą▓ąĮąĄąĮąĖčÅ ąĖčģ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ.
ąöą╗čÅ ąĖčüčéąĖąĮąĮčŗčģ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ čāčĆą░ą▓ąĮąĄąĮąĖąĄ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ ąŠčéčĆą░ąČą░ąĄčé č鹊ą╗čīą║ąŠ čäą░ą║čé ą┐ąĄčĆąĄčģąŠą┤ą░ čüą▓čÅąĘą░ąĮąĮčŗčģ ąĖąŠąĮąŠą▓ ąĖąĘ čāąĘą╗ąŠą▓ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĖ ą▓ čüą▓ąŠą▒ąŠą┤ąĮčŗąĄ ą│ąĖą┤čĆą░čéąĖčĆąŠą▓ą░ąĮąĮčŗąĄ ąĖąŠąĮčŗ ą▓ čĆą░čüčéą▓ąŠčĆąĄ.
ą¤čĆąĖą╝ąĄčĆ.
ąōąĖą┤čĆąŠą║čüąĖą┤ ąĮą░čéčĆąĖčÅ ą┤ąĖčüčüąŠčåąĖąĖčĆčāąĄčé ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą▓ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĖąĖ čü čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝:
NaOH Ōćä Na+ + OH–
ąōąĖą┤čĆąŠą║čüąĖą┤ ąĮą░čéčĆąĖčÅ ą┐čĆą░ą║čéąĖč湥čüą║ąĖ ą┐ąŠą╗ąĮąŠčüčéčīčÄ ą┤ąĖčüčüąŠčåąĖąĖčĆčāąĄčé ąĮą░ ąĖąŠąĮčŗ ąĖ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ (ąĖą╝ąĄčÄčéčüčÅ ą▓ ą▓ąĖą┤čā čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮčŗąĄ < 0,1M čĆą░čüčéą▓ąŠčĆčŗ ąĖčüčéąĖąĮąĮčŗčģ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓, čé.ą║. ą▓ ą▒ąŠą╗ąĄąĄ ą║ąŠąĮčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮčŗčģ čĆą░čüčéą▓ąŠčĆą░čģ ą┐čĆąĖčüčāčéčüčéą▓čāčÄčé čéą░ą║ąČąĄ ą║ą▓ą░ąĘąĖą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąĖąŠąĮąĮčŗąĄ ą┐ą░čĆčŗ čéąĖą┐ą░ Na+Cl– ąĖ ą▒ąŠą╗ąĄąĄ čüą╗ąŠąČąĮčŗąĄ ą░čüčüąŠčåąĖą░čéčŗ – čéčĆąŠą╣ąĮąĖą║ąĖ, ą║ą▓ą░ą┤čĆčāą┐ąŠą╗ąĖ) ąŠąĮ ąĮą░čģąŠą┤ąĖčéčüčÅ ąĖčüą║ą╗čÄčćąĖč鹥ą╗čīąĮąŠ ą▓ ą▓ąĖą┤ąĄ ąĖąŠąĮąŠą▓ Na+ ąĖ OH–.
ąöą╗čÅ ą┐ąŠč鹥ąĮčåąĖą░ą╗čīąĮčŗčģ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ čāčĆą░ą▓ąĮąĄąĮąĖąĄ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ ąŠčéčĆą░ąČą░ąĄčé čäą░ą║čé čĆą░ąĘčĆčŗą▓ą░ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗčģ čüą▓čÅąĘąĄą╣ ą▓ ąĖčģ ą╝ąŠą╗ąĄą║čāą╗ą░čģ. ąĢčüą╗ąĖ čéą░ą║ąŠą╣ čĆą░ąĘčĆčŗą▓ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą┐ąŠą╗ąĮąŠčüčéčīčÄ ą┤ą╗čÅ ą▓čüąĄčģ čĆą░čüčéą▓ąŠčĆąĄąĮąĮčŗčģ ą╝ąŠą╗ąĄą║čāą╗ (čé.ąĄ. ą╝ąŠą╗ąĄą║čāą╗ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ąĮąĄ čüčāčēąĄčüčéą▓čāąĄčé), č鹊 čāčĆą░ą▓ąĮąĄąĮąĖąĄ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ ąĘą░ą┐ąĖčüčŗą▓ą░ąĄčéčüčÅ ą░ąĮą░ą╗ąŠą│ąĖčćąĮąŠ čāčĆą░ą▓ąĮąĄąĮąĖčÄ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ ąĖčüčéąĖąĮąĮčŗčģ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓.
ą¤čĆąĖą╝ąĄčĆ.
ąźą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ ąĖą╝ąĄąĄčé čüąĖą╗čīąĮąŠ ą┐ąŠą╗čÅčĆąĮčāčÄ (ąĮąŠ ąĮąĄ ąĖąŠąĮąĮčāčÄ čüą▓čÅąĘčī), ą┐ąŠčŹč鹊ą╝čā ąŠąĮ ąŠčéąĮąŠčüąĖčéčüčÅ ą║ ą┐ąŠč鹥ąĮčåąĖą░ą╗čīąĮčŗą╝ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ą╝. ąĀą░čüčéą▓ąŠčĆąĄąĮąĮčŗą╣ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ ą┤ąĖčüčüąŠčåąĖąĖčĆčāąĄčé ą▓ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĖąĖ čüąŠ čüą╗ąĄą┤čāčÄčēąĖą╝ čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝:
HCl Ōćä H+ + Cl–; H+ + H2O Ōćä H3O+
ąÆ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮčŗčģ (< 0.1M) ą▓ąŠą┤ąĮčŗčģ čĆą░čüčéą▓ąŠčĆą░čģ čģą╗ąŠčĆąŠą▓ąŠą┤ąŠčĆąŠą┤ ą┤ąĖčüčüąŠčåąĖąĖčĆčāąĄčé ąĮą░ ąĖąŠąĮčŗ ą┐čĆą░ą║čéąĖč湥čüą║ąĖ ą┐ąŠą╗ąĮąŠčüčéčīčÄ.
ąÆ čāčĆą░ą▓ąĮąĄąĮąĖčÅčģ ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ čüą╗ąĄą┤čāąĄčé čāčćąĖčéčŗą▓ą░čéčī čüąŠčüčéą░ą▓ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ ąĖ čāą║ą░ąĘčŗą▓ą░čéčī čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖąĄ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéčŗ ą┐ąĄčĆąĄą┤ č乊čĆą╝čāą╗ą░ą╝ąĖ ąĖąŠąĮąŠą▓.
ą¤čĆąĖą╝ąĄčĆ.
Al2(SO4)3 Ōćä 2Al3+ + 3SO42-
ąŁčéą░ ąĘą░ą┐ąĖčüčī ąŠąĘąĮą░čćą░ąĄčé, čćč鹊 ąŠą┤ąĮą░ č乊čĆą╝čāą╗čīąĮą░čÅ ąĄą┤ąĖąĮąĖčåą░ čüčāą╗čīčäą░čéą░ ą░ą╗čÄą╝ąĖąĮąĖčÅ ą▓ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ čĆą░čüą┐ą░ą┤ą░ąĄčéčüčÅ ąĮą░ ą┤ą▓ą░ ą║ą░čéąĖąŠąĮą░ ą░ą╗čÄą╝ąĖąĮąĖčÅ Al3+ ąĖ čéčĆąĖ ą░ąĮąĖąŠąĮą░ čüčāą╗čīčäą░čé-ąĖąŠąĮą░ SO42-.










