ą¤čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ ą▓ąŠą┤ąĮčŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ ą▓ 菹╗ąĄą║čéčĆąŠą┤ąĮčŗčģ ą┐ąŠą╗čā-ą┐čĆąŠčåąĄčüčüą░čģ ą╝ąŠąČąĄčé ą┐čĆąĖąĮąĖą╝ą░čéčī čāčćą░čüčéąĖąĄ, ą║čĆąŠą╝ąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░, ą▓ąŠą┤ą░. ąÆ čĆąĄąĘčāą╗čīčéą░č鹥 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąŠą│ąŠ čĆą░ąĘą╗ąŠąČąĄąĮąĖčÅ ą▓ąŠą┤čŗ ąĮą░ ą║ą░č鹊ą┤ąĄ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą▓ąŠą┤ąŠčĆąŠą┤, ą░ ąĮą░ ą░ąĮąŠą┤ąĄ – ą║ąĖčüą╗ąŠčĆąŠą┤.
ą¤čĆąŠčüč鹥ą╣čłąĄąĄ ąŠą▒čŖčÅčüąĮąĄąĮąĖąĄ ą┐čĆąŠč鹥ą║ą░čÄčēąĖčģ ą┐čĆąŠčåąĄčüčüąŠą▓ ąĘą░ą║ą╗čÄčćą░ąĄčéčüčÅ ą▓ č鹊ą╝, čćč鹊 ąĖąŠąĮčŗ H+ (H3O+), čüąŠą┤ąĄčƹȹ░čēąĖąĄčüčÅ ą▓ ą▓ąŠą┤ąĄ, ą┐ąŠą┤čģąŠą┤čÅčé ą║ ą║ą░č鹊ą┤čā ąĖ čéą░ą╝ čĆą░ąĘčĆčÅąČą░čÄčéčüčÅ
H+ + e– = H0; H3O+ + e– = H0 + H2O
ą░ ąĖąŠąĮčŗ OH–, čéą░ą║ąČąĄ čüąŠą┤ąĄčƹȹ░čēąĖąĄčüčÅ ą▓ ą▓ąŠą┤ąĄ, ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ ą┐ąŠą┤čģąŠą┤čÅčé ą║ ą░ąĮąŠą┤čā ąĖ čéą░ą╝ čĆą░ąĘčĆčÅąČą░čÄčéčüčÅ
2OH– – 2e– = O + H2O
ąÉč鹊ą╝ąĮčŗąĄ ą▓ąŠą┤ąŠčĆąŠą┤ ąĖ ą║ąĖčüą╗ąŠčĆąŠą┤ (ą║ą░ąČą┤čŗą╣ ą┐ąŠ ąŠčéą┤ąĄą╗čīąĮąŠčüčéąĖ) čéčāčé ąČąĄ ą▓čüčéčāą┐ą░čÄčé ą▓ąŠ ą▓č鹊čĆąĖčćąĮčŗąĄ ą┐čĆąŠčåąĄčüčüčŗ, ąĮąĄ ąĖą╝ąĄčÄčēąĖąĄ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╣ ą┐čĆąĖčĆąŠą┤čŗ ąĖ ąĘą░ą║ą╗čÄčćą░čÄčēąĖąĄčüčÅ ą▓ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ ą┤ą▓čāčģą░č鹊ą╝ąĮčŗčģ ą╝ąŠą╗ąĄą║čāą╗
2H0 = H2; 2O0 = O2
ąĪčāą╝ą╝ą░čĆąĮąŠ čŹčéąĖ ą┐čĆąŠčåąĄčüčüčŗ ą╝ąŠąČąĮąŠ ąĘą░ą┐ąĖčüą░čéčī čéą░ą║:
ąÜą░č鹊ą┤ (ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ): 2H+ + 2e– = H2
ąÉąĮąŠą┤ (ąŠą║ąĖčüą╗ąĄąĮąĖąĄ): 4OH– – 4e– = O2 + 2H2O
4H+ + 4OH– = 2H2 + O2 + 2H2O; 4H3O+ + 4OH– = 2H2 + O2 + 6H2O
ąÆ čćąĖčüč鹊ą╣ ą▓ąŠą┤ąĄ ąĖ ąĮąĄą╣čéčĆą░ą╗čīąĮčŗčģ čĆą░čüčéą▓ąŠčĆą░čģ (pH = 7) ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÅ ąĖąŠąĮąŠą▓ H+ ąĖ OH– ąŠč湥ąĮčī ą╝ą░ą╗ą░ (1e-7 ą╝ąŠą╗čī/ą┤ą╝3 ą┤ą╗čÅ ą║ą░ąČą┤ąŠą│ąŠ ąĖąĘ ąĖąŠąĮąŠą▓ ą┐čĆąĖ 25*C). ąÆčüą╗ąĄą┤čüčéą▓ąĖąĄ čĆą░čüčģąŠą┤ą░ ąĖąŠąĮąŠą▓ H+ ąĖ OH– ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ ąĖčģ čüąŠą┤ąĄčƹȹ░ąĮąĖąĄ ą┤ąŠą╗ąČąĮąŠ ąĮąĄą┐čĆąĄčĆčŗą▓ąĮąŠ ą┐ąŠą┐ąŠą╗ąĮčÅčéčīčüčÅ ąĘą░ čüč湥čé ą░ą▓č鹊ą┤ąĖčüčüąŠčåąĖą░čåąĖąĖ (ą░ą▓č鹊ą┐čĆąŠč鹊ą╗ąĖąĘą░) ą▓ąŠą┤čŗ:
H2O Ōćä H+ + OH–; H+ + H2O = H3O+
H2O + H2O Ōćä OH– + H3O+
ąśąŠąĮčŗ H+ (H3O+), ąŠą▒čĆą░ąĘčāčÄčēąĖąĄčüčÅ ąĘą░ čüč湥čé ą░ą▓č鹊ą┐čĆąŠč鹊ą╗ąĖąĘą░ ą▓ąŠą┤čŗ, ąĮąĄą┐čĆąĄčĆčŗą▓ąĮąŠ čĆą░ąĘčĆčÅąČą░čÄčéčüčÅ ąĮą░ ą║ą░č鹊ą┤ąĄ, ą░ ąĖąŠąĮčŗ OH– ąĮąĄą┐čĆąĄčĆčŗą▓ąĮąŠ čĆą░ąĘčĆčÅąČą░čÄčéčüčÅ ąĮą░ ą░ąĮąŠą┤ąĄ, čćč鹊 ą┐čĆąĖą▓ąŠą┤ąĖčé ą║ ąŠą▒ąŠą│ą░čēąĄąĮąĖčÄ ąŠą║ąŠą╗ąŠą║ą░č鹊ą┤ąĮąŠą│ąŠ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ą░ ąĖąŠąĮą░ą╝ąĖ OH– ąĖ ąŠą║ąŠą╗ąŠą░ąĮąŠą┤ąĮąŠą│ąŠ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ą░ – ąĖąŠąĮą░ą╝ąĖ H+ (H3O+). ąØą░ ą┐čĆą░ą║čéąĖą║ąĄ čŹč鹊 ą╝ąŠąČąĮąŠ čāčüčéą░ąĮąŠą▓ąĖčéčī čü ą┐ąŠą╝ąŠčēčīčÄ ą╗ą░ą║ą╝čāčüą░ ąĖą╗ąĖ ą┤čĆčāą│ąŠą│ąŠ ą║ąĖčüą╗ąŠčéąĮąŠ-ąŠčüąĮąŠą▓ąĮąŠą│ąŠ ąĖąĮą┤ąĖą║ą░č鹊čĆą░. ą¤čĆąĖ ą┐čĆąŠčģąŠąČą┤ąĄąĮąĖąĖ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░ č湥čĆąĄąĘ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄčĆ ąĖąĘą▒čŗč鹊čćąĮčŗąĄ ąĖąŠąĮčŗ OH– (ąĖąĘ ąŠą║ąŠą╗ąŠą║ą░č鹊ą┤ąĮąŠą│ąŠ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ą░) ąĖ ąĖąŠąĮčŗ H+ (ąĖąĘ ąŠą║ąŠą╗ąŠą░ąĮąŠą┤ąĮąŠą│ąŠ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ą░) ą┐ąĄčĆąĄą╝ąĄčēą░čÄčéčüčÅ ąĮą░ą▓čüčéčĆąĄčćčā ą┤čĆčāą│ ą┤čĆčāą│čā ąĖ ą▓ąĮąŠą▓čī ąŠą▒čŖąĄą┤ąĖąĮčÅčÄčéčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čŗ ą▓ąŠą┤čŗ H2O.
ą¤ąŠčüą║ąŠą╗čīą║čā ą▓ąŠą┤ą░ – čüą╗ą░ą▒čŗą╣ 菹╗ąĄą║čéčĆąŠą╗ąĖčé, ą▓ ąĖąŠąĮąĮčŗčģ čāčĆą░ą▓ąĮąĄąĮąĖčÅčģ ą┐ąŠą╗ąŠąČąĄąĮąŠ ąĘą░ą┐ąĖčüčŗą▓ą░čéčī ąĮąĄ ąĄąĄ ąĖąŠąĮčŗ, ą░ ą╝ąŠą╗ąĄą║čāą╗čŗ ą▓ąŠą┤čŗ. ąśą╝ąĄąĮąĮąŠ ą╝ąŠą╗ąĄą║čāą╗čŗ (ą░ ąĮąĄ ąĮąĄą▒ąŠą╗čīčłąĖąĄ ą║ąŠą╗ąĖč湥čüčéą▓ą░ ąĖąŠąĮąŠą▓ H+ ąĖ OH–) ą▓ ąŠčüąĮąŠą▓ąĮąŠą╝ čāčćą░čüčéą▓čāčÄčé ą▓ ą┐ąŠą╗čāą┐čĆąŠčåąĄčüčüą░čģ ąĮą░ 菹╗ąĄą║čéčĆąŠą┤ą░čģ:
ąÜą░č鹊ą┤ (ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĄ): 2H2O + 2e– = H2 + 2OH–
ąÉąĮąŠą┤ (ąŠą║ąĖčüą╗ąĄąĮąĖąĄ): 2H2O – 4e– = O2 + 4H+
ąśąĘ čŹčéąĖčģ ą┐ąŠą╗čāčĆąĄą░ą║čåąĖą╣ čéą░ą║ąČąĄ čüą╗ąĄą┤čāąĄčé, čćč鹊 čā ą║ą░č鹊ą┤ą░ ą▓ąŠąĘčĆą░čüčéą░ąĄčé ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÅ ąĖąŠąĮąŠą▓ OH–, ą░ čā ą░ąĮąŠą┤ą░ – ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÅ ąĖąŠąĮąŠą▓ H+ (H3O+), ą░ čé.ą║. ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠąĄ čāą▓ąĄą╗ąĖč湥ąĮąĖąĄ ąŠą▒ąĄąĖčģ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖą╣ ą▓ ą▓ąŠą┤ąĄ ąĮąĄą▓ąŠąĘą╝ąŠąČąĮąŠ ąĖąĘ-ąĘą░ čäąĖą║čüąĖčĆąŠą▓ą░ąĮąĮąŠą│ąŠ čüąŠčüč鹊čÅąĮąĖčÅ ąĖąŠąĮąĮąŠą│ąŠ čĆą░ą▓ąĮąŠą▓ąĄčüąĖčÅ (K = [H3O+][OH–] = 1e-14 ą┐čĆąĖ 25*ąĪ), č鹊 čŹčéąĖ ąĖąŠąĮčŗ ąŠą▒čŖąĄą┤ąĖąĮčÅčÄčéčüčÅ ą▓ ą╝ąŠą╗ąĄą║čāą╗čŗ H2O.┬Ā ą×čéčüčÄą┤ą░ ąŠą║ąŠąĮčćą░č鹥ą╗čīąĮąŠąĄ čüčāą╝ą╝ą░čĆąĮąŠąĄ čāčĆą░ą▓ąĮąĄąĮąĖąĄ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ą▓ąŠą┤čŗ čüą╗ąĄą┤čāąĄčé ąĘą░ą┐ąĖčüčŗą▓ą░čéčī čéą░ą║:
H2O ŌåÆ 2H2 + O2
ą¤čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ ą▓ąŠą┤ąĮčŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ ą▓ ą║ą░č鹊ą┤ąĮąŠą╝ ą▓ąŠčüčüčéą░ąĮąŠą▓ą╗ąĄąĮąĖąĖ ąĖ ą░ąĮąŠą┤ąĮąŠą╝ ąŠą║ąĖčüą╗ąĄąĮąĖąĖ ą▓ ą┐čĆąĖąĮčåąĖą┐ąĄ ą╝ąŠą│čāčé čāčćą░čüčéą▓ąŠą▓ą░čéčī ąĖąŠąĮčŗ ą▓ąŠą┤čŗ (H+ ąĖ OH–) ąĖ ąĖąŠąĮčŗ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░. ą×ą┤ąĮąŠąĖą╝ąĄąĮąĮčŗąĄ ą┐ąŠ ąĘąĮą░ą║čā ąĖąŠąĮčŗ ą▓ąŠą┤čŗ ąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ ą║ąŠąĮą║čāčĆąĖčĆčāčÄčé ą╝ąĄąČą┤čā čüąŠą▒ąŠą╣ ąĖ čĆą░ąĘčĆčÅąČą░čéčīčüčÅ ą▒čāą┤ąĄčé č鹊čé ą║ą░čéąĖąŠąĮ (ąĮą░ ą║ą░č鹊ą┤ąĄ) ąĖ č鹊čé ą░ąĮąĖąŠąĮ (ąĮą░ ą░ąĮąŠą┤ąĄ), ą║ąŠč鹊čĆąŠą╝čā ąŠčéą▓ąĄčćą░ąĄčé ą▒ąŠą╗ąĄąĄ ąĮąĖąĘą║ąŠąĄ ą┐ąŠ ąĘąĮą░č湥ąĮąĖčÄ ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ čĆą░ąĘčĆčÅą┤ą░.
ąöą╗čÅ čĆą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮąĮčŗčģ ą║ą░čéąĖąŠąĮąŠą▓ ąĖą╝ąĄąĄčéčüčÅ čüą╗ąĄą┤čāčÄčēąĖą╣ čĆčÅą┤ čĆą░ąĘčĆčÅąČą░ąĄą╝ąŠčüčéąĖ ąĮą░ ą║ą░č鹊ą┤ąĄ:
K+ Na+ Mg2+ Al3+ | H+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ | Cu2+ Ag+ Au+
I ą│čĆčāą┐ą┐ą░ ą║ą░čéąĖąŠąĮąŠą▓ – ąĮąĄą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ, ą║ąŠč鹊čĆčŗąĄ čéčĆčāą┤ąĮąŠ čĆą░ąĘčĆčÅąČą░čÄčéčüčÅ, ą┐ąŠčŹč鹊ą╝čā ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ ą▓ąŠą┤ąĮčŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ čüąŠą┤ąĄčƹȹ░čēąĖčģ čāą║ą░ąĘą░ąĮąĮčŗąĄ ą║ą░čéąĖąŠąĮčŗ ą▓ ą┐ąĄčĆą▓čāčÄ ąŠč湥čĆąĄą┤čī ąĮą░ ą║ą░č鹊ą┤ąĄ čĆą░ąĘčĆčÅąČą░čÄčéčüčÅ ąĖąŠąĮčŗ H+ ąĖ ą▓ ą║ą░č鹊ą┤ąĮčŗčģ ą┐čĆąŠą┤čāą║čéą░čģ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ č鹊ą╗čīą║ąŠ ą▓ąŠą┤ąŠčĆąŠą┤ H2:
K+ Na+ Mg2+ Al3+
II ą│čĆčāą┐ą┐ą░ ą║ą░čéąĖąŠąĮąŠą▓ – ą╝ąĄąĮąĄąĄ ąĮąĄą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ, ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ čĆą░ąĘčĆčÅą┤ą░ ą║ąŠč鹊čĆčŗčģ ą┐ąŠ ąĘąĮą░č湥ąĮąĖčÄ ąĮą░čģąŠą┤ąĖčéčüčÅ ą▓ą▒ą╗ąĖąĘąĖ ąĮą░ą┐čĆčÅąČąĄąĮąĖčÅ čĆą░ąĘčĆčÅą┤ą░ ąĖąŠąĮąŠą▓ ą▓ąŠą┤ąŠčĆąŠą┤ą░, ą┐ąŠčŹč鹊ą╝čā ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ ą▓ąŠą┤ąĮčŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ čüąŠą┤ąĄčƹȹ░čēąĖčģ čāą║ą░ąĘą░ąĮąĮčŗąĄ ą║ą░čéąĖąŠąĮčŗ ąĮą░ ą║ą░č鹊ą┤ąĄ ą▒čāą┤čāčé čĆą░ąĘčĆčÅąČą░čéčīčüčÅ ąĖ ą║ą░čéąĖąŠąĮčŗ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąĖ ą║ą░čéąĖąŠąĮčŗ ą▓ąŠą┤ąŠčĆąŠą┤ą░, ą▓ ą║ą░č鹊ą┤ąĮčŗčģ ą┐čĆąŠą┤čāą║čéą░čģ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ąŠą▒čĆą░ąĘčāčÄčéčüčÅ ąĖ ą╝ąĄčéą░ą╗ą╗čŗ ąĖ ą▓ąŠą┤ąŠčĆąŠą┤ H2:
H+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+
III ą│čĆčāą┐ą┐ą░ ą║ą░čéąĖąŠąĮąŠą▓ – ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ, ąĮą░ą┐čĆčÅąČąĄąĮąĖąĄ čĆą░ąĘčĆčÅą┤ą░ ą║ąŠč鹊čĆčŗčģ ą╝ąĄąĮčīčłąĄ ąĮą░ą┐čĆčÅąČąĄąĮąĖčÅ čĆą░ąĘčĆčÅą┤ą░ H+, ą┐ąŠčŹč鹊ą╝čā ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ ą▓ąŠą┤ąĮčŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓ čüąŠą┤ąĄčƹȹ░čēąĖčģ čāą║ą░ąĘą░ąĮąĮčŗąĄ ą║ą░čéąĖąŠąĮčŗ ąĮą░ ą║ą░č鹊ą┤ąĄ ą▒čāą┤čāčé čĆą░ąĘčĆčÅąČą░čéčīčüčÅ č鹊ą╗čīą║ąŠ ą║ą░čéąĖąŠąĮčŗ ą╝ąĄčéą░ą╗ą╗ąŠą▓:
Cu2+ Ag+ Au+
ąÜą░čéąĖąŠąĮčŗ I ą│čĆčāą┐ą┐čŗ ą╝ąŠąČąĮąŠ ą▓čŗą┤ąĄą╗ąĖčéčī ą▓ ą▓ąĖą┤ąĄ ą╝ąĄčéą░ą╗ą╗ą░ čü ą┐ąŠą╝ąŠčēčīčÄ čŹą╗ąĄą║čéčĆąŠą╗ąĖąĘą░ č鹊ą╗čīą║ąŠ ąĖąĘ čĆą░čüą┐ą╗ą░ą▓ą░, ą│ą┤ąĄ ąĮąĄčé ą║ąŠąĮą║čāčĆąĄąĮčåąĖąĖ čü ąĖąŠąĮą░ą╝ąĖ H+, ąĖą╗ąĖ ą┐čĆąĖ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ąĮąĖąĖ ąČąĖą┤ą║ąŠčĆčéčāčéąĮąŠą│ąŠ 菹╗ąĄą║čéčĆąŠą┤ą░ (ą╝ąĄčéą░ą╗ą╗čŗ ąŠą▒čĆą░ąĘčāčÄčé čüąŠ čĆčéčāčéčīčÄ ą░ą╝ą░ą╗čīą│ą░ą╝čŗ).
ąĀą░ąĘą╗ąĖčćąĮąŠ ą┐ąŠą╗ąŠąČąĄąĮąĖąĄ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą▓ čĆčÅą┤čā čĆą░ąĘčĆčÅąČą░ąĄą╝ąŠčüčéąĖ ą║ą░čéąĖąŠąĮąŠą▓ ąĖ ą▓ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╝ čĆčÅą┤čā ąĮą░ą┐čĆčÅąČąĄąĮąĖą╣ ą╝ąŠąČąĮąŠ ąŠą▒čŖčÅčüąĮąĖčéčī čü ą┐ąŠą╝ąŠčēčīčÄ čāčĆą░ą▓ąĮąĄąĮąĖčÅ ąØąĄčĆąĮčüčéą░.
ąĪčéą░ąĮą┤ą░čĆčéąĮčŗą╣ ą┐ąŠč鹥ąĮčåąĖą░ą╗ ą▓ąŠą┤ąŠčĆąŠą┤ąĮąŠą│ąŠ 菹╗ąĄą║čéčĆąŠą┤ą░ H+/H0, čĆą░ą▓ąĮčŗą╣ E0 = 0,00 (ą┐ąŠčŹč鹊ą╝čā ą▓ąŠą┤ąŠčĆąŠą┤ ą┐ąŠčüčéą░ą▓ą╗ąĄąĮ ą▓ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╝ čĆčÅą┤čā ąĮą░ą┐čĆčÅąČąĄąĮąĖą╣ ą╝ąĄąČą┤čā Pb ąĖ Cu), ą┤ąĄą╣čüčéą▓ąĖč鹥ą╗ąĄąĮ ą┤ą╗čÅ čĆą░čüčéą▓ąŠčĆąŠą▓ čü ą░ą║čéąĖą▓ąĮąŠčüčéčīčÄ ąĖąŠąĮąŠą▓ H+ 1 ą╝ąŠą╗čī/ą┤ą╝3, čćč鹊 čüąŠąŠčéą▓ąĄčéčüčéą▓čāąĄčé pH = 0. ąöą╗čÅ ą▓ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ ąĮąĄą║ąŠč鹊čĆąŠą╣ čüąŠą╗ąĖ, ąĄčüą╗ąĖ ąŠąĮą░ ąĮąĄ ą┐ąŠą┤ą▓ąĄčĆą│ą░ąĄčéčüčÅ ą│ąĖą┤čĆąŠą╗ąĖąĘčā, ą║ą░ą║ ąĖ ą┤ą╗čÅ čćąĖčüč鹊ą╣ ą▓ąŠą┤čŗ, pH = 7. ąÉą║čéąĖą▓ąĮąŠčüčéčī ąĖąŠąĮąŠą▓ H+ ą▓ąĄčüčīą╝ą░ ąĮąĖąĘą║ą░ ąĖ čüąŠčüčéą░ą▓ą╗čÅąĄčé 1e-7 ą╝ąŠą╗čī/ą┤ą╝3. ą¤ąŠč鹥ąĮčåąĖą░ą╗ ą┐ą░čĆčŗ H+/H2, čĆą░čüčüčćąĖčéą░ąĮąĮčŗą╣ ą┐ąŠ čāčĆą░ą▓ąĮąĄąĮąĖčÄ ąØąĄčĆąĮčüčéą░ (z = 1, T = 298,15K = 25*ąĪ) čüąŠčüčéą░ą▓ą╗čÅąĄčé:
E = E0 + (RT) / (Fz) * ln([H+]) = 0,000 + (8,31441 * 298,15) / (96484,56 * 1) * ln(1e-7) = -0,4141 B
ąĪą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ, ąĄčüą╗ąĖ ą┐ąŠą│čĆčāąĘąĖčéčī ąĮąĄą║ąŠč鹊čĆčŗą╣ ą╝ąĄčéą░ą╗ą╗ ą▓ ąĮąĄą╣čéčĆą░ą╗čīąĮčŗą╣ čĆą░čüčéą▓ąŠčĆ ą║ą░ą║ąŠą╣-ą╗ąĖą▒ąŠ čüąŠą╗ąĖ čü ą░ą║čéąĖą▓ąĮąŠčüčéčīčÄ 1 ą╝ąŠą╗čī/ą┤ą╝3 ą┐čĆąĖ 25*ąĪ, čĆąĄą░ą╗čīąĮčŗą╣ 菹╗ąĄą║čéčĆąŠą┤ąĮčŗą╣ ą┐ąŠč鹥ąĮčåąĖą░ą╗ čŹč鹊ą│ąŠ ą╝ąĄčéą░ą╗ą╗ą░ čāą▓ąĄą╗ąĖčćąĖą▓ą░ąĄčéčüčÅ ąĮą░ 0,4141 ąÆ. ą¤ąŠčŹč鹊ą╝čā ąĖąĘ čéą░ą║ąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ ą╝ąŠą│čāčé ą▒čŗčéčī 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąĖ ąŠčüą░ąČą┤ąĄąĮčŗ ą▓čüąĄ ą╝ąĄčéą░ą╗ą╗čŗ, ąĘąĮą░č湥ąĮąĖčÅ E0 ą║ąŠč鹊čĆčŗčģ ą▓ ą┐ą░čĆą░čģ Men+/Me0 ą▒ąŠą╗čīčłąĄ, č湥ą╝ -0,4141 ąÆ. ąŁč鹊 ą┐ąŠąĘą▓ąŠą╗čÅąĄčé ą┐čĆąĖčćąĖčüą╗ąĖčéčī ą║ čéą░ą║ąĖą╝ ą╝ąĄčéą░ą╗ą╗ą░ą╝, ą║čĆąŠą╝ąĄ čüč鹊čÅčēąĖčģ ą▓ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╝ čĆčÅą┤čā ąĮą░ą┐čĆčÅąČąĄąĮąĖą╣ ą┐čĆą░ą▓ąĄąĄ ą▓ąŠą┤ąŠčĆąŠą┤ą░ (Cu, Ag, Pt, Au), čéą░ą║ąČąĄ Pb, Sn, Ni, čģąŠčéčÅ ąŠąĮąĖ čüč鹊čÅčé ą╗ąĄą▓ąĄąĄ ą▓ąŠą┤ąŠčĆąŠą┤ą░. ąĪą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ, ą▓ čĆčÅą┤čā čĆą░ąĘčĆčÅąČą░ąĄą╝ąŠčüčéąĖ ą║ą░čéąĖąŠąĮąŠą▓ ąĖąŠąĮ H+ ąĘą░ąĮąĖą╝ą░ąĄčé ą┐ąŠą╗ąŠąČąĄąĮąĖąĄ ąĘąĮą░čćąĖč鹥ą╗čīąĮąŠ ą╗ąĄą▓ąĄąĄ, č湥ą╝ ą▓ 菹╗ąĄą║čéčĆąŠčģąĖą╝ąĖč湥čüą║ąŠą╝ čĆčÅą┤čā ąĮą░ą┐čĆčÅąČąĄąĮąĖą╣.
ą×ą┤ąĮą░ą║ąŠ ąĖ ą▓ čĆčÅą┤čā čĆą░ąĘčĆčÅąČą░ąĄą╝ąŠčüčéąĖ čüą╗ąĄą┤ąŠą▓ą░ą╗ąŠ ą▒čŗ čāą║ą░ąĘą░čéčī ąĖąŠąĮ H+ ą╝ąĄąČą┤čā Fe2+ ąĖ Ni2+, ąĮąŠ ąŠąĮ ą┐ąŠčüčéą░ą▓ą╗ąĄąĮ ą╝ąĄąČą┤čā Al3+ ąĖ Zn2+ (čé.ąĄ. ąĄčēąĄ ą╗ąĄą▓ąĄąĄ). ąöąĄą╣čüčéą▓ąĖč鹥ą╗čīąĮąŠ, ąĮą░ ą┐čĆą░ą║čéąĖą║ąĄ čāą┤ą░ąĄčéčüčÅ ąŠčüą░ą┤ąĖčéčī 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąĖ ąĖąĘ čĆą░čüčéą▓ąŠčĆąŠą▓ čéą░ą║ąĖąĄ ą╝ąĄčéą░ą╗ą╗čŗ, ą║ą░ą║ Fe Cr Zn. ąŁč鹊 ąŠą▒čŖčÅčüąĮčÅąĄčéčüčÅ č鹥ą╝, čćč鹊 ąŠąČąĖą┤ą░ąĄą╝ąŠą╝čā ą▓čŗą┤ąĄą╗ąĄąĮąĖčÄ ąĮą░ ą║ą░č鹊ą┤ąĄ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą│ąŠ ą▓ąŠą┤ąŠčĆąŠą┤ą░ ą┐čĆąĄą┐čÅčéčüčéą▓čāąĄčé čÅą▓ą╗ąĄąĮąĖąĄ ą┐ąĄčĆąĄąĮą░ą┐čĆčÅąČąĄąĮąĖčÅ.
ąöą╗čÅ čĆą░čüą┐čĆąŠčüčéčĆą░ąĮąĄąĮąĮčŗčģ ą░ąĮąĖąŠąĮąŠą▓ ąĖą╝ąĄąĄčéčüčÅ čĆčÅą┤ čĆą░ąĘčĆčÅąČą░ąĄą╝ąŠčüčéąĖ ąĮą░ ą░ąĮąŠą┤ąĄ:
SO42- NO3– ąĖ ą┤čĆ. ą║ąĖčüą╗ąŠčĆąŠą┤čüąŠą┤ąĄčƹȹ░čēąĖąĄ ą║ąĖčüą╗ąŠčéąĮčŗąĄ ąŠčüčéą░čéą║ąĖ | OH– Cl– Br– I–
ąÜąĖčüą╗ąŠčĆąŠą┤čüąŠą┤ąĄčƹȹ░čēąĖąĄ ą║ąĖčüą╗ąŠčéąĮčŗąĄ ąŠčüčéą░čéą║ąĖ čÅą▓ą╗čÅčÄčéčüčÅ čéčĆčāą┤ąĮąŠ čĆą░ąĘčĆčÅąČą░ąĄą╝čŗą╝ąĖ, ą┐ąŠčŹč鹊ą╝čā ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ ą▓ąŠą┤ąĮčŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ čüąŠą┤ąĄčƹȹ░čēąĖčģ čŹčéąĖ ą░ąĮąĖąŠąĮčŗ, ą▓ ą┐ąĄčĆą▓čāčÄ ąŠč湥čĆąĄą┤čī čĆą░ąĘčĆčÅąČą░čÄčéčüčÅ ąĖąŠąĮčŗ OH– ąĖ ą▓ ą┐čĆąŠą┤čāą║čéą░čģ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą║ąĖčüą╗ąŠčĆąŠą┤.
ąĢčüą╗ąĖ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ ąĮą░čģąŠą┤čÅčéčüčÅ ąĖąŠąĮčŗ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąĮąĄčüą║ąŠą╗čīą║ąĖčģ ą▓ąĖą┤ąŠą▓, č鹊 ąŠąĮąĖ čĆą░ąĘčĆčÅąČą░čÄčéčüčÅ ą▓ ą┐ąŠčĆčÅą┤ą║ąĄ ąŠčé ą▒ąŠą╗ąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą║ ą╝ąĄąĮąĄąĄ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą╝čā.
ąĢčüą╗ąĖ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ ąĮą░čģąŠą┤čÅčéčüčÅ ą╗ąĄą│ą║ąŠ čĆą░ąĘčĆčÅąČą░ąĄą╝čŗąĄ ą░ąĮąĖąŠąĮčŗ, č鹊 čĆą░ąĘčĆčÅąČąĄąĮąĖąĄ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą▓ ą┐ąŠčĆčÅą┤ą║ąĄ čüą┐čĆą░ą▓ą░ ąĮą░ą╗ąĄą▓ąŠ, ąĮą░ą┐čĆąĖą╝ąĄčĆ ąŠčé ąĖąŠą┤ą░ ą║ čģą╗ąŠčĆčā.
ąĪ ą┐ąŠą╝ąŠčēčīčÄ čĆčÅą┤ąŠą▓ čĆą░ąĘčĆčÅąČą░ąĄą╝ąŠčüčéąĖ ą╗ąĄą│ą║ąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĖčéčī, ą║ą░ą║ąĖą╝ąĖ ą▒čāą┤čāčé ą┐čĆąŠą┤čāą║čéčŗ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ą┤ą╗čÅ ą▓ąŠą┤ąĮčŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ čĆą░ąĘą╗ąĖčćąĮčŗčģ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓. ą×ą┤ąĮą░ą║ąŠ, ą┐ąŠą╝ąĖą╝ąŠ ą┐čĆąŠą┤čāą║č鹊ą▓ ąĮą░ ą║ą░č鹊ą┤ąĄ ąĖ ąĮą░ ą░ąĮąŠą┤ąĄ, čāą║ą░ąĘą░ąĮąĮčŗčģ ąĮąĖąČąĄ, ąŠą▒čŗčćąĮąŠ ą▓ ą║ąŠąĮąĄčćąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ąŠą▒čĆą░ąĘčāąĄčéčüčÅ čéčĆąĄčéąĖą╣ ą┐čĆąŠą┤čāą║čé (čćą░čüč鹊 ąĮąĄ ą╝ąĄąĮąĄąĄ ą┐čĆąŠą╝čŗčłą╗ąĄąĮąĮąŠ ą▓ą░ąČąĮčŗą╣). ąóą░ą║, ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ CuSO4, ą║čĆąŠą╝ąĄ Cu ąĖ O2, ą▓ ą║ąŠąĮąĄčćąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ ą┐ąŠą╗čāčćą░čÄčé H2SO4, ą░ ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ NaCl, ą║čĆąŠą╝ąĄ H2 ąĖ Cl2, ąŠą▒čĆą░ąĘčāąĄčéčüčÅ čéą░ą║ąČąĄ NaOH. ą¤čĆąĖ čŹč鹊ą╝ ąĖčüčģąŠą┤ąĮčŗą╣ 菹╗ąĄą║čéčĆąŠą╗ąĖčé ą╝ąŠąČąĄčé čĆą░čüčģąŠą┤ąŠą▓ą░čéčīčüčÅ ą┐čĆąĖ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘąĄ ąĄą│ąŠ ą▓ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ ą┐ąŠą╗ąĮąŠčüčéčīčÄ (HCl, CuCl2) ąĖą╗ąĖ čćą░čüčéąĖčćąĮąŠ (CuSO4, NaCl), ąĮąŠ ą╝ąŠąČąĄčé ąĖ ąĮąĄ čĆą░čüčģąŠą┤ąŠą▓ą░čéčīčüčÅ ą▓ąŠą▓čüąĄ (H2SO4, HNO3, NaOH, Na2SO4).
ą¤čĆąĖą╝ąĄčĆčŗ.
|
ąĢą╗ąĄą║čéčĆąŠą╗ąĖčé |
ą¤čĆąŠą┤čāą║čéčŗ |
|
|
ąÜą░č鹊ą┤ |
ąÉąĮąŠą┤ |
|
|
HCl |
H2 |
Cl2 |
|
H2SO4 |
H2 |
O2 |
|
HNO3 |
H2 |
O2 |
|
NaOH |
H2 |
O2 |
|
CuCl2 |
Cu |
Cl2 |
|
CuSO4 |
Cu |
O2 |
|
NiSO4 |
Ni, H2 |
O2 |
|
NaCl |
H2 |
Cl2 |
|
Na2SO4 |
H2 |
O2 |
ąöą╗čÅ ą╗čāčćčłąĄą│ąŠ ą┐ąŠąĮąĖą╝ą░ąĮąĖčÅ ąŠą┐ąĖčüą░ąĮąĮčŗčģ ą┐čĆąŠčåąĄčüčüąŠą▓ čĆą░čüčüą╝ąŠčéčĆąĖč鹥 ąĖ čĆą░ąĘą▒ąĄčĆąĖč鹥čüčī ą▓ ą┐čĆąĖą▓ąĄą┤ąĄąĮąĮčŗčģ ąĮąĖąČąĄ čüčģąĄą╝ą░čģ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ąĮąĄą║ąŠč鹊čĆčŗčģ 菹╗ąĄą║čéčĆąŠą╗ąĖč鹊ą▓.
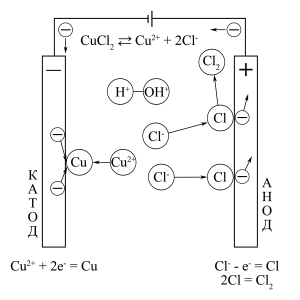
ąĪčģąĄą╝ą░ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ą▓ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ CuCl2
ąĪčģąĄą╝ą░ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ą▓ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ CuSO4

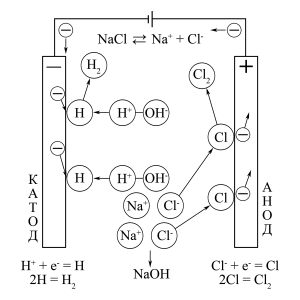
ąĪčģąĄą╝ą░ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ą▓ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ NaCl
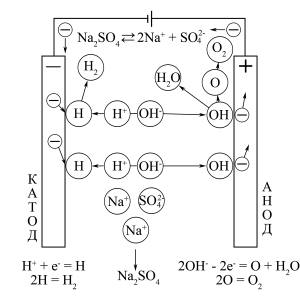
ąĪčģąĄą╝ą░ 菹╗ąĄą║čéčĆąŠą╗ąĖąĘą░ ą▓ąŠą┤ąĮąŠą│ąŠ čĆą░čüčéą▓ąŠčĆą░ 菹╗ąĄą║čéčĆąŠą╗ąĖčéą░ Na2SO4