Алкены (олефины, этиленовые углеводороды) CnH2n – это углеводороды, в молекуле которых содержатся атомы углерода, образующие с соседними атомами углерода двойные химические связи (-C=C-).
Родоначальником алкенов является этилен H2C=CH2.
Алкены в природе встречаются в некоторых растениях, например этилен – является растительным гормоном. Мускалур или цис-трикозен-9 – гормон мухи. Алкены входят в состав нефти. В чистом виде из нефти выделены углеводороды от C6H12 до C13H26.
Изомерия алкенов начинается с C4 члена гомологического ряда – бутена. Наряду с изомерией углеродного скелета в ряду алкенов наблюдается структурная изомерия обусловленная положением двойной связи в углеродной цепи; а также пространственная (геометрическая) изомерия – цис-транс-изомерия.
Номенклатура алкенов. Названия алкенов образуют из названий аналогично построенных алканов, заменяя суффиксы -ан- на -ен-; цифрой показывают положение двойной связи (после какого по счету атома углерода находится двойная связь). За главную углеродную цепь принимают самую длинную цепь содержащую двойную связь. Нумерацию углеродных атомов начинают с того конца цепи, к которому двойная связь расположена ближе.
Примеры
4-метил-2-пентен
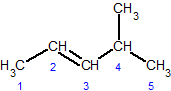
транс-3,4-диметил-3-гексен
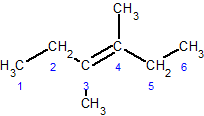
цис-3,4-диметил-3-гексен
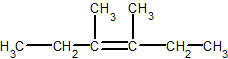
4-метил-4-этил-1-гексен
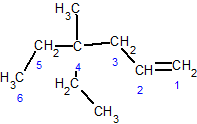
2,2,6-триметил-3-этил-4-октен
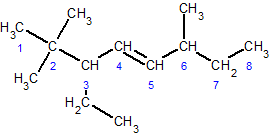
Непредельные углеводородные радикалы называют, добавляя к корню суффикс -енил: этенил H3C-CH=, 1-пропенил H3C-CH=CH-, 2-пропенил H2C=CH-CH2-. Иногда используют некоторые эмпирические названия: винил H2C=CH-, аллил H2C=CH-CH2-, изопропенил H2C=C(-)-CH3, кротил H3C-CH=CH-CH2-.
Способы получения алкенов
1. Первые четыре члена ряда олефинов получают в технике в чистом состоянии разгонкой под давлением или при пониженной температуре газообразной части продуктов крекинга нефтяных дистиллятов, газов коксования (этилен, пропилен).
2. Дегидрогенизация алканов с применением специальным образом подготовленного катализатора Cr2O3, при 300*С:
2H3C-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H3C-CH=CH-CH3 + 2H2
3. Дегидратация (отщепление воды) спиртов с применением катализатора (различные кислоты – серная, фосфорная, кислые соли KHSO4, оксид фосфора(V), Al2O3 и соли алюминия):
H-CH2-CH2–OH → H2C=CH2 + H2O
Условия дегидратации зависят от природы спирта. Легче всех отщепляют воду третичные спирты (часто уже при перегонке).
Порядок отщепления воды от спиртов (в большинстве случаев) определяет правило Зайцева: при образовании воды наиболее легко отщепляется водород от наименее гидрогенизированного атома углерода:
H3C-CH(OH)-C*H(CH3)-CH3 → H3C-CH=C*(CH3)-CH3 + H2O
“*” обозначен наименее гидрогенизированный атом углерода.
В процессе дегидратации двойная связь часто перемещается и строение полученного углеводорода не соответствует строению исходного спирта:
3H3C-CH(CH3)-CH2-CH2OH → H3C-CH(CH3-CH=CH2 + H3C-C(CH3)=CH-CH3 + H2C=C(CH3)-CH2-CH3
4. Отщепление галогеноводородов или галогенов от галогенопроизводных (дегидрогалогенирование):
H-CH2-CH2–Cl + KOH → H2C=CH2 + KCl + H2O
Для осуществления реакции применяют твердую измельченную щелочь, органические основания (диметиланилин, хинолин), используют также спиртовой раствор KOH или NaOH. Однако в случае использования спиртового раствора щелочи, возможна побочная реакция с образованием простых эфиров:
H3C-CH2-OH + KOH ⇄ H3C-CH2-O-K + H2O
H3C-CH2-Cl + K-O-CH2-CH3 → H3C-CH2-O-CH2-CH3 + KCl
Направление дегидрогалогенирования соответствует правилу Зайцева:
H3C-CHBr–HCH-CH3 → H3C-CH=CH-CH3 + HBr
Для получения алкенов иногда используют метод отщепления галогенов от дигалогенпроизводных с атомами галогена у соседних атомов углерода, с помощью цинковой пыли в водно-спиртовой среде:
Br-CH2-CH2–Br + Zn → H2C=CH2 + ZnBr2
Под влиянием галогенида цинка высока вероятность изомеризации образующегося алкена. Кроме цинка применяют иодид натрия в метаноле или ацетоне, соли хрома(II), тиосульфат натрия в диметилсульфоксиде, литий-алюминий-гидрид.
Данный метод применяют для защиты двойной связи от участия в других реакциях; сначала алкен насыщают бромом, проводят другие химические реакции, затем регенерируют двойные связи.
5. В некоторых случаях ацетиленовые углеводороды с определенным строением получить легче, чем отвечающие им по строению олефины. В таких случаях последние получают частичным “селективным” гидрированием ацетиленовых углеводородов, например над палладиевым катализатором:
HC≡CH + H2 → H2C=CH2
6. Для синтеза алкенов с крайней двойной связью используют реакция Виттига:
[(C6H5)3PCH3]Br + C4H9Li → (C6H5)3Pδ+=Cδ-H2 + C4H10 + LiBr
(C6H5)3Pδ+=Cδ-H2-C4H9 + δ-O=Cδ+=H-C4H9 → (C3H5)3P=O + H2C=CH-C4H9
Физические свойства алкенов
Первые четыре члена гомологического ряда этиленовых углеводородов – газы. Алкены с числом углеродных атомов от 5 до 17 при нормальных условиях находятся в жидком агрегатном состоянии. Алкены с числом углеродных атомов 18 и более, при н.у. находятся в твердом агрегатном состоянии.
Алкены с нормальной цепью кипят при более высокой температуре, чем их изомеры с разветвленной цепью. Перемещение двойной связи в центр молекулы вызывает повышение температуры кипения олефина. цис-Изомеры обычно кипят при более высокой температуре, чем транс-изомеры. Перемещение двойной связи в центр молекулы повышает температуру плавления. транс-Изомеры плавятся при более высокой температуре, чем цис-изомеры.
Плотность алкенов меньше единицы, но, больше, чем плотность соответствующих алканов. В гомологическом ряду плотность алкенов увеличивается. Для алкенов характерны более высокие показатели преломления света, чем для алканов.
Растворимость алкенов в воде незначительна, но выше чем у алканов. Алкены могут растворяться в растворах некоторых солей тяжелых металлов, образуя с ними комплексные соединения (например, в растворах Cu2Cl2).
Химические свойства алкенов
Главным структурным элементом, определяющим реакционную способность алкенов, является двойная связь, представляющая собой сочетание σ- и π-связей (sp2-гибридизация). Для алкенов наиболее типичны реакции присоединения (реакция электрофильного присоединения AE). Также для алкенов характерны реакции замещения (наиболее легко замещается водород у α-углеродного атома).
Гидрирование алкенов. Алкены присоединяют водород в присутствии катализаторов (Pt, Pd, Ni):
H2C=CH2 + H2 → H3C-CH3
Для гидрирования необходима адсорбция молекулы олефина на катализаторе по двойной связи, олефины гидрируются тем легче, чем меньше заместителей имеется у двойной связи (правило Лебедева С.В.).
Галогенирование алкенов. Алкены легко присоединяют галогены:
H2C=CH2 + Br2 → BrH2C-CH2Br
Скорость реакции галогенирования алкенов зависит от природы галогена и строения алкена. Фтор реагирует с алкенами с воспламенением; иод – медленно на свету.
Чем больше заместителей у двойной связи, тем легче проходит реакция галогенирования алкенов.
Галогенирование алкенов проходит по радикальному механизму или по ионному электрофильному механизму. При радикальном галогенировании алкенов, под дейсвием света или температуры происходит образование галогенид-радикалов, которые, вначале, присоединяются к наиболее доступному атому углерода с двойной связью с образованием радикала и дальнейшим развитием радикальной реакции.
Чаще происходит присоединение по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя π-комплекс. Затем отделяется отрицательный ион галогена. К образовавшемуся карбониевому или бромониевому катиону присоединяется отрицательный ион галогена:

Реакция алкенов с галогенами служит для качественного и количественного определения алкенов в смесях. По количеству поглощенного брома можно установить наличие алкена.
Гидрогалогенирование алкенов. Алкены присоединяют галогеноводороды:
H2C=CH2 + HCl → H3C-CH2Cl
Наиболее легко реагирует иодистый водород. Фтористый водород (особенно в присутствии влаги) присоединяется с одновременной полимеризацией алкена.
Присоединение галогеноводородов к несимметричным алкенам происходит по следующему правилу: водород присоединяется к наиболее гидрогенизированному атому углерода (правило Марковникова В.В.).
Правило Марковникова соблюдается только при ионном (гетеролитическом) механизме присоединения галогеноводорода.
При радикальном (гомолитическом) механизме присоединения галогеноводорода – присоединение происходит в обратном порядке: водород присоединяется к наименее гидрогенизированному атому углерода с двойной связью (перекисный эффект Караша). Радикальное присоединение галогеноводородов к алкенам наблюдается в присутствии пероксидов или кислорода.
Гипогалогенирование алкенов. Присоединение к алкенам гипогалогенитных кислот и их эфиров происходит по правилу Марковникова: электроотрицательный гидроксил направляется к наименее гидрогенизированному атому углерода:
H3C-CH=CH2 + HO-Cl+ → H3C-CHOH-CH2Cl
Для реакции не обязательно использовать готовый раствор хлорноватистой кислоты. Можно взять хлор и воду:
H2C=CH2 + Cl2 + H2O → H2CCl-CH2OH + HCl
Гидратация алкенов. В присутствии катализаторов алкены присоединяют воду с образованием спиртов:
H2C=CH2 + H2O → H3C-CH2-OH
В случае вторичных и третичных алкенов, присоединение воды происходит по правилу Марковникова.
Процесс гидратации алкенов проводят при температуре 300-350*С, давлении не ниже 9,8 МПа и в присутствии катализатора – силикагель пропитанный смесью фосфорной и вольфрамовой кислот.
Ранее использовался сернокислотный метод гидратации алкенов, который имеет ряд существенных недостатков (большой расход серной кислоты, коррозия аппаратуры и др.). Алкены поглощаются серной кислотой тем легче, чем большее количество заместителей имеется у двойной связи (чем более полярной является двойная связь). Эту закономерность используют для разделения олефинов различного строения.
Окисление алкенов. Алкены окисляются кислородом воздуха и другими окислителями. Направление окисления алкенов зависит условий реакции и выбора окислителя.
1. Алкены с кислородом воздуха без катализатора образуют гидропероксиды, распадающиеся с образованием спиртов и карбонильных соединений. Воздействию кислорода подвергается обычно наиболее подвижный атом водорода с разрывом β-связи по отношению к двойной:
H2C=CH-CH2-H → H2C=CH-CH2-O-O-H → …
… → H2C=CH-CH2-O• + R-H → H2C=CH-CH2OH + R•
… → H2C=CH-CH2-O• → H2C=CH-CHO + H•
2. Кислородом воздуха в присутствии серебрянного катализатора алкены окисляются до органических окисей (эпоксидов):
2H2C=CH2 + O2 → 2(H2C-CH2)O
Аналогично действуют гидроперекиси ацилов (реакция Прилежаева):
H2C=CH2 + C6H5-CO-O-O-H → (CH2-CH2)O + C6H5-COOH
3. Разбавленный раствор перманганата калия (реакция Вагнера) или пероксид водорода в присутствии катализаторов (CrO3, OsO4 и др.) с алкенами образуют гликоли. По месту двойной связи присоединяются два гидроксила:
3H2C=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2MnO2 + 2KOH
H2C=CH2 + H2O2 → CH2OH + CH2OH
4. При действии концентрированных растворов окислителей (перманганат калия, хромовая кислота, азотная кислота) молекула алкена разрывается по месту двойной связи, образуя кетоны или кислоты:
H3C-C(CH3)=CH-CH3 → H3C-CO-CH3 + H3C-COOH
H3C-CH=CH-CH2-CH3 → H3C-COOH + H3C-CH2-COOH
Эта реакция используется для определения строения алкенов, т.к. по образовавшимся кислотам и кетонам можно сделать заключение о строении и составе радикалов, связанных с атомами углерода по двойной связи.
5. Алкены окисляются озоном по месту двойной связи с образованием озонидов (нестойкие, взрывчатые соединения), которые с водой образуют пероксид водорода и карбонильные соединения (реакция озонирования Гарриеса):
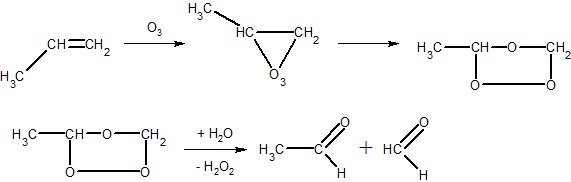
Альдегиды при этом могут окисляться пероксидом водорода до кислот.
Алкилирование алкенов. Алкилирование алкенов алканами происходит в присутствии фосфорной или серной кислот:
(H3C)2C=CH2 + (H3C)3CH → (H3C)3CH-CH2-C(CH3)3
С помощью этой реакции можно получать алканы с изостроением.
Диспропорционирование алкенов. Диспропорционирование алкенов происходит в присутствии катализаторов Циглера (катализаторы получают взаимодействием WCl6 и MoCl5 с этилалюминийдихлоридом):
2R-CH=CH-R’ ⇄ R-CH=CH=R + R’-CH=CH-R’
Полимеризация алкенов. Реакция полимеризации это процесс образования высокомолекулярного вещества (полимера) путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества (мономера).
Полимеризация алкенов может быть вызвана нагреванием, высоким давлением, облучением, действием свободных радикалов или катализаторов.
В реакцию полимеризации могут вступать как индивидуальные вещества, так и смеси мономеров (сополимеризация).
Полимеризация алкенов в зависимости от механизма бывает двух видов:
- радикальная полимеризация (инициированная полимеризация);
- ионная полимеризация (каталитическая полимеризация)
Радикальная полимеризация инициируется веществами, способными в условиях реакции распадаться на свободные радикалы (пероксиды, диазоаминосоединения и др.) а также действием тепла и света. Растущая частица полимера вплоть до момента стабилизации представляет собой свободный радикал. Радикалы инициаторы входят в состав молекулы полимера, образуя его конечную группу:
H2C=CH2 + R• → R-CH2-CH2• + H2C=CH2 → R-CH2-CH2-CH2-CH2• + H2C=CH2 → …
Обрыв цепи происходит при столкновении либо с молекулой регулятора роста цепи (которым может быть специально добавленное вещество, легко отдающее атом водорода или галогена), либо с молекулой мономера.
Ионная (катионная и анионная) полимеризация происходит благодаря образованию из молекул мономера реакционноспособных ионов.
Катализаторами катионной полимеризации являются кислоты, хлориды алюминия, бора и т.д. При каталитической полимеризации катализатор обычно регенерируется и не входит в состав полимера. Процесс также может иметь цепной характер и протекать с очень большой скоростью. Поэтому ионную полимеризацию проводят при очень низких температурах.
Механизм катионной полимеризации этилена в присутствии AlCl3 и следов HCl можно представить следующим образом:
H2C=CH2 + HAlCl4 → H3C-C+H2 + AlCl4–
H3C-C+H2 + nH2C=CH2 → H3C-CH2-(-CH2-CH2-)+n
Обрыв цепи может произойти вследствие захвата растущим катионом аниона или с потерей протона и образованием конечной двойной связи.
Катализаторы анионной полимеризации – щелочные металлы, металлоорганические соединения, амиды щелочных металлов и т.д.
Механизм анионной полимеризации под влиянием металлалкилов можно представить следующим образом:
H2C=CH2 + R-Me → [R-CH2-CH2]–Me+
[R-CH2-CH2]–Me+ + nH2C=CH2 → [R-CH2-CH2-(CH2-CH2)n]–Me+
Анионной полимеризацией получают полиэтилен низкого давления (в присутствии катализаторов R2AlCl и TiCl3).
На реакцию полимеризации сильное влияние оказывает наличие в мономере ничтожных примесей. Некоторые примеси, например многоатомные фенолы, ароматические амины, хиноны, способны задерживать полимеризацию. Такие вещества называются ингибиторы полимеризации (замедлители). Ингибиторы используют при хранении мономеров.
В результате полимеризации могут получаться жидкие вещества различной консистенции или твердые вещества. Изменяя условия полимеризации, а также применяя полимеризацию смеси различных веществ, можно получать продукты с заданными свойствами.
В определенных условиях полимеризация может быть прекращена на ранних стадиях процесса в результате обрыва реакционной цепи.
Различают три типа твердых полимеров:
- эластомеры (каучуки);
- термопласты;
- термореактивные полимеры (при нагревании теряют пластичность и растворимость).
Полимеры, содержащие асимметричные атомы углерода, могут быть пространственно упорядоченными (стереорегулярными) – синдиотактические полимеры и изотактические полимеры или неупорядоченными – атактические полимеры.
Изомеризация алкенов. При высоких температурах или в присутствии катализаторов алкены способны к изомеризации. При этом происходит или перемещение двойной связи (обычно в центр молекулы), или изменение строения углеродного скелета, или одновременно оба процесса.
Применение алкенов
Этилен в больших количествах выделяют из газов крекинга и коксования и используют для получения полимеров (полиэтилен, поливинилхлорид), растворителей (спирт, дихлорэтан, эфиры гликолей), “антифризов” (жидкости понижающие температуру замерзания воды), уксусного альдегида и уксусной кислоты.
Пропилен также выделяют из промышленных газов и применяют главным образом для получения полипропилена и изопропилового спирта (для получения ацетона). Исходя из пропилена можно получить акрилонитрил, глицерин и фенол.
Бутилены с нормальным строением перерабатываются на дивинил (важнейший мономер в производстве синтетического каучука). Изобутилен используют для синтеза изопрена (мономер в производстве изопренового каучука), высокооктанового топлива (изооктана), полиизобутилена.
Амилены с нормальным строением изомеризуются в изоамилены, и последние дегидрируются в изопрен.
Один из высших гомологов этилена цис-9-трикозен H3C-(CH2)12-CH=CH-(CH2)7-CH3 – вещество (феромон), привлекающее самцов домашней мухи. Оно используется для прекращения ее размножения.










