
Молекули-сигнали
У кожній клітині нашого тіла кожну частку секунди відбуваються тисячі різних біохімічних реакцій – основа життєдіяльності організму. Це ціла симфонія високоорганізованих і точних хімічних реакцій, узгоджених за місцем і часом з іншими процесами в клітинах і організмі вцілому. Для регулювання метаболізму (обміну речовин) в ході еволюції утворилися такі системи, як генетична, ендокринна, імунна, нервова і інші. Всі ці системи функціонують за допомогою різних переносників інформації – молекул речовин, які виникають в ході метаболізму і виконують функції сигналів. Ці молекули називають біологічні регулятори. Приєднання молекул біологічних регуляторів до рецепторів клітинної оболонки (мембрани) є сигналом до початку або зупинки біохімічних реакцій.
Серед біорегуляторов особливе місце займають пептидні і білкові гормони, які утворюються в залозах внутрішньої секреції (гіпофізі, підшлунковій залозі, тимусі і ін.). Гормони регулюють всі види обміну речовин, зростання і диференціацію тканин і органів, статеве дозрівання і розмноження, роботу центральної нервової системи і пам’ять, імунні реакції і безліч інших фізіологічних процесів.
Крім гормонів ендокринного походження, не менш важливу роль в організмі відіграють так звані тканинні гормони, або кініни. Вони формуються в тих точках (тканинах) організму, де їх вплив в даний момент є необхідним, вони діють зазвичай поблизу місця свого утворення. До них відносяться, наприклад, ангіотензин і брадикінін. Перший з них підвищує кров’яний тиск і бере участь в регуляції водно-сольового обміну, а другий – брадикінін – знижує кров’яний тиск, впливає на проникність капілярів, викликає больові реакції.
Пептидний біорегулятор – це потужний важіль управління внутрішньоклітинними процесами. Дослідження механізмів їх дії має значення не тільки теоретичне, а й практичне. Пептидно-білкові біорегулятори широко використовуються в медицині. Наприклад, інсулін – для лікування цукрової хвороби (діабету), кортикотропін – для запобігання різних запальних процесів, окситоцин – для стимуляції родової діяльності та ін. Гормони застосовуються також для лікування сільськогосподарських тварин, для стимуляції їх росту та продуктивності. Природні біорегулятори діють в дуже низьких концентраціях (їх дози вимірюються сотими і тисячними частками міліграма) і практично нешкідливі для організму, бо продукти їх розпаду – це ті ж амінокислоти, які утворюються при розщепленні харчових білків. Потреба у виробництві гормонів достатньо велика, і було б зовсім непогано налагодити масове виробництво пептидних препаратів.
Однак все пізнається в порівнянні. В організмі пептиди недовговічні, їх дія вимірюється лише десятками секунд. Така короткочасність дії необхідна для забезпечення гнучкості регулювання на молекулярному рівні. Але якщо застосовувати пептиди як препарати в медицині або тваринництві, виникає проблема, бо робити ін’єкції необхідно занадто часто. Отже, при створенні препаратів-аналогів природним пептидам потрібно усунути цей недолік шляхом продовження дії гормону.
Але спершу необхідно провести фундаментальні дослідження – вивчити механізми дії пептидів.
В кінці 60-х років лабораторія хімії пептидів, організована в Інституті органічного синтезу Латвії, почала пошук закономірностей дії пептидних біорегуляторів. Оскільки регулювання в живому організмі залежить від зв’язку, а зв’язок – це передача певної кількості інформації, латвійські вчені вирішили провести аналіз структур і функцій пептидних біорегуляторів з точки зору теорії інформації та кібернетики.
Код сигнатур
Пептидні гормони, як і білки, в основному побудовані з двадцяти природних амінокислот, з’єднаних в ланцюг. Кожен гормон відрізняється від іншого числом і послідовністю амінокислот так само, як слова нашої мови відрізняються числом і послідовністю букв. Двадцять природних амінокислот – це своєрідний алфавіт природи. Але на відміну від слів інформація в молекулах гормонів закодована не тільки порядковим (лінійним) розташуванням амінокислот, але і тією формою, яку займає в просторі пептидний ланцюг. Цей ланцюг може бути вигнутим або згорнутим найрізноманітнішим чином, утворюючи певну структуру. І саме цією структурою визначаються біологічні функції пептидів.

Молекула пептидного гормону може утворювати в просторі різноманітні геометричні форми. Наприклад, молекула брадикініну, яка складається з 9 амінокислот, може утворювати мільярд різноманітних просторових структур (конформацій). На малюнку показані дві структури з мільярда можливих: зліва – витягнутий ланцюг, зправа – квазіциклічна структура. Різноманіття структур обумовлює різноманіття функцій, які можуть виконувати молекули гормона.
Якщо структура змінилася, стала іншою, то змінилася і закодована в ній інформація. Отже, зміниться і функція пептиду, тобто він запустить іншу біохімічну реакцію, однак найчастіше, пошкоджений пептид повністю втрачає активність. Пептиди як біорегулятори в більшості випадків діють на певні, рецепторні ділянки клітинної мембрани, на локалізовані в них ферментні системи. Клітинні мембрани це ніби панель керування біохімічними процесами всередині клітинни, рецептори – окремі осередки на панелі керування, а пептидні біорегулятори – своєрідні важелі, які впливають на ці осередки.
Контакт гормону з рецептором – це первинний сигнал до початку реакції, але не прямий, бо в цьому випадку біорегулятор включає відповідну мембранну систему, а вже вона дає вторинний внутрішньоклітинний сигнал, який і запускає певну біохімічну реакцію (результатом якої стане певна фізіологічна дія – переварювання їжі, обмін речовин, почастішання пульсу і ін.).
Таким чином інформація, записана в просторово-тимчасовій структурі молекули пептиду, керує молекулярними процесами. Але кожна молекула біорегулятора для точної і специфічної передачі інформації повинна взаємодіяти лише з одним або декількома певними рецепторами. Тому в кожній пептидній молекулі повинен бути якийсь код, необхідний для розпізнавання “свого” рецептора.
Де і як в молекулах пептидів закодована адреса рецепторів? І, з іншого боку, яким чином клітинний рецептор дізнається “свою” молекулу пептидного биорегулятора? Пошук відповіді на ці питання привів вчених до важливого висновку:
клітинні рецептори впізнають молекули не за їх хімічною структурою, а за певним набором властивостей (або ознак), притаманних цим структурам
Це можна порівняти з тим, як ми впізнаємо своїх знайомих за профілем обличчя, голосу, звуку кроків і багатьма іншими ознаками. Але нам для впізнавання потрібні не всі, а лише деякі характерні ознаки – які саме, це визначається конкретною ситуацією.
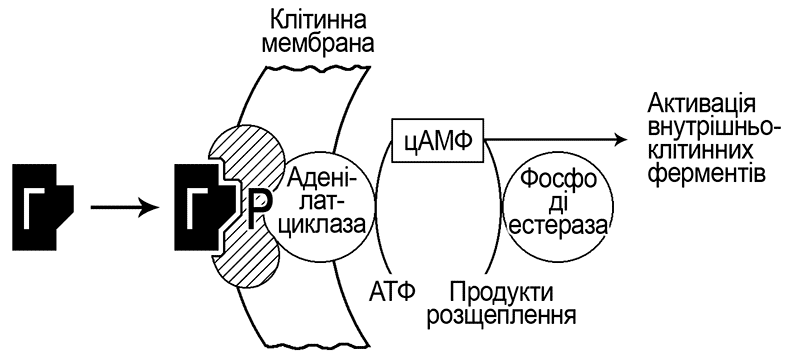
На схематичному малюнку видно, що взаємодія молекули гормона (Г) з рецептором клітинної мембрани (Р) можлива тільки в тому випадку, якщо їх структури відповідають одна одній, як ключ до замка. Вступивши у взаємодію, гормон і рецептор утворюють комплекс ГР. Цей комплекс є первинним сигналом, який запускає внутрішньоклітинні реакції; наприклад активує фермент аденілатциклазу, який в свою чергу запускає реакцію перетворення АТФ (аденозинтрифосфат – основий носій енергії в організмі) в циклічний аденозинмонофосфат (АМФ), який активізує (вторинний сигнал) беспосередньо внутрішньоклітинні ферментативні системи. Як наслідок, запускаються певні фізіологічні дії, наприклад, біосинтез білків, скорочення м’язів, секреція інсуліну, тощо.
Так само відбувається і в світі молекул. Щоб клітинний рецептор розпізнав свою молекулу, йому не потрібні всі структурні елементи біорегулятора, достатньо лише деяких, сукупність яких називають сигнатурою. Подальші дослідження показали, що ці сигнатури можуть бути загальними для різних за структурою природних сполук (або їх синтетичних аналогів).
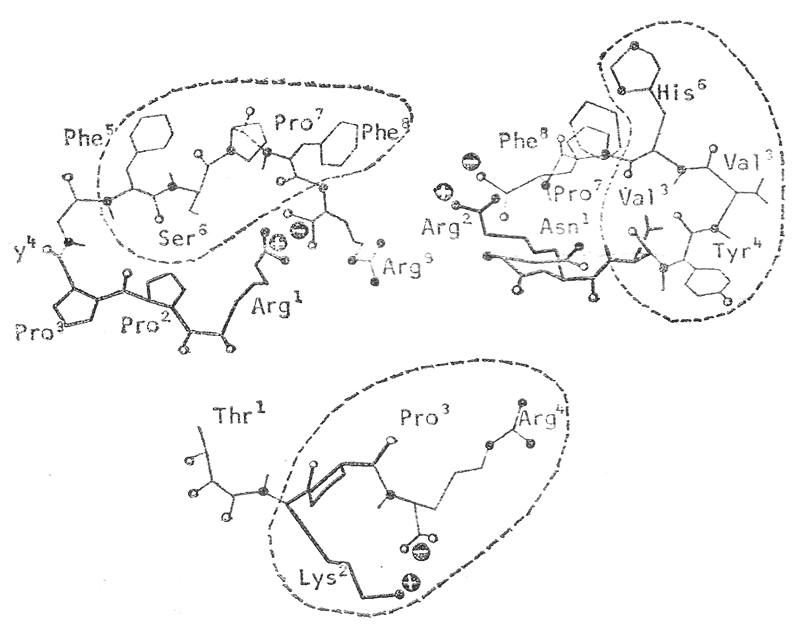
На малюнку представлені квазіциклічні структури гормонів брадикініну, ангіотензіну і імуностимулятору тафтеіну. Пунктирною лінією обведені розпізнавальні частини молекул, які забезпечують взаємодію гормону з рецептором клітини. Знаками + та – позначені місця, де іони стабілізують квазіциклічну структуру молекули. При проектуванні зинтезу аналогів природних гормонів, вчені замінили слабкий іонний зв’язок більш міцним ковалентним і отримали більш стійкі циклічні сполуки, які мають більш ефективну дію за природні.
З іншого боку, відомо, що один і той самий гормон діє на різні органи, викликаючи різні реакції-відповіді, тобто володіє певним спектром біологічної дії. Відомо також, що хімічні модифікації амінокислот пептидного ланцюга, не впливаючи на одну функцію гормону, можуть сильно змінити іншу. Біологічний спектр дії гормону і можливість його зміни говорять про те, що одна сполука може мати кілька сигнатур.
В природі ми часто стикаємося з явищем біохімічної універсальності. Це універсальність будови і властивостей клітин і біохімічних систем (в тому числі і живих організмів), принципів їх дії і управління, кодування інформації і ін. Виходячи з цього, вчені припустили, що повинні існувати якісь загальні принципи в кодуванні і декодуванні інформації, записаної природою в пептидних гормонах і кінінах. І якщо такі принципи існують, то вони повинні якимось чином проявлятися в структурах цих сполук.
Щоб розібратися в цьому, латвійські хіміки застосували так званий матричний аналіз – метод, який широко використовують лінгвісти і криптографи для з’ясування особливостей різних мов і розшифровки кодованих повідомлень. Для кожної мови характерні звуки або їх поєднання, які зустрічаються найчастіше. Виявити їх можна, якщо побудувати квадратну матрицю, тобто окреслити на папері в клітку квадрат зі стороною по кількості букв алфавіту, і написати літери уздовж двох його перпендикулярних сторін. Потім, аналізуючи якийсь чималий уривок тексту, у відповідних клітинах точкою відзначати пари поруч розташованих букв. Вийде в підсумку, що деякі клітини майже заповнені точками, в інших точок мало, треті залишилися порожніми.
Матричний аналіз частоти виникнення поєднань амінокислот в молекулах гормонів і кінінів дав подібну картину: в окремих пептидних біорегуляторах особливо часто зустрічаються деякі амінокислоти, які виконують однакові функції. В структурах гормонів ці амінокислоти розташовані поруч і утворюють цілий фрагмент, загальний для різних пептидних біорегуляторів. Експерименти показали, що видалення або зворотне приєднання загальних фрагментів в пептидних молекулах викликає дуже різку, на 3-4 порядки, зміну їх біологічної активності, від чого залежить, увімкнеться чи ні в клітині вторинний сигнал і відповідна йому реакція. До того ж загальні фрагменти завжди розташовані поруч зі специфічно активними ділянками молекул. Так була виявлена структурна організація молекул гормонів, яка відіграє важливу функціональну роль.
На цій основі вчені розробили теоретичну модель структурної і функціональної організації деяких груп гормонів і кінінів. Відповідно до цієї моделі, молекулу пептиду можна умовно розділити на дві частини – адресну аби розрізняти, що дозволяє дізнаватися «свій» рецептор, і загальний фрагмент, який бере участь в активізації клітинних рецепторів.
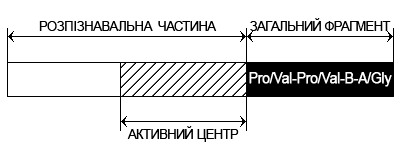
Вчені встановили універсальні закономірності організації структур пептидних гормонів – біорегуляторів. Молекула пептиду поділена на дві частини. Перша частина молекули розпізнавальна, або адресна частина, яка забезпечує розпізнавання “свого” рецептора в клітинній мембрані; розпізнавальна частина має активний центр, який обумовлює специфічну для даного гормону біологічну активність. Інша частина молекули пептида – загальний фрагмент, однаковий для різних гормонів, в багатьох випадках він грає роль “підсилювача” активності рецептора клітинної мембрани, з яким контактує молекула гормона.
Біологи, імунологи і фармакологи інституту експериментально перевірили цю модель, Тобто, взявши її за основу, синтезували близько 70 штучних гормонів і досліджували їх біологічну активність. У всіх випадках результати підтвердили правильність теоретичної моделі, зокрема, роль загального фрагмента як підсилювача активності.
Незамкнуте кільце
Подальші дослідження прояснили цю роль загального фрагмента. Справа в тому, що просторова структура пептидів не настільки визначена, як у білків. Завдяки особливостям будови пептидного ланцюга молекула, що складається, наприклад, з 8 амінокислот, може утворити близько 100 мільйонів різних просторових форм. Але тільки деякі з них біологічно активні, тобто можуть взаємодіяти з клітинними рецепторами. Які саме?
Аналізуючи просторові структури низькомолекулярних пептидних біорегуляторів, вчені розраховували їх за допомогою комп’ютеру. І ці розрахунки показали, що цілий ряд низькомолекулярних лінійних пептидних гормонів фактично має не лінійну, а квазіциклічну будову, тобто форму незамкнутого кільця (слово “кільце” використано тут для наочності, насправді пептидний ланцюг може прийняти форму якої завгодно складної незамкненої кривої) . Стабілізує ж таку структуру взаємодія іонів однієї з амінокислот загального фрагмента, що несе позитивний заряд, і амінокислот ланцюга, де є негативно заряджені групи.
Так було розкрито участь загальних фрагментів у формуванні та закріпленні просторової структури пептидної молекули, що визначає специфічну біологічну активність гормону. Адже якщо видалити загальний фрагмент, то розпізнавальна ділянка молекули втрачає свою характерну просторову структуру, а разом з нею і можливість контакту зі “своїм” клітинним рецептором.
Квазіцикли надають молекулам низькомолекулярних біорегуляторів відносно жорстку специфічну форму, проте іонний зв’язок, який її стабілізує є слабким і недовговічним. Тому, коли на черговому етапі роботи почали синтезувати аналоги природних гормонів, то слабкий іонний зв’язок в квазіциклах було замінено на більш міцний ковалентний, в наслідок чого циклічні структури набували стійкості і міцності. Так було отримано принципово новий тип аналогів природних пептидів.
Модельними сполуками для них спочатку стали тканинні гормони типу брадикініну. Ці сполуки викликають безліч біологічних ефектів: діють на кровоносні судини, серце, нирки, центральну нервову систему, інші органи. На жаль, саме через широту і короткочасність дії брадикінін, високоефективний природній засіб зниження кров’яного тиску, на той час не знайшов практичного використання в медицині. Але вже перші результати біологічних випробувань циклічних аналогів, проведені на тваринах, показали, що вони на кілька порядків перевищують природний прототип по тривалості дії. Той же брадикінін замість колишніх десятків секунд діє кілька годин. Крім того, на відміну від природних, аналоги не діють, наприклад, на різні ділянки кишечника, матки і ін. Тобто їх дія стала не тільки більш тривалою, але і більш специфічною.
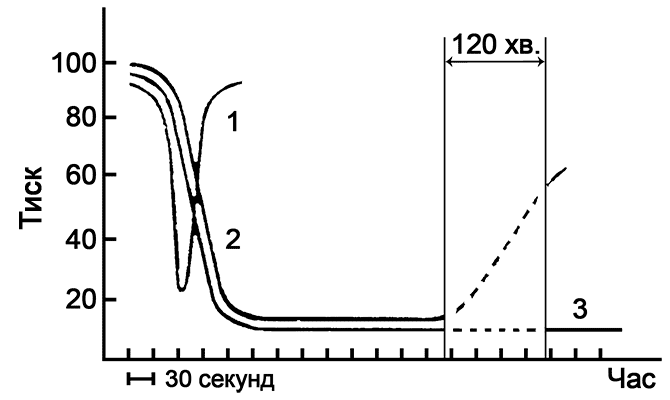
Діаграма дозволяє порівняти єфективність природного брадикініну (1) і його синтетичних аналогів Е-циклобрадикініну (2) і альфа-циклобрадикініну (3). На діаграмі показано, як знижується артеріальний тиск у піддослідних тварин під дією цих препаратів.
В латвійському Інституті органічного синтезу були отримані циклічні аналоги і інших груп пептидних біорегуляторів, Серед них речовини, що стимулюють імунну систему, викликають біосинтез стероїдних гормонів в наднирниках, які діють на центральну нервову систему і ін.
У підсумку всі ці дослідження дозволили встановити універсальну закономірність структурної і функціональної організації пептидних гормонів і кінінів і на її основі розробити технологію виробництва високоактивних циклічних пептидних препаратів для медицини і народного господарства.










