Термін валентність був введений в хімію в 1853 році англійським хіміком-органіком Франклендом для обґрунтування кількісних співвідношень атомів елементів в хімічних сполуках. Розвиток вчення про валентність у великій мірі пов’язан з відкриттям Д.І. Менделєєвим Періодичного закону (1869 рік). Ним було встановлено зв’язок між валентністю елемента і його положенням в Періодичній системі, введено поняття про змінну валентність елементів в їх сполуках з оксигеном і гідрогеном. Вчення про будову атомів і молекул сприяло розробці електронної теорії валентності.
Стехіометрична валентність
Для стехіометричних розрахунків, а також для складання хімічних формул і рівнянь необхідно знання кількісні співвідношення атомів різних елементів, в яких вони з’єднуються або реагують. Така інформація передається значенням стехіометричною валентністю або валентністю.
Стехіометрична валентність (валентність) елемента показує, зі скількома атомами одновалентного елемента з’єднується атом даного елемента
Одновалентними вважаються всі елементи, атоми яких в двоелементних сполуках завжди пов’язані з одним атомом іншого елемента. Прикладом одновалентного елемента є гідроген H. Тому вважається, що стехіометрична валентність елемента вказує на те, зі скількома атомами гідрогену сполучений один атом елемента, що розглядається. Так, в HCl хлор – одновалентний, в H2O оксиген – двовалентний, в NH3 нітроген – трехвалентен.
Водневі сполуки відомі не для всіх елементів, але майже всі елементи утворюють сполуки з оксигеном O. Оксиген як правило стехіометрично двовалентний і за складом оксигенвмісних сполук інших елементів можна визначити валентність цих елементів. Вважають, що всі оксиди можна отримати формальним заміщенням атомів гідрогену в воді на атоми інших елементів. Наприклад, з порівняння формул H2O і Na2O або H2O і CaO роблять висновок про одновалентність натрію і двовалентність кальцію.
Стехіометрична валентність (валентність) елемента визначається числом атомів гідрогену, яке може бути приєднано або заміщено одним атомом даного елементу
Багато елементів виявляють кілька стехіометричних валентностей, тобто вони можуть утворювати з деякими іншими елементом кілька сполук різного стехіометричного складу. Для опису таких сполук в їхніх назвах необхідно або вказувати валентність цих елементів (римською цифрою без знака “+” або “-“), або стехіометричний склад. Для сполук металів краще використовувати перший спосіб, а для сполук неметалів – другий. Наприклад Cu2O – купрум(I) оксид, CuO – купрум(II) оксид, SO2 – сульфур діоксид, SO3 – сульфур триоксид.
Виходячи з принципу, що в хімічній двоелементній сполуці валентності елементів взаємно скомпенсовані, шляхом нескладного арифметичного розрахунку можна визначити валентність одного елемента, якщо відомий склад сполуки і валентність іншого елемента. Знаючи, що гідроген одновалентний (HI), можна знайти валентність інших елементів в наступних сполуках: NaIH, BeIIH2, BIII2H6, CIVH4, NIIIH3, H2SII, HClI.
Аналогічно, враховуючи двовалентність оксигену (OII), визначають валентність інших елементів в оксидах: NaI2O, BeIIO, BIII2O3, CIVO2, NV2O5, SVIO3, ClVII2O7, CIIO, NIII2O3, SIVO2, ClI2O.
Якщо відомі стехіометричні валентності обох елементів в сполуках, то можна скласти їх хімічні сумарні формули. Слід врахувати, що ні сама стехіометрична валентність, ні сумарні формули не надають інформації про тип хімічного зв’язку в сполуках і тим більше про наявність або будові молекул.
Поняття про стехіометричну валентніть було введено в хімію до того, як стала відома будова атома. Нині встановлено, що ця властивість елементів тісно пов’язана з числом зовнішніх електронів. Для багатьох елементів максимальна валентність випливає з положення цих елементів в Періодичній системі.
Заряд іонів
Електричний заряд іонів (позначається в формулах арабською цифрою з подальшим знаком “+” або “-“) і визначає, в якому співвідношенні ці іони знаходяться в кристалічній решітці іонної сполуки.
Приклад. Відповідно до заряду катіонів та аніонів сполуки, що містять ці іони, мають наступний склад:
|
Іони |
Na+ |
Ca2+ |
Al3+ |
|
F– |
NaF |
CaF2 |
AlF3 |
|
O2- |
Na2O |
CaO |
Al2O3 |
|
N3- |
Na3N |
Ca3N2 |
AlN |
|
NO3– |
NaNO3 |
Ca(NO3)2 |
Al(NO3)3 |
|
SO42- |
Na2SO4 |
CaSO4 |
Al2(SO4)3 |
|
PO43- |
Na3PO4 |
Ca3(PO4)2 |
AlPO4 |
У старій літературі заряд іонів називали іонна валентність.
Між зарядом одноелементних іонів і числом валентних електронів нейтральних атомів елементів є безпосередній зв’язок:
позитивний заряд іона дорівнює числу електронів, відданих одним атомом елемента; негативний заряд іона дорівнює числу електронів, прийнятих одним атомом елемента
Приклад. Записи Na+, Ca2+, Al3+ означають, що атоми цих елементів втратили (віддали) відповідно 1, 2, 3 електрона, а записи F–, O2-, N3- означають, що атоми цих елементів прийняли відповідно 1, 2, 3 електрона.
Ступінь окиснення хімічних елементів
Для визначення складу молекулярних (SO2, NH3, CO2, H2SO4, HNO3, H2CO3 і ін.) і іонних сполук (Na2O, Na2SO4 і ін.), А також комплексних сполук введено поняття ступінь окиснення хімічних елементів. В процесі визначення ступені окиснення хімічних елементів, сполуки представляють розщепленими на одноатомні іони незалежно від типу зв’язку між атомами (чисто ковалентний, ковалентний полярний, іонний).
Ступінь окиснення елементів – це електричний заряд, який може нести атом елемента в з’єднанні за умови, що всі зв’язки іонні.
Звідси випливає, що для одноатомних іонів значення їх заряду і ступені окиснення елементів збігаються за кількістю і за знаком. Ступінь окиснення елементів позначають римською цифрою зі знаком “+” або “-” попереду. Наприклад, запис ступені окиснення для сполук NaCl, K2SO4, Al2O3:
Na+ICl-I або NaICl-I
K+I2S+VIO-II4 або KI2SVIO-II4
Al+III2O-II3 або AlIII2O-II3
Запис зарядів іонів для сполук NaCl, K2SO4, Al2O3:
Na+Cl– або Na1+Cl1- (зазвичай одиничний заряд не пишуть цифрою, але якщо цифра 1 вказана, це не вважається помилкою)
K+2SO42-
Al3+2O2-3
Зверніть увагу, заряд багатоатомного іона відноситься до групи атомів (наприклад, кислотному залишку або комплексному іону), тому якщо в молекулі кілька однакових груп атомів, заряд групи атомів вказується до індексу, який позначає кількість цих груп; і після індексу, що позначає кількість будь-яких атомів в складі групи:
H+2SO42- = 2H+ + SO42- (запис SO2-4 буде не вірним)
Al3+2(SO42-)3 = 2Al3+ + 3SO42-
Зазвичай ступень окиснення вказують в сумарних формулах іонних сполук, а іонні заряди – в формулах вільних іонів (існуючих в газі, в розчині, в розплаві).
Ступінь окиснення в молекулах – як визначити ступінь окиснення хімічних елементів в молекулі?
Для визначення ступені окиснення елементів в сполуках побудованих з молекул, необхідно подумки розділити молекулу на одноатомні іони. При цьому, з огляду на полярність ковалентних зв’язків, загальні електронні пари слід передати повністю атомам більш електронегативного елемента, а при наявності чисто ковалентного зв’язку електронні пари слід розділити навпіл між двома пов’язаними атомами. Таким шляхом визначають електричний заряд кожного атома елемента в сполуці, тобто ступінь окиснення елемента.
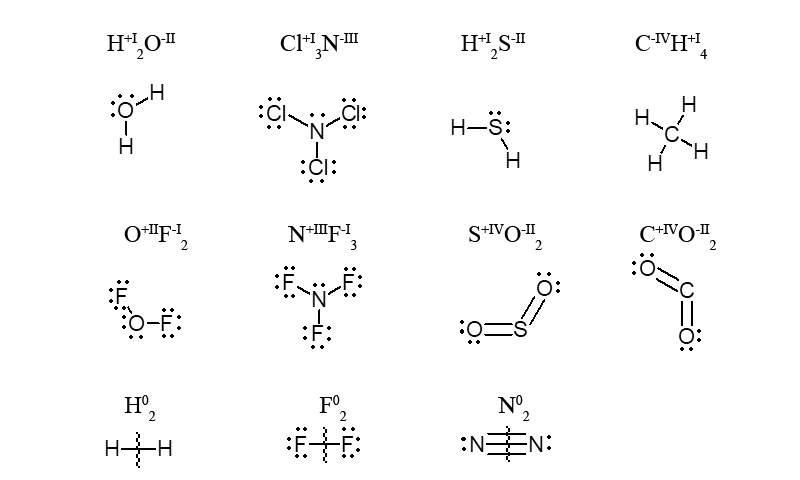
У більшості сполук оксиген, як сильно електронегативний елемент, має ступінь окиснення (-II), він відтягує на себе обидві загальні пари електронів і, набуває на свій зовнішній енергетичний рівень два зайвих електрона (8e– замість 6e–). Однак в OF2 ступінь окиснення оксигену інша, а саме, дорівнює (+II), тому, що атом флуору більш електронегативний елемент ніж оксиген, він відтягує електрон від атому оксигену до себе.
У простих речовинах (H2, F2, N2) елемент який їх утворює має ступінь окиснення яка дорівнює нулю.
У молекулі алгебраїчна сума ступенів окиснення елементів з урахуванням числа їх атомів дорівнює нулю.
Приклад. У молекулі хлор нітриду Cl3N загальний заряд трьох атомів хлору дорівнює (+3), а заряд одного атома нітрогену (-3), що в сумі дає загальний заряд молекули 0.
Ступінь окиснення в багатоелементних іонах
Для визначення ступені окиснення елементів в багатоелементних іонах, останні так само, як і молекули, треба розділити на одноатомні іони, використовуючи вище наведені вказівки.
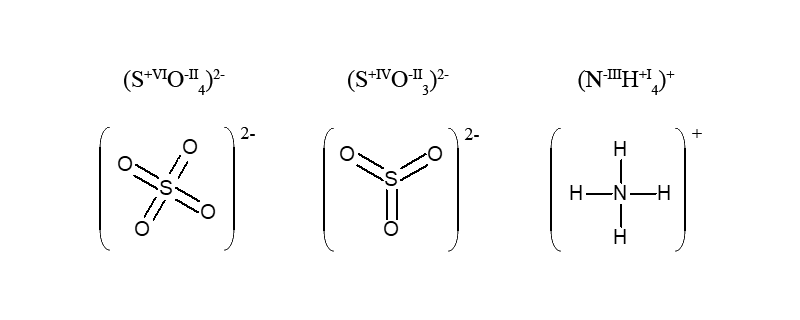
В сульфат-іоні SO42- атоми оксигену відтягують на себе всі електрони від атома сульфуру, який замість 6e– (в нейтральному атомі) не має їх зовсім в стані S+VI.
В багатоелементному іоні, алгебраїчна сума ступенів окиснення елементів з урахуванням числа їх атомів дорівнює заряду іона
Приклад. У катіоні амонію загальний заряд чотирьох атомів гідрогену дорівнює (+4), а заряд атома нітрогену (-3), що дає в сумі (+1), тобто заряд іона NH4+.
У комплексних іонах ступінь окиснення центрального атома легко встановити, віднімаючи з заряду всього комплексного іона загальний заряд лігандів.
Приклади.
[Al+III(OH–)4]–; [Cu+II(NH30)4]2+; [Fe+II(CN–)6]4-
Заряд комплексу [Al+III(OH–)4]– дорівнює (-1) і загальний заряд лігандів становить (-4), звідси (-1) – (-4) = +3, тобто атом алюмінію в цьому комплексі знаходиться в стані AlIII.
Як визначити ступінь окиснення елементів в сполуці за допомогою арифметичного розрахунку?
Встановлення ступенів окиснення елементів за електронними формулами молекул і складних іонів часто ускладнюється практичними труднощами складання самих електронних формул. Ступінь окиснення елементів в більшості сполук можна оцінити арифметичним розрахунком, якщо деяким елементам заздалегідь надати певні значення ступенів окиснення.
Правила визначення ступеня окиснення елемента в з’єднанні:
- Елемент в простій речовині має нульову ступінь окиснення;
- Всі метали в сполуках мають позитивну ступінь окиснення;
- Бор і силіцій в сполуках мають позитивні ступені окиснення;
- Гідроген в сполуках має ступінь окиснення (+I);
- Оксиген в сполуках має ступінь окиснення (-II);
- Флуор в сполуках має ступінь окиснення (-I).
Ці правила, за винятком першого і останнього мають деякі винятки. Так, ступінь окиснення гідрогену в гідридах дорівнює (-I), наприклад в Na+IH-I; ступінь окиснення оксигену в сполуці OF2 становить (+II), а в гідрогенпероксиді H2O2 (-I).
Приклади.
H3PO4: 3 * (+1) – 4 * (-2) = +5 отже P+V
H2(PHO3): 2 * (+1) + 1 * (+1) – 3 * (-2) = +3 отже P+III
H(PH2O3): 1 * (+1) + 2 * (+1) – 2 * (-2) = +1 отже P+I
(поширені значення та непоширені значення)
В органічній хімії, як правило, ступінню окиснення карбону не оперують, але якщо необхідно, то їх оцінюють за тими самими правилами. При цьому ступінь окиснення карбону знаходять для кожного атома окремо.
Приклади.
Метан C-IVH4
Етан C-IIIH3-C-IIIH3
Пропан C-IIIH3-C-IIH2-C-IIIH3
Етанол C-IIIH3-C-IH2OH
Ацетальдегід C-IIIH3-C+IHO
Оцтова кислота C-IIIH3-C+IIIOOH
Найбільш важливе застосування ступенів окиснення елементів – це їх використання при підборі стехіометричних коефіцієнтів в окисно-відновних реакціях. Звідси і сама назва – ступінь окиснення.
Ковалентність атомів
У вченні про будову атомів і молекул найважливішим теоретичним поняттям є ковалентність атома (в закордонній літературі використовується термін зв’язність атома) в молекулі.
Ковалентність атома – це число ковалентних зв’язків, утворених даними атомом
З точки зору методу валентних зв’язків, в якому всі ковалентні зв’язки розглядаються як двоцентрові,
ковалентність атома – це число загальних електронних пар, утворених даними атомом.
Ковалентність атома – завжди ціле число; для двоатомних частинок вона дорівнює кратності зв’язку.
Приклади.
З електронних формул таких молекул, як H2, F2, N2, виходить, що атоми H і F – одновалентні, а атом N – тривалентний. В сполуках H2O і OF2 атом O двовалентний, а атоми H і F – одновалентні. В сполуках Cl3N і NH4+ атом N відповідно три- і чоти-валентний, хоча ступінь окиснення нітрогену одна і та сама N-III. В органічних сполуках CH4, C2H6, C2H4, C2H2 та інших атом карбону чотиривалентний, хоча ступінь окиснення атома карбону може відрізнятися.
Ковалентність атома може не збігатися зі значенням ступені окиснення даного атома в сполуках
Для багатоатомних частинок типу SO2, CO2, SO42-, SO32-, C6H6, в яких π-зв’язки краще розглядати як багатоцентрові і делокалізовані, підрахунок числа загальних електронних пар для окремих атомів втрачає свій сенс, а число валентностей нічого не говорить про ковалентність атомів.
Умовно вважають, що SO2, CO2, SO32-, C6H6 атоми S і C – чотиривалентні, а в SO42- атом S – шестивалентний і відносять ковалентність до ступенів окиснення цих атомів без урахування знака. Особливо наочно це положення (притаманні ступені окиснення і ковалентність атомів) можна простежити на прикладі оксигенвмісних кислот хлору:
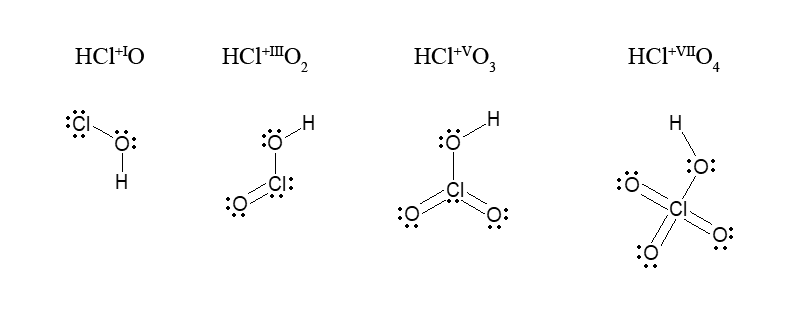
В молекулі HClO, до може бути застосовано поняття про ковалентність (відсутні делокалізовані π-зв’язки), ступінь окиснення хлору (Cl+I) і ковалентність атома Cl (1) збігаються. Умовно збігаються вони й у кислот HClO2, HClO3, HClO4: ступінь окиснення хлору відповідно дорівнює +III, +V, +VII, а ковалентностям 3, 5, 7 відповідають загальні електронні пари. Однак при переході від молекул цих трьох кислот до їх анионів електронне оточення центрального атома хлору стає іншим, і ковалентність зв’язку атома хлору підвищується:
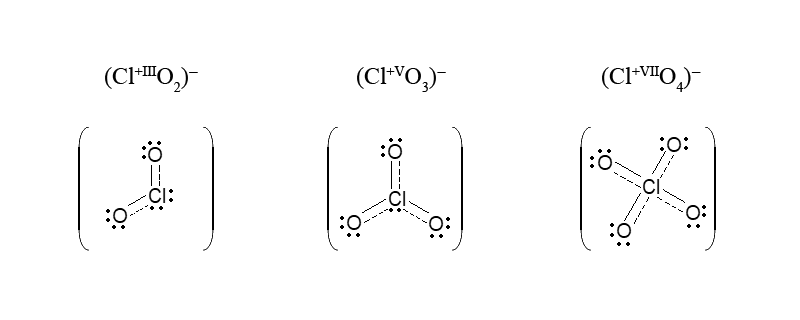
У методі молекулярних орбіталей, для частинок, які складаються з двох атомів, ковалентність атомів передається порядком зв’язку.
Порядок зв’язку в двоатомних частинках дорівнює піврізниці між числом зв’язуючих і числом розпушуючих електронів
Приклади. У молекулах H2, F2, HCl порядок зв’язку H-H, F-F, HCl дорівнює 1, в молекулі O2 – 2, в молекулі N2 і CO – 3.
Порядок зв’язку (на відміну від кратності зв’язку) може бути і цілочисельним і дробовим. У всіх попередніх прикладах сумарне число валентних електронів для двох атомів було парним, тому і порядок зв’язку виявляється цілим (1, 2, 3). Однак в частці NO порядок зв’язку дорівнює (6 – 1) / 2 = 2,5. Для таких частинок з дробовим порядком зв’язку неможливо зобразити електронні формули.
Формальний заряд атома
Для уточнення граничних значень ефективного заряду на атомах в молекулах введено поняття формальний заряд атома. Для оцінки формального заряду атома приймають, що всі зв’язки в молекулі чисто ковалентні, загальні електронні пари ділять між пов’язаними атомами і порівнюють число електронів пов’язаного і вільного нейтрального атома.
Формальний заряд атома – це різниця між числом валентних електронів у вільного нейтрального атома і у пов’язаної атома за умови, що всі його зв’язки з іншими атомами чисто ковалентні
Формальний заряд позначають арабською цифрою зі знаком “+” або “-” попереду. Сума формальних зарядів всіх атомів в молекулі дорівнює нулю, а в багатоатомних іонах – його реальному заряду.
Приклад.
У молекулі CO формальний заряд атомів дорівнює C-1O+1; для порівняння неведено оцінку ступені окиснення елементів і значення ефективних зарядів на атомах C+IIO-II; C0,02-O0,02+. Відповідно до теорії ковалентного зв’язку формальний заряд, наприклад, на атомі карбону змінюється від (-1) за умови чисто ковалентного зв’язку до (+2) за умови чисто іонного зв’язку (ступінь окиснення – це так само умовний, тобто в певному сенсі формальний заряд). Насправді експериментальне значення ефективного заряду на атомі карбону дорівнює (-0,02), тобто знаходиться в межах від (-1) до (+2).
Для більшості молекул оцінка формальних зарядів призводить до нульових значень, наприклад, H0Cl0 (H+ICl-I, H0,17+Cl0,17-), H02S0 (H+I2S-II, H0,1+2S0,1-), S0Cl02 (S+IICl02, S0,2+Cl0,1-2), в той час як в іонах атом хоча б одного елемента формально заряджений, наприклад в катіоні амонію (N+1H04)+, (N-IIIH+I4)+.










