ą»ą║čēąŠ ą┤ą▓ą░ čĆč¢ąĘąĮč¢ ą╝ąĄčéą░ą╗ąĖ ąĘą░ąĮčāčĆąĖčéąĖ ą▓ čĆąŠąĘčćąĖąĮ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā, č鹊 ą╝č¢ąČ ąĮąĖą╝ąĖ ą▓ąĖąĮąĖą║ą░čö ąĄą╗ąĄą║čéčĆąĖčćąĮą░ ąĮą░ą┐čĆčāą│ą░ (čĆč¢ąĘąĮąĖčåčÅ ą┐ąŠč鹥ąĮčåč¢ą░ą╗č¢ą▓). ąóą░ą║čā čüąĖčüč鹥ą╝čā ąĮą░ąĘąĖą▓ą░čÄčéčī ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé, ą░ą▒ąŠ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ą╗ą░ąĮčåčÄą│.
ą£ąĄčéą░ą╗ 1 | ąĀąŠąĘčćąĖąĮ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā | ą£ąĄčéą░ą╗ 2
ąŚą░ą╝č¢čüčéčī ą╝ąĄčéą░ą╗č¢ą▓ ą▓ ą│ą░ą╗čīą▓ą░ąĮąŠą╝čā ą╗ą░ąĮčåčÄą│čā ą╝ąŠąČąĮą░ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāą▓ą░čéąĖ č¢ č¢ąĮčłč¢ čĆąĄč湊ą▓ąĖąĮąĖ ąĘ ą╝ąĄčéą░ą╗ąĄą▓ąŠčÄ ą┐čĆąŠą▓č¢ą┤ąĮč¢čüčéčÄ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą│čĆą░čäč¢čé (ą▓čāą│č¢ą╗čīąĮąĖą╣ ąĄą╗ąĄą║čéčĆąŠą┤).
ąĀč¢ąĘąĮąĖčåčÅ ą┐ąŠč鹥ąĮčåč¢ą░ą╗č¢ą▓, čÅą║ą░ ą▓ąĖąĮąĖą║ą░čö ą╝č¢ąČ ą┤ą▓ąŠą╝ą░ ą╝ąĄčéą░ą╗ąĄą▓ąĖą╝ąĖ ąĄą╗ąĄą║čéčĆąŠą┤ą░ą╝ąĖ ą┐ąŠčÅčüąĮčÄčöčéčīčüčÅ čĆč¢ąĘąĮąŠčÄ čüčģąĖą╗čīąĮč¢čüčéčÄ ą╝ąĄčéą░ą╗č¢ą▓ ą▓č¢ą┤ą┤ą░ą▓ą░čéąĖ ą║ą░čéč¢ąŠąĮąĖ ą▓ čĆąŠąĘčćąĖąĮ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā. ąØą░ ą┐ąŠą▓ąĄčĆčģąĮč¢ ą║ąŠąČąĮąŠą│ąŠ ąĘ ąĄą╗ąĄą║čéčĆąŠą┤č¢ą▓ ą▓ąĖąĮąĖą║ą░čö ą┐ąŠą┤ą▓č¢ą╣ąĮąĖą╣ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéąĖčćąĮąĖą╣ čłą░čĆ, čÅą║ąĖą╣ ą┐čĆąŠčéąĖą┤č¢čö ą┐ąŠą┤ą░ą╗čīčłąŠą╝čā ą┐ąĄčĆąĄčģąŠą┤čā ą║ą░čéč¢ąŠąĮč¢ą▓ ą▓ čĆąŠąĘčćąĖąĮ. ą»ą║čēąŠ ąŠą▒ąĖą┤ą▓ą░ ą╝ąĄčéą░ą╗ąĖ ąĘŌĆÖčöą┤ąĮą░čéąĖ ą╝ąĄčéą░ą╗ąĄą▓ąĖą╝ ąĄą╗ąĄą║čéčĆąŠą┐čĆąŠą▓č¢ą┤ąĮąĖą║ąŠą╝, ą▓ ąĮą░čüą╗č¢ą┤ąŠą║ ąĄą╗ąĄą║čéčĆąŠą┐čĆąŠą▓č¢ą┤ąĮąŠčüčéč¢ čĆąŠąĘčćąĖąĮčā ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā (č¢ąŠąĮąĮą░ ąĄą╗ąĄą║čéčĆąŠą┐čĆąŠą▓č¢ą┤ąĮč¢čüčéčī) čāčéą▓ąŠčĆčÄčöčéčīčüčÅ ąĘą░ą╝ą║ąĮčāčéąĖą╣ ąĄą╗ąĄą║čéčĆąĖčćąĮąĖą╣ ą╗ą░ąĮčåčÄą│.
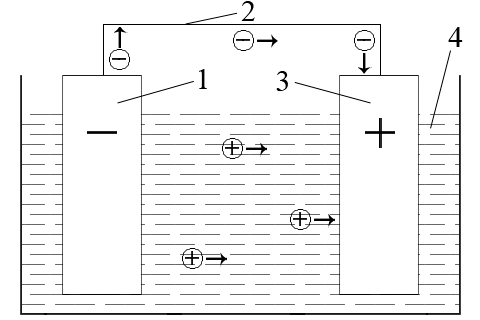
ąÆ ąĮą░ą▓ąĄą┤ąĄąĮąŠą╝čā ą╗ą░ąĮčåčÄą│čā ą┐ąŠčéč¢ą║ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą▒čāą┤ąĄ ą┐ąĄčĆąĄą╝č¢čēčāą▓ą░čéąĖčüčī ą▓č¢ą┤ ą╝ąĄąĮčł ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗čā č湥čĆąĄąĘ ąĘąŠą▓ąĮč¢čłąĮčÄ čćą░čüčéąĖąĮčā ą╗ą░ąĮčåčÄą│ą░ (ą╝ąĄčéą░ą╗ąĄą▓ąĖą╣ ą┐čĆąŠą▓č¢ą┤ąĮąĖą║) ą┤ąŠ ą▒č¢ą╗čīčł ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗čā. ą¤čĆąĖ čåčīąŠą╝čā ą▓ čĆąŠąĘčćąĖąĮč¢ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā ą║ą░čéč¢ąŠąĮąĖ ą▒čāą┤čāčéčī čĆčāčģą░čéąĖčüčī ą┤ąŠ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗čā č¢ čĆąŠąĘčĆčÅą┤ąČą░čéąĖčüčÅ ą┐č¢ą┤ ą┤č¢čöčÄ ąĮą░čÅą▓ąĮąĖčģ ą▓ ąĮčīąŠą╝čā ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓. ąÆ čĆąĄąĘčāą╗čīčéą░čéč¢ ą▓ ąĘą░ą╝ą║ąĮąĄąĮąŠą╝čā ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą╝čā ą╗ą░ąĮčåčÄą│čā ą▓ąĖąĮąĖą║ąĮąĄ ąĄą╗ąĄą║čéčĆąĖčćąĮąĖą╣ čüčéčĆčāą╝.
ąĢą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮč¢ ą┐čĆąŠčåąĄčüąĖ, čēąŠ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ą▓ ąŠčüąĮąŠą▓č¢ čäčāąĮą║čåč¢ąŠąĮčāą▓ą░ąĮąĮčÅ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖčģ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓, čüčģąĄą╝ą░čéąĖčćąĮąŠ ą╝ąŠąČąĮą░ ą┐čĆąĄą┤čüčéą░ą▓ąĖčéčī čéą░ą║:
ąÉąĮąŠą┤ (-): ąØąĄą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąĖą╣ ą╝ąĄčéą░ą╗; ą×ą║ąĖčüąĮąĄąĮąĮčÅ (ą▓č¢ą┤ą┤ą░čćą░ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, čāčéą▓ąŠčĆąĄąĮąĮčÅ ą║ą░čéč¢ąŠąĮč¢ą▓).
ąÜą░č鹊ą┤ (+): ąæą╗ą░ą│ąŠčĆąŠą┤ąĮąĖą╣ ą╝ąĄčéą░ą╗; ąÆč¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ (ą┐čĆąĖą╣ąŠą╝ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, čĆąŠąĘčĆčÅą┤ ą║ą░čéč¢ąŠąĮč¢ą▓).
ą¤čĆąĖą║ą╗ą░ą┤.
ąōą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé ąöą░ąĮč¢ąĄą╗čÅ-ą»ą║ąŠą▒č¢ čüą║ą╗ą░ą┤ą░čöčéčīčüčÅ č¢ąĘ čåąĖąĮą║ąŠą▓ąŠą│ąŠ ąĄą╗ąĄą║čéčĆąŠą┤ą░ – čåąĖąĮą║ąŠą▓ą░ ą┐ą╗ą░čüčéąĖąĮą░, ąĘą░ąĮčāčĆąĄąĮą░ čā čĆąŠąĘčćąĖąĮ čåąĖąĮą║(ąåąå) čüčāą╗čīčäą░čéčā, čéą░ ą╝č¢ą┤ąĮąŠą│ąŠ ąĄą╗ąĄą║čéčĆąŠą┤ą░ – ą╝č¢ą┤ąĮą░ ą┐ą╗ą░čüčéąĖąĮą░, ąĘą░ąĮčāčĆąĄąĮą░ ą▓ čĆąŠąĘčćąĖąĮ ą║čāą┐čĆčāą╝(II) čüčāą╗čīčäą░čéčā:
Zn | ZnSO4 || CuSO4 | Cu
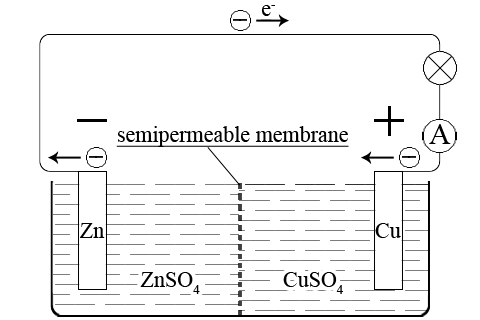
ąóą░ą║ąĖą╝ čćąĖąĮąŠą╝, ą┤ą░ąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé čÅą▓ą╗čÅčö čüąŠą▒ąŠčÄ ąĄą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮčā čüąĖčüč鹥ą╝čā:
ą£ąĄčéą░ą╗ 1| ąĀąŠąĘčćąĖąĮ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā 1 || ąĀąŠąĘčćąĖąĮ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā 2 | ą£ąĄčéą░ą╗ 2
ąÆ čåčīąŠą╝čā ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą╝čā ąĄą╗ąĄą╝ąĄąĮčéč¢ ą┐čĆąŠčéč¢ą║ą░čÄčéčī ąĮą░čüčéčāą┐ąĮč¢ ąĄą╗ąĄą║čéčĆąŠą┤ąĮč¢ ą┐čĆąŠčåąĄčüąĖ:
ąÉąĮąŠą┤ (-): Zn0 – 2ąĄ– = Zn2+ (ąŠą║ąĖčüąĮąĄąĮąĮčÅ)
ąÜą░č鹊ą┤ (+): Cu2+ + 2ąĄ– = Cu0 (ą▓č¢ą┤ąĮąŠą▓ą╗ąĄąĮąĮčÅ)
ąĪčāą╝ą░čĆąĮą░ ąŠą║ąĖčüąĮąŠ-ą▓č¢ą┤ąĮąŠą▓ąĮą░ čĆąĄą░ą║čåč¢čÅ
Zn0 + Cu2+ = Zn2+ + Cu0
ąÜąŠąČąĮąĖą╣ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé čüą║ą╗ą░ą┤ą░čöčéčīčüčÅ ąĘ ą┤ą▓ąŠčģ ąĄą╗ąĄą║čéčĆąŠą┤č¢ą▓ (ąŠą║ąĖčüąĮąŠ-ą▓č¢ą┤ąĮąŠą▓ąĮą░ ą┐ą░čĆą░), ąŠą┤ąĖąĮ ąĘ čÅą║ąĖčģ čö ą┤ąŠąĮąŠčĆąŠą╝ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, ą░ ą┤čĆčāą│ąĖą╣ ą░ą║čåąĄą┐č鹊čĆąŠą╝ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓. ą¤čĆąĖ čåčīąŠą╝čā ąĮą░ ąŠą┤ąĮąŠą╝čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ ą▓ąĖąĮąĖą║ą░čö ąĮą░ą┤ą╗ąĖčłąŠą║ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ (čåąĖąĮą║), ą░ ąĮą░ ą┤čĆčāą│ąŠą╝čā ąĮąĄčüčéą░čćą░ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ (ą╝č¢ą┤čī).
ąĢą╗ąĄą║čéčĆąŠą┤ ąĘ ąĮą░ą┤ą╗ąĖčłą║ąŠą╝ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ąĮą░ąĘąĖą▓ą░čÄčéčī ąĮąĄą│ą░čéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░, ą░ą▒ąŠ ą░ąĮąŠą┤ąŠą╝
ąĢą╗ąĄą║čéčĆąŠą┤ ąĘ ąĮąĄčüčéą░č湥čÄ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓-ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝, ą░ą▒ąŠ ą║ą░č鹊ą┤ąŠą╝
ąØąĄą│ą░čéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ čö ą╝ąĄąĮčł ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąĖą╣ ą╝ąĄčéą░ą╗, ąĮą░ čÅą║ąŠą╝čā ą▓ąĖąĮąĖą║ą░čö ąĮą░ą┤ą╗ąĖčłąŠą║ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓.
ą¤ąŠąĘąĖčéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ čö ą▒č¢ą╗čīčł ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąĖą╣ ą╝ąĄčéą░ą╗, ąĮą░ čÅą║ąŠą╝čā ą▓ąĖąĮąĖą║ą░čö ąĮąĄčüčéą░čćą░ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓.
ąĢą╗ąĄą║čéčĆąŠąĮąĖ ą┐ąŠ ąĘąŠą▓ąĮč¢čłąĮč¢ą╣ ą┤č¢ą╗čÅąĮčåč¢ ą╗ą░ąĮčåčÄą│ą░, č鹊ą▒č鹊 ą┐ąŠ ą╝ąĄčéą░ą╗ąĄą▓ąŠą╝čā ą┐čĆąŠą▓č¢ą┤ąĮąĖą║čā ą┐ąĄčĆąĄčģąŠą┤čÅčéčī ą▓č¢ą┤ ąĮąĄą│ą░čéąĖą▓ąĮąŠą│ąŠ ą┤ąŠ ą┐ąŠąĘąĖčéąĖą▓ąĮąŠą│ąŠ ą┐ąŠą╗čÄčüčā ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░.
ąØą░ą┐čĆąĖą║ą╗ą░ą┤.
ąÆ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą╝čā ąĄą╗ąĄą╝ąĄąĮčéč¢ ąĘ čåąĖąĮą║ąŠą▓ąĖą╝ č¢ čüą▓ąĖąĮčåąĄą▓ąĖą╝ ąĄą╗ąĄą║čéčĆąŠą┤ą░ą╝ąĖ ąĮąĄą│ą░čéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝ ą▒čāą┤ąĄ čåąĖąĮą║ (ąĢ0 = -0,763 ąÆ), ą░ ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝ čüą▓ąĖąĮąĄčåčī (E0 = -0,126 ąÆ). ąĪčéą░ąĮą┤ą░čĆčéąĮąĖą╣ ą┐ąŠč鹥ąĮčåč¢ą░ą╗ ą┐ą╗čÄą╝ą▒čāą╝čā ą▒č¢ą╗čīčł ą┐ąŠąĘąĖčéąĖą▓ąĮąĖą╣ ąĮč¢ąČ čåąĖąĮą║čā.
ąØą░ą┐čĆčāą│ą░ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ čéąĖą╝ ą▒č¢ą╗čīčłą░, čćąĖą╝ ą▒č¢ą╗čīčłąĄ ą▓č¢ą┤čĆč¢ąĘąĮčÅčÄčéčīčüčÅ ą╝č¢ąČ čüąŠą▒ąŠčÄ ąĘąĮą░č湥ąĮąĮčÅ čüčéą░ąĮą┤ą░čĆčéąĮąŠą│ąŠ ą┐ąŠč鹥ąĮčåč¢ą░ą╗čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ą▓.
ąØą░ą┐čĆčāą│čā, čÅą║čā ą┐ąŠą║ą░ąĘčāčö ą▓ąŠą╗čīčéą╝ąĄčéčĆ, ą┐č¢ą┤ą║ą╗čÄč湥ąĮąĖą╣ ą┤ąŠ ą┐ąŠą╗čÄčüč¢ą▓ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░, ąĮą░ąĘąĖą▓ą░čÄčéčī ąĮą░ą┐čĆčāą│ą░ ąĮą░ ą║ą╗ąĄą╝ą░čģ. ą”čÅ ąĮą░ą┐čĆčāą│ą░ ą▓ąĮą░čüą╗č¢ą┤ąŠą║ ąĮą░čÅą▓ąĮąŠčüčéč¢ ą▓ąĮčāčéčĆč¢čłąĮčīąŠą│ąŠ ąŠą┐ąŠčĆčā ą┤ąČąĄčĆąĄą╗ą░ ąĮą░ą┐čĆčāą│ąĖ ą╝ąĄąĮčłąĄ č¢čüčéąĖąĮąĮąŠčŚ ąĮą░ą┐čĆčāą│ąĖ, čÅą║čā ąĮą░ąĘąĖą▓ą░čÄčéčī ąĄą╗ąĄą║čéčĆąŠčĆčāčłč¢ą╣ąĮąŠčÄ čüąĖą╗ąŠčÄ, čüą║ąŠčĆąŠč湥ąĮąŠ ąĄ.čĆ.čü (ą┐ąŠąĘąĮą░čćą░čöčéčīčüčÅ čÅą║ E ąĄ.čĆ.čü.). ąĢą╗ąĄą║čéčĆąŠčĆčāčłč¢ą╣ąĮą░ čüąĖą╗ą░ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ ą╝ąŠąČąĄ ą▒čāčéąĖ čĆąŠąĘčĆą░čģąŠą▓ą░ąĮą░, ą▓ąĖčģąŠą┤čÅčćąĖ č¢ąĘ ąĘąĮą░č湥ąĮąĮčÅ čüčéą░ąĮą┤ą░čĆčéąĮąĖčģ ą┐ąŠč鹥ąĮčåč¢ą░ą╗č¢ą▓ ąŠą▒ąŠčģ ą┐ą░čĆ ą£n+/M0, ą░ą╗ąĄ ą╝ąŠąČąĄ ą▒čāčéąĖ č¢ ąĄą║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠ ą▓ąĖąĘąĮą░č湥ąĮą░ ąĘą░ ą┤ąŠą┐ąŠą╝ąŠą│ąŠčÄ ą║ąŠą╝ą┐ąĄąĮčüą░čåč¢ą╣ąĮąŠčŚ ą▓ąĖą╝č¢čĆčÄą▓ą░ą╗čīąĮąŠčŚ čüčģąĄą╝ąĖ ą░ą▒ąŠ ąĘą░┬Ā ą┤ąŠą┐ąŠą╝ąŠą│ąŠčÄ ą▓ąŠą╗čīčéą╝ąĄčéčĆą░ ąĘ ąĮąĄčüą║č¢ąĮč湥ąĮąĮąŠ ą▓ąĄą╗ąĖą║ąĖą╝ ą▓čģč¢ą┤ąĮąĖą╝ ąŠą┐ąŠčĆąŠą╝.
ą¤čĆąĖ čüčéą░ąĮą┤ą░čĆčéąĮąĖčģ čāą╝ąŠą▓ą░čģ (25*ąĪ, 101,325 ą║ą¤ą░, ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢čÅ ą║ąŠąČąĮąŠą│ąŠ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéčā 1 ą╝ąŠą╗čī/ą┤ą╝3) č¢čüčéąĖąĮąĮą░ ąĮą░ą┐čĆčāą│ą░ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ ą┤ąŠčĆč¢ą▓ąĮčÄčö čĆč¢ąĘąĮąĖčåč¢ ą╝č¢ąČ čüčéą░ąĮą┤ą░čĆčéąĮąĖą╝ ą┐ąŠč鹥ąĮčåč¢ą░ą╗ąŠą╝ ą┐ąŠąĘąĖčéąĖą▓ąĮąŠą│ąŠ ą┐ąŠą╗čÄčüą░ č¢ čüčéą░ąĮą┤ą░čĆčéąĮąĖą╝ ą┐ąŠč鹥ąĮčåč¢ą░ą╗ąŠą╝ ąĮąĄą│ą░čéąĖą▓ąĮąŠą│ąŠ ą┐ąŠą╗čÄčüą░, č鹊ą▒č鹊
E ąĄ.čĆ.čü. = E0 ą┐ąŠąĘ. ą┐ – ąĢ0 ąĮąĄą│. ą┐
ąŚąĮą░č湥ąĮąĮčÅ E ąĄ.čĆ.čü. ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéčā ą┤ąŠčĆč¢ą▓ąĮčÄčö čĆč¢ąĘąĮąĖčåč¢ čüčéą░ąĮą┤ą░čĆčéąĮąĖčģ ą┐ąŠč鹥ąĮčåč¢ą░ą╗č¢ą▓ ą▒č¢ą╗čīčł ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗čā č¢ ą╝ąĄąĮčł ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗čā.
ą¤čĆąĖą║ą╗ą░ą┤.
ąåčüčéąĖąĮąĮą░ ąĮą░ą┐čĆčāą│ą░ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ ąöą░ąĮč¢ąĄą╗čÅ-ą»ą║ąŠą▒č¢ ą┤ąŠčĆč¢ą▓ąĮčÄčö
E ąĄ.čĆ.čü. = E0Cu – E0Zn = +0,338 – (-0,763) = 1,101 ąÆ
ąŚąĮą░čćąĮąŠ ą▒č¢ą╗čīčł ą▓ąĖčüąŠą║čā ąĮą░ą┐čĆčāą│čā ą╝ą░čö ą╗č¢čéč¢čöą▓ąŠą╝č¢ą┤ąĮąĖą╣ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé:
E ąĄ.čĆ.čü. = E0Cu – E0Li = +0,338 – (-3,045) = 3,383 ąÆ
ą£ą░ą╗ąŠą│ą░ą▒ą░čĆąĖčéąĮč¢ ą╗č¢čéč¢čöą▓č¢ ąĄą╗ąĄą╝ąĄąĮčéąĖ čłąĖčĆąŠą║ąŠ ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčÄčéčīčüčÅ ą▓ čÅą║ąŠčüčéč¢ ą┤ąČąĄčĆąĄą╗ ąĄą╗ąĄą║čéčĆąŠąČąĖą▓ą╗ąĄąĮąĮčÅ ą┤ą╗čÅ ą╝č¢ą║čĆąŠą║ą░ą╗čīą║čāą╗čÅč鹊čĆč¢ą▓, ąĄą╗ąĄą║čéčĆąŠąĮąĮąĖčģ ąĮą░čĆčāčćąĮąĖčģ ą│ąŠą┤ąĖąĮąĮąĖą║č¢ą▓ čéą░ č¢ąĮčłąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮąĮąĖčģ ą┐čĆąĖčüčéčĆąŠčŚą▓.
ą¤čĆąĖ ą┐čĆąŠčģąŠą┤ąČąĄąĮąĮč¢ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā č湥čĆąĄąĘ ąĘą░ą╝ą║ąĮčāčéąĖą╣ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé ąĄą╗ąĄą║čéčĆąŠą┤ ąĘ ą╝ąĄąĮčł ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗čā čĆčāą╣ąĮčāčöčéčīčüčÅ, ą╝ąĄčéą░ą╗ ą┐ąŠčüčéčāą┐ąŠą▓ąŠ ą┐ąĄčĆąĄčģąŠą┤ąĖčéčī ą▓ čĆąŠąĘčćąĖąĮ čā č乊čĆą╝č¢ č¢ąŠąĮč¢ą▓ (ąĄą╗ąĄą║čéčĆąŠčģč¢ą╝č¢čćąĮą░ ą║ąŠčĆąŠąĘč¢čÅ). ąŚ čåč¢čöčŚ ą┐čĆąĖčćąĖąĮąĖ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮč¢ ąĄą╗ąĄą╝ąĄąĮčéąĖ ą╝ą░čÄčéčī ą┤ąŠčüąĖčéčī ąŠą▒ą╝ąĄąČąĄąĮąĖą╣ č鹥čĆą╝č¢ąĮ ąĄą║čüą┐ą╗čāą░čéą░čåč¢čŚ.
ąöč¢čÅ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖčģ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓ čÅą║ ą┤ąČąĄčĆąĄą╗ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā ąĘą░čüąĮąŠą▓ą░ąĮąĖčģ ąĮą░ čģč¢ą╝č¢čćąĮč¢ą╣ ą┐čĆąĖčĆąŠą┤č¢ ąĄą╗ąĄą║čéčĆąŠą┤č¢ą▓ č¢ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéč¢ą▓.
ą¤ąĄčĆą▓ąĖąĮąĮč¢ ą┤ąČąĄčĆąĄą╗ą░ čüčéčĆčāą╝čā – čåąĄ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮč¢ ąĄą╗ąĄą╝ąĄąĮčéąĖ.
ąÆč鹊čĆąĖąĮąĮč¢ ą┤ąČąĄčĆąĄą╗ą░ čüčéčĆčāą╝čā – čåąĄ ąĄą╗ąĄą║čéčĆąĖčćąĮč¢ ą░ą║čāą╝čāą╗čÅč鹊čĆąĖ.
ąĢą╗ąĄą║čéčĆąĖčćąĮč¢ ą░ą║čāą╝čāą╗čÅč鹊čĆąĖ, ąĮą░ ą▓č¢ą┤ą╝č¢ąĮčā ą▓č¢ą┤ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖčģ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓, ą╝ąŠąČąĮą░ ąĘą░čĆčÅą┤ąČą░čéąĖ, ą┐č¢ą┤ą║ą╗čÄčćąĖą▓čłąĖ ą┤ąŠ ąĘąŠą▓ąĮč¢čłąĮčīąŠą│ąŠ ą┤ąČąĄčĆąĄą╗ą░ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā. ąóąŠą╝čā ąĄą╗ąĄą║čéčĆąĖčćąĮč¢ ą░ą║čāą╝čāą╗čÅč鹊čĆąĖ ą╝ą░čÄčéčī č¢čüč鹊čéąĮąŠ ą▒č¢ą╗čīčłąĖą╣ č鹥čĆą╝č¢ąĮ ąĄą║čüą┐ą╗čāą░čéą░čåč¢čŚ.
ąØą░ą╣ą▒č¢ą╗čīčłąŠą│ąŠ ą┐ąŠčłąĖčĆąĄąĮąĮčÅ ąĮą░ą▒čāą╗ąĖ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮč¢ ąĄą╗ąĄą╝ąĄąĮčéąĖ ąÆąŠą╗čīčéą░, ąöą░ąĮč¢ąĄą╗čÅ-ą»ą║ąŠą▒č¢ č¢ ąøąĄą║ą╗ą░ąĮčłąĄ.
ąōą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé ąÆąŠą╗čīčéą░ čüą║ą╗ą░ą┤ą░čöčéčīčüčÅ ąĘ ą╝č¢ą┤ąĮąŠčŚ čéą░ čåąĖąĮą║ąŠą▓ąŠčŚ ą┐ą╗ą░čüčéąĖąĮ, ąĘą░ąĮčāčĆąĄąĮąĖčģ ą▓ čĆąŠąĘą▒ą░ą▓ą╗ąĄąĮąĖą╣ čĆąŠąĘčćąĖąĮ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ. ąÆąĮą░čüą╗č¢ą┤ąŠą║ ą▓ąĖą┤č¢ą╗ąĄąĮąĮčÅ ąĮą░ ą╝č¢ą┤ąĮąŠą╝čā ąĄą╗ąĄą║čéčĆąŠą┤č¢ ą│ą░ąĘąŠą┐ąŠą┤č¢ą▒ąĮąŠą│ąŠ ą▓ąŠą┤ąĮčÄ (ą┐ąŠą╗čÅčĆąĖąĘą░čåč¢čÅ) ąĄą╗ąĄą╝ąĄąĮčé ąÆąŠą╗čīčéą░ ąĮąĄ ą╝ą░čö ą┐ąŠčüčéč¢ą╣ąĮąŠčŚ ąĮą░ą┐čĆčāą│ąĖ. ąĢą╗ąĄą╝ąĄąĮčé ąÆąŠą╗čīčéą░ ą▒čāą▓ č¢čüč鹊čĆąĖčćąĮąŠ ą┐ąĄčĆčłąĖą╝ čģč¢ą╝č¢čćąĮąĖą╝ ą┤ąČąĄčĆąĄą╗ąŠą╝ ąĄą╗ąĄą║čéčĆąĖčćąĮąŠą│ąŠ čüčéčĆčāą╝čā, čüčéą▓ąŠčĆąĄąĮąĖą╣ č¢čéą░ą╗č¢ą╣čüčīą║ąĖą╝ čäč¢ąĘąĖą║ąŠą╝ ąÆąŠą╗čīčéą░ (1880 čĆč¢ą║) čā ą▓ąĖą│ą╗čÅą┤č¢ ą╝č¢ą┤ąĮąĖčģ č¢ čåąĖąĮą║ąŠą▓ąĖčģ ą┐ą╗ą░čüčéąĖąĮ, čēąŠ č湥čĆą│čāčÄčéčīčüčÅ, čĆąŠąĘą┤č¢ą╗ąĄąĮąĖčģ čüą╝čāąČą║ą░ą╝ąĖ č乥čéčĆčā, ąĘą╝ąŠč湥ąĮąŠą│ąŠ čĆąŠąĘčćąĖąĮąŠą╝ čüčāą╗čīčäą░čéąĮąŠčŚ ą║ąĖčüą╗ąŠčéąĖ.
ąōą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé ąöą░ąĮč¢ąĄą╗čÅ-ą»ą║ąŠą▒č¢ čüčéą▓ąŠčĆąĄąĮąĖą╣ ą▓ 1836 čĆąŠčåč¢ ą░ąĮą│ą╗č¢ą╣čüčīą║ąĖą╝ ą▓č湥ąĮąĖą╝ ąöą░ąĮč¢ąĄą╗ąĄą╝ č¢ ą▓ą┤ąŠčüą║ąŠąĮą░ą╗ąĄąĮąĖą╣ ą▓ 1938 čĆąŠčåč¢ čäč¢ąĘąĖą║ąŠą╝ ąæ.ąĪ. ą»ą║ąŠą▒č¢. ąÆč¢ąĮ čüą║ą╗ą░ą┤ą░čöčéčīčüčÅ ąĘ ą╝č¢ą┤ąĮąŠčŚ čéą░ čåąĖąĮą║ąŠą▓ąŠčŚ ą┐ą╗ą░čüčéąĖąĮ, ąĘą░ąĮčāčĆąĄąĮąĖčģ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą▓ čĆąŠąĘčćąĖąĮąĖ CuSO4 č¢ ZnSO4. ąĀąŠąĘčćąĖąĮ CuSO4 ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ą▓ ą┐ąŠčĆąĖčüč鹊ą╝čā ą║ąĄčĆą░ą╝č¢čćąĮąŠą╝čā čåąĖą╗č¢ąĮą┤čĆč¢ (ą┐ąŠčĆąĖčüčéą░ ą┤č¢ą░čäčĆą░ą│ą╝ą░), čÅą║ąĖą╣ čĆąŠąĘą╝č¢čēąĄąĮąŠ ą▓ čüą║ą╗čÅąĮčā ą┐ąŠčüčāą┤ąĖąĮčā ą▒č¢ą╗čīčłąŠą│ąŠ čĆąŠąĘą╝č¢čĆčā ą▓ čÅą║ąŠą╝čā ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ čĆąŠąĘčćąĖąĮ ZnSO4. ąĀčāčģ č¢ąŠąĮč¢ą▓ ąĘ ąŠą┤ąĮąŠą│ąŠ čĆąŠąĘčćąĖąĮčā ą▓ č¢ąĮčłąĖą╣ ąĘą┤č¢ą╣čüąĮčÄčöčéčīčüčÅ č湥čĆąĄąĘ ą┤č¢ą░čäčĆą░ą│ą╝čā. ąØą░ą┐čĆčāą│ą░ ąĮą░ ą║ą╗ąĄą╝ą░čģ ąĄą╗ąĄą╝ąĄąĮčéą░ ąöą░ąĮč¢ąĄą╗čÅ-ą»ą║ąŠą▒č¢ 1,1 ąÆ.
ąōą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ąĄą╗ąĄą╝ąĄąĮčé ąøąĄą║ą╗ą░ąĮčłąĄ, čĆąŠąĘčĆąŠą▒ą╗ąĄąĮąĖą╣ ą▓ 1877 čĆąŠčåč¢ čäčĆą░ąĮčåčāąĘčīą║ąĖą╝ č¢ąĮąČąĄąĮąĄčĆąŠą╝ ą¢. ąøąĄą║ą╗ą░ąĮčłąĄ, ą▓ąĖą║ąŠčĆąĖčüč鹊ą▓čāčöčéčīčüčÅ č¢ čüčīąŠą│ąŠą┤ąĮč¢ ą▓ čÅą║ąŠčüčéč¢ čüčāčģąŠą│ąŠ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░ ą┤ą╗čÅ ąČąĖą▓ą╗ąĄąĮąĮčÅ ą║ąĖčłąĄąĮčīą║ąŠą▓ąĖčģ ą╗č¢čģčéą░čĆč¢ą▓ č¢ ąĄą╗ąĄą║čéčĆąŠąĮąĮąĖčģ ą┐čĆąĖčüčéčĆąŠčŚą▓. ąÆ ąĄą╗ąĄą╝ąĄąĮčéč¢ ąøąĄą║ą╗ą░ąĮčłąĄ čĆąĄą░ą╗č¢ąĘčāčöčéčīčüčÅ ąĮą░čüčéčāą┐ąĮąĖą╣ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąĖą╣ ą╗ą░ąĮčåčÄą│:
C | NH4Cl | Zn
ą¤ąŠąĘąĖčéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝ čö ą▓čāą│ą╗ąĄčåčī (ą│čĆą░čäč¢čé), ąĮąĄą│ą░čéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝ čö čåąĖąĮą║ (ą▓ ą┐čĆąŠą╝ąĖčüą╗ąŠą▓ąĖčģ ą╝ąŠą┤ąĖčäč¢ą║ą░čåč¢čÅčģ čåčīąŠą│ąŠ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéčā, ąĮąĄą│ą░čéąĖą▓ąĮąĖą╝ ą┐ąŠą╗čÄčüąŠą╝ čö čüčéč¢ąĮą║ąĖ čüčāą┤ąĖąĮąĖ). ąĢą╗ąĄą║čéčĆąŠą╗č¢č鹊ą╝ čö ąČąĄą╗ą░čéąĖąĮč¢ąĘąŠą▓ą░ąĮąĖą╣ čĆąŠąĘčćąĖąĮ ą░ą╝ąŠąĮč¢ą╣ čģą╗ąŠčĆąĖą┤čā. ąØą░ą▓ą║ąŠą╗ąŠ ą│čĆą░čäč¢č鹊ą▓ąŠą│ąŠ ąĄą╗ąĄą║čéčĆąŠą┤čā čĆąŠąĘą╝č¢čēčāčöčéčīčüčÅ ą┤čĆč¢ą▒ąĮąŠ čĆąŠąĘą┤čĆąŠą▒ą╗ąĄąĮąĖą╣ ą╝ą░ąĮą│ą░ąĮ(IV) ąŠą║čüąĖą┤ MnO2, čÅą║ąĖą╣ ąŠą║ąĖčüąĮčÄčö ą▓ąŠą┤ąĄąĮčī, čēąŠ ą▓ąĖą┤č¢ą╗čÅčöčéčīčüčÅ ą▓ ą┐čĆąŠčåąĄčüč¢ čĆąŠą▒ąŠčéąĖ ą│ą░ą╗čīą▓ą░ąĮč¢čćąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéčā čā ą▓ąŠą┤čā. ąØą░ą┐čĆčāą│ą░ ąĮą░ ą║ą╗ąĄą╝ą░čģ ąĄą╗ąĄą╝ąĄąĮčéą░ ąøąĄą║ą╗ą░ąĮčłąĄ čüčéą░ąĮąŠą▓ąĖčéčī 1,5 ąÆ.










