Будь-яка хімічна реакція записується у вигляді рівняння хімічної реакції. Відповідно за хімічним змістом реакції (реагенти взаємодіють і утворюють продукти реакції) в лівій частині рівняння вказують формули реагентів, а в правій частині – формули продуктів, з’єднуючи їх стрілкою. Таку форму запису хімічної реакції називають схема хімічної реакції:
Реагенти → Продукти реакції
Часто, замість стрілки ставлять знак хімічного рівності:
Реагенти = Продукти реакції
Відомо, що всі хімічні реакції в тій чи іншій мірі зворотні. Двостороннє протікання хімічної реакції, тобто одночасне протікання її в прямому і зворотному напрямку, позначається знаком оборотності:
H2+ S ⇄ H2S
Рівняння реакції яка протікає в прямому напрямку, відображає процес утворення продукту реакції сірководню з реагентів водню і сірки, а рівняння реакції у зворотному напрямку характеризує розкладання реагенту сірководню, на продукти водень і сірку.
Якщо в схемі реакції числа атомів хімічних елементів, до і після реакції, не однакові, проводять підбір коефіцієнтів, прирівнюють числа атомів в рівнянні хімічної реакції:
4Fe + 3O2 → 2Fe2O3
Схема хімічної реакції: N2+ H2 ⇄ NH3
Рівняння хімічної реакції: 1N2+ 3H2 ⇄ 2NH3
Числа, що стоять перед формулами речовин в рівнянні (число 1 зазвичай не пишуть), називаються стехиометрическими коефіцієнтами. Вони показують (на мікрорівні), скільки хімічно однакових часток (іонів, атомів, молекул та ін.) беруть участь у реакції, тобто
N2 + (H2 + H2 + H2) ⇄ NH3 + NH3 що дає N2 + 3H2 ⇄ 2NH3
• зверніть увагу на те, що стехіометричні коефіцієнти відносяться до всієї формули речовини, хоча ця формула не укладена в дужки, на відміну від алгебраїчних записів типу 2a · 2b = 2 (ab), але розуміти хімічний запис треба так само – наприклад : N2 + 3(H2) ⇄ 2(NH3).
Визначення коефіцієнтів в рівнянні хімічної реакції заснований на тому, що сума атомів кожного елемента не змінюється при протіканні хімічної реакції.
Це положення випливає з закону збереження маси.
Перш ніж перейти до підбору коефіцієнтів в схемі реакції, слід встановити, змінюється чи ні ступінь окислення елементів при протіканні реакції.
У схемах реакцій, в яких ступені окиснення елементів не змінюються – обмінних реакціях, підбирати коефіцієнти слід поелементно, починаючи з формули найскладнішого за складом речовини (ця формула, у наведеному нижче прикладі відзначена рисою).
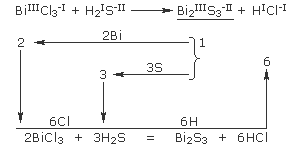
При підборі коефіцієнтів в обмінних реакціях за участю іонних сполук, особливо якщо іони багатоатомні і не змінюють свого складу в ході реакції, можна проводити підрахунок числа іонів, це значно спрощує розстановку коефіцієнтів.
Для простих окисно-відновних реакцій, спосіб підбору коефіцієнтів аналогічний описаному вище для обмінних реакцій. Для складних окисно-відновних реакцій, такий поелементний процес підбору коефіцієнтів дуже складний, і тому для них розроблені спеціальні методи розстановки коефіцієнтів в окисно-відновних реакціях.










