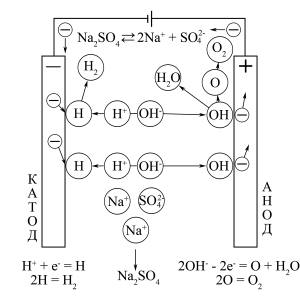
При електролізі водних розчинів електролітів в електродних напів-процесах може приймати участь, крім електроліту, вода. В результаті електролітичного розкладання води на катоді утворюється гідроген, а на аноді – оксиген.
Найпростіше пояснення процесів, що протікають полягає в тому, що іони H+ (H3O+), які містяться у воді, наближуються до катода і там розряджаються
H+ + e– = H0; H3O+ + e– = H0 + H2O
а іони OH–, які таксамо містяться в воді, одночасно наближуються до анода і там розряджаються
2OH– – 2e– = O + H2O
Гідроген і оксиген (кожен окремо) одразу вступають у вторинні процеси, які не мають електрохімічної природи і полягають в утворенни двоатомних молекул водню і кисню
2H0 = H2; 2O0 = O2
Сумарно ці процеси можна записати так:
Катод (відновлення): 2H+ + 2e– = H2
Анод (окиснення): 4OH– – 4e– = O2 + 2H2O
4H+ + 4OH– = 2H2 + O2 + 2H2O; 4H3O+ + 4OH– = 2H2 + O2 + 6H2O
У чистій воді і нейтральних розчинах (pH = 7) концентрація іонів H+ і OH– дуже мала (1e-7 моль/дм3 для кожного з іонів при 25*C). Внаслідок участі іонів H+ і OH– в електрохімічних процесах при електролізі їх кількість повинна безперервно поповнюватися за рахунок автодисоціаціі (автопротоліза) води:
H2O ⇄ H+ + OH–; H+ + H2O = H3O+
H2O + H2O ⇄ OH– + H3O+
Іони H+ (H3O+), які утворюються в процесі автопротоліза води, безперервно розряджаються на катоді, а іони OH– безперервно розряджаються на аноді, що призводить до збагачення навколокатодного простору іонами OH– і навколоанодного простору – іонами H+ (H3O+). Практично, перевірити середовище навколо електродів можна за допомогою лакмусу або іншого кислотно-основного індикатора. При проходженні електричного струму через електролізер надлишкові іони OH– (з навколокатодного простору) і іони H+ (з навколоанодного простору) рухаються назустріч один одному і знову об’єднуються в молекули води H2O.
Оскільки вода – слабкий електроліт, в іонних рівняннях записують не її іони, а молекули води. Саме молекули (а не невеликі кількості іонів H+ і OH–) в основному беруть участь в напівреакціях на електродах:
Катод (відновлення): 2H2O + 2e– = H2 + 2OH–
Анод (окиснення): 2H2O – 4e– = O2 + 4H+
З цих напівреакцій можна зробити висновок, що навколо катода зростає концентрація іонів OH–, а навколо анода – концентрація іонів H+ (H3O+), а оскільки одночасне збільшення концентрацій обох цих іонів у воді неможливо через фіксований стану іонної рівноваги (K = [H3O+][OH–] = 1e-14 при 25*С), то ці іони об’єднуються в молекули H2O. Звідси остаточне сумарне рівняння електролізу води записують так:
H2O → 2H2 + O2
При електролізі водних розчинів електролітів в процесах катодного відновлення і анодного окиснення можуть брати участь іони води (H+ і OH–) і іони електроліту. Однойменні по знаку іони води і електроліту конкурують між собою і розряджатися буде той катіон (на катоді) і той аніон (на аноді), якому відповідає більш низьке значення напруги розряду.
Для поширених катіонів існує ряд розряджуваності на катоді:
K+ Na+ Mg2+ Al3+ | H+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ | Cu2+ Ag+ Au+
I група катіонів – неблагородні метали, які важко розряджаються, тому при електролізі водних розчинів електролітів, що містять зазначені катіони в першу чергу на катоді розряджаються іони H+ і в катодних продуктах електролізу утворюється тільки водень H2:
K+ Na+ Mg2+ Al3+
II група катіонів – менш неблагородні метали, напруга розряду яких за значенням знаходиться поблизу напруги розряду іонів гідрогену, тому при електролізі водних розчинів електролітів, що містять зазначені катіони на катоді будуть розряджатися і катіони металів і катіони гідрогену, в катодних продуктах електролізу утворюються і метали і водень H2:
H+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+
III група катіонів – благородні метали, напруга розряду яких менше напруги розряду H+, тому при електролізі водних розчинів електролітів, що містять зазначені катіони на катоді будуть розряджатися тільки катіони металів:
Cu2+ Ag+ Au+
Катіони I групи можна виділити у вигляді металу за допомогою електролізу тільки з розплаву, де немає конкуренції з іонами H+, або при використанні рідкого ртутного електрода (метали утворюють з ртуттю амальгами).
Відмінне положення гідрогену в ряду розряджуваності катіонів і в електрохімічному ряду напруг можна пояснити використовуючи рівняння Нернста.
Стандартний потенціал гідрогенного електрода H+/H0, рівний E0 = 0,00 (тому гідроген поставлений в електрохімічному ряду напруг між Pb і Cu), є дійсним для розчинів з активністю іонів H+ 1 моль/дм3, що відповідає pH = 0. Для водного розчину певної солі, якщо вона не піддається гідролізу, як і для чистої води, pH = 7. Активність іонів H+ дуже низька і становить 1e-7 моль/дм3. Потенціал пари H+/H2, з урахуванням концентрації [H+] = 1e-7 моль/дм3 розрахований за рівнянням Нернста (z = 1, T = 298,15K = 25*С) становить:
E = E0 + (RT) / (Fz) * ln([H+]) = 0,000 + (8,31441 * 298,15) / (96484,56 * 1) * ln(1e-7) = -0,4141 B
Отже, якщо занурити деякий метал в нейтральний розчин будь-якої солі з активністю 1 моль/дм3 при 25*С, реальний електродний потенціал цього металу збільшується на 0,4141 В. Тому з такого розчину можна електролітично виділити всі метали, значення E0 яких в парах Men+/Me0 більше, ніж -0,4141 В. Стає зрозумілим, що зарахувати до таких металів, крім тих, що стоять в електрохімічному ряді напруг правіше гідрогену (Cu, Ag, Pt, Au), можна також Pb, Sn, Ni, хоча вони стоять лівіше гідрогену. Отже, в ряду розряджуваності катіонів іон H+ займає становище значно лівіше, ніж в електрохімічному ряду напруг.
Однак і в ряду розряджаємості варто було б вказати іон H+ між Fe2+ і Ni2+, але він поставлений між Al3+ і Zn2+ (тобто ще лівіше). Дійсно, практично вдається електролітично осадити з розчинів такі метали, як Fe Cr Zn. Це пояснюється тим, що очікуваному утворенню на катоді газоподібного водню перешкоджає явище перенапруги.
Для поширених аніонів існує ряд розряджуваності на аноді:
SO42- NO3– і інш. оксиґенвмісні кислотні залишки | OH– Cl– Br– I–
Оксигенвмісні кислотні залишки є важко розряджаються, тому при електролізі водних розчинів, що містять ці аніони, в першу чергу розряджаються іони OH– і в продуктах електролізу утворюється кисень.
Якщо в розчині одночасно знаходяться іони благородних металів декількох видів, то вони розряджаються в порядку від більш благородного до менш благородного.
Якщо в розчині одночасно знаходяться легко аніони які розряджаються, то розрядження відбувається в порядку справа наліво, наприклад від йоду до хлору.
За допомогою рядів розряджуваності легко визначити, якими будуть продукти електролізу для водних розчинів різних електролітів. Однак, крім продуктів на катоді і на аноді, зазначених нижче, зазвичай в кінцевому розчині утворюється третій продукт (часто промислово важливий). Так, при електролізі CuSO4, крім Cu і O2, в кінцевому розчині отримують H2SO4, а при електролізі NaCl, крім H2 і Cl2, утворюється NaOH. При цьому вихідний електроліт може витрачатися при електролізі його водного розчину повністю (HCl, CuCl2) або частково (CuSO4, NaCl), але може і не витрачатися зовсім (H2SO4, HNO3, NaOH, Na2SO4).
Приклади.
|
Електроліт |
Продукти |
|
|
Катод |
Анод |
|
|
HCl |
H2 |
Cl2 |
|
H2SO4 |
H2 |
O2 |
|
HNO3 |
H2 |
O2 |
|
NaOH |
H2 |
O2 |
|
CuCl2 |
Cu |
Cl2 |
|
CuSO4 |
Cu |
O2 |
|
NiSO4 |
Ni, H2 |
O2 |
|
NaCl |
H2 |
Cl2 |
|
Na2SO4 |
H2 |
O2 |
Для кращого розуміння описаних процесів розгляньте і розберіться в наведених нижче схемах електролізу деяких електролітів.
Схема процесу електроліза водного розчину електроліта CuCl2
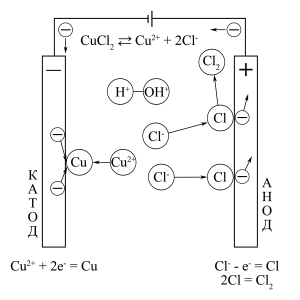
Схема процесу електроліза водного розчину електроліта CuSO4

Схема процесу електроліза водного розчину електроліта NaCl
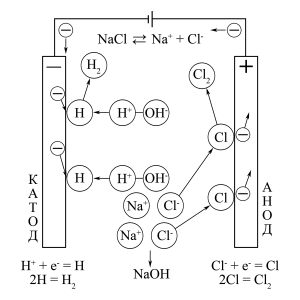
Схема процесу електроліза водного розчину електроліта Na2SO4