Розподіл електронної густини в органічних молекулах. Індукційний ефект (+I, -I). Приклади. Ефект спряження (мезомерний ефект: -М, +М). Види мезомерних ефектів (ππ, pπ, σπ), приклади.
Здатність органічних молекул до участі в хімічних реакціях різних типів – реакційна здатність, обумовлена їх складом та просторовою будовою.
- Склад і будова органічних молекул зумовлюють перерозподіл електронної густини в молекулі.
- Електронна густина в різних частинах молекули – різна, такий, неоднаковий перерозподіл електронної густини створює на різних частинах молекули, ділянки, які мають різні часткові заряди – поляризовані ділянки молекули.
- Саме поляризація окремих ділянок молекули і обумовлює її реакційну здатність.
Наприклад, поляризація зв’язку С-Н в органічній хімії прийнята рівною 0. Логічно, що молекули які мають тільки С-С та С-Н зв’язки мають мінімальну реакційну здатність. Алкани – саме цей клас органічних сполук вважається найменш реакційно здатним. Але серед молекул які мають тільки С-С та С-Н зв’язки теж спостерігається різниця у реакційній здатності, обумовлена просторовою будовою та розмірами молекули.
Якщо в органічній молекулі присутні замісники, окремі атоми або групи атомів, які мають відмінну від атомів карбону або гідрогену електронегативність, вони впливають на перерозподіл електронної густини в молекулі, тобто на її реакційну здатність – поляризаційний ефект який проявляє замісник відносно органічної молекули.
В залежності від типу хімічних зв’язків між атомами в молекулі, розрізняють:
- Індукційний ефект – передача електронного впливу замісника через ланцюг σ-зв’язків.
Індукційний ефект найбільш сильно проявляється на перших, найближчих до замісника, двох атомах з’єднаних σ-зв’язком.
σ-зв’язок – це зв’язок який виникає між атомами при перекритті атомних орбіталей на одній вісі, яка з’єднує атомні ядра.
Індукційний ефект, який проявляє замісник може бути позитивним або негативним по відношенню до молекули.
-І – негативний Індукційний ефект проявляється коли замісник більш електронегативний за атом карбону, внаслідок чого замісник відтягує, віднімає від молекули електронну густину на себе. При цьому замісник набуває частково-негативного заряду (δ-), а атоми молекули, які з’єднані з замісником, затухаючий частково позитивний заряд (δ+)
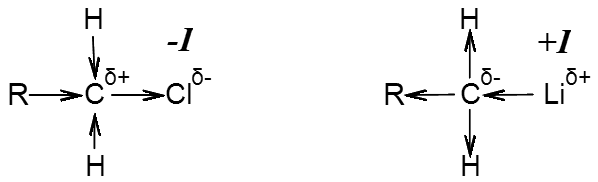
+I – позитивний Індукційний ефект проявляється коли замісник менш електронегативний за атом карбону, в наслідок чого замісник віддає від себе та додає до основної частини молекули електронну густину. При цьому замісник набуває частково-позитивний заряд, а атоми молекули, які з’єднані з замісником, затухаючий частково негативний заряд.
На зображенні структурних формул, Індукційний ефект позначається
- стрілочками (замість рисок одинарних зв’язків), які вказують напрямок зсуву електронної густини в молекулі;
- та позначкою часткового позитивного (δ+) або негативного (δ-) заряду у верхньому індексі атома справа, який набуває замісник та пов’язані з ним атоми.
- Мезомерний ефект (ефект спряження) – це передача електронного впливу замісника через систему π-зв’язків або за участю р-електронів атомів замісників.
Мезомерний ефект потребує обов’язкової наявності спряжених ділянок – ділянок з подвійними зв’язками поміж-якими не більше однієї ділянки з σ-зв’язком, або замісника який має вільні р-електрони.
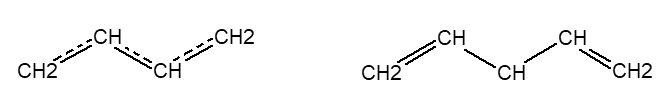
Мезомерний ефект передається на більш значну відстань ніж Індукційний ефект внаслідок більшої рухливості π-зв’язків.
π-зв’язок – це зв’язок який виникає між атомами при боковому перекритті р-атомних орбіталей по обидва боки від вісі, яка з’єднує атомні ядра.
Мезомерний ефект (ефект спряження) може бути позитивним або негативним. Якщо замісник здатен входити до спряженої системи він може або відтягувати електронну густину системи на себе (-М), або навпаки відштовхувати електронну густину спряженої системи (+М).
Як розпізнати, який замісник може утворювати з подвійними зв’язками спряжені системи, та ефект якого знаку він проявлятиме?
- Будь-який атом, або група атомів які мають р-електрони або подвійні зв’язки здатна до спряження.
Наприклад: -Cl, -Br, -NH2, -CHO, -COOH, -SO3H, -OH…
р-електрони мають р-елементи періодичної системи, а от s-елементи не мають р-електронів, тому не здатні до утворення спряжених систем.
Наприклад, до утворення спряжених систем не здатні: -Na, -Li, замісники всі р-електрони яких зайняті σ-зв’язками, наприклад алкіли: -СН3, -СН2-СН3 ін.
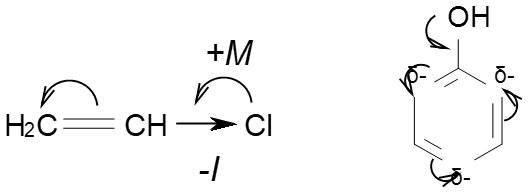
2. Якщо замісник, який має вільні р-електрони зв’язаний безпосередньо з атомом карбону який має подвійний зв’язок, цей замісник проявляє +М ефект:
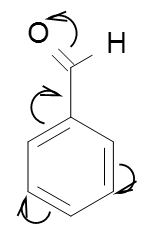
Якщо замісник – група атомів, а атом який пов’язаний з карбоном σ-зв’язком має р-електрони зв’язані подвійними зв’язками з іншими атомами групи, то він проявляє -М ефект, тобто відтягує електронну густину спряженої системи на себе:
В бензеновому кільці, вплив замісників обумовлює орієнтацію приєднання інших замісників.
Якщо бензен має замісник який проявляє +М ефект, приєднання інших замісників по електрофільному механізму переважно проходить в орто- і пара- положення.
Якщо бензен має замісник який проявляє -М ефект, приєднання замісників по електрофільному механізму переважає в мета- положення.










