ąźč¢ą╝č¢čÅ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüą┐ąŠą╗čāą║ – ąŠą┤ąĖąĮ ąĘ ą▓ąĄą╗ąĖą║ąĖčģ čĆąŠąĘą┤č¢ą╗č¢ą▓ ąĮąĄąŠčĆą│ą░ąĮč¢čćąĮąŠčŚ čģč¢ą╝č¢čŚ. ą¤ąŠčćą░č鹊ą║ ą▓ąĖą▓č湥ąĮąĮčÄ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüą┐ąŠą╗čāą║ ą┐ąŠą║ą╗ą░ą▓ čłą▓ąĄą╣čåą░čĆčüčīą║ąĖą╣ čģč¢ą╝č¢ą║ ąÆąĄčĆąĮąĄčĆ (1893 čĆč¢ą║), čÅą║ąĖą╣ čĆąŠąĘčĆąŠą▒ąĖą▓ ąŠčüąĮąŠą▓ąĖ ą║ąŠąŠčĆą┤ąĖąĮą░čåč¢ą╣ąĮąŠčŚ č鹥ąŠčĆč¢čŚ. ąÆč¢ąĮ ą▓č¢ą┤ąŠą║čĆąĄą╝ą╗čÄą▓ą░ą▓ ą┐čĆąŠčüčéč¢ čüą┐ąŠą╗čāą║ąĖ, ą░ą▒ąŠ čüą┐ąŠą╗čāą║ąĖ ą┐ąĄčĆčłąŠą│ąŠ ą┐ąŠčĆčÅą┤ą║čā, čÅą║ čāčéą▓ąŠčĆąĄąĮč¢ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą┤ąŠ čüč鹥čģč¢ąŠą╝ąĄčéčĆąĖčćąĮąŠčŚ ą▓ą░ą╗ąĄąĮčéąĮąŠčüčéč¢ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓, č¢ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮč¢ čüą┐ąŠą╗čāą║ąĖ, ą░ą▒ąŠ čüą┐ąŠą╗čāą║ąĖ ą▓ąĖčēąŠą│ąŠ ą┐ąŠčĆčÅą┤ą║čā, ą▓ čÅą║ąĖčģ ą░č鹊ą╝ąĖ čéąĖčģ čüą░ą╝ąĖčģ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓ ą┐čĆąĖčöą┤ąĮčāčÄčéčī ą▒č¢ą╗čīčłčā ą║č¢ą╗čīą║č¢čüčéčī ą┐ą░čĆčéąĮąĄčĆč¢ą▓ ą┐ąŠ čģč¢ą╝č¢čćąĮąŠą╝čā ąĘą▓’čÅąĘą║čā (ą░č鹊ą╝č¢ą▓ ą░ą▒ąŠ ą│čĆčāą┐ ą░č鹊ą╝č¢ą▓). ą¦č¢čéą║ąŠčŚ ą╝ąĄąČč¢ ą╝č¢ąČ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖą╝ąĖ č¢ ą┐čĆąŠčüčéąĖą╝ąĖ (ą┐ąŠ ąÆąĄčĆąĮąĄčĆčā) čüą┐ąŠą╗čāą║ą░ą╝ąĖ ąĮąĄą╝ą░čö.
ąÜąŠą╝ą┐ą╗ąĄą║čüąĮą░ čüą┐ąŠą╗čāą║ą░ čüą║ą╗ą░ą┤ą░čöčéčīčüčÅ ąĘ čĆč¢ąĘąĮąŠąĘą░čĆčÅą┤ąČąĄąĮąĖčģ ąĘą░čĆčÅą┤ąČąĄąĮąĖčģ ąĘąŠą▓ąĮč¢čłąĮčīąŠčŚ č¢ ą▓ąĮčāčéčĆč¢čłąĮčīąŠčŚ čüč乥čĆąĖ (ą▓ą╗ą░čüąĮąĄ ą║ąŠą╝ą┐ą╗ąĄą║čüčā); ąĘčāčüčéčĆč¢čćą░čÄčéčīčüčÅ čéą░ą║ąŠąČ ąĮąĄą╣čéčĆą░ą╗čīąĮč¢ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ. ążąŠčĆą╝čāą╗čā ą║ąŠą╝ą┐ą╗ąĄą║čüčā ąĘą░ą┐ąĖčüčāčÄčéčī ą▓ ą║ą▓ą░ą┤čĆą░čéąĮąĖčģ ą┤čāąČą║ą░čģ; ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ ą┐čĆąĖčüčāčéąĮč¢ą╣ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╣ ą░č鹊ą╝ (ąĘą░čĆčÅą┤ąČąĄąĮąĖą╣ ą░ą▒ąŠ ąĮąĄą╣čéčĆą░ą╗čīąĮąĖą╣) čéą░ č¢ąĮčłč¢ ą░č鹊ą╝ąĖ ą░ą▒ąŠ ą│čĆčāą┐ąĖ ą░č鹊ą╝č¢ą▓ (ąĘą░čĆčÅą┤ąČąĄąĮč¢ ą░ą▒ąŠ ąĮąĄą╣čéčĆą░ą╗čīąĮč¢) – ą╗č¢ą│ą░ąĮą┤ąĖ, čÅą║č¢ ą┐ąŠą▓’čÅąĘą░ąĮč¢ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ ą░č鹊ą╝ąŠą╝ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠ ą┐ąŠ ą┤ąŠąĮąŠčĆąĮąŠ-ą░ą║čåąĄą┐č鹊čĆąĮąŠą│ąŠ ą╝ąĄčģą░ąĮč¢ąĘą╝čā.
ą»ą║čēąŠ ą╗č¢ą│ą░ąĮą┤ čāčéą▓ąŠčĆčÄčö ąŠą┤ąĖąĮ Žā-ąĘą▓’čÅąĘąŠą║ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ ą░č鹊ą╝ąŠą╝, č鹊 čćąĖčüą╗ąŠ čéą░ą║ąĖčģ ą╗č¢ą│ą░ąĮą┤č¢ą▓ ą┤ąŠčĆč¢ą▓ąĮčÄčö ą║ąŠąŠčĆą┤ąĖąĮą░čåč¢ą╣ąĮąŠą╝čā čćąĖčüą╗čā čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░. ąŚą░čĆčÅą┤ ą▓čüčīąŠą│ąŠ ą║ąŠą╝ą┐ą╗ąĄą║čüčā ą▓ąĖąĘąĮą░čćą░čöčéčīčüčÅ čüčāą╝ą░čĆąĮąĖą╝ ąĘą░čĆčÅą┤ąŠą╝ ą▓čüč¢čģ ą╗č¢ą│ą░ąĮą┤č¢ą▓ (čÅą║čēąŠ ą▓ąŠąĮąĖ – č¢ąŠąĮąĖ) č¢ ąĘą░čĆčÅą┤ąŠą╝ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░, ą▓ąĖčĆą░ąČąĄąĮąĖą╝ čüčéčāą┐ąĄąĮąĄą╝ ąŠą║ąĖčüąĮąĄąĮąĮčÅ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠą│ąŠ ąĄą╗ąĄą╝ąĄąĮčéą░.
ą”ąĄąĮčéčĆą░ą╗čīąĮąĖą╣ ą░č鹊ą╝ ą╝ąŠąČąĄ ą▒čāčéąĖ ą░č鹊ą╝ąŠą╝ ąĮąĄą╝ąĄčéą░ą╗ą╗ą░ ą░ą▒ąŠ ą╝ąĄčéą░ą╗ą╗ą░.
ąÜąŠą╝ą┐ą╗ąĄą║čüąĮč¢ čüą┐ąŠą╗čāą║ąĖ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ ą░č鹊ą╝ąŠą╝ ąĮąĄą╝ąĄčéą░ą╗č¢ą▓
ąóą░ą║č¢ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮč¢ čüą┐ąŠą╗čāą║ąĖ čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ ąĘ ą╝ąŠą╗ąĄą║čāą╗ ą┐čĆąŠčüčéąĖčģ čüą┐ąŠą╗čāą║ č¢ ą┤ąŠą┤ą░čéą║ąŠą▓ąĖčģ čćą░čüčéąĖąĮąŠą║ ą╗č¢ą│ą░ąĮą┤čā.
ą¤čĆąĖą║ą╗ą░ą┤ąĖ.
BF3 + F– = [BF4]–;┬Ā PF5 + F– = [PF6]–
ąÜąŠą╝ą┐ą╗ąĄą║čüąĮč¢ č¢ąŠąĮąĖ [BF4]– č¢ [PF6]– č¢čüąĮčāčÄčéčī čÅą║ ą▓ čĆąŠąĘčćąĖąĮč¢ čéą░ą║ č¢ ą▓ ą▓čāąĘą╗ą░čģ ą║čĆąĖčüčéą░ą╗č¢čćąĮąĖčģ čĆąĄčłč¢č鹊ą║ čéą░ą║ąĖčģ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüą┐ąŠą╗čāą║ čÅą║
K[BF4] – ą║ą░ą╗č¢ą╣ č鹥čéčĆą░čäą╗čāąŠčĆą▒ąŠčĆą░čé(III)
Na[PF6] – ąĮą░čéčĆč¢ą╣ ą│ąĄą║čüą░čäą╗čāąŠčĆč乊čüčäą░čé(V)
ą×čĆą▒č¢čéą░ą╗čīąĮą░ ą╝ąŠą┤ąĄą╗čī ą░č鹊ą╝ą░ č¢ ą╝ąĄč鹊ą┤ ą▓ą░ą╗ąĄąĮčéąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ą┤ąŠąĘą▓ąŠą╗čÅčÄčéčī ą┐ąŠčÅčüąĮąĖčéąĖ čāčéą▓ąŠčĆąĄąĮąĮčÅ čåąĖčģ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓ ą▓ čéą░ą║ąĖą╣ čüą┐ąŠčüč¢ą▒. ąÉč鹊ą╝ ą▒ąŠčĆčā B (2s22p1) č¢ ą░č鹊ą╝ č乊čüč乊čĆčā P (3s23p3) ą┐ąĄčĆąĄčģąŠą┤čÅčéčī ą▓ ąĘą▒čāą┤ąČąĄąĮąĖą╣ čüčéą░ąĮ B* (2s12p2) čéą░ P* (3s13p33d1) č¢ č乊čĆą╝čāčÄčéčī Žā-ąĘą▓’čÅąĘąŠą║ ąĘą░ čĆč¢ą▓ąĮąŠčåč¢ąĮąĮąĖą╝ ą╝ąĄčģą░ąĮč¢ąĘą╝ąŠą╝ ąĘ čéčĆčīąŠą╝ą░ č¢ ą┐’čÅčéčīą╝ą░ ą░č鹊ą╝ą░ą╝ąĖ čäą╗čāąŠčĆčā F (2s22p5). ą×čéčĆąĖą╝ą░ąĮč¢ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą┐čĆąŠčüčéąĖčģ čüą┐ąŠą╗čāą║ BF3 č¢ PF6 ą┐čĆąĖčöą┤ąĮčāčÄčéčī ą┐ąŠ ąŠą┤ąĮąŠą╝čā čäą╗čāąŠčĆąĖą┤ č¢ąŠąĮčā F– (2s22p6). ąÆąĖąĮąĖą║ą░čÄčéčī ą║ąŠą╝ą┐ą╗ąĄą║čüąĮč¢ č¢ąŠąĮąĖ [BF4]– č¢ [PF6]–.
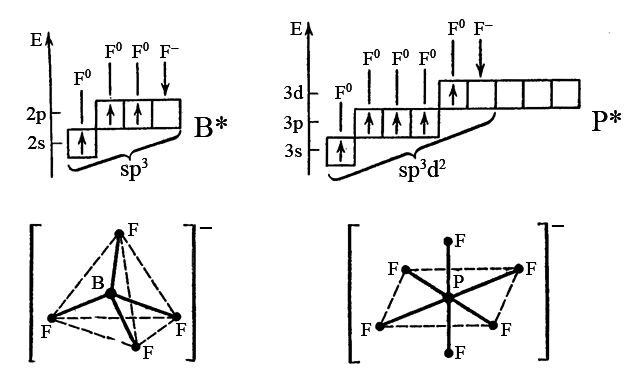
ąåąŠąĮ [BF4]– ą╝ą░čö č鹥čéčĆą░ąĄą┤čĆąĖčćąĮčā č乊čĆą╝čā, ąŠčüą║č¢ą╗čīą║ąĖ ą░č鹊ą╝ ą▒ąŠčĆčā ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ą▓ sp3-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čŚ, ą░ č¢ąŠąĮ [PF6]– – ąŠą║čéą░ąĄą┤čĆąĖčćąĮčā č乊čĆą╝čā, ąŠčüą║č¢ą╗čīą║ąĖ ą░č鹊ą╝ č乊čüč乊čĆčā ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ą▓ sp3d2-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čŚ. ąÜąŠą╝ą┐ą╗ąĄą║čüąĮč¢ č¢ąŠąĮąĖ, čÅą║č¢ čāčéą▓ąŠčĆąĖą╗ąĖčüčÅ, čüčéč¢ą╣ą║č¢čłč¢ č¢ ą╝ąĄąĮčł čĆąĄą░ą║čåč¢ą╣ąĮąŠąĘą┤ą░čéąĮč¢ ąĘą░ ą╝ąŠą╗ąĄą║čāą╗ąĖ BF3 č¢ PF5 ąŠčüą║č¢ą╗čīą║ąĖ čĆąŠąĘčéą░čłčāą▓ą░ąĮąĮčÅ ą░č鹊ą╝č¢ą▓ BIII č¢ PV ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüą░čģ čö ą▒č¢ą╗čīčł čüąĖą╝ąĄčéčĆąĖčćąĮąĖą╝ (ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ BF3 č¢ BF5 ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö čéčĆč¢ą│ąŠąĮą░ą╗čīąĮą░ čéą░ čéčĆąĖą│ąŠąĮą░ą╗čīąĮąŠ-ą▒č¢ą┐č¢čĆą░ą╝č¢ą┤ą░ą╗čīąĮą░ ą│ąĄąŠą╝ąĄčéčĆč¢čÅ). ąÆčüč¢ č湊čéąĖčĆąĖ ąĘą▓’čÅąĘą║ąĖ B-F ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ [BF4]– č¢ ą▓čüč¢ čłč¢čüčéčī ąĘą▓’čÅąĘą║č¢ą▓ P-F ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ [PF6]– ąŠą┤ąĮą░ą║ąŠą▓č¢.
ąóąŠą╣ čüą░ą╝ąĖą╣ ą▓ąĖčüąĮąŠą▓ąŠą║ ą╝ąŠąČąĮą░ ąĘčĆąŠą▒ąĖčéąĖ ąĘą░čüč鹊čüąŠą▓čāčÄčćąĖ ą╝ąĄč鹊ą┤ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣, čÅą║ąĖą╣ čĆąŠąĘą│ą╗čÅą┤ą░čö ą▓čüč¢ ąĘą░ą│ą░ą╗čīąĮč¢ ąĄą╗ąĄą║čéčĆąŠąĮąĮč¢ ą┐ą░čĆąĖ – 4 ą┐ą░čĆąĖ ą▓ [PF4]– č¢ 6 ą┐ą░čĆ ą▓ [PF6]– čÅą║ čéą░ą║č¢, čēąŠ ąĘąĮą░čģąŠą┤čÅčéčīčüčÅ ąĮą░ ą┐ŌĆÖčÅčéąĖčåąĄąĮčéčĆąŠą▓ąĖčģ č¢ čüąĄą╝ąĖčåąĄąĮčéčĆąŠą▓ąĖčģ ąĘą▓ŌĆÖčÅąĘčāčÄčćąĖčģ ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗čÅčģ.
ąÜąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüą┐ąŠą╗čāą║ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ ąĮąĄą╝ąĄčéą░ą╗č¢ą▓ ą▓č¢ą┤ąĮąŠčüąĮąŠ ąĮąĄą▒ą░ą│ą░č鹊.
ąÜąŠą╝ą┐ą╗ąĄą║čüąĮč¢ čüą┐ąŠą╗čāą║ąĖ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ ą╝ąĄčéą░ą╗č¢ą▓
ąóą░ą║č¢ čüą┐ąŠą╗čāą║ąĖ čłąĖčĆąŠą║ąŠ ą▓č¢ą┤ąŠą╝č¢ č¢ ą┐ąŠčłąĖčĆąĄąĮč¢. ąØą░ą╣čćą░čüčéč¢čłąĄ ą▓ąĮčāčéčĆč¢čłąĮčÅ čüč乥čĆą░ ą▓ čåąĖčģ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüą┐ąŠą╗čāą║ą░čģ ąĘą░čĆčÅą┤ąČąĄąĮą░, č鹊ą▒č鹊 ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčö čüąŠą▒ąŠčÄ ą░ą▒ąŠ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖą╣ ą║ą░čéč¢ąŠąĮ, ą░ą▒ąŠ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖą╣ ą░ąĮč¢ąŠąĮ. ąĀą░ąĘąŠą╝ ąĘ ą▒čāą┤čī-čÅą║ąŠčÄ ąĘąŠą▓ąĮč¢čłąĮčīąŠčÄ čüč乥čĆąŠčÄ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮč¢ č¢ąŠąĮąĖ čāčéą▓ąŠčĆčÄčÄčéčī ą║ąŠą╝ą┐ą╗ąĄą║čüąĮč¢ čüąŠą╗č¢.
ą»ą║ č¢ ą▓ č乊čĆą╝čāą╗ą░čģ ą┐čĆąŠčüčéąĖčģ čüąŠą╗ąĄą╣, ą▓ č乊čĆą╝čāą╗ą░čģ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüąŠą╗ąĄą╣ ąĘą╗č¢ą▓ą░ ąĘą░ą┐ąĖčüčāčÄčéčī č乊čĆą╝čāą╗čā ą║ą░čéč¢ąŠąĮą░, ą░ ą┐čĆą░ą▓ąŠčĆčāčć – č乊čĆą╝čāą╗čā ą░ąĮč¢ąŠąĮą░.
ą¤čĆąĖą║ą╗ą░ą┤ąĖ.
[Cu(NH3)4]SO4 – č鹥čéčĆą░ą░ą╝č¢ąĮą║čāą┐čĆčāą╝(II) čüčāą╗čīčäą░čé
K3[Fe(CN)6] – ą║ą░ą╗č¢ą╣ ą│ąĄą║čüą░čåč¢ą░ąĮąŠč乥čĆą░čé(III)
ąŻ č乊čĆą╝čāą╗č¢ ą║ąŠą╝ą┐ą╗ąĄą║čüčā čüąĖą╝ą▓ąŠą╗ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ ąĘą░ą▓ąČą┤ąĖ čüč鹊čŚčéčī ąĮą░ ą┐ąĄčĆčłąŠą╝čā ą╝č¢čüčåč¢ (ąĘą╗č¢ą▓ą░), ą░ č乊čĆą╝čāą╗ąĖ ą╗č¢ą│ą░ąĮą┤č¢ą▓ ąĘą░ ąĮąĖą╝:
ąÜąŠą╝ą┐ą╗ąĄą║čü: [Cu(NH3)4]2+; ą”ąĄąĮčéčĆą░ą╗čīąĮąĖą╣ ą░č鹊ą╝: Cu+II; ąøč¢ą│ą░ąĮą┤ąĖ: NH3.
ąÜąŠą╝ą┐ą╗ąĄą║čü: [Fe(CN)6]3-; ą”ąĄąĮčéčĆą░ą╗čīąĮąĖą╣ ą░č鹊ą╝: Fe+III; ąøč¢ą│ą░ąĮą┤ąĖ: CN–.
ąŚą░čĆčÅą┤ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąŠą│ąŠ č¢ąŠąĮą░ ą┤ąŠčĆč¢ą▓ąĮčÄčö ą░ą╗ą│ąĄą▒čĆą░čŚčćąĮč¢ą╣ čüčāą╝č¢ ąĘą░čĆčÅą┤čā (čüčéčāą┐ąĄąĮč¢ ąŠą║ąĖčüąĮąĄąĮąĮčÅ) čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ č¢ ą▓čüč¢čģ ą╣ąŠą│ąŠ ą╗č¢ą│ą░ąĮą┤č¢ą▓
ąæč¢ą╗čīčłč¢čüčéčī ą╝ąĄčéą░ą╗č¢ą▓, čÅą║č¢ čö čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüą░čģ, ą▓č¢ą┤ąĮąŠčüčÅčéčī ą┤ąŠ ą┐ąĄčĆąĄčģč¢ą┤ąĮąĖčģ ą╝ąĄčéą░ą╗č¢ą▓ (ąĄą╗ąĄą╝ąĄąĮčéąĖ ą┐ąŠą▒č¢čćąĮąĖčģ ą┐č¢ą┤ą│čĆčāą┐), čéą░ą║ąĖą╝ čÅą║ č乥čĆčāą╝, ą║ąŠą▒ą░ą╗čīčé, ąĮč¢ą║ąŠą╗, ą┐ą╗ą░čéąĖąĮą░, ą║čāą┐čĆčāą╝, ą░čĆą│ąĄąĮčéčāą╝, ąĘąŠą╗ąŠč鹊, čåąĖąĮą║, ą║ą░ą┤ą╝č¢ą╣, ą╝ąĄčĆą║čāčĆč¢ą╣.
ąÆ čÅą║ąŠčüčéč¢ ą╗č¢ą│ą░ąĮą┤č¢ą▓ ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüą░čģ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ ą╝ąĄčéą░ą╗č¢ą▓ ą╝ąŠąČčāčéčī ą▒čāčéąĖ ą░ą▒ąŠ ąĮąĄą╣čéčĆą░ą╗čīąĮč¢ ą┐ąŠą╗čÅčĆąĮč¢ čćą░čüčéą║ąĖ (ą╝ąŠą╗ąĄą║čāą╗ąĖ), ą░ą▒ąŠ ąĮąĄą│ą░čéąĖą▓ąĮč¢ č¢ąŠąĮąĖ (ą░ąĮč¢ąŠąĮąĖ), ąĮą░ą┐čĆąĖą║ą╗ą░ą┤ ą▓ąŠą┤ą░ H2O (ą┤ąŠąĮąŠčĆąĮąĖą╣ ą░č鹊ą╝ O; [Ni(H2O)6]2+), ą░ą╝ąŠąĮč¢ą░ą║ NH3 (ą┤ąŠąĮąŠčĆąĮąĖą╣ ą░č鹊ą╝ N; [Co(NH3)6]3+), čģą╗ąŠčĆąĖą┤- ą╣ąŠą┤ąĖą┤-č¢ąŠąĮ Cl– I– ([PtCl4]2-, [HgI4]2-), ą│č¢ą┤čĆąŠą║čüąĖą┤ č¢ąŠąĮ OH– (ą┤ąŠąĮąŠčĆąĮąĖą╣ ą░č鹊ą╝ O; [Zn(OH)4]2-), čåč¢ą░ąĮč¢ą┤ č¢ąŠąĮ CN– (ą┤ąŠąĮąŠčĆąĮąĖą╣ ą░č鹊ą╝ C; [Ag(CN)2]–).
ą¤čĆąĖ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéąĖčćąĮč¢ą╣ ą┤ąĖčüąŠčåč¢ą░čåč¢čŚ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüąŠą╗ąĄą╣ čā ą▓ąŠą┤ąĮąŠą╝čā čĆąŠąĘčćąĖąĮč¢ ą▒č¢ą╗čīčłč¢čüčéčī ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ ą║ą░čéč¢ąŠąĮč¢ą▓ ą░ą▒ąŠ ą░ąĮč¢ąŠąĮč¢ą▓ ąĘą▒ąĄčĆč¢ą│ą░čö čüą▓č¢ą╣ čüą║ą╗ą░ą┤. ą×ą┤ąĮą░ą║ ą┐čĆąĖ ą┐ąĄą▓ąĮąĖčģ čāą╝ąŠą▓ą░čģ (č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░, pH čĆąŠąĘčćąĖąĮčā, č¢ąĮčłč¢ čĆąĄą░ą│ąĄąĮčéąĖ) ą▓ąŠąĮąĖ ą╝ąŠąČčāčéčī čĆąŠąĘą║ą╗ą░ą┤ą░čéąĖčüčÅ ąĮą░ čüą║ą╗ą░ą┤ąŠą▓č¢ čćą░čüčéąĖąĮąĖ ą░ą▒ąŠ čāčéą▓ąŠčĆčÄą▓ą░čéąĖ ąĮąŠą▓č¢ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ.
ą¤čĆąĖą║ą╗ą░ą┤ąĖ.
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-
[Cu(NH3)4]SO4 ŌåÆ CuSO4 + NH3
[Cu(NH3)4]2+ + 4H3O+ = [Cu(H2O)4]2+ + 4NH4+
[Ag(NH3)2]+ + I– + 2H2O = AgI + 2NH3*H2O
[Ag(NH3)2]+ + 2CN– + 2H2O = [Ag(CN)2]– + 2NH3*H2O
[Al(OH)4]– + CO2 = Al(OH)3 + HCO3–
2[Co(NH3)6]2+ + H2O2 = 2[Co(NH3)6]3+ + 2OH–
ąĪą┐ąŠčüąŠą▒ąĖ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüą┐ąŠą╗čāą║ ą▓ąĄą╗čīą╝ąĖ čĆč¢ąĘąĮąŠą╝ą░ąĮč¢čéąĮč¢; ą▓ąŠąĮąĖ ąĘą░ą╗ąĄąČą░čéčī ą▓č¢ą┤ ą▓ą╗ą░čüčéąĖą▓ąŠčüč鹥ą╣ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓, ą░č鹊ą╝ąĖ čÅą║ąĖčģ čö čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ąĖ, č¢ ą╗č¢ą│ą░ąĮą┤č¢ą▓, ą░ čéą░ą║ąŠąČ ą▓č¢ą┤ čüčéč¢ą╣ą║ąŠčüčéč¢ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓.
ą¤čĆąĖą║ą╗ą░ą┤ąĖ.
NiSO4 + 6H2O = [Ni(H2O)6]2+ + SO42-
Co(OH)2 + 6NH3*H2O = [Co(NH3)6]2+ + 2OH– + 6H2O
HgCl2 + 4I– = [HgI4]2- + 2Cl–
[Zn(H2O)4]2+ + 4OH– = [Zn(OH)4]2- + 4H2O
4Ag + 8CN– + 2H2O + O2 = 4 [Ag(CN)2]– + 4OH–
ąÆč¢ą┤ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖčģ čüą┐ąŠą╗čāą║ čüą╗č¢ą┤ ą▓č¢ą┤čĆč¢ąĘąĮčÅčéąĖ ą┐ąŠą┤ą▓č¢ą╣ąĮč¢ čüąŠą╗č¢, čÅą║č¢ čā ą▓ąŠą┤ąĮąŠą╝čā čĆąŠąĘčćąĖąĮč¢ ą┤ąĖčüąŠčåč¢čÄčÄčéčī ąĮą░ ą▓čüč¢ ą▓ąĖą┤ąĖ č¢ąŠąĮč¢ą▓, čÅą║č¢ ą▓čģąŠą┤čÅčéčī ą┤ąŠ čŚčģ čüą║ą╗ą░ą┤čā.
ą¤čĆąĖą║ą╗ą░ą┤ąĖ.
ąōą░ą╗čāąĮ KAl(SO4)2*12H2O = K+ + Al3+ + 2SO42- + 12H2O
ąÜą░čĆąĮą░ą╗č¢čé KMgCl3*6H2O = K+ + Mg2+ + 3Cl– + 6H2O
ążąŠčĆą╝čāą▓ą░ąĮąĮčÅ čģč¢ą╝č¢čćąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ą▓ ą▒č¢ą╗čīčłąŠčüčéč¢ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ ą░č鹊ą╝ąŠą╝ ą╝ąĄčéą░ą╗čā ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą┐čĆąĖ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąŠą╝čā čéčÅąČč¢ąĮąĮč¢ ą╝č¢ąČ ą┐ąŠąĘąĖčéąĖą▓ąĮąŠ ąĘą░čĆčÅą┤ąČąĄąĮąĖą╝ąĖ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ ą░č鹊ą╝ąŠą╝ č¢ č¢ąŠąĮąĮąĖą╝ąĖ ą╗č¢ą│ą░ąĮą┤ą░ą╝ąĖ ą░ą▒ąŠ ąĮąĄą╣čéčĆą░ą╗čīąĮąĖą╝ąĖ ą╗č¢ą│ą░ąĮą┤ą░ą╝ąĖ – ą┐ąŠą╗čÅčĆąĮąĖą╝ąĖ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ, čÅą║č¢ ąŠčĆč¢čöąĮčéčāčÄčéčīčüčÅ ą┤ąŠ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝čā ąĮąĄą│ą░čéąĖą▓ąĮąĖą╝ ą║č¢ąĮčåąĄą╝ ą┤ąĖą┐ąŠą╗čÅ.
ą¤čĆąĖą║ą╗ą░ą┤.
ąŻ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮč¢ą╣ čüą┐ąŠą╗čāčåč¢ [Cu(H2O)4]SO4*H2O – ą│č¢ą┤čĆą░čé č鹥čéčĆą░ą░ą║ą▓ą░ą║čāą┐čĆčāą╝(II) čüčāą╗čīčäą░čé, č湊čéąĖčĆąĖ ą╝ąŠą╗ąĄą║čāą╗ąĖ ą▓ąŠą┤ąĖ ą▓ čÅą║ąŠčüčéč¢ ą╗č¢ą│ą░ąĮą┤č¢ą▓ ąĘą▓’čÅąĘčāčÄčéčīčüčÅ ąĘ ą░č鹊ą╝ą░ą╝ąĖ CuII ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüąĮąĖą╣ ą║ą░čéč¢ąŠąĮ, ą░ ą┐’čÅčéą░ ą╝ąŠą╗ąĄą║čāą╗ą░ ą▓ąŠą┤ąĖ č湥čĆąĄąĘ ą│č¢ą┤čĆąŠą│ąĄąĮąŠą▓ąĖą╣ ąĘą▓’čÅąĘąŠą║ ą┐čĆąĖčöą┤ąĮčāčöčéčīčüčÅ ą┤ąŠ čüčāą╗čīčäą░čé-č¢ąŠąĮą░.
ąÜąŠą▓ą░ą╗ąĄąĮčéąĮč¢ ąĘą▓’čÅąĘą║ąĖ ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüą░čģ ą▓ąĖąĮąĖą║ą░čÄčéčī ą┐čĆąĖ čāąĘą░ą│ą░ą╗čīąĮąĄąĮąĮč¢ ąĮąĄą┐ąŠą┤č¢ą╗ąĄąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮąĮąĖčģ ą┐ą░čĆ ą┤ąŠąĮąŠčĆąĮąĖčģ ą░č鹊ą╝č¢ą▓ ą╗č¢ą│ą░ąĮą┤č¢ą▓; čåąĄąĮčéčĆą░ą╗čīąĮąĖą╣ ą░č鹊ą╝ ą▓ąĖą║ąŠąĮčāčö čäčāąĮą║čåč¢čÄ ą░ą║čåąĄą┐č鹊čĆą░, ąĮą░ą┤ą░čÄčćąĖ čüą▓ąŠčŚ ą░č鹊ą╝ąĮč¢ ąŠčĆą▒č¢čéą░ą╗č¢ ą▓ą░ą╗ąĄąĮčéąĮąĖčģ ą┐č¢ą┤čĆč¢ą▓ąĮč¢ą▓. ą×čüąŠą▒ą╗ąĖą▓ąŠ čüčéč¢ą╣ą║ąĖą╝ąĖ ą▓ąĖčÅą▓ą╗čÅčÄčéčīčüčÅ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ, ą▓ čÅą║ąĖčģ 4, 8, 12 ą░ą▒ąŠ 16 ąĘą▓’čÅąĘčāčÄčćąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, čēąŠ č¢ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö ą┐ąŠčłąĖčĆąĄąĮąĖą╝ ą║ąŠąŠčĆą┤ąĖąĮą░čåč¢ą╣ąĮąĖą╝ čćąĖčüą╗ą░ą╝ čåąĄąĮčéčĆą░ą╗čīąĮąĖčģ ą░č鹊ą╝č¢ą▓ 2, 4, 6 č¢ 8.
ą¤čĆąĖą║ą╗ą░ą┤.
ąŻ ą│ąĄą║čüą░čåč¢ą░ąĮąŠč乥čĆą░čé(II) – č¢ąŠąĮč¢ [Fe(CN)6]4- ą▒č¢ą╗čÅ ą▓č¢ą╗čīąĮąŠą│ąŠ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ FeII ąĘą░ą╗ąĖčłą░čöčéčīčüčÅ 24 ąĄą╗ąĄą║čéčĆąŠąĮą░ (ąĘ 26 ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ąĮąĄą╣čéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ Fe); čłč¢čüčéčī ą╗č¢ą│ą░ąĮą┤č¢ą▓ CN– ąĘą░ čĆą░čģčāąĮąŠą║ čłąĄčüčéąĖ ąĮąĄą┐ąŠą┤č¢ą╗ąĄąĮąĖčģ ą┐ą░čĆ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ ą┤ąŠąĮąŠčĆąĮąĖčģ ą░č鹊ą╝č¢ą▓ C ąĮą░ą┤ą░čÄčéčī ą┤ą╗čÅ čāčéą▓ąŠčĆąĄąĮąĮčÅ čłąĄčüčéąĖ Žā-ąĘą▓’čÅąĘą║č¢ą▓ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ ą░č鹊ą╝ąŠą╝ 12 ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓. ąŻ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ ą░č鹊ą╝ FeII ą╝ą░čö 24 + 12 = 36 ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, č鹊ą▒č鹊 ą▓č¢ąĮ ąĮą░ą▒čāą▓ą░čö čüčéč¢ą╣ą║čā ąĄą╗ąĄą║čéčĆąŠąĮąĮčā ą║ąŠąĮčäč¢ą│čāčĆą░čåč¢čÄ ąĮą░ą╣ą▒ą╗ąĖąČč湊ą│ąŠ ąĮą░čüčéčāą┐ąĮąŠą│ąŠ ą▒ą╗ą░ą│ąŠčĆąŠą┤ąĮąŠą│ąŠ ą│ą░ąĘčā – ą║čĆąĖą┐č鹊ąĮčā Kr (Z = 36). ąŚ čåč¢čöčŚ ą┐čĆąĖčćąĖąĮąĖ ą┤ą░ąĮąĖą╣ ą║ąŠą╝ą┐ą╗ąĄą║čü čö ą┐čĆąĖą║ą╗ą░ą┤ąŠą╝ ą┤čāąČąĄ čüčéč¢ą╣ą║ąĖčģ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓.
ą¤čĆąŠčåąĄčü čāčéą▓ąŠčĆąĄąĮąĮčÅ čģč¢ą╝č¢čćąĮąĖčģ ąĘą▓’čÅąĘą║č¢ą▓ ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüą░čģ ą┐čĆąŠčéč¢ą║ą░čö č湥čĆąĄąĘ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮčā ą▓ąĘą░čöą╝ąŠą┤č¢čÄ č¢ąŠąĮ-č¢ąŠąĮ ą░ą▒ąŠ č¢ąŠąĮ-ą┤č¢ą┐ąŠą╗čī ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąĄ ąĘą▓’čÅąĘčāą▓ą░ąĮąĮčÅ ąĘą░ čĆą░čģčāąĮąŠą║ ą▓ąĘą░čöą╝ąĮąŠą│ąŠ ą┐ąĄčĆąĄą║čĆąĖą▓ą░ąĮąĮčÅ ą░č鹊ą╝ąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ą╗č¢ą│ą░ąĮą┤č¢ą▓ č¢ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░
ą×ą▒ąĖą┤ą▓ą░ ą┐č¢ą┤čģąŠą┤ąĖ ą┤ąŠ ą┐ąŠčÅčüąĮąĄąĮąĮčÅ čüčéč¢ą╣ą║ąŠčüčéč¢ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓ čÅą║ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ č¢ąŠąĮąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā, čéą░ą║ č¢ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā, ą▒čāą┤čāčéčī čüą┐čĆą░ą▓ąĄą┤ą╗ąĖą▓č¢. ą×ą▒ąĖą┤ą▓ą░ čåč¢ ą┐č¢ą┤čģąŠą┤ąĖ ą┐čĆąĖąĘą▓ąŠą┤čÅčéčī ą┤ąŠ ąŠą┤ąĮąŠą│ąŠ ą▓ąĖčüąĮąŠą▓ą║čā – čģč¢ą╝č¢čćąĮąĖą╣ ąĘą▓’čÅąĘąŠą║ ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüą░čģ ą╝ą░čö čéčā čüą░ą╝čā ą┐ąŠą╗čÅčĆąĮąŠ-ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčā ą┐čĆąĖčĆąŠą┤čā, čēąŠ č¢ ą▓ č¢ąĮčłąĖčģ čüą┐ąŠą╗čāą║ą░čģ.
ą¤ąĄčĆąĄą▓ą░ąČą░ąĮąĮčÅ č¢ąŠąĮąĮąŠčŚ čüą║ą╗ą░ą┤ąŠą▓ąŠčŚ ą▓ ąĘą▓’čÅąĘą║čā ąĘą░ą▒ąĄąĘą┐ąĄčćčāčö ą▓č¢ą┤ąĮąŠčüąĮčā čĆčāčģą╗ąĖą▓č¢čüčéčī ą╗č¢ą│ą░ąĮą┤č¢ą▓; čéą░ą║č¢ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ ą╝ą░ą╗ąŠ čüčéč¢ą╣ą║ąĖą╣. ąÆąĖčüąŠą║ąĖą╣ čüčéčāą┐č¢ąĮčī ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠčüčéč¢ ąŠą▒čāą╝ąŠą▓ą╗čÄčö ą▓ąĖčüąŠą║čā ą╝č¢čåąĮč¢čüčéčī ąĘą▓’čÅąĘą║č¢ą▓ ą╗č¢ą│ą░ąĮą┤č¢ą▓ ąĘ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ ą░č鹊ą╝ąŠą╝ č¢, čÅą║ ąĮą░čüą╗č¢ą┤ąŠą║, ą▓ąĖčüąŠą║čā čüčéč¢ą╣ą║č¢čüčéčī ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓. ą£č¢ąČ ąŠą▒ąŠą╝ą░ čéąĖą┐ą░ą╝ąĖ ąĘą▓’čÅąĘčāą▓ą░ąĮąĮčÅ (čÅą║č¢ ąĮč¢ą║ąŠą╗ąĖ ąĮąĄ ąĘą┤č¢ą╣čüąĮčÄčÄčéčīčüčÅ ą▓ čćąĖčüč鹊ą╝čā ą▓ąĖą│ą╗čÅą┤č¢) ąĮąĄą╝ą░čö čĆč¢ąĘą║ąŠą│ąŠ čĆąŠąĘą╝ąĄąČčāą▓ą░ąĮąĮčÅ, ą░ čüčéčāą┐č¢ąĮčī č¢ąŠąĮąĮąŠčüčéč¢ (ą░ą▒ąŠ čüčéčāą┐č¢ąĮčī ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠčüčéč¢) ąĘą▓’čÅąĘą║č¢ą▓ ą▓ąĖąĘąĮą░čćą░čöčéčīčüčÅ čģč¢ą╝č¢čćąĮąŠčÄ ą┐čĆąĖčĆąŠą┤ąŠčÄ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ č¢ ą╗č¢ą│ą░ąĮą┤č¢ą▓.
ą¤čĆąĖą║ą╗ą░ą┤ąĖ čāčéą▓ąŠčĆąĄąĮąĮčÅ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓ ąĘ ą┐ąĄčĆąĄą▓ą░ąČąĮąŠ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąĖą╝ č¢ ąĘ ą┐ąĄčĆąĄą▓ą░ąČąĮąŠ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąĖą╝ ąĘą▓’čÅąĘčāą▓ą░ąĮąĮčÅą╝.
ąÆ čÅą║ąŠčüčéč¢ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ čĆąŠąĘą│ą╗čÅą┤ą░čöčéčīčüčÅ č乥čĆčāą╝ ą▓ čüčéčāą┐ąĄąĮč¢ ąŠą║ąĖčüąĮąĄąĮąĮčÅ (+II) č¢ ąĘ ą║ąŠąŠčĆą┤ąĖąĮą░čåč¢ą╣ąĮąĖą╝ čćąĖčüą╗ąŠą╝ 4 ą░ą▒ąŠ 6. ąÜąŠąČąĄąĮ ą╗č¢ą│čĆą░ąĮą┤, ą▓ ąĮą░ą▓ąĄą┤ąĄąĮč¢ą╣ čüčģąĄą╝č¢ (ą┐ąŠąĘąĮą░čćą░čöčéčīčüčÅ ą▒čāą║ą▓ąŠčÄ L) ąĘą░ą╣ą╝ą░čö ąĮą░ą▓ą║ąŠą╗ąŠ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ ąŠą┤ąĮąĄ ą║ąŠąŠčĆą┤ąĖąĮą░čåč¢ą╣ąĮąĄ ą╝č¢čüčåąĄ.
ą£ąŠąĮąŠą┤ąĄąĮčéą░čéąĮč¢ ą╗č¢ą│ą░ąĮą┤ąĖ – čåąĄ ą╗č¢ą│ą░ąĮą┤ąĖ ąĘą░ą╣ą╝ą░čÄčéčī ą╗ąĖčłąĄ 1 ą║ąŠąŠčĆą┤ąĖąĮą░čåč¢ą╣ąĮąĄ ą╝č¢čüčåąĄ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ (H2O, NH3, CN–).
ą¤ąŠą╗č¢ą┤ąĄąĮčéą░čéąĮč¢ ą╗č¢ą│ą░ąĮą┤ąĖ – čåąĄ ą╗č¢ą│ą░ąĮą┤ąĖ, ą║ąŠąČąĄąĮ ąĘ čÅą║ąĖčģ ąĘą░ą╣ą╝ą░čö 2 (ą▒č¢-), 3 (čéčĆąĖ-) č¢ ą▒č¢ą╗čīčłčā ą║č¢ą╗čīą║č¢čüčéčī ą║ąŠąŠčĆą┤ąĖąĮą░čåč¢ą╣ąĮąĖčģ ą╝č¢čüčåčī čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░ (NH2CH2CH2NH2 – ą▒č¢ą┤ąĄąĮčéą░čéąĮąĖą╣ ą╗č¢ą│ą░ąĮą┤, ą╝ą░čö ą┤ą▓ą░ ą┤ąŠąĮąŠčĆąĮąĖčģ ą░č鹊ą╝ą░ N).
ąĢą╗ąĄą║čéčĆąŠąĮąĮą░ ą║ąŠąĮčäč¢ą│čāčĆą░čåč¢čÅ ą░č鹊ą╝ą░ FeII ą╝ąŠąČąĄ ą▒čāčéąĖ ąĮą░čüčéčāą┐ąĮąŠčÄ (ą▓ą░ą╗ąĄąĮčéąĮč¢ ą┐č¢ą┤čĆč¢ą▓ąĮč¢ čāą╝ąŠą▓ąĮąŠ ą┐ąŠą║ą░ąĘą░ąĮč¢ ąĮą░ ąŠą┤ąĮč¢ą╣ ą│ąŠčĆąĖąĘąŠąĮčéą░ą╗č¢):
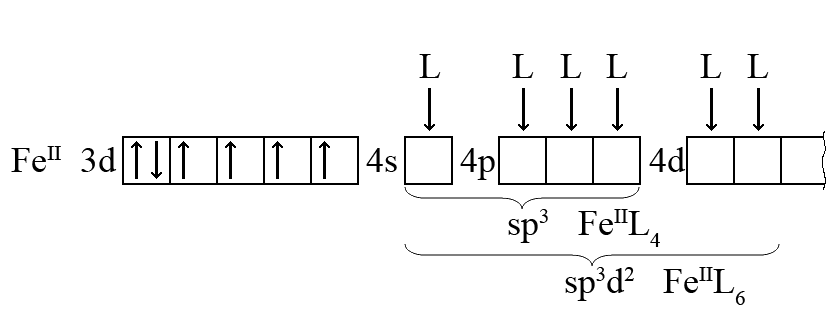
ąØąĄą╣čéčĆą░ą╗čīąĮąĖą╣ ą░č鹊ą╝ Fe (3d64s2) ą┐čĆąĖ ą┐ąĄčĆąĄčģąŠą┤č¢ ą▓ čüčéą░ąĮ FeII (3d6) ą▓čéčĆą░čćą░čö ą┤ą▓ą░ ąĘąŠą▓ąĮč¢čłąĮč¢čģ ąĄą╗ąĄą║čéčĆąŠąĮą░ (4s2). ąÆ čĆąĄąĘčāą╗čīčéą░čéč¢ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąŠą│ąŠ ąĮą░ą▒ą╗ąĖąČąĄąĮąĮčÅ č湊čéąĖčĆčīąŠčģ ą░ą▒ąŠ čłąĄčüčéąĖ ą╗č¢ą│ą░ąĮą┤č¢ą▓ čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ [FeIIL4] ą░ą▒ąŠ [FeIIL6] ąĘč¢ čüą╗ą░ą▒ą║ąĖą╝ąĖ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąĖą╝ąĖ ąĘą▓’čÅąĘą║ą░ą╝ąĖ. ąōąĄąŠą╝ąĄčéčĆąĖčćąĮą░ č乊čĆą╝ą░ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓ ą▒čāą┤ąĄ ą░ą▒ąŠ č鹥čéčĆą░ąĄą┤čĆąĖčćąĮąŠčÄ (sp3-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čÅ), ą░ą▒ąŠ ąŠą║čéą░ąĄą┤čĆąĖčćąĮąŠčÄ (sp3d2-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čÅ). ąØą░čÅą▓ąĮč¢čüčéčī č湊čéąĖčĆčīąŠčģ ąĮąĄčüą┐ą░čĆąĄąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ čā ą░č鹊ą╝ą░ FeII ą┐čĆąĖąĘą▓ąŠą┤ąĖčéčī ą┤ąŠ čüąĖą╗čīąĮąŠą│ąŠ ą▓č¢ą┤čłč鹊ą▓čģčāą▓ą░ąĮąĮčÅ ą╗č¢ą│ą░ąĮą┤č¢ą▓ č¢, ąŠčéąČąĄ, ą┤ąŠ čüąĖą╗čīąĮąŠ ą┐ąŠą╗čÅčĆąĮąŠą│ąŠ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠą│ąŠ ąĘą▓’čÅąĘą║čā Fe-L.
ąøč¢ą│ą░ąĮą┤ąĖ, čÅą║č¢ ąĮąĄ ą▓ąĖą║ą╗ąĖą║ą░čÄčéčī čüą┐ą░čĆčÄą▓ą░ąĮąĮčÅ ą▓ą░ą╗ąĄąĮčéąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░, ąĮą░ąĘąĖą▓ą░čÄčéčīčüčÅ ą╗č¢ą│ą░ąĮą┤ąĖ ąĘč¢ čüą╗ą░ą▒ą║ąĖą╝ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąĖą╝ ą┐ąŠą╗ąĄą╝; ą┤ąŠ ąĮąĖčģ ą▓č¢ą┤ąĮąŠčüčÅčéčīčüčÅ, ąĮą░ą┐čĆąĖą║ą╗ą░ą┤, F–, Cl–, I–, H2O. ąóą░ą║č¢ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ, čÅą║ [FeCl4]2- ą░ą▒ąŠ [Fe(H2O)6]2-, ąĮą░ąĘąĖą▓ą░čÄčéčīčüčÅ ą▓ąĖčüąŠą║ąŠčüą┐č¢ąĮąŠą▓č¢ (ą▒ą░ą│ą░č鹊 ąĮąĄčüą┐ą░čĆąĄąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓), ą░ą▒ąŠ ąĘąŠą▓ąĮč¢čłąĮčīąŠąŠčĆą▒č¢čéą░ą╗čīąĮč¢ (ą▓č¢ą┤ ą░č鹊ą╝ą░ FeII ą▓ čāčéą▓ąŠčĆąĄąĮąĮč¢ ąĘą▓’čÅąĘą║č¢ą▓ ą▒ąĄčĆčāčéčī čāčćą░čüčéčī čéč¢ą╗čīą║ąĖ ą░č鹊ą╝ąĮč¢ ąŠčĆą▒č¢čéą░ą╗č¢ č湥čéą▓ąĄčĆč鹊ą│ąŠ, ąĘąŠą▓ąĮč¢čłąĮčīąŠą│ąŠ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ čĆč¢ą▓ąĮčÅ).
ąåčüąĮčāčÄčéčī ą╗č¢ą│ą░ąĮą┤ąĖ č¢ č¢ąĮčłąŠą│ąŠ čéąĖą┐čā, čÅą║č¢ ą▓ąĖą║ą╗ąĖą║ą░čÄčéčī čüą┐ą░čĆčÄą▓ą░ąĮąĮčÅ ą▓ą░ą╗ąĄąĮčéąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ čåąĄąĮčéčĆą░ą╗čīąĮąŠą│ąŠ ą░č鹊ą╝ą░, ąŠčüą║č¢ą╗čīą║ąĖ ą╝ą░čÄčéčī čüąĖą╗čīąĮąĄ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąĄ ą┐ąŠą╗ąĄ. ąóą░ą║, čåąĄąĮčéčĆą░ą╗čīąĮąĖą╣ ą░č鹊ą╝ FeII ą┐čĆąĖ ąĮą░ą▒ą╗ąĖąČąĄąĮąĮč¢ ą╗č¢ą│ą░ąĮą┤č¢ą▓ ąĘ čüąĖą╗čīąĮąĖą╝ ąĄą╗ąĄą║čéčĆąŠčüčéą░čéąĖčćąĮąĖą╝ ą┐ąŠą╗ąĄą╝ čāčéą▓ąŠčĆčÄčö ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ ą▓ ąĮą░čüčéčāą┐ąĮč¢ą╣ ąĄą╗ąĄą║čéčĆąŠąĮąĮč¢ą╣ ą║ąŠąĮčäč¢ą│čāčĆą░čåč¢čŚ:

ąōąĄąŠą╝ąĄčéčĆąĖčćąĮą░ č乊čĆą╝ą░ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ą▓ FeIIL6 čéą░ą║ąŠąČ ąŠą║čéą░ąĄą┤čĆąĖčćąĮą░, ą░ą╗ąĄ čéąĖą┐ ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čŚ č¢ąĮčłąĖą╣ – d2sp3-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čÅ. ąÆč¢ą┤čüčāčéąĮč¢čüčéčī ąĮąĄčüą┐ą░čĆąĄąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ čā ą░č鹊ą╝ą░ FeII ą┐čĆąĖąĘą▓ąŠą┤ąĖčéčī ą┤ąŠ čüąĖą╗čīąĮąŠą│ąŠ čéčÅąČč¢ąĮąĮčÅ ą╗č¢ą│ą░ąĮą┤č¢ą▓, čéą░ą║ąĖčģ čÅą║ CN–. ąÜąŠą╝ą┐ą╗ąĄą║čüąĖ ąĘ ą▓č¢ą┤čüčāčéąĮč¢čüčéčÄ ąĮąĄčüą┐ą░čĆąĄąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓ čéąĖą┐čā [Fe(CN)6]4- ą░ą▒ąŠ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ ąĘ č¢ąĮčłąĖą╝ąĖ čåąĄąĮčéčĆą░ą╗čīąĮąĖą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ, čēąŠ ą╝ą░čÄčéčī ąĮąĄąĘąĮą░čćąĮčā ą║č¢ą╗čīą║č¢čüčéčī ąĮąĄčüą┐ą░čĆąĄąĮąĖčģ ąĄą╗ąĄą║čéčĆąŠąĮč¢ą▓, ąĮą░ąĘąĖą▓ą░čÄčéčīčüčÅ ąĮč¢ąĘčīą║ąŠčüą┐č¢ąĮąŠą▓č¢ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ, ą░ą▒ąŠ ą▓ąĮčāčéčĆč¢čłąĮčīąŠčĆą▒č¢čéą░ą╗čīąĮč¢ ą║ąŠą╝ą┐ą╗ąĄą║čüąĖ (ą▓ čāčéą▓ąŠčĆąĄąĮąĮč¢ ąĘą▓’čÅąĘą║č¢ą▓ ą▒ąĄčĆčāčéčī čāčćą░čüčéčī ąŠčĆą▒č¢čéą░ą╗č¢ ą▓ąĮčāčéčĆč¢čłąĮčīąŠą│ąŠ ąĄąĮąĄčĆą│ąĄčéąĖčćąĮąŠą│ąŠ čĆč¢ą▓ąĮčÅ, ą▓ ą┤ą░ąĮąŠą╝čā ą┐čĆąĖą║ą╗ą░ą┤č¢ – 3d-ą░č鹊ą╝ąĮč¢ ąŠčĆą▒č¢čéą░ą╗č¢ č乥čĆčāą╝čā).
ąŻčćą░čüčéčī (n – 1) d-ą░č鹊ą╝ąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ą░ą▒ąŠ nd-ą░č鹊ą╝ąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ ą╝ąĄčéą░ą╗čā ą▓ čāčéą▓ąŠčĆąĄąĮąĮč¢ ąĘą▓’čÅąĘą║č¢ą▓ ąĘ ą╗č¢ą│ą░ąĮą┤ą░ą╝ąĖ ą┐čĆąĖčéą░ą╝ą░ąĮąĮąŠ, ą▓ ą┐ąĄčĆčłčā č湥čĆą│čā, ą┤ą╗čÅ ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓ ą┐ąŠą▒č¢čćąĮąĖčģ ą┐č¢ą┤ą│čĆčāą┐, čģąŠčćą░ ąĘčāčüčéčĆč¢čćą░čöčéčīčüčÅ č¢ čā ąĄą╗ąĄą╝ąĄąĮčéč¢ą▓ ą│ąŠą╗ąŠą▓ąĮąĖčģ ą│čĆčāą┐ (sp3d2-ą│č¢ą▒čĆąĖą┤ąĖąĘą░čåč¢čÅ ą░č鹊ą╝ąĮąĖčģ ąŠčĆą▒č¢čéą░ą╗ąĄą╣ č乊čüč乊čĆčā ą▓ ą║ąŠą╝ą┐ą╗ąĄą║čüč¢ [PF6]–).










