Среди элементов, атомы которого не являются центральными в молекулах неорганических соединений, наиболее распространенным является атом кислорода. Атом кислорода O (2s22p4) имеет на 2p-подуровне два неспаренных электрона, один из которых принимает участие в образовании σ-связи, а другой – в образовании π-связи.
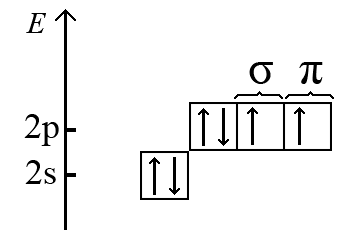
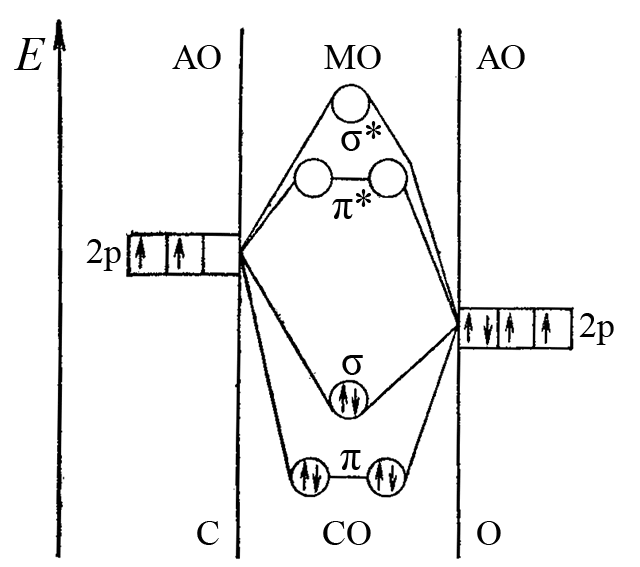
Если молекула содержит два атома, один из которых кислород, например молекула CO, то σ- и π-составляющие связи в этой молекуле являются двуцентровыми. По методу молекулярных орбиталей образование тройной связи углерод-кислород в молекуле CO описывается энергетической диаграммой представленной на рисунке ниже.
Образование связей элемент-кислород в кислородсодержащих соединениях, молекулы которых состоят из трех и более атомов двух разных элементов, практически удобно рассматривать, совмещая метод валентных связей (двуцентровые σ-связи и геометрия молекул) и метод молекулярных орбиталей (многоцентровые π-связи).
Например, формирование связей в молекуле триоксида серы SO3 устанавливается следующим образом. Принимается во внимание, что степень окисления центрального атома серы в этой молекуле равна +VI, и что его внешний энергетический уровень изображается с учетом потери числа электронов, равного степени окисления (для атома S+VI потеря всех его валентных электронов 3s23p4 → 3s03p0). При образовании молекулы SO3 формируется нужное число σ-связей по донорно-акцепторному механизму, при этом атом S+VI будет акцептором электронной пары, а атомы O-II (2s22p6) – донорами.
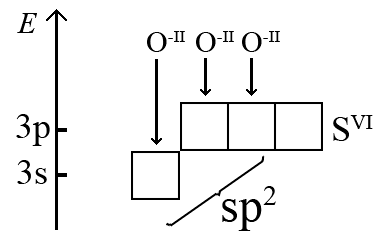
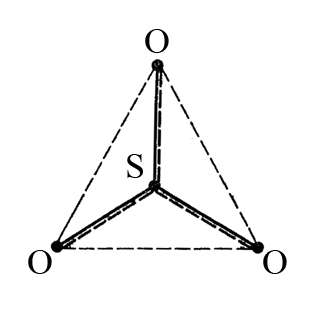
Отсюда следует, что молекула триоксида серы имеет тригональную форму, но, помимо трех σ-связей сера-кислород, образуется четырехцентровая π-молекулярная система, которую изображают пунктиром вдоль линии σ-связи (на рисунке наглядное изображение делокализации π-электронов).
–ê–Ω–∞–ª–æ–≥–∏—á–Ω–æ —É—Å—Ç–∞–Ω–∞–≤–ª–∏–≤–∞–µ—Ç—Å—è –ª–∏–Ω–µ–π–Ω–æ–µ —Å—Ç—Ä–æ–µ–Ω–∏–µ –º–æ–ª–µ–∫—É–ª—ã CO2 (sp-–≥–∏–±—Ä–∏–¥–∏–∑–∞—Ü–∏—è –æ—Ä–±–∏—Ç–∞–ª–µ–π –∞—Ç–æ–º–∞ C), –∞ —Ç–∞–∫–∂–µ –≥–µ–æ–º–µ—Ç—Ä–∏—è –∫–∏—Å–ª–æ—Ä–æ–¥—Å–æ–¥–µ—Ä–∂–∞—â–∏—Ö –∞–Ω–∏–æ–Ω–æ–≤ (–∫–∏—Å–ª–æ—Ç–Ω—ã—Ö –æ—Å—Ç–∞—Ç–∫–æ–≤), –Ω–∞–ø—Ä–∏–º–µ—Ä –∫–∞—Ä–±–æ–Ω–∞—Ç-–∏–æ–Ω–æ–≤ CO32- (sp2-–≥–∏–±—Ä–∏–¥–∏–∑–∞—Ü–∏—è –æ—Ä–±–∏—Ç–∞–ª–µ–π –∞—Ç–æ–º–∞ C) –∏ —Å—É–ª—å—Ñ–∞—Ç-–∏–æ–Ω–æ–≤ SO42- (sp3-–≥–∏–±—Ä–∏–¥–∏–∑–∞—Ü–∏—è –æ—Ä–±–∏—Ç–∞–ª–µ–π –∞—Ç–æ–º–∞ S)
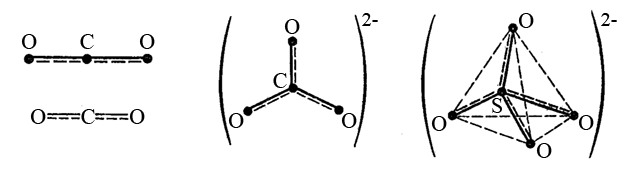
–°–ª–µ–¥—É–µ—Ç –æ–±—Ä–∞—Ç–∏—Ç—å –≤–Ω–∏–º–∞–Ω–∏–µ, —á—Ç–æ –Ω–µ –≤—Å–µ–≥–¥–∞ –≤–µ—Ä—à–∏–Ω—ã –≥–µ–æ–º–µ—Ç—Ä–∏—á–µ—Å–∫–æ–π —Ñ–∏–≥—É—Ä—ã –∑–∞–Ω—è—Ç—ã –±–æ–∫–æ–≤—ã–º–∏ –∞—Ç–æ–º–∞–º–∏. –ù–∞–ø—Ä–∏–º–µ—Ä –¥–∏–æ–∫—Å–∏–¥ —Å–µ—Ä—ã SO2 –∏ —Å—É–ª—å—Ñ–∏—Ç-–∏–æ–Ω SO32-. –û–Ω–∏ —Å–æ–¥–µ—Ä–∂–∞—Ç –∞—Ç–æ–º S+IV (3s23p0), –∫–æ—Ç–æ—Ä—ã–π –Ω–∞ –≤–∞–ª–µ–Ω—Ç–Ω–æ–º —ç–Ω–µ—Ä–≥–µ—Ç–∏—á–µ—Å–∫–æ–º —É—Ä–æ–≤–Ω–µ —Å–æ–¥–µ—Ä–∂–∏—Ç –Ω–µ–ø–æ–¥–µ–ª–µ–Ω–Ω—É—é –ø–∞—Ä—É —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤. –≠—Ç–∞ –ø–∞—Ä–∞ —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤ –∑–∞–Ω–∏–º–∞–µ—Ç –æ–¥–Ω—É –∏–∑ –≥–∏–±—Ä–∏–¥–Ω—ã—Ö –æ—Ä–±–∏—Ç–∞–ª–µ–π –∞—Ç–æ–º–∞ S+IV (–≤ —Å–æ—Å—Ç–æ—è–Ω–∏–∏ sp2-–≥–∏–±—Ä–∏–¥–∏–∑–∞—Ü–∏–∏ –¥–ª—è SO2 –∏ –≤ —Å–æ—Å—Ç–æ—è–Ω–∏–∏ sp3-–≥–∏–±—Ä–∏–¥–∏–∑–∞—Ü–∏–∏ –¥–ª—è SO32-). –ì–µ–æ–º–µ—Ç—Ä–∏—á–µ—Å–∫–∏–µ —Ñ–æ—Ä–º—ã —ç—Ç–∏—Ö —á–∞—Å—Ç–∏—Ü —Å–ª–µ–¥—É—é—â–∏–µ:
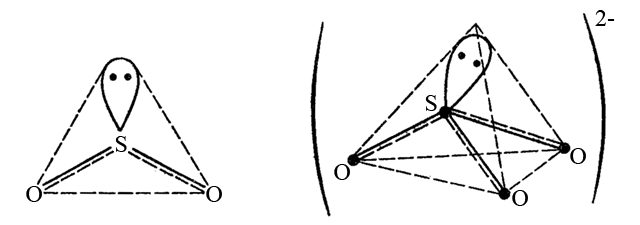
–í –æ—Ç–ª–∏—á–∏–µ –æ—Ç SO3 –∏ SO42-, –∏–º–µ—é—â–∏—Ö —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤–µ–Ω–Ω–æ –∑–∞–≤–µ—Ä—à–µ–Ω–Ω—É—é —Ç—Ä–∏–≥–æ–Ω–∞–ª—å–Ω—É—é –∏ —Ç–µ—Ç—Ä–∞—ç–¥—Ä–∏—á–µ—Å–∫—É—é —Ñ–æ—Ä–º—ã (–≤—Å–µ –≤–µ—Ä—à–∏–Ω—ã –º–Ω–æ–≥–æ–≥—Ä–∞–Ω–Ω–∏–∫–æ–≤ –∑–∞–Ω—è—Ç—ã –∞—Ç–æ–º–∞–º–∏ –∫–∏—Å–ª–æ—Ä–æ–¥–∞), SO2 –∏ SO32- –æ–±–ª–∞–¥–∞—é—Ç –Ω–µ–∑–∞–≤–µ—Ä—à–µ–Ω–Ω–æ–π —Ç—Ä–∏–≥–æ–Ω–∞–ª—å–Ω–æ–π –∏ —Ç–µ—Ç—Ä–∞—ç–¥—Ä–∏—á–µ—Å–∫–æ–π –≥–µ–æ–º–µ—Ç—Ä–∏–µ–π —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤–µ–Ω–Ω–æ. –ù–µ–ø–æ–¥–µ–ª–µ–Ω–Ω—ã–µ –ø–∞—Ä—ã —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤ –Ω–∞ –≥–∏–±—Ä–∏–¥–Ω—ã—Ö –∞—Ç–æ–º–Ω—ã—Ö –æ—Ä–±–∏—Ç–∞–ª—è—Ö —è–≤–ª—è—é—Ç—Å—è —Ä–µ–∞–∫—Ü–∏–æ–Ω–Ω–æ—Å–ø–æ—Å–æ–±–Ω—ã–º–∏ –∏ —Ç–∞–∫–∂–µ –º–æ–≥—É—Ç –æ–±—Ä–∞–∑–æ–≤—ã–≤–∞—Ç—å —Ö–∏–º–∏—á–µ—Å–∫–∏–µ —Å–≤—è–∑–∏.










