Натрий Na в виде металла впервые получен в 1807 году (Деви, Англия) при электролизе расплава гидроксида натрия с помощью вольтова столба.
Распространение натрия в природе. Натрий – шестой элемент по распространению в земной коре, где он находится только в виде соединений. Входит в состав минералов, соляных пластов, живых организмов, содержится в природных водах (10,6 грамм ионов Na+ в 1 дм3 морской воды).
Минералы натрия: Галит (каменная соль) NaCl; Нитронатрит (натронная или чилийская селитра) NaNO3; Криолит Na3[AlF6]; Альбит (натриевый полевой шпат) Na(AlSiO3O8).
Происхождение и состав соляных пластов. Нерастворимые силикатные минералы, содержащие щелочные элементы, например группа полевых шпатов, которые находятся на поверхности Земли, постоянно подвергаются выветриванию – поглощают воду и образуют глины и растворимые соли щелочных элементов. Эти соли с водой рек и ручьев переносятся в озера, моря и океаны. Испарение воды приводит к выпадению кристаллов различных солей из прибрежных вод и образованию пластов.
Порядок расположения солей в пластах определяется растворимостью: наименее растворимые соли расположены снизу (обычно это ангидрит CaSO4); над мощными пластами галита NaCl могут находиться некоторые соли калия и магния. Между пластами отдельных солей обычно имеются слои глин и песчаников.
Добыча природных солей. Разработку соляных пластов, в частности каменной соли проводят либо методом взрывного разрушения и извлечения твердой соли, либо методом растворения соли под землей, откачиванием рассола – концентрированного раствора соли и его выпаривания.
Обнаружение натрия. По интенсивно-желтому окрашиванию пламени, которое исчезает при рассмотрении его через кобальтовое (синее) стекло.
Физиологическое действие натрия. Натрий – жизненно важный элемент для всех животных и некоторых растений; ионы Na+ содержатся в плазме крови и в лимфе, в отличие от ионов K+ всегда находятся вне клеток.
Получение натрия. Электролиз расплава NaOH или смеси NaCl + CaCl2; в качестве материала катода используют либо твердое железо, либо жидкий свинец (в последнем случае натрий отделяют от свинца дистилляцией).
Свойства натрия. Натрий – металл с серебристым глянцем. Мягкий, режется ножом. Пар натрия окрашен в темно-красный цвет. На воздухе поверхность металла быстро покрывается слоем NaOH и Na2CO3.
Натрий бурно реагирует с водой
2Na + 2H2O = 2NaOH + H2
Кусочки натрия под действием выделяющейся теплоты реакции (для реакции с твердым натрием ΔH0 = -368 кДж) расплавляются в шарики, которые начинают беспорядочно двигаться по поверхности воды вследствие выделения водорода. Над отдельными участками поверхности происходит самовоспламенение водорода или местные взрывы гремучего газа (характерные щелчки), особенно если шарик жидкого натрия прилипает к стенке сосуда и сильно разогревается. При этом возможно разбрызгивание раствора образующейся щелочи (при работе с натрием необходимо соблюдать осторожность, глаза следует защищать предохранительными очками!).
Взаимодействие натрия с низшими предельными спиртами протекает менее интенсивно, чем с водой (что используется для удаления остатков натрия):
2Na + 2C2H5OH = 2Na(C2H5O) + H2
При нагревании на воздухе и в атмосфере хлора натрий образует соответственно пероксид Na2O2 (Na2O в реакции с кислородом образуется как примесь, для получения Na2O, Na2O2 сплавляют с Na) и хлорид натрия NaCl:
2Na + O2 = Na2O2; 2Na + Cl2 = 2NaCl
Со ртутью натрий образует амальгаму. Натрий растворим в жидком аммиаке.
Применение натрия. Натрий используется в качестве наполнителя натриевых газоразрядных ламп, жидкого теплоносителя в ядерных реакторах, осушителя обычного эфира и других (только безалкогольных) органических растворителей, для получения Na2O2, NaCl, в некоторых органических синтезах.
Соединения натрия
Хлорид натрия NaCl
Распространение в природе хлорида натрия. Хлорид натрия содержится в соляных пластах (галит), природных рассолах, морской воде (ср. 2,7%) и соленом угле (более 12%), в живых организмах.
Добыча хлорида натрия
- Хлорид натрия получают из соляных рассолов выпариванием (выварочная соль). Чаще всего до выпаривания проводят градирование – концентрирование раствора, для чего в специальных башнях – градирнях – соляной рассол разбрызгивают, при этом часть воды испаряется, а малорастворимые соли типа гипса осаждаются. Повторяя эту операцию несколько раз, рассол концентрируют до 20% и затем выпаривают всю воду вакуумных выпарных аппаратах.
- Методом взрывного разрушения из соляных пластов, или растворения под землей с последующим откачиванием рассола и его выпариванием.
- Из морской воды путем упаривания или охлаждения (получение самосадочной соли).
Очистка хлорида натрия. Обычно проводят очистку хлорида натрия от катионов Mg2+ и Ca2+, для чего соль обрабатывают раствором Na2CO3 и осаждают CaCO3 и MgCO3. От анионов SO42- раствор очищают обработкой Ca(OH)2 до осаждения CaSO4.
Физиологическое действие хлорида натрия. В организме человека (в крови и тканях) содержится 150-300 грамм NaCl, ежедневное восполнение составляет 10-15 грамм. Избыточное потребление поваренной соли вредно для здоровья (при болезнях почек пища должна быть бессолевой); острая токсическая доза поваренной соли равна 5 г./кг веса.
В крови содержится 0,9% NaCl, такую же концентрацию NaCl создают в физиологическом растворе, который используется как временная замена плазмы крови.
Свойства хлорида натрия. Белые кристаллы, температура плавления 801*С, температура кипения 1440*С. Примерно одинаково хорошо растворяются в горячей и холодной воде (поэтому очистка перекристаллизацией невозможна): при 20*С 35,8 г. NaCl растворяется в 100 г. H2O, это насыщенный 26,4% раствор. Насыщенный раствор хлорида натрия закипает при 109*С. При сильном нагревании кристаллы NaCl (кристаллизационная вода отсутствует) с хрустом рассыпаются в результате испарения остаточного маточного раствора.
Кристаллы NaCl негигроскопичны, но продажная поваренная соль (пищевая) обычно легко слеживается из-за наличия примеси гигроскопичного хлорида магния. Для обеспечения хорошей сохраняемости поваренной соли ее очищают от ионов Mg2+ путем обработки ортофосфатом натрия Na3PO4 и отделения практически нерастворимого ортофосфата магния.
В особых, почти безводных условиях, например под действием концентрированной серной кислоты, из NaCl можно получить хлороводород:
NaCl + H2SO4 = NaHSO4 + HCl
Применение хлорида натрия. В химической промышленности хлорид натрия используется как исходное вещество для получения многих других соединений натрия и хлора. Некоторые из них, а также пути их получения представлены на схеме
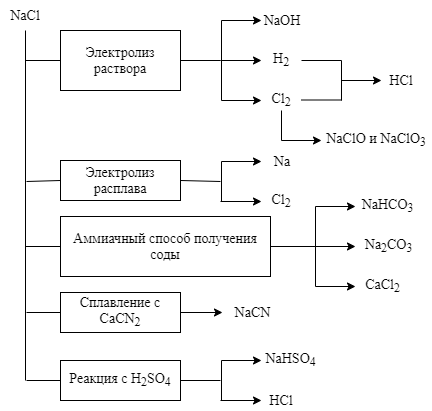
Кроме того, NaCl используется как консервирующее средство и охлаждающий рассол, средство для отсолки при производстве мыла и органических красителей, компонент глазурей, в керамической промышленности и предохранительных взрывчатых смесей, присадка при травлении алюминия и электролитическом никелировании. Охлаждающая смесь NaCl со льдом в отношении 3,5 : 1 обеспечивает температуру до -21*С.
Гидроксид натрия NaOH
Тривиальные названия: едкий натр, каустическая сода, каустик; водный раствор NaOH – натровый щелок.
Получение гидроксида натрия.
- Важнейший промышленный способ получения гидроксида натрия – электролиз хлорида натрия. Основными продуктами электролиза являются NaOH и газообразные Cl2 и H2. Процесс проводят двумя методами: амальгамным и диафрагменным.
По амальгамному (ртутному) методу получается очень чистый и свободный от хлора концентрированный раствор гидроксида натрия.
Через закрытый, периодически наклоняемый электролизер (с размерами, например: длина 12 метров, ширина 1,20 метра) со скоростью 15 см/с проходит ртуть. Ее слой на дне служит катодом. Титановые аноды, покрытые слоем оксидов платиновых металлов, погружены в горячий (60-80*С) раствор NaCl. На аноде выделяется газообразный хлор (2Cl– – 2e– = Cl2), который далее используют в разных химических производствах. На ртутном катоде вместо катионов водорода (перенапряжение водорода на ртути высокое) разряжаются катионы натрия (Na+ + e– = Na), чему способствует также образование амальгамы NaHgx (до 0,2% Na). Амальгамированная ртуть при очередном наклоне электролизера перетекает в разлагатель, где амальгама в присутствии графита как катализатора реагирует с горячей водой:
2NaHgx + 2H2O = 2NaOH + H2 + 2xHg
Освобождающуюся ртуть возвращают в электролизер.
По диафрагментному методу получают относительно дешевый, но содержащий хлор, гидроксид натрия.
В электролизере, работающем по диафрагментному методу, анодное и катодное пространства отделены друг от друга пористой перегородкой – диафрагмой (например, ионообменной мембраной на основе фторопластов). Такая конструкция позволяет предотвратить взаимодействие щелочи с газообразным хлором, которое может привести к получению гипохлорита натрия вместо щелочи:
2NaOH + Cl2 = NaClO + NaCl + H2O
На железном катоде разряжаются катионы H+ (2H2O + 2e– = H2 + 2OH–), а ионы OH– остаются в растворе. Получают 12% раствор гидроксида натрия, при упаривании которого выкристаллизовывается избыточный хлорид натрия (все же достичь чистоты NaOH выше технической не удается).
- Из карбоната натрия Na2CO3 путем обработки его в водном растворе гашеной известью Ca(OH)2 (процесс каустификации; это старый, но действенный способ):
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3
Осадок карбоната кальция отфильтровывают, а фильтрат выпаривают в железных чанах, затем сухую щелочь переплавляют.
Свойства гидроксида натрия. Белые гигроскопичные сильно агрессивные кристаллы; выпускаются в виде гранул, палочек, пластинок или чешуек. Температура плавления 322*С, температура кипения 1390*С. Гидроксид натрия поглощает диоксид углерода из воздуха (поэтому продукт следует хранить в герметично закрытой таре).
Гидроксид натрия хорошо растворяется в воде с выделением большого количества теплоты и сильным разогреванием раствора (необходимо соблюдать осторожность и предохранять глаза!). Раствор имеет сильнощелочную среду. Хранят раствор NaOH в полиэтиленовой посуде, поскольку он реагирует со стеклом.
Гидроксид натрия вытесняет при нагревании аммиак из солей аммония:
NaOH + NH4Cl = NaCl + H2O + NH3
Гидроксид натрия легко разрушает поверхность алюминия и цинка, с трудом – поверхность свинца и олова, на большинство металлов NaOH не действует.
Применение гидроксида натрия. NaOH является важнейшим сырьем в химической промышленности для получения различных натриевых солей: нитрата, нитрита, сульфита, фосфатов, гипохлорита или белильного щелока, силикатов, растворимого стекла (канцелярский клей, силикатный клей), фторида, хромата, органический солей и др. Гидроксид натрия применяется в производстве целлюлозы из древесины при сульфатной варке, искусственных волокон, мыла, моющих средств, смачивателей и эмульгаторов, красителей, оксида алюминия и боксита, фенолов из минеральных масел. Гидроксид натрия входит в состав электролитов, предназначенных для воронения (чернения), обезжиривания, проведения некоторых электролитических процессов (в технологии олова и цинка), травления алюминия, например в процессе анодирования алюминия.
Карбонат натрия Na2CO3
Тривиальные названия: кальцинированная сода Na2CO3; кристаллическая сода Na2CO3*10H2O – декагидрат карбоната натрия, содержит 63% кристаллизационной воды.
Распространение карбоната натрия в природе. Карбонат натрия содержится в воде содовых озер (соль кристаллизуется в результате испарения воды) и минеральных источников, в золе некоторых морских водорослей (200 – 250 лет тому назад соду получали преимущественно из золы растений).
Получение карбоната натрия.
- Промышленный аммиачный способ (способ Сольве, Франция, 1863 год). В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, т.е. как бы вводят гидрокарбонат аммония NH4HCO3:
NH3 + H2O + CO2 + NaCl = NaHCO3 + NH4Cl
Выпавший осадок малорастворимого гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием, при этом он переходит в карбонат натрия:
2NaHCO3 = Na2CO3 + H2O + CO2
Образовавшийся диоксид углерода, а также аммиак, выделенный из маточного раствора (на первой стадии процесса) по реакции
NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
возвращают в производственный цикл.
Схема аммиачного способа получения соды по Сольве

- Способ получения соды по Леблану (Франция, 1791 год) из хлорида натрия, серной кислоты и угля (не применяется).
Свойства карбоната натрия. Карбонат натрия представляет собой белые кристаллы. Температура плавления 853*С. Кристаллогидрат на воздухе выветривается (теряет часть кристаллизационной воды), а при 32*С расплавляется. Растворим в воде, водный раствор имеет щелочную реакцию вследствие гидролиза соли. При действии многих сильных и слабых кислот карбонат натрия разлагается с выделением диоксида углерода:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
Na2CO3 + 2CH3COOH = 2Na(CH3COO) + CO2 + H2O
Применение карбоната натрия. Карбонат натрия является сырьем для получения других соединений натрия, для производства стекла, мыла и синтетических моющих средств, эмалей, ультрамарина. Средство для устранения жесткости воды, обезжиривания металлов и десульфуризации доменного чугуна.
Сульфат натрия Na2SO4
Тривиальные названия: кальцинированный сульфат Na2SO4; глауберова соль Na2SO4*10H2O.
Распространение сульфата натрия в природе. Крупное месторождение сульфата натрия находится в заливе Кара-Богаз-Гол (Каспийское море).
Свойства сульфата натрия. Безводный сульфат натрия кристаллизуется из водного раствора при температуре выше 32,4*С, ниже этой температуры выделяется кристаллогидрат Na2SO4*10H2O, который именно при 32,4*С плавится и одновременно теряет воду. Температура плавления безводного сульфата натрия 884*С.
Получение сульфата натрия.
- Взаимодействие хлорида натрия с серной кислотой. При сильном нагревании реакционной смеси образуется сульфат натрия Na2SO4, при более умеренном нагревании (в лабораторных условиях) образуется гидросульфат натрия NaHSO4.
- Из остаточных растворов производства хлорида калия, содержащих ионы Na+, Mg2+, Cl–, SO42-; при температуре -5*С из этих растворов кристаллизуется глауберова соль Na2SO4*10H2O.
Оба способа используются в промышленности.
Применение сульфата натрия. В производстве вискозного волокна, стекла, сульфида натрия, ультрамарина, фармацевтических препаратов. Используется при сульфатной варке целлюлозы и крашении хлопчатобумажных тканей.
Оксид натрия Na2O белый гигроскопичный порошок с температурой плавления 920*С.
Пероксид натрия Na2O2 светло-желтый порошок. Воспламеняет вату, бумагу и порошок алюминия в присутствии небольшого количества (несколько капель) воды. В промышленности получают сжиганием натрия во вращающихся трубчатых печах. Используется для отбеливания тканей, а также для регенерации кислорода при поглощении диоксида углерода:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Эта реакция применяется в кислородных изолирующих приборах.
Сульфид натрия Na2S*9H2O – белые кристаллы с запахом сероводорода вследствие протекающей реакции замещения с участием диоксида углерода. Растворим в воде. Получают спеканием сульфата натрия с углем:
Na2SO4 + 4C = Na2S + 4CO
Применяют при удалении волосяного покрова шкур и дублении кож, в производстве сернистых красителей и в качестве флотоагента.
Сульфит натрия Na2SO3, гидросульфит натрия NaHSO3, пентаоксодисульфат динатрия Na2S2O5 (старое название метабисульфит натрия) – белые твердые вещества. Образуются при введении диоксида серы в раствор гидроксида или карбоната натрия. При действии сильных кислот выделяют SO2. Сульфит натрия ниже 37*С кристаллизуется в виде гептагидрата Na2SO3*7H2O.
Na2S2O5 имеет необычное строение аниона – (O2S-SO3)2-, он содержит связь S-S со степенями окисления серы (+III) и (+V) соответственно.
Тиосульфат натрия Na2S2O3*5H2O представляет собой белые кристаллы. При охлаждении легко образует пересыщенный раствор. Получают по реакции:
Na2CO3 + 2Na2S + 4SO2 = 3Na2S2O3 + CO2
При подкислении раствора тиосульфата натрия образуется коллоидный раствор серы:
Na2S2O3 + 2HCl = 2NaCl + SO2 + S + H2O
Хлорид серебра AgCl и другие малорастворимые соли серебра можно перевести в раствор под действием тиосульфата натрия (образуются тиосульфатные комплексы). На этом основано применение тиосульфата натрия в качестве фотографических закрепителей. Na2S2O3 используется также в производстве бумаги при отбелке ее хлором (как “антихлор”):
Na2S2O3 + 4Cl2 + 5H2O = Na2SO4 + H2SO4 + 8HCl
В аналитической химии применяется как титрант для количественного определения иода:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Нитрат натрия NaNO3 представляет собой белые, гигроскопичные, хорошо растворимые в воде кристаллы. Температура плавления 311*С. При 380*С нитрат натрия разлагается с образованием нитрита натрия и газообразного кислорода:
2NaNO3 = 2NaNO2 + O2
При нагревании с концентрированной серной кислотой можно отогнать довольно чистую азотную кислоту:
2NaNO3 + H2SO4 = Na2SO4 + HNO3
В природе нитрат натрия в больших количествах содержится в месторождениях чилийской селитры, которую перерабатывают на азотную кислоту и гидроксид натрия. NaNO3 применяют как составную часть удобрений и взрывчатых веществ, а также как окислитель в производстве стекла и эмалей.
Нитрит натрия NaNO2 – белые, очень хорошо растворимые в воде кристаллы. Температура плавления нитрита натрия 271*С. Ядовит.
В промышленности нитрит натрия получают по реакции нитрозных газов (смесь NO и NO2) с гидроксидом натрия. Из эквимолярной смеси NO и NO2 образуется в основном NaNO2, а при избытке NO2 – еще и NaNO3. Наоборот, при действии сильных кислот на NaNO2 происходит выделение нитрозных газов.
Применяют NaNO3 в производстве азокрасителей, как компонент смеси для воронения (NaOH + NaNO3 + NaNO2) и как средство для придания естественной окраски вареным мясным изделиям при их подсаливании (NaCl + 0,4% NaNO2 сохраняют красный цвет вареного мяса вследствие образования окрашенного аддукта NO с миоглобином).
Амид натрия NaNH2 – белые кристаллы. Температура плавления 206*С. При попадании на вещество воды взрывается, на воздухе постепенно образует желтые взрывчатые продукты окисления. Амид натрия можно получить из смеси Na + NH3. Применяют амид натрия для органических синтезов, например в производстве красителя индиго, а также для получения азида натрия NaN3 по реакции:
NaNH2 + Na2O = NaN3 + H2O
Гидрокарбонат натрия NaHCO3 – белый, негигроскопичный кристаллический порошок. Умеренно растворим в воде. При 300*С разлагается на карбонат натрия и диоксид углерода:
2NaHCO3 = Na2CO3 + H2O + CO2
При комнатной температуре газообразный CO2 можно получить из NaHCO3 при действии кислот-неокислителей. Получается как промежуточный продукт в производстве карбоната натрия по способу Сольве. Применяют NaHCO3 в качестве компонента моющих и огнетушащих средств, искусственных минеральных вод лимонадов, как источник CO2 в хлебопекарной промышленности (разрыхлитель), а так же как лекарственный препарат (для нейтрализации повышенной кислотности желудочного сока).










