ąĪčāčéąĮč¢čüčéčī čģč¢ą╝č¢čćąĮąĖčģ čĆąĄą░ą║čåč¢ą╣ ą┐ąŠą╗čÅą│ą░čö čā ą▓ąĘą░čöą╝ąŠą┤č¢čŚ čĆąĄą░ą│ąĄąĮčéč¢ą▓ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ ą┐čĆąŠą┤čāą║čéč¢ą▓. ą×ą┤ąĮą░ą║, ąĮąĄ čüą╗č¢ą┤ ą▓ą▓ą░ąČą░čéąĖ, čēąŠ ą┐ąĄčĆąĄą▒č¢ą│ čģč¢ą╝č¢čćąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ ą╝ąŠąČą╗ąĖą▓ąĖą╣ čéč¢ą╗čīą║ąĖ ą▓ ąŠą┤ąĮąŠą╝čā ąĮą░ą┐čĆčÅą╝ą║čā čĆąĄą░ą│ąĄąĮčéąĖ ŌåÆ ą┐čĆąŠą┤čāą║čéąĖ. ąØą░čüą┐čĆą░ą▓ą┤č¢, čģč¢ą╝č¢čćąĮč¢ čĆąĄą░ą║čåč¢čŚ ą┐čĆąŠčéč¢ą║ą░čÄčéčī č¢ ą▓ ą┐čĆčÅą╝ąŠą╝čā, č¢ ą▓ ąĘą▓ąŠčĆąŠčéąĮąŠą╝čā ąĮą░ą┐čĆčÅą╝ą║ą░čģ:
ąĀąĄą░ą│ąĄąĮčéąĖ Ōćä ą¤čĆąŠą┤čāą║čéąĖ
ąÆčüč¢ čģč¢ą╝č¢čćąĮč¢ čĆąĄą░ą║čåč¢čŚ ąŠą▒ąŠčĆąŠčéąĮč¢.
ąÆ čĆąĄą░ą║čåč¢ą╣ąĮč¢ą╣ čüčāą╝č¢čłč¢ ąĘą┤č¢ą╣čüąĮčÄčöčéčīčüčÅ č¢ ą▓ąĘą░čöą╝ąŠą┤č¢čÅ čĆąĄą░ą│ąĄąĮčéč¢ą▓ (ą┐čĆąĖ čåčīąŠą╝čā čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ ą┐čĆąŠą┤čāą║čéąĖ), č¢ ą▓ąĘą░čöą╝ąŠą┤č¢čÅ ą┐čĆąŠą┤čāą║čéč¢ą▓ (ą┐čĆąĖ čåčīąŠą╝čā čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ čĆąĄą░ą│ąĄąĮčéąĖ). ąÆ ąŠą▒ąŠčĆąŠčéąĮąĖčģ čĆąĄą░ą║čåč¢čÅčģ ą▓č¢ą┤ą╝č¢ąĮąĮč¢čüčéčī ą╝č¢ąČ čĆąĄą░ą│ąĄąĮčéą░ą╝ąĖ č¢ ą┐čĆąŠą┤čāą║čéą░ą╝ąĖ čāą╝ąŠą▓ąĮą░ č¢ ą▓ąĖąĘąĮą░čćą░čöčéčīčüčÅ ąĘą░ą┐ąĖčüąŠą╝ čĆč¢ą▓ąĮčÅąĮąĮčÅ ąŠą▒ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ: ąĘą╗č¢ą▓ą░ ą▓č¢ą┤ ąĘąĮą░ą║ą░ ąŠą▒ąŠčĆąŠčéąĮąŠčüčéč¢ ŌĆ£ŌćäŌĆØ ąĘą░ą┐ąĖčüčāčÄčéčī č乊čĆą╝čāą╗ąĖ čĆąĄą░ą│ąĄąĮčéč¢ą▓, ą░ ą┐čĆą░ą▓ąŠčĆčāčć – č乊čĆą╝čāą╗ąĖ ą┐čĆąŠą┤čāą║čéč¢ą▓.
ą¤čĆąĖą║ą╗ą░ą┤.
ąŻ ąĘą░ą║čĆąĖčéč¢ą╣ čĆąĄą░ą║čåč¢ą╣ąĮąŠčŚ čüąĖčüč鹥ą╝č¢, čÅą║ą░ ą╝č¢čüčéąĖčéčī čüą┐ąŠčćą░čéą║čā čĆčéčāčéčī č¢ ą║ąĖčüąĄąĮčī, ą╝ąŠąČčāčéčī ą┐čĆąŠčéč¢ą║ą░čéąĖ čĆąĄą░ą║čåč¢čŚ:
2Hg + O2 ŌåÆ 2HgO
2HgO ŌåÆ 2Hg + O2
ąóą░ą║ąĖą╝ čćąĖąĮąŠą╝, ą▓ ą┤ą░ąĮč¢ą╣ čüąĖčüč鹥ą╝č¢ ąŠą┤ąĮąŠčćą░čüąĮąŠ ą┐čĆąŠčéč¢ą║ą░čÄčéčī ą┤ą▓ą░ ą┐čĆąŠčåąĄčüąĖ. ąĪčāą╝ą░čĆąĮąĄ čĆč¢ą▓ąĮčÅąĮąĮčÅ ąŠą▒ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ:
2Hg + O2 Ōćä 2HgO
ąÆč¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą┤ąŠ čĆč¢ą▓ąĮčÅąĮąĮčÅ ą║ąŠąĮą║čĆąĄčéąĮąŠčŚ ąŠą▒ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ čĆąŠąĘčĆč¢ąĘąĮčÅčÄčéčī ą┐čĆčÅą╝čā čĆąĄą░ą║čåč¢čÄ, čēąŠ ą┐čĆąŠčéč¢ą║ą░čö ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą┤ąŠ čĆč¢ą▓ąĮčÅąĮąĮčÅ ąĘą╗č¢ą▓ą░ ąĮą░ą┐čĆą░ą▓ąŠ, č¢ ąĘą▓ąŠčĆąŠčéąĮčā čĆąĄą░ą║čåč¢čÄ, čēąŠ ą┐čĆąŠčéč¢ą║ą░čö ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąŠ ą┤ąŠ čĆč¢ą▓ąĮčÅąĮąĮčÅ čüą┐čĆą░ą▓ą░ ąĮą░ą╗č¢ą▓ąŠ.
ąÜąŠąĮą║čĆąĄčéąĮąĖą╣ ąĘą░ą┐ąĖčü ąĘą▓ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ čćą░čüč鹊 ą▓ąĖąĘąĮą░čćą░čöčéčīčüčÅ čéą░ą║ąŠąČ čéąĖą╝, čÅą║č¢ čĆąĄč湊ą▓ąĖąĮąĖ ą▒čāą╗ąĖ ą▓ąĖčģč¢ą┤ąĮąĖą╝ąĖ ą┐čĆąĖ ąĄą║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠą╝čā ą┐čĆąŠą▓ąĄą┤ąĄąĮąĮč¢ čĆąĄą░ą║čåč¢čŚ, ą░ čÅą║č¢ – ą║č¢ąĮčåąĄą▓ąĖą╝ąĖ, č鹊ą▒č鹊 čāčéą▓ąŠčĆąĄąĮąĖą╝ąĖ ą▓ ą┐čĆąŠčåąĄčüč¢ čŚčŚ ą┐čĆąŠčéč¢ą║ą░ąĮąĮčÅ.
ą¤čĆąĖą║ą╗ą░ą┤.
ą¤čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢ ą▓ąĖčģč¢ą┤ąĮąŠčŚ čĆąĄč湊ą▓ąĖąĮąĖ ą╝ą░ą│ąĮč¢ą╣ ą║ą░čĆą▒ąŠąĮą░čéčā čāčéą▓ąŠčĆčÄčÄčéčīčüčÅ ą┐čĆąŠą┤čāą║čéąĖ čĆąŠąĘą║ą╗ą░ą┤ą░ąĮąĮčÅ – ą╝ą░ą│ąĮč¢ą╣ ąŠą║čüąĖą┤ č¢ ą║ą░čĆą▒ąŠąĮ ą┤č¢ąŠą║čüąĖą┤:
ą¤čĆčÅą╝ą░ čĆąĄą░ą║čåč¢čÅ
MgCO3 ŌåÆ MgO + CO2
ąÆ ą┐čĆąŠčåąĄčüč¢ čÅą║ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą┐čĆčÅą╝ą░ čĆąĄą░ą║čåč¢čÅ ą▓ ąĘą░ą║čĆąĖčéč¢ą╣ čüąĖčüč鹥ą╝č¢ ąĮą░ą║ąŠą┐ąĖčćčāčÄčéčīčüčÅ ą║č¢ąĮčåąĄą▓č¢ ą┐čĆąŠą┤čāą║čéąĖ, ąĘą▒č¢ą╗čīčłąĄąĮąĮčÅ ą║č¢ą╗čīą║ąŠčüčéč¢ čÅą║ąĖčģ čüą┐čĆąĖčÅčö čĆąŠąĘą▓ąĖčéą║čā ąĘą▓ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ ą╝č¢ąČ ąĮąĖą╝ąĖ:
ąŚą▓ąŠčĆąŠčéąĮą░ čĆąĄą░ą║čåč¢čÅ
MgO + CO2 ŌåÉ MgCO3
ą×čéąČąĄ, ąŠą▒ąŠčĆąŠčéąĮąĖą╣ ą┐čĆąŠčåąĄčü č鹥čĆą╝č¢čćąĮąŠą│ąŠ čĆąŠąĘą║ą╗ą░ą┤ą░ąĮąĮčÅ ą╝ą░ą│ąĮč¢ą╣ ą║ą░čĆą▒ąŠąĮą░čéčā ąĘą░ą┐ąĖčüčāčöčéčīčüčÅ čéą░ą║:
MgCO3 Ōćä MgO + CO2
ą»ą║čēąŠ ą▓ čÅą║ąŠčüčéč¢ ą▓ąĖčģč¢ą┤ąĮąĖčģ čĆąĄč湊ą▓ąĖąĮ ą▓ąĘčÅčéąĖ ą╝ą░ą│ąĮč¢ą╣ ąŠą║čüąĖą┤ č¢ ą║ą░čĆą▒ąŠąĮ ą┤č¢ąŠą║čüąĖą┤, č鹊ą┤č¢ čĆč¢ą▓ąĮčÅąĮąĮčÅ čüąĖąĮč鹥ąĘčā ą╝ą░ą│ąĮč¢ą╣ ą║ą░čĆą▒ąŠąĮą░čéčā ąĘą░ą┐ąĖčüčāčÄčéčī čéą░ą║:
MgO + CO2 Ōćä MgCO3
ąØą░ą┐čĆčÅą╝ąŠą║ ą┐čĆąŠčéč¢ą║ą░ąĮąĮčÅ čģč¢ą╝č¢čćąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ ą▓ąĖąĘąĮą░čćą░čöčéčīčüčÅ čāą╝ąŠą▓ą░ą╝ąĖ čŚčŚ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĮčÅ (č鹥ą╝ą┐ąĄčĆą░čéčāčĆąŠčÄ, čéąĖčüą║ąŠą╝, ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢čöčÄ čĆąĄč湊ą▓ąĖąĮ)
ąæą░ą│ą░č鹊 čĆąĄą░ą║čåč¢ą╣ ą╝ą░čÄčéčī ąŠą┤ąĖąĮ ą┐ąĄčĆąĄą▓ą░ąČąĮąĖą╣ ąĮą░ą┐čĆčÅą╝ąŠą║ č¢ ą┤ą╗čÅ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĮčÅ čéą░ą║ąĖčģ čĆąĄą░ą║čåč¢ą╣ ą▓ ą┐čĆąŠčéąĖą╗ąĄąČąĮąŠą╝čā ąĮą░ą┐čĆčÅą╝ą║čā ą┐ąŠčéčĆč¢ą▒ąĮč¢ ąĄą║čüčéčĆąĄą╝ą░ą╗čīąĮč¢ čāą╝ąŠą▓ąĖ. ąÆ ą┐ąŠą┤č¢ą▒ąĮąĖčģ čĆąĄą░ą║čåč¢čÅčģ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą╝ą░ą╣ąČąĄ ą┐ąŠą▓ąĮąĄ ą┐ąĄčĆąĄčéą▓ąŠčĆąĄąĮąĮčÅ čĆąĄą░ą│ąĄąĮčéč¢ą▓ ą▓ ą┐čĆąŠą┤čāą║čéąĖ.
ą¤čĆąĖą║ą╗ą░ą┤.
ąŚą░ą╗č¢ąĘąŠ č¢ čüč¢čĆą║ą░ ą┐čĆąĖ ąĮą░ą│čĆč¢ą▓ą░ąĮąĮč¢ čĆąĄą░ą│čāčÄčéčī ą╝č¢ąČ čüąŠą▒ąŠčÄ ąĘ čāčéą▓ąŠčĆąĄąĮąĮčÅą╝ č乥čĆčāą╝(II) čüčāą╗čīčäč¢ą┤čā, FeS ąĘą░ čéą░ą║ąĖčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ čüčéč¢ą╣ą║ąĖą╣ č¢ ą┐čĆą░ą║čéąĖčćąĮąŠ ąĮąĄ čĆąŠąĘą║ą╗ą░ą┤ą░čöčéčīčüčÅ ą▓ ąĘą▓ąŠčĆąŠčéąĮąŠą╝čā ąĮą░ą┐čĆčÅą╝ą║čā ąĮą░ ąĘą░ą╗č¢ąĘąŠ č¢ čüč¢čĆą║čā:
Fe + S ŌåÆ FeS
ąŻ čģč¢ą╝č¢čćąĮąĖčģ čĆąĄą░ą║čåč¢čÅčģ, čÅą║č¢ ąĘą┤ą░čéąĮč¢ ą┐čĆąĖ ąĘą░ą┤ą░ąĮąĖčģ čāą╝ąŠą▓ą░čģ ą┐čĆąŠčéč¢ą║ą░čéąĖ ą▓ ąŠą▒ąŠčģ ąĮą░ą┐čĆčÅą╝ą║ą░čģ, ąĮąĄ ą▓č¢ą┤ą▒čāą▓ą░čöčéčīčüčÅ ą▓ąĘą░čöą╝ąŠą┤č¢čŚ čĆąĄč湊ą▓ąĖąĮ ą▒ąĄąĘ ąĘą░ą╗ąĖčłą║čā. ą×čüąŠą▒ą╗ąĖą▓ąŠ čåąĄ čģą░čĆą░ą║č鹥čĆąĮąŠ ą┤ą╗čÅ ą│ąŠą╝ąŠą│ąĄąĮąĮąĖčģ čĆąĄą░ą║čåč¢ą╣ (čĆąĄą░ą║čåč¢čŚ ą╝č¢ąČ ą│ą░ąĘą░ą╝ąĖ, čĆąĄą░ą║čåč¢čŚ ą▓ čĆąŠąĘčćąĖąĮą░čģ).
ą¤čĆąĖą║ą╗ą░ą┤.
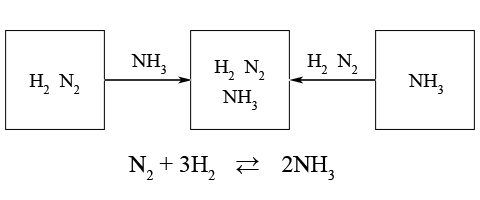
ąĀąĄą░ą║čåč¢čÅ čüąĖąĮč鹥ąĘčā ą░ą╝ąŠąĮč¢ą░ą║čā čö ąŠą▒ąŠčĆąŠčéąĮąŠčÄ
N2 + 3H2 Ōćä 2NH3
ą¤čĆąĖ 20 ą£ą¤ą░ č¢ 400*ąĪ ą┤ąŠčüčÅą│ą░čöčéčīčüčÅ ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮąĖą╣ 36% (ąĘą░ ąŠą▒ŌĆÖčöą╝ąŠą╝) ą▓ą╝č¢čüčé NH3 ą▓ čĆąĄą░ą║čåč¢ą╣ąĮč¢ą╣ čüčāą╝č¢čłč¢. ą¤čĆąĖ ą┐ąŠą┤ą░ą╗čīčłąŠą╝čā ą┐č¢ą┤ą▓ąĖčēąĄąĮąĮč¢ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĖ ą▓ąĮą░čüą╗č¢ą┤ąŠą║ ą┐ąŠčüąĖą╗ąĄąĮąŠą│ąŠ ą┐čĆąŠčéč¢ą║ą░ąĮąĮčÅ ąĘą▓ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ ąŠą▒’čöą╝ąĮą░ ą┤ąŠą╗čÅ ą░ą╝ąŠąĮč¢ą░ą║čā ą▓ čüčāą╝č¢čłč¢ ąĘą╝ąĄąĮčłčāčöčéčīčüčÅ.
ą¤čĆčÅą╝ą░ č¢ ąĘą▓ąŠčĆąŠčéąĮą░ čĆąĄą░ą║čåč¢čŚ ą┐čĆąŠčéč¢ą║ą░čÄčéčī ąŠą┤ąĮąŠčćą░čüąĮąŠ ą▓ ą┐čĆąŠčéąĖą╗ąĄąČąĮąĖčģ ąĮą░ą┐čĆčÅą╝ą║ą░čģ
ąŚą░ą╗ąĄąČąĮč¢čüčéčī ą╝č¢ąČ ą┐čĆčÅą╝ąŠčÄ č¢ ąĘą▓ąŠčĆąŠčéąĮąŠčÄ čĆąĄą░ą║čåč¢čÅą╝ąĖ ą║č¢ą╗čīą║č¢čüąĮąŠ ą▓ąĖčĆą░ąČą░čöčéčīčüčÅ č湥čĆąĄąĘ čłą▓ąĖą┤ą║č¢čüčéčī čĆąĄą░ą║čåč¢čŚ. ą©ą▓ąĖą┤ą║č¢čüčéčī čĆąĄą░ą║čåč¢čŚ ąĘą░ą╗ąĄąČąĖčéčī ą▓č¢ą┤ ą║č¢ą╗čīą║ąŠčüčéč¢ čćą░čüčéąĖąĮąŠą║, čēąŠ čĆąĄą░ą│čāčÄčéčī (č鹊ą▒č鹊 ąĘč¢čłč鹊ą▓čģčāčÄčéčīčüčÅ). ąŻ ą┐ąĄčĆčłąĖą╣ ą╝ąŠą╝ąĄąĮčé ą┐čĆąŠčéč¢ą║ą░ąĮąĮčÅ ąŠą▒ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ ą▓ čüąĖčüč鹥ą╝č¢ ą╝č¢čüčéčÅčéčīčüčÅ čéč¢ą╗čīą║ąĖ čćą░čüčéąĖąĮą║ąĖ ą▓ąĖčģč¢ą┤ąĮąĖčģ čĆąĄč湊ą▓ąĖąĮ (ąĮą░ą┐čĆąĖą║ą╗ą░ą┤, ą▓ ą┐čĆąŠčåąĄčüč¢ čüąĖąĮč鹥ąĘčā ą░ą╝ąŠąĮč¢ą░ą║čā N2 č¢ H2). ąóąŠą╝čā ą▓ ą┐ąĄčĆčłąĖą╣ ą╝ąŠą╝ąĄąĮčé ą┐čĆąŠčéč¢ą║ą░čö čéč¢ą╗čīą║ąĖ ą┐čĆčÅą╝ą░ čĆąĄą░ą║čåč¢čÅ, ą┐čĆąĖč湊ą╝čā ąĘ ą┤čāąČąĄ ą▓ąĖčüąŠą║ąŠčÄ čłą▓ąĖą┤ą║č¢čüčéčÄ.
ąÆ ą┐čĆąŠčåąĄčüč¢ ą┐čĆąŠčéč¢ą║ą░ąĮąĮčÅ ą┐čĆčÅą╝ąŠčŚ čĆąĄą░ą║čåč¢čŚ ąĮą░ą║ąŠą┐ąĖčćčāčöčéčīčüčÅ ą▓čüąĄ ą▒č¢ą╗čīčłąĄ čćąĖčüą╗ąŠ čćą░čüčéąĖąĮąŠą║ ą║č¢ąĮčåąĄą▓ąĖčģ čĆąĄč湊ą▓ąĖąĮ (ą┐čĆąŠą┤čāą║čéč¢ą▓), čÅą║č¢ ą▒ąĄčĆčāčéčī čāčćą░čüčéčī ą▓ ąĘą▓ąŠčĆąŠčéąĮč¢ą╣ čĆąĄą░ą║čåč¢čŚ, č鹊ą╝čā čłą▓ąĖą┤ą║č¢čüčéčī ąĘą▓ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ ąĘčĆąŠčüčéą░čö. ą×ą┤ąĮąŠčćą░čüąĮąŠ ąĘą╝ąĄąĮčłčāčöčéčīčüčÅ čćąĖčüą╗ąŠ čćą░čüčéąĖąĮąŠą║ ą▓ąĖčģč¢ą┤ąĮąĖčģ čĆąĄč湊ą▓ąĖąĮ – čłą▓ąĖą┤ą║č¢čüčéčī ą┐čĆčÅą╝ąŠčŚ čĆąĄą░ą║čåč¢čŚ ąĘą╝ąĄąĮčłčāčöčéčīčüčÅ. ąÆ čĆąĄąĘčāą╗čīčéą░čéč¢ ą▓ čĆąĄą░ą║čåč¢ą╣ąĮą░ čüąĖčüč鹥ą╝ą░ ą┤ąŠčüčÅą│ą░čö čüčéą░ąĮčā, ą┐čĆąĖ čÅą║ąŠą╝čā čłą▓ąĖą┤ą║ąŠčüčéčī ą┐čĆčÅą╝ąŠčŚ čĆąĄą░ą║čåč¢čŚ ą┤ąŠčĆč¢ą▓ąĮčÄčö čłą▓ąĖą┤ą║ąŠčüčéč¢ ąĘą▓ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ.
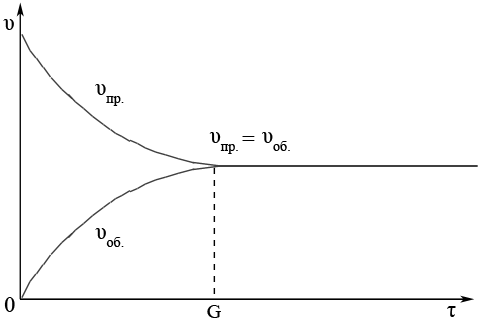
ąĪčéą░ąĮ čģč¢ą╝č¢čćąĮąŠčŚ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ – čåąĄ čüčéą░ąĮ čĆąĄą░ą║čåč¢ą╣ąĮąŠčŚ čüąĖčüč鹥ą╝ąĖ ą┐čĆąĖ čÅą║ąŠą╝čā čłą▓ąĖą┤ą║ąŠčüčéč¢ ą┐čĆčÅą╝ąŠčŚ čĆąĄą░ą║čåč¢čŚ č¢ ąĘą▓ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ ąŠą┤ąĮą░ą║ąŠą▓č¢
ąÆ čüčéą░ąĮč¢ čģč¢ą╝č¢čćąĮąŠčŚ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ ąŠą▒ąĖą┤ą▓č¢ čĆąĄą░ą║čåč¢čŚ, ą┐čĆčÅą╝ą░ č¢ ąĘą▓ąŠčĆąŠčéąĮą░, ą┐čĆąŠą┤ąŠą▓ąČčāčÄčéčī ą▓č¢ą┤ą▒čāą▓ą░čéąĖčüčÅ, ąŠčéąČąĄ, čéą░ą║ąĖą╣ čüčéą░ąĮ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ ą▒čāą┤ąĄ ą┤ąĖąĮą░ą╝č¢čćąĮąĖą╝ (ą░ą▒ąŠ čĆčāčģąŠą╝ąĖą╝) čĆč¢ą▓ąĮąŠą▓ą░ąČąĮąĖą╝ čüčéą░ąĮąŠą╝, ą░ ąĮąĄ čüčéą░čéąĖčćąĮąĖą╝.
ąŻ ą▓čüč¢čģ ąŠą▒ąŠčĆąŠčéąĮąĖčģ čĆąĄą░ą║čåč¢čÅčģ čłą▓ąĖą┤ą║č¢čüčéčī ą┐čĆčÅą╝ąŠčŚ čĆąĄą░ą║čåč¢čŚ ąĘą╝ąĄąĮčłčāčöčéčīčüčÅ, čłą▓ąĖą┤ą║č¢čüčéčī ąĘą▓ąŠčĆąŠčéąĮąŠčŚ čĆąĄą░ą║čåč¢čŚ ąĘčĆąŠčüčéą░čö ą┤ąŠ čéąĖčģ ą┐č¢čĆ, ą┐ąŠą║ąĖ ąŠą▒ąĖą┤ą▓č¢ čłą▓ąĖą┤ą║ąŠčüčéč¢ ąĮąĄ čüčéą░ąĮčāčéčī ąŠą┤ąĮą░ą║ąŠą▓ąĖą╝ąĖ – čüčéą░ąĮ čģč¢ą╝č¢čćąĮąŠčŚ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ
ąĪą┐č¢ą▓ą▓č¢ą┤ąĮąŠčłąĄąĮąĮčÅ ą║ąŠąĮčåąĄąĮčéčĆą░čåč¢ą╣ čĆąĄč湊ą▓ąĖąĮ, čēąŠ ą▒ąĄčĆčāčéčī čāčćą░čüčéčī ą▓ čĆąĄą░ą║čåč¢čŚ (čĆąĄą░ą│ąĄąĮčéč¢ą▓, ą┐čĆąŠą┤čāą║čéč¢ą▓), ą▓ čüčéą░ąĮč¢ čģč¢ą╝č¢čćąĮąŠčŚ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ą░čö ą┐ąŠą╗ąŠąČąĄąĮąĮčÄ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ.
ą¤čĆąĖą║ą╗ą░ą┤.
ąÆ ąŠą▒ąŠčĆąŠčéąĮč¢ą╣ čĆąĄą░ą║čåč¢čŚ ąĄą╗ąĄą║čéčĆąŠą╗č¢čéąĖčćąĮąŠčŚ ą┤ąĖčüąŠčåč¢ą░čåč¢čŚ (ą░ą▓č鹊ą┐čĆąŠč鹊ą╗č¢ąĘą░) ą▓ąŠą┤ąĖ ą╗ąĖčłąĄ ą┤čāąČąĄ ąĮąĄąĘąĮą░čćąĮą░ čćą░čüčéąĖąĮą░ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤ąĖ ą▒ąĄčĆąĄ čāčćą░čüčéčī ą▓ čåč¢ą╣ čĆąĄą░ą║čåč¢čŚ:
H2O Ōćä H+ + OH– ą░ą▒ąŠ H2O + H2O Ōćä H3O+ + OH–
ąóąŠą╝čā ą║ą░ąČčāčéčī, čēąŠ čüčéą░ąĮ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ ąĘąĮą░čģąŠą┤ąĖčéčīčüčÅ ą▓ ąŠą▒ą╗ą░čüčéč¢ ąĮąĄą┤ąĖčüąŠčåč¢ą╣ąŠą▓ą░ąĮąĖčģ ą╝ąŠą╗ąĄą║čāą╗ H2O.
ąÜąŠąČąĮą░ čģč¢ą╝č¢čćąĮą░ čĆąĄą░ą║čåč¢čÅ, čēąŠ ą┐čĆąŠą▓ąŠą┤ąĖčéčīčüčÅ ąĘą░ ą┐ąĄą▓ąĮąĖčģ čāą╝ąŠą▓, ą╝ą░čö ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ ą┐čĆąĖčéą░ą╝ą░ąĮąĮąĄ čéč¢ą╗čīą║ąĖ čåč¢ą╣ čĆąĄą░ą║čåč¢čŚ.
ą¤čĆąĖą║ą╗ą░ą┤.
ą¤čĆąĖ 400*ąĪ č¢ 20 ą£ą¤ą░ ą▓ čĆąĄą░ą║čåč¢čŚ čüąĖąĮč鹥ąĘčā ą░ą╝ąŠąĮč¢ą░ą║čā čāčéą▓ąŠčĆčÄčöčéčīčüčÅ 36% (ąĘą░ ąŠą▒ŌĆÖčöą╝ąŠą╝) NH3, ą░ ą┐čĆąĖ 500*ąĪ č¢ 10 ą£ą¤ą░ – ą▓čüčīąŠą│ąŠ 10%.
ąöą╗čÅ ąŠą┤ąĮą░ą║ąŠą▓ąĖčģ čāą╝ąŠą▓ ą▓č¢ą┤ą┐ąŠą▓č¢ą┤ąĮąĄ ą┐ąŠą╗ąŠąČąĄąĮąĮčÅ čĆč¢ą▓ąĮąŠą▓ą░ą│ąĖ ąĮąĄ ąĘą░ą╗ąĄąČąĖčéčī ą▓č¢ą┤ č鹊ą│ąŠ, čĆąĄą░ą│ąĄąĮčéąĖ čćąĖ ą┐čĆąŠą┤čāą║čéąĖ čĆąĄą░ą║čåč¢čŚ ą▒čāą╗ąĖ ą▓ąĖčģč¢ą┤ąĮąĖą╝ąĖ čĆąĄč湊ą▓ąĖąĮą░ą╝ąĖ.
ąÆąĖą▒č¢čĆ čāą╝ąŠą▓ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĮčÅ ąŠą▒ąŠčĆąŠčéąĮąĖčģ čĆąĄą░ą║čåč¢ą╣ čö ą┐čĆą░ą║čéąĖčćąĮąŠ ą▓ą░ąČą╗ąĖą▓ąŠčÄ ąĘą░ą┤ą░č湥čÄ ą┤ą╗čÅ ąĘą░ą▒ąĄąĘą┐ąĄč湥ąĮąĮčÅ ąĄč乥ą║čéąĖą▓ąĮąŠčüčéč¢ čģč¢ą╝č¢ą║ąŠ-č鹥čģąĮąŠą╗ąŠą│č¢čćąĮąĖčģ ą┐čĆąŠčåąĄčüč¢ą▓, č鹊ą▒č鹊 ą┤ą╗čÅ ąŠčéčĆąĖą╝ą░ąĮąĮčÅ ąŠą┐čéąĖą╝ą░ą╗čīąĮąŠčŚ ą║č¢ą╗čīą║ąŠčüčéč¢ ąĮąĄąŠą▒čģč¢ą┤ąĮąĖčģ čĆąĄč湊ą▓ąĖąĮ.










