Образование ковалентной связи можно описать с помощью двух механизмов – равноценного и донорно-акцепторного.
–Ý–∞–≤–Ω–æ—Ü–µ–Ω–Ω—ã–π –º–µ—Ö–∞–Ω–∏–∑–º –ø—Ä–µ–¥–ø–æ–ª–∞–≥–∞–µ—Ç, —á—Ç–æ –æ–±—â–∞—è —ç–ª–µ–∫—Ç—Ä–æ–Ω–Ω–∞—è –ø–∞—Ä–∞ (–≤ –º–µ—Ç–æ–¥–µ –≤–∞–ª–µ–Ω—Ç–Ω—ã—Ö —Å–≤—è–∑–µ–π) –æ–±—Ä–∞–∑—É–µ—Ç—Å—è –∏–∑ –Ω–µ—Å–ø–∞—Ä–µ–Ω–Ω—ã—Ö —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤ –æ–±–æ–∏—Ö –∞—Ç–æ–º–æ–≤-–ø–∞—Ä—Ç–Ω–µ—Ä–æ–≤ –ø–æ —Å–≤—è–∑–∏.
Донорно-акцепторный механизм образования ковалентной связи предполагает, что один из атомов предоставляет для образования связи неподеленную (собственную) пару электронов, а другой атом – вакантную (пустую, без электронов) атомную орбиталь.
Донор – это атом, который поставляет пару электронов в область образования химической связи.
Акцептор – это атом, имеющий вакантную орбиталь, который притягивает часть электронной плотности от электронной пары донора.
–ü—Ä–∏ –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏–∏ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–π —Å–≤—è–∑–∏ —É—á–∞—Å—Ç–≤—É—é—â–∏–µ –∞—Ç–æ–º—ã –º–æ–≥—É—Ç –±—ã—Ç—å –∫–∞–∫ –Ω–µ–π—Ç—Ä–∞–ª—å–Ω—ã–º–∏, —Ç–∞–∫ –∏ –∑–∞—Ä—è–∂–µ–Ω–Ω—ã–º–∏; –∫–∞–∫ —Å–≤–æ–±–æ–¥–Ω—ã–º–∏, —Ç–∞–∫ –∏ —É–∂–µ —Ö–∏–º–∏—á–µ—Å–∫–∏ —Å–≤—è–∑–∞–Ω–Ω—ã–º–∏, —Ç.–µ. –≤—Ö–æ–¥—è—â–∏–º–∏ –≤ —Å–æ—Å—Ç–∞–≤ –º–æ–ª–µ–∫—É–ª.
После образования связи по донорно-акцепторному механизму уже нельзя указать, какой атом был донором, а какой – акцептором электронной пары.
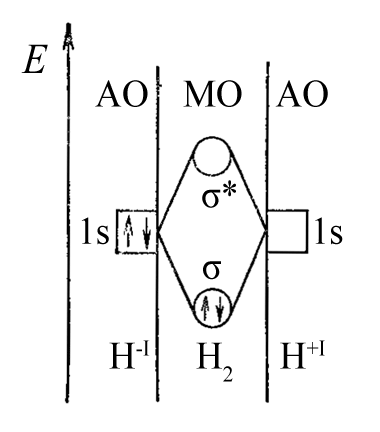
–ù–∞–ø—Ä–∏–º–µ—Ä, –º–æ–ª–µ–∫—É–ª–∞ H2 —Å–æ —Å–≤—è–∑—å—é H-H –º–æ–∂–µ—Ç –æ–±—Ä–∞–∑–æ–≤—ã–≤–∞—Ç—å—Å—è (–≤ —Ä–∞–º–∫–∞—Ö –º–µ—Ç–æ–¥–∞ –≤–∞–ª–µ–Ω—Ç–Ω—ã—Ö —Å–≤—è–∑–µ–π) –∏–∑ –¥–≤—É—Ö –∞—Ç–æ–º–æ–≤ –≤–æ–¥–æ—Ä–æ–¥–∞ –ø—Ä–∏ –æ–±–æ–±—â–µ—Å—Ç–≤–ª–µ–Ω–∏–∏ –¥–≤—É—Ö –Ω–µ—Å–ø–∞—Ä–µ–Ω–Ω—ã—Ö —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤ (—Ä–∞–≤–Ω–æ—Ü–µ–Ω–Ω—ã–π –º–µ—Ö–∞–Ω–∏–∑–º). –û–¥–Ω–∞–∫–æ —Ç–æ—Ç –∂–µ —Ä–µ–∑—É–ª—å—Ç–∞—Ç –¥–æ—Å—Ç–∏–≥–∞–µ—Ç—Å—è, –µ—Å–ª–∏ –∏—Å—Ö–æ–¥–Ω—ã–º–∏ —è–≤–ª—è—é—Ç—Å—è –∑–∞—Ä—è–∂–µ–Ω–Ω—ã–µ –∞—Ç–æ–º—ã H-1 –∏ H+1. –ê—Ç–æ–º H-1 –ø—Ä–µ–¥–æ—Å—Ç–∞–≤–ª—è–µ—Ç –¥–ª—è –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏—è —Å–≤—è–∑–∏ H-H —Å–≤–æ—é –Ω–µ–ø–æ–¥–µ–ª–µ–Ω–Ω—É—é –ø–∞—Ä—É —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤ 1s2, –∞ –∞—Ç–æ–º H+1 – –≤–∞–∫–∞–Ω—Ç–Ω—É—é 1s-–∞—Ç–æ–º–Ω—É—é –æ—Ä–±–∏—Ç–∞–ª—å.
–ù–µ–ø–æ–¥–µ–ª–µ–Ω–Ω—ã–µ –ø–∞—Ä—ã —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤, –∏–º–µ—é—â–∏–µ—Å—è —É —Ü–µ–Ω—Ç—Ä–∞–ª—å–Ω—ã—Ö –∞—Ç–æ–º–æ–≤ –º–Ω–æ–≥–∏—Ö –º–æ–ª–µ–∫—É–ª (:SO2, :NH3), —Ç–∞–∫–∂–µ –º–æ–≥—É—Ç –æ–±—Ä–∞–∑–æ–≤—ã–≤–∞—Ç—å –¥–æ–ø–æ–ª–Ω–∏—Ç–µ–ª—å–Ω—ã–µ —Å–≤—è–∑–∏ –ø–æ –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–æ–º—É –º–µ—Ö–∞–Ω–∏–∑–º—É. –ü–∞—Ä—Ç–Ω–µ—Ä–æ–º —Ç–∞–∫–∏—Ö —Ü–µ–Ω—Ç—Ä–∞–ª—å–Ω—ã—Ö –∞—Ç–æ–º–æ–≤ –¥–æ–ª–∂–Ω–∞ –±—ã—Ç—å —á–∞—Å—Ç–∏—Ü–∞ (–∏–ª–∏ –∞—Ç–æ–º —Å–ª–æ–∂–Ω–æ–π —á–∞—Å—Ç–∏—Ü—ã) —Å –Ω–µ–¥–æ—Å—Ç–∞—Ç–∫–æ–º —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤.
–ú–æ–ª–µ–∫—É–ª–∞ SO2 –ø—Ä–∏—Å–æ–µ–¥–∏–Ω—è–µ—Ç –≤ –∞—Ç–æ–º—É —Å–µ—Ä—ã –ø–æ –º–µ—Å—Ç—É –µ–µ –Ω–µ–ø–æ–¥–µ–ª–µ–Ω–Ω–æ–π –ø–∞—Ä—ã –∞—Ç–æ–º –∫–∏—Å–ª–æ—Ä–æ–¥–∞ (2s22p4) –∏ –æ–±—Ä–∞–∑—É–µ—Ç –º–æ–ª–µ–∫—É–ª—É SO3. –ì–µ–æ–º–µ—Ç—Ä–∏—á–µ—Å–∫–∞—è —Ñ–æ—Ä–º–∞ —á–∞—Å—Ç–∏—Ü—ã-–ø—Ä–æ–¥—É–∫—Ç–∞ —Å—Ç–∞–Ω–æ–≤–∏—Ç—Å—è –±–æ–ª–µ–µ —Å–∏–º–º–µ—Ç—Ä–∏—á–Ω–æ–π (–ø—Ä–∞–≤–∏–ª—å–Ω—ã–π —Ç—Ä–µ—É–≥–æ–ª—å–Ω–∏–∫) –ø–æ —Å—Ä–∞–≤–Ω–µ–Ω–∏—é —Å –Ω–µ–∑–∞–≤–µ—Ä—à–µ–Ω–Ω–æ–π —Ñ–æ—Ä–º–æ–π —É —Ä–µ–∞–≥–µ–Ω—Ç–∞ SO2.
Молекула аммиака NH3 содержит неподеленную пару электронов у атома азота; молекула воды H2O также имеет неподеленные пары у атома кислорода. Вместе с активным акцептором – ионом водорода H+ по донорно-акцепторному механизму образуются катионы аммония NH4+ и оксония H3O+.
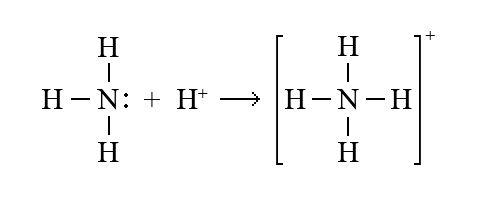

–§–æ—Ä–º–∞ –º–æ–ª–µ–∫—É–ª—ã NH3 (–Ω–µ–∑–∞–≤–µ—Ä—à–µ–Ω–Ω—ã–π —Ç–µ—Ç—Ä–∞—ç–¥—Ä) —Å—Ç–∞–Ω–æ–≤–∏—Ç—Å—è –ø–æ–ª–Ω–æ—Å—Ç—å—é —Å–∏–º–º–µ—Ç—Ä–∏—á–Ω–æ–π –≤ –∫–∞—Ç–∏–æ–Ω–µ NH4+ (–ø—Ä–∞–≤–∏–ª—å–Ω—ã–π —Ç–µ—Ç—Ä–∞—ç–¥—Ä); —Å–∏–º–º–µ—Ç—Ä–∏—á–Ω–æ—Å—Ç—å –∫–∞—Ç–∏–æ–Ω–∞ –æ–∫—Å–æ–Ω–∏—è H3O+ —Ç–∞–∫–∂–µ –≤—ã—à–µ, —á–µ–º —É –º–æ–ª–µ–∫—É–ª—ã –≤–æ–¥—ã H2O. –í –∏–æ–Ω–∞—Ö H3O+ –∏ NH4+ –≤—Å–µ –∞—Ç–æ–º—ã –≤–æ–¥–æ—Ä–æ–¥–∞ –Ω–µ—Ä–∞–∑–ª–∏—á–∏–º—ã, —Ç.–µ. —É–∂–µ –Ω–µ–ª—å–∑—è —É–∫–∞–∑–∞—Ç—å —Ç–æ—Ç –∞—Ç–æ–º –≤–æ–¥–æ—Ä–æ–¥–∞, –∫–æ—Ç–æ—Ä—ã–π –±—ã–ª –¥–æ –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏—è —Å–≤—è–∑–∏ –≤ –≤–∏–¥–µ H+ –∏ —Å–ª—É–∂–∏–ª –∞–∫—Ü–µ–ø—Ç–æ—Ä–æ–º —ç–ª–µ–∫—Ç—Ä–æ–Ω–Ω–æ–π –ø–∞—Ä—ã. –¢–∏–ø –≥–∏–±—Ä–∏–¥–∏–∑–∞—Ü–∏–∏ —Ü–µ–Ω—Ç—Ä–∞–ª—å–Ω—ã—Ö –∞—Ç–æ–º–æ–≤ O-II (–≤ H3O+) –∏ N-III (–≤ NH4+) –æ—Å—Ç–∞–µ—Ç—Å—è —Ç–µ–º –∂–µ, —á—Ç–æ –±—ã–ª –≤ –º–æ–ª–µ–∫—É–ª–∞—Ö H2O –∏ NH3 (sp3-–≥–∏–±—Ä–∏–¥–∏–∑–∞—Ü–∏—è). –°–ª–µ–¥—É–µ—Ç –æ—Ç–º–µ—Ç–∏—Ç—å, —á—Ç–æ –∫–∞—Ç–∏–æ–Ω NH4+ – —ç—Ç–æ –ø–æ —Ñ–æ—Ä–º–µ —Ç–∞–∫–æ–π –∂–µ –ø—Ä–∞–≤–∏–ª—å–Ω—ã–π —Ç–µ—Ç—Ä–∞—ç–¥—Ä, –∫–∞–∫ –∏ –º–æ–ª–µ–∫—É–ª–∞ CCl4 –∏–ª–∏ –º–æ–ª–µ–∫—É–ª–∞ –º–µ—Ç–∞–Ω–∞ CH4.
–í —Å—Ç–∞—Ä–æ–π –ª–∏—Ç–µ—Ä–∞—Ç—É—Ä–µ –±—ã–ª –ø—Ä–∏–Ω—è—Ç —Å–ø–æ—Å–æ–± –æ—Ç–º–µ—á–∞—Ç—å —Å–≤—è–∑—å –ø–æ –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–æ–º—É –º–µ—Ö–∞–Ω–∏–∑–º—É –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏—è –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–π —Å–≤—è–∑–∏ —Å—Ç—Ä–µ–ª–∫–æ–π (–≤ –æ—Ç–ª–∏—á–∏–µ –æ—Ç —á–µ—Ä—Ç—ã –¥–ª—è –æ–±–æ–∑–Ω–∞—á–µ–Ω–∏—è –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–π —Å–≤—è–∑–∏ –ø–æ —Ä–∞–≤–Ω–æ—Ü–µ–Ω–Ω–æ–º—É –º–µ—Ö–∞–Ω–∏–∑–º—É), –Ω–∞–ø—Ä–∏–º–µ—Ä:
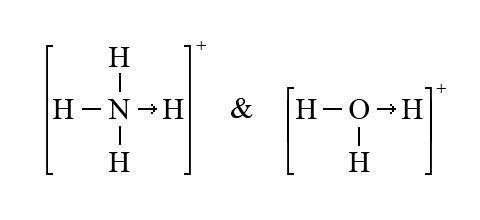
Кроме того, для образовавшейся по донорно-акцепторному механизму ковалентной связи были приняты названия в простых соединениях – семиполярная, а в комплексных соединениях – донорно-акцепторная, или координационная связь. Поскольку ковалентные связи, образующиеся по обоим механизмам, по свойствам не различаются, указанные названия применять нецелесообразно.










