Химия комплексных соединений – один из обширных разделов неорганической химии. Начало изучению комплексных соединений положил швейцарский химик Вернер (1893 год), который разработал основы координационной теории. Он выделял простые соединения, или соединения первого порядка, как образованные в соответствии со стехиометрической валентностью элементов, и комплексные соединения, или соединения высшего порядка, в которых атомы тех же элементов присоединяют большее число партнеров по химической связи (атомов или групп атомов). Четкой границы между комплексными и простыми (по Вернеру) соединениями нет.
Комплексное соединение состоит из разных заряженных внешней и внутренней сферы (собственно комплекса); встречаются также нейтральные комплексы. Формулу комплекса записывают в квадратных скобках; в комплексе различают центральный атом (заряженный или нейтральный) и другие атомы или группы атомов (заряженные или нейтральные) – лиганды, которые связаны с центральным атомом ковалентно по донорно-акцепторному механизму.
Если лиганд образуют одну сигма связь центральным атомом, то число таких лигандов равно координационное число центрального атома. Заряд всего комплекса определяется суммарным зарядом всех лигандов (если они – ионы) и зарядом центрального атома, выраженным степенью окисления соответствующего элемента.
Центральный атом может быть атомом неметалла или металла.
Комплексные соединения с центральным атомом неметаллов
Такие комплексные соединения образуются из молекул простых соединений и дополнительных частиц лиганда.
Примеры.
BF3 + F– = [BF4]–; PF5 + F– = [PF6]–
Комплексные ионы BF и PF существует в растворе и в узлах кристаллических решеток таких комплексных соединений как
K[BF4] – тетрафтороборат(III) калийя
Na[PF6] – гексафторофосфат(V) натрия
Орбитальная модель атома и метод валентных связей позволяют объяснить образование этих комплексов следующим образом. Атом бора B(2s22p1) и атом фосфора P(3s23p3) переходят в возбужденные состояния B* (2s12p2) и P* (3s13p33d1) и формируют о связи по равноценному механизму с тремя и пятью атомами фтора F (2s22p5). Полученные молекулы простых соединений BF3 и PF6 присоединяют по одному фторид иону F (2s22p6). Возникают комплексные ионы [BF4]– и [PF6]–.
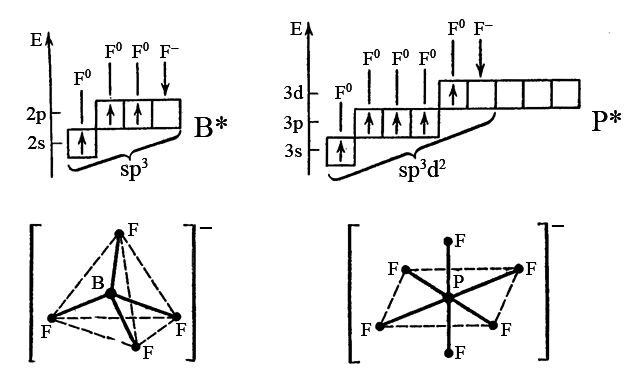
Ион [BF4]– имеет тетраэдрическую форму, так как атом бора находится в sp3-гибридизации, а ион [PF6]– – октаэдрическую форму, так как атом фосфора находится в sp3d2-гибридизации. Образовавшиеся комплексные ионы устойчивее реакционноспособных исходных молекул BF3 и PF5 поскольку окружение атомов BIII и PV в комплексах более симметрично (молекулам BF3 и BF5 отвечает тригональная тригонально-бипирамидальная геометрия). Все четыре связи B-F в комплексе [BF4]– и все шесть связей P-F в комплексе [PF6]– одинаковы.
Тот же вывод даёт применение метода молекулярных орбиталей, которые рассматривают все общие электронные пары – 4 пары в [PF4]– и 6 пар в [PF6]– как находящиеся на соответственно пятицентровых и семицентровых связывающих молекулярных орбиталях.
Комплексных соединений с центральными атомами неметаллов относительно немного.
Комплексные соединения с центральными атомами металлов
Такие соединения широко известны и распространены. Чаще всего внутренняя сфера в этих комплексных соединениях заряжена, т.е представляет собой либо комплексный катион, либо комплексный анион. Вместе с какой-либо внешней сферы комплексные ионы образуют комплексные соли.
Как и в формулах простых солей, в формулах комплексных солей вначале (слева) записывают формулу катиона,а затем (справа) – формулу аниона.
Примеры.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди(II)
K3[Fe(CN)6] – гексацианоферрат(III) калия
В формуле комплекса символ центрального атома всегда стоит на первом месте (слева), а формулі лигандов следуют за ним:
Комплекс: [Cu(NH3)4]2+; Центральный атом: Cu+II; Лиганды: NH3.
Комплекс: [Fe(CN)6]3-; Центральный атом: Fe+III; Лиганды: CN–.
Заряд комплексного иона равен алгебраической сумме заряда (степени окисления) центрального атома и всех его лигандов
Большинство металлов, выступающих в качестве центрального атома в комплексах, относится к переходным металлом (элементом побочных подгрупп), таким как железо, кобальт, никель, платина, медь, серебро, золото, цинк, кадмий, ртуть.
В качестве лигандов в комплексах с центральными атомами металлов выступают либо нейтральные полярные частицы (молекулы), либо отрицательные ионы (анионы), в первую очередь такие как вода H2O (донорный атом O; [Ni(H2O)6])2+), аммиак NH3 (донорный атом N; [Co(NH3)6]3+), хлорид- иодид-ион Cl– I– ([PtCl4]2-, [HgI4]2-), гидроксид ион OH– (донорный атом O; [Zn(OH)4]2-), цианид ион CN– (донорный атом C; [Ag(CN)2]–).
При электролитической диссоциации комплексных солей в водном растворе многие комплексные катионы или анионы и сохраняет свой состав. Однако при определённых условиях (температура, pH раствора, другие реагенты) они могут разлагаться на составные части или образовывать новые комплексы.
Примеры:
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42-
[Cu(NH3)4]SO4 → CuSO4 + NH3
[Cu(NH3)4]2+ + 4H3O+ = [Cu(H2O)4]2+ + 4NH4+
[Ag(NH3)2]+ + I– + 2H2O = AgI + 2NH3*H2O
[Ag(NH3)2]+ + 2CN– + 2H2O = [Ag(CN)2]– + 2NH3*H2O
[Al(OH)4]– + CO2 = Al(OH)3 + HCO3–
2[Co(NH3)6]2+ + H2O2 = 2[Co(NH3)6]3+ + 2OH–
Способы получения комплексных соединений весьма разнообразны; они зависят от свойств элементов, атомы которых являются центральными, и лигандов, а также от устойчивости комплексов.
Примеры:
NiSO4 + 6H2O = [Ni(H2O)6]2+ + SO42-
Co(OH)2 + 6NH3*H2O = [Co(NH3)6]2+ + 2OH– + 6H2O
HgCl2 + 4I– = [HgI4]2- + 2Cl–
[Zn(H2O)4]2+ + 4OH– = [Zn(OH)4]2- + 4H2O
4Ag + 8CN– + 2H2O + O2 = 4 [Ag(CN)2]– + 4OH–
От комплексных соединений следует отличать двойные соли, которые в водном растворе диссоциируют на все виды ионов, входящих в их состав.
Примеры:
Квасцы KAl(SO4)2*12H2O = K+ + Al3+ + 2SO42- + 12H2O
Карналлит KMgCl3*6H2O = K+ + Mg2+ + 3Cl– + 6H2O
Формирование химических связей в большинстве комплексов с центральным атомом металла происходит при электростатическом притяжении между положительно заряженными центральным атомом и ионными лигандами или нейтральными лигандами – полярными молекулами, которые ориентируются к центральному атому отрицательным концом диполя.
Пример. В соединении [Cu(H2O)4]SO4*H2O – гидрат сульфата тетрааквамеди(II), четыре молекулы воды в качестве лигандом связывается с атомами CuII в комплексный катион, а пятая молекулы воды с помощью водородной связи присоединяется к сульфат-иону.
Ковалентные связи в комплексах возникают при вообще вставления неподеленных электронных пар донорных атомов лигандов; центральный атом выполняет функцию акцептора, предоставляя свои атомные орбитали валентных подуровней. Особенно устойчивыми оказываются комплексы, в которых 4, 8, 12 или 16 связывающих их электронов, что и соответствует распространенным координационным числам центральных атомов 2, 4, 6 и 8.
Пример. В гексацианоферрат(II)-ионе [Fe(CN)6]4- у свободного центрального атома Fe+II остается 24 электрона (из 26 электронов нейтрального атома Fe); шесть лигандов CN– за счет шести неподеленных пар электронов донорных атомов C предоставляют для образования шести σ-связей с центральным атомом 12 электронов. В комплексе атом FeII оказывается имеющим 24 + 12 = 36 электронов, т.е. он приобретает устойчивую электронную конфигурацию ближайшего последующего благородного газа – криптона Kr (Z = 36). По этой причине данный комплекс – пример очень устойчивых комплексов.
Таким образом, процесс образования химических связей в комплексах протекает через
электростатическое взаимодействие ион-ион или ион-диполь ковалентное связывание за счет взаимного перекрывания атомных орбиталей лигандов и центрального атома
Оба подхода к объяснению устойчивости комплексов как образованием ионной связи, так и образованием ковалентной связи, равным образом применимы. Оба эти подхода приводят к одному выводу – химическая связь в комплексах имеет ту же полярно-ковалентную природу, что и в простых соединениях. Преобладание ионной составляющей в связи обеспечивает относительную подвижность лигандов; такие комплексы мало устойчивый. Высокая степень ковалентности обуславливает высокую прочность связей лигандов с центральным атомом и, как следствие, высокую устойчивость комплексов. Между обоими типами связывания (которые никогда не осуществляются в чистом виде) нет резкой границы, а степень ионности (или степень ковалентности) связей определяется химической природой центрального атома и лигандов.
Примеры образования комплексов с преимущественно электростатическим и с преимущественно ковалентным связыванием. В качестве центрального атома рассматривается железо степени окисления (+II) и c координационным числом 4 или 6. Каждый лигранд, в приведенной схеме (обозначается буквой L) занимает вокруг центрального атома одно координационное место.
Монодентатные лиганды – это лиганды занимающие только 1 координационное место центрального атома (H2O, NH3, CN–).
Полидентатные лиганды – это лиганды, каждая из которых занимает 2 (би-), 3 (три-) и более координационных мест центрального атома (NH2CH2CH2NH2 – бидентатный лиганд, имеет два донорных атома N).
Электронная конфигурация атома FeII может быть следующей (валентные подуровни условно показаны на одной горизонтали):
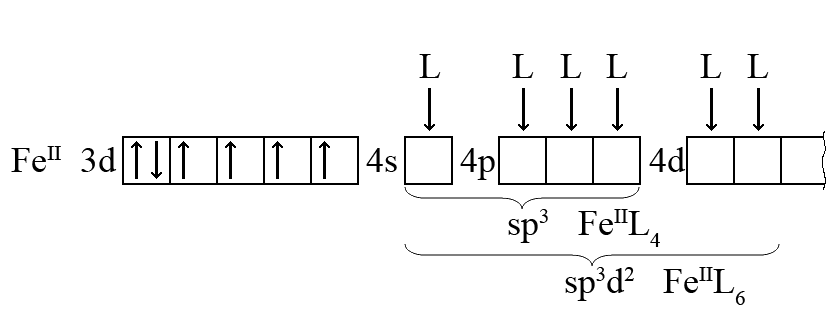
Нейтральный атом Fe (3d64s2) при переходе в состояние FeII(3d6) теряет два внешних электрона (4s2). В результате электростатического приближения четырех или шести лигандов образуются комплексы [FeIIL4] или [FeIIL6] со слабыми ковалентными связями. Геометрическая форма комплексов будет либо тетраэдрической (sp3-гибридизация), либо октаэдрической (sp3d2-гибридизация). Наличие четырех неспаренных электронов у атома FeII приводит к сильному отталкиванию лигандов и, следовательно, к сильно полярной ковалентной связи Fe-L.
Лиганды, которые не вызывают спаривания валентных электронов центрального атома, называются лиганды со слабым электростатическим полем; к ним относятся, например, F–, Cl–, I–, H2O. Такие комплексы, как [FeCl4]2- или [Fe(H2O)6]2-, называются высокоспиновыми (много неспаренных электронов), или внешнеорбитальными (от атома FeII в образовании связей принимают участие только атомные орбитали четвертого, внешнего энергетического уровня).
Существуют лиганды и другого типа, которые вызывают спаривание валентных электронов центрального атома, поскольку обладают сильным электростатическим полем. Так, центральный атом FeII при приближении лигандов с сильным полем образует комплексы в такой электронной конфигурации:

Геометрическая форма комплексов FeIIL6 также октаэдрическая, но тип гибридизации иной – d2sp3-гибридизация. Отсутствие неспаренных электронов у атома FeII приводит к сильному притяжению лигандов, таких как CN–. Комплексы с отсутствием неспаренных электронов типа [Fe(CN)6]4- или комплексы с другими центральными атомами, имеющими малое число неспаренных электронов, называются низкоспиновые комплексы, или внутриорбитальные комплексы (в образовании связей принимают участие орбитали внутреннего энергетического уровня, в данном примере – 3d-атомные орбитали железа).
Участие (n – 1)d-атомных орбиталей или nd-атомных орбиталей металла в образовании связей с лигандами характерно, в первую очередь, для элементов побочных подгрупп, хотя встречается и у элементов главных групп (sp3d2-гибридизация атомных орбиталей фосфора в комплексе [PF6]–).










