ąÜą░ąČą┤ąŠąĄ čüą╗ąŠąČąĮąŠąĄ ąĖą╗ąĖ ą┐čĆąŠčüč鹊ąĄ ą▓ąĄčēąĄčüčéą▓ąŠ čüąŠčüč鹊ąĖčé ąĖąĘ 菹╗ąĄą╝ąĄąĮčéčĆą░čĆąĮčŗčģ čćą░čüčéąĖčå – ą░č鹊ą╝ąŠą▓ ąĖ ą╝ąŠą╗ąĄą║čāą╗, ą║ąŠč鹊čĆčŗąĄ ąĖą╝ąĄčÄčé ąŠą┤ąĖąĮą░ą║ąŠą▓čŗą╣ ą░č鹊ą╝ąĮčŗą╣ čüąŠčüčéą░ą▓ ąĖ čüčéčĆčāą║čéčāčĆąĮąŠąĄ čüčéčĆąŠąĄąĮąĖąĄ.
ąźąĖą╝ąĖč湥čüą║ą░čÅ č乊čĆą╝čāą╗ą░ – čŹč鹊 ąĖąĘąŠą▒čĆą░ąČąĄąĮąĖąĄ ą║ą░č湥čüčéą▓ąĄąĮąĮąŠą│ąŠ ąĖ ą║ąŠą╗ąĖč湥čüčéą▓ąĄąĮąĮąŠą│ąŠ čüąŠčüčéą░ą▓ą░ ą▓ąĄčēąĄčüčéą▓ą░ ą┐čĆąĖ ą┐ąŠą╝ąŠčēąĖ čüąĖą╝ą▓ąŠą╗ąŠą▓ čģąĖą╝ąĖč湥čüą║ąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓, ą░ čéą░ą║ąČąĄ čćąĖčüą╗ąŠą▓čŗčģ, ą▒čāą║ą▓ąĄąĮąĮčŗčģ ąĖ ą┤čĆčāą│ąĖčģ ąĘąĮą░ą║ąŠą▓.
ąźąĖą╝ąĖč湥čüą║ąĖąĄ č乊čĆą╝čāą╗čŗ ąĖą╝ąĄčÄčé ąĖąĮč鹥čĆąĮą░čåąĖąŠąĮą░ą╗čīąĮčŗąĄ ąĖąĘąŠą▒čĆą░ąČąĄąĮąĖčÅ.
ąźąĖą╝ąĖč湥čüą║ą░čÅ č乊čĆą╝čāą╗ą░ ą┤ą░ąĄčé čüą╗ąĄą┤čāčÄčēčāčÄ ąĖąĮč乊čĆą╝ą░čåąĖčÄ ąŠ ą▓ąĄčēąĄčüčéą▓ąĄ: ą║ą░ą║ąĖąĄ 菹╗ąĄą╝ąĄąĮčéčŗ ą▓čģąŠą┤čÅčé ą▓ čüąŠčüčéą░ą▓ ą▓ąĄčēąĄčüčéą▓ą░ ąĖ ą║ą░ą║ąŠąĄ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĄ ą░č鹊ą╝ąŠą▓ čŹčéąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓, ąĖ čüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ, ą║ą░ą║ąŠą╣ čüąŠčüčéą░ą▓ ą╝ąŠą╗ąĄą║čāą╗čŗ ą┤ą╗čÅ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ ąĖą╗ąĖ čüąŠčüčéą░ą▓ ąĖ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĄ ąĖąŠąĮąŠą▓ ą▓ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĄ ą┤ą╗čÅ ąĖąŠąĮąĮčŗčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣.
ą¤čĆąĖą╝ąĄčĆ. ążąŠčĆą╝čāą╗ą░ H2O ą┐ąŠą║ą░ąĘčŗą▓ą░ąĄčé, čćč鹊 ą▓ąŠą┤ą░ (ą║ąŠą▓ą░ą╗ąĄąĮčéąĮąŠąĄ ą▓ąĄčēąĄčüčéą▓ąŠ) ą▓ą║ą╗čÄčćą░ąĄčé 菹╗ąĄą╝ąĄąĮčéčŗ ą▓ąŠą┤ąŠčĆąŠą┤ H ąĖ ą║ąĖčüą╗ąŠčĆąŠą┤ O ą▓ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĖ ąĖčģ ą░č鹊ą╝ąŠą▓ 2 : 1, ą░ č乊čĆą╝čāą╗ą░ Na2SO4 – čüčāą╗čīčäą░čé ąĮą░čéčĆąĖčÅ (ąĖąŠąĮąĮąŠąĄ ą▓ąĄčēąĄčüčéą▓ąŠ) ą▓ą║ą╗čÄčćą░ąĄčé 菹╗ąĄą╝ąĄąĮčéčŗ ąĮą░čéčĆąĖą╣ Na, čüąĄčĆčā S ąĖ ą║ąĖčüą╗ąŠčĆąŠą┤ ą▓ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĖ ąĖčģ ą░č鹊ą╝ąŠą▓ 2 : 1 : 4 ąĖą╗ąĖ ą▓ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĖ ąĖąŠąĮąŠą▓ Na+ ąĖ SO42-, čĆą░ą▓ąĮąŠą╝ 2 : 1. ąĪąŠąŠčéąĮąŠčłąĄąĮąĖąĄ ą┤ą╗čÅ ąĖąŠąĮąŠą▓ ąĮą░ą▒ą╗čÄą┤ą░ąĄčéčüčÅ ąĮąĄ č鹊ą╗čīą║ąŠ ą┤ą╗čÅ ą▓ąĄčēąĄčüčéą▓ ą▓ čéą▓ąĄčĆą┤ąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ, ąĮąŠ ąĖ ą▓ čĆą░ąĘą▒ą░ą▓ą╗ąĄąĮąĮąŠą╝ ą▓ąŠą┤ąĮąŠą╝ čĆą░čüčéą▓ąŠčĆąĄ, ą│ą┤ąĄ Na2SO4 菹╗ąĄą║čéčĆąŠą╗ąĖčéąĖč湥čüą║ąĖ ą┤ąĖčüčüąŠčåąĖąĖčĆčāąĄčé ąĮą░ ą║ą░čéąĖąŠąĮčŗ Na+ ąĖ ą░ąĮąĖąŠąĮčŗ SO42- ą▓ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĖ 2 : 1.
ąźąĖą╝ąĖč湥čüą║ąĖąĄ č乊čĆą╝čāą╗čŗ ą▓ąĖą┤ą░ H2O, Na2SO4, C2H2 ąĮą░ąĘčŗą▓ą░čÄčéčüčÅ čüčāą╝ą╝ą░čĆąĮčŗą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ. ą¦ąĖčüą╗ąŠ ą░č鹊ą╝ąŠą▓ ą║ą░ąČą┤ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ ą▓ č乊čĆą╝čāą╗ąĄ čāą║ą░ąĘčŗą▓ą░ąĄčéčüčÅ ąĮąĖąČąĮąĖą╝ čćąĖčüą╗ąŠą▓čŗą╝ ąĖąĮą┤ąĄą║čüąŠą╝ čüą┐čĆą░ą▓ą░ čā čüąĖą╝ą▓ąŠą╗ą░ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĄą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░.
ą¤ąŠą╝ąĖą╝ąŠ čüčāą╝ą╝ą░čĆąĮčŗčģ č乊čĆą╝čāą╗ ą▓ čģąĖą╝ąĖąĖ ąĖčüą┐ąŠą╗čīąĘčāčÄčéčüčÅ čüčéčĆčāą║čéčāčĆąĮčŗąĄ č乊čĆą╝čāą╗čŗ ą╝ąŠą╗ąĄą║čāą╗, ą║ąŠč鹊čĆčŗąĄ ą┐ąŠą║ą░ąĘčŗą▓ą░čÄčé ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠąĄ ą▓ąĘą░ąĖą╝ąĮąŠąĄ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮąĖąĄ ą░č鹊ą╝ąŠą▓ ą▓ ą╝ąŠą╗ąĄą║čāą╗ąĄ.
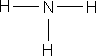
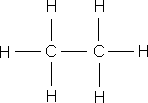
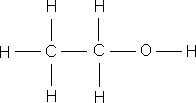
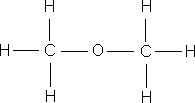
ą×ą▒čĆą░čéąĖč鹥 ą▓ąĮąĖą╝ą░ąĮąĖąĄ ąĮą░ čüčāą╝ą╝ą░čĆąĮčŗąĄ č乊čĆą╝čāą╗čŗ čŹčéą░ąĮąŠą╗ą░ ąĖ ą┤ąĖą╝ąĄčéąĖą╗ąŠą▓ąŠą│ąŠ čŹčäąĖčĆą░ – ąŠąĮąĖ ąŠą┤ąĖąĮą░ą║ąŠą▓čŗąĄ, čćč鹊 ą│ąŠą▓ąŠčĆąĖčé ąŠą▒ ąŠą┤ąĖąĮą░ą║ąŠą▓ąŠą╝ ą░č鹊ą╝ą░čĆąĮąŠą╝ ąĖ ą║ąŠą╗ąĖč湥čüčéą▓ąĄąĮąĮąŠą╝ čüąŠčüčéą░ą▓ąĄ, ąĮąŠ ą▓ąĘą░ąĖą╝ąĮąŠąĄ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮąĖąĄ ą░č鹊ą╝ąŠą▓ ą▓ ą╝ąŠą╗ąĄą║čāą╗ą░čģ čŹčéąĖčģ ą▓ąĄčēąĄčüčéą▓ čĆą░ąĘą╗ąĖčćąĮąŠąĄ, ą┐ąŠčŹč鹊ą╝čā čŹčéą░ąĮąŠą╗ ąĖ ą┤ąĖą╝ąĄčéąĖą╗ąŠą▓čŗą╣ čŹčäąĖčĆ – čĆą░ąĘąĮčŗąĄ ą▓ąĄčēąĄčüčéą▓ą░ čü čĆą░ąĘą╗ąĖčćąĮčŗą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ. ąÆ ąŠčĆą│ą░ąĮąĖč湥čüą║ąŠą╣ čģąĖą╝ąĖąĖ, ą┤ą╗čÅ ąŠč鹊ą▒čĆą░ąČąĄąĮąĖčÅ ą╝ąŠą╗ąĄą║čāą╗ ą║ą░ą║ ą┐čĆą░ą▓ąĖą╗ąŠ ą┐ąŠą╗čīąĘčāčÄčéčüčÅ čüčéčĆčāą║čéčāčĆąĮčŗą╝ąĖ č乊čĆą╝čāą╗ą░ą╝ąĖ.
ą¤čĆą░ą▓ąĖą╗ą░ ą┐ąŠčüčéčĆąŠąĄąĮąĖčÅ čüčāą╝ą╝ą░čĆąĮčŗčģ č乊čĆą╝čāą╗ ą┤ą▓čāčģ菹╗ąĄą╝ąĄąĮčéąĮčŗčģ ąĖą╗ąĖ ą┤ą▓čāčģąĖąŠąĮąĮčŗčģ ąĮąĄąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣
1. ąŚą░ą┐ąĖčüčŗą▓ą░čÄčé čüąĖą╝ą▓ąŠą╗čŗ 菹╗ąĄą╝ąĄąĮč鹊ą▓ ąĖą╗ąĖ č乊čĆą╝čāą╗čŗ ąĖąŠąĮąŠą▓, ą┐čĆąĖč湥ą╝ ą┤ą╗čÅ čŹą╗ąĄą╝ąĄąĮč鹊ą▓ ą┤ąŠą╗ąČąĮčŗ ą▒čŗčéčī ąĖąĘą▓ąĄčüčéąĮčŗ ąĖą╗ąĖ ąĘą░ą┤ą░ąĮčŗ ąĖčģ čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖąĄ ą▓ą░ą╗ąĄąĮčéąĮąŠčüčéąĖ, ą░ ą┤ą╗čÅ ąĖąŠąĮąŠą▓ – ąĖčģ 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ ąĘą░čĆčÅą┤.
ą¤čĆąĖą╝ąĄčĆ. ąöą╗čÅ č乊čĆą╝čāą╗ ąŠą║čüąĖą┤ą░ ą╝čŗčłčīčÅą║ą░ (V) ąĖ ąŠčĆč鹊č乊čüčäą░čéą░ ą║ą░ą╗čīčåąĖčÅ, čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖą╝ąĖ 菹╗ąĄą╝ąĄąĮčéą░ą╝ąĖ ąĖ ąĖąŠąĮą░ ą╝ąĖ ą▒čāą┤čāčé
AsVOII┬Ā ┬Ā ┬ĀCa2+PO43-
2. ąØą░čģąŠą┤čÅčé ąĮą░ąĖą╝ąĄąĮčīčłąĄąĄ ąŠą▒čēąĄąĄ ą║čĆą░čéąĮąŠąĄ čāą║ą░ąĘą░ąĮąĮčŗčģ čćąĖčüąĄą╗ ą▓ą░ą╗ąĄąĮčéąĮąŠčüčéąĖ ąĖą╗ąĖ ąĘą░čĆčÅą┤ą░. ąÆ ą┤ą░ąĮąĮąŠą╝ ą┐čĆąĖą╝ąĄčĆąĄ ą┤ą╗čÅ ą┐ąĄčĆą▓ąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░ ąŠąĮąŠ čĆą░ą▓ąĮąŠ 10 = 2 ┬Ę 5, ą░ ą┤ą╗čÅ ą▓č鹊čĆąŠą│ąŠ 6 = 2 ┬Ę 3.
3. ąöąĄą╗čÅčé ąĮą░ąĖą╝ąĄąĮčīčłąĄąĄ ąŠą▒čēąĄąĄ ą║čĆą░čéąĮąŠąĄ ąĮą░ ą▓ą░ą╗ąĄąĮčéąĮąŠčüčéčī 菹╗ąĄą╝ąĄąĮčéą░ ąĖą╗ąĖ ąĮą░ ąĘą░čĆčÅą┤ ąĖąŠąĮą░ (ą▒ąĄąĘ čāč湥čéą░ ąĘąĮą░ą║ą░) ąĖ čéą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝ ąĮą░čģąŠą┤čÅčé čćąĖčüą╗ąŠ ą░č鹊ą╝ąŠą▓ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĄą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ ąĖą╗ąĖ čćąĖčüą╗ąŠ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖčģ ąĖąŠąĮąŠą▓ ą▓ č乊čĆą╝čāą╗ąĄ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ
AsV OII┬Ā ┬Ā Ca2+ PO43-
2 ┬Ā ┬Ā 5 ┬Ā ┬Ā ┬Ā ┬Ā3 ┬Ā ┬Ā 2
4. ąŁčéąĖ čćąĖčüą╗ą░ ąĘą░ą┐ąĖčüčŗą▓ą░čÄčé ą▓ ą▓ąĖą┤ąĄ ąĮąĖąČąĮąĖčģ ąĖąĮą┤ąĄą║čüąŠą▓ čüą┐čĆą░ą▓ą░ čā čüąĖą╝ą▓ąŠą╗ąŠą▓ 菹╗ąĄą╝ąĄąĮč鹊ą▓ ąĖą╗ąĖ č乊čĆą╝čāą╗ ąĖąŠąĮąŠą▓ (ąŠą┐čāčüą║ą░čÅ ą▓ą░ą╗ąĄąĮčéąĮąŠčüčéąĖ 菹╗ąĄą╝ąĄąĮč鹊ą▓ ąĖ ąĘą░čĆčÅą┤čŗ ąĖąŠąĮąŠą▓) ąĖ ą┐ąŠą╗čāčćą░čÄčé čüčāą╝ą╝ą░čĆąĮčŗąĄ č乊čĆą╝čāą╗čŗ ą▓ąĄčēąĄčüčéą▓
As2O5┬Ā ┬Ā Ca3(PO4)2
ążąŠčĆą╝čāą╗čŗ ą╝ąĮąŠą│ąŠčŹą╗ąĄą╝ąĄąĮčéąĮčŗčģ ąĖąŠąĮąŠą▓ ąĘą░ą║ą╗čÄčćą░čÄčé ą▓ ą║čĆčāą│ą╗čŗąĄ čüą║ąŠą▒ą║ąĖ, čćč鹊ą▒čŗ ą▒čŗą╗ąŠ ąŠč湥ą▓ąĖą┤ąĮąŠ, čćč鹊 čćąĖčüą╗ąŠą▓ąŠą╣ ąĖąĮą┤ąĄą║čü ąŠčéąĮąŠčüąĖčéčüčÅ ą║ąŠ ą▓čüąĄą╣ č乊čĆą╝čāą╗ąĄ ąĖąŠąĮą░ (Ca3(PO4)2).










