Орбитальная модель атома.
Электрон обладает одновременно свойствами частицы и свойствами волны. Двойственный характер электрона называют корпускулярно-волновым дуализмом. Поэтому, только с учетом корпускулярно-волнового дуализма электрона, можно сформулировать орбитальную модель атома.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90%-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90%-ой плотности заряда электрона (как волны).
Главное квантовое число (n) – это номер энергетического уровня от 1 до 7. Номер энергетического уровня характеризует энергию электронов, не может быть отрицательным. Главное квантовое число определяет размеры электронного облака, чем больше главное квантовое число (т.е. энергия электрона), тем дальше электрон от ядра и тем больше размер электронного облака.
Орбитальное квантовое число (l) (побочное или азимутальное) – это число, которое характеризует форму электронного облака, форму атомной орбитали, и принимает целочисленные значения от 0 до n – 1. Определенному энергетическому уровню соответствует определенное число орбитальных квантовых чисел – атомных орбиталей определенной формы, называемых энергетическими подуровнями. Например, для энергетического уровня 1 характерен один энергетический подуровень характеризующийся орбитальным квантовым числом l = 0 (1 – 1 = 0); для энергетического уровня 4 характерны четыре энергетических подуровня отличающихся формой: l = 0, 1, 2, 3. Количество энергетических подуровней численно равно номеру энергетического уровня. Энергетическим подуровням присвоены буквенные обозначения: l = 0 – s-подуровень (на нем находятся s-электроны); l = 1 – p-подуровень (p-электроны); l = 2 – d-подуровень (d-электроны); l = 3 – f-подуровень (f-электроны).
Электронное облако s-электронов первого энергетического уровня обладает сферической симметрией (имеет форму шара). Электронные облака s-электронов 2, 3 и последующих энергетических уровней, так-же обладают сферической симметрией (шарообразная форма); но волновая функция, описывающая форму электронного облака, меняется более сложным образом и не является монотонной. Если в случае 1s-электронов, график радиального распределения электронной плотности имеет один максимум, то графики радиального распределения электронной плотности 2s- и 3s-электронов, имеют соответственно два и три максимума. При этом главный максимум располагается тем дальше от ядра, чем больше значение главного квантового числа.
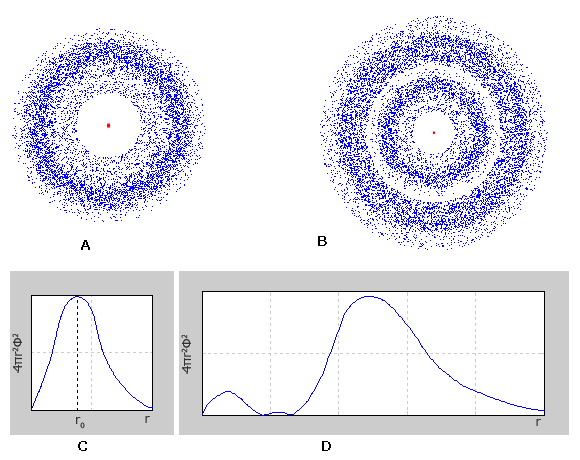
A – Электронное облако 1s-электрона;
B – Электронное облако 2s-электрона;
C – График радиального распределения вероятности для 1s-электрона;
D – График радиального распределения вероятности для 2s-электрона.
В отличие от s-электронов p-электроны не обладают сферической симметрией. Форма электронных облаков p-электронов напоминает приплюснутую с торцов восьмерку.
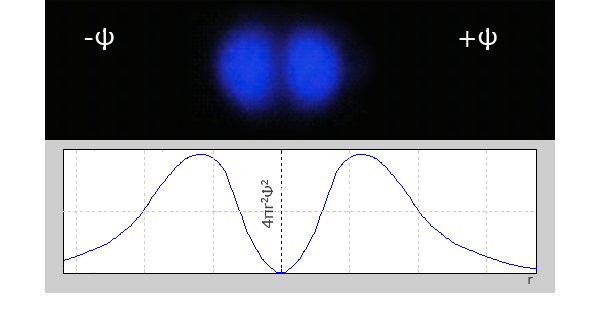
График радиального распределения вероятности для 2p-электрона.
Радиальное распределение электронной плотности в электронных облаках последующих 3p-(два максимума) 4p-электронов (3 максимума), так-же, будет иметь “слоистый” характер, при этом, наибольший максимум располагается все дальше от ядра. Знак волновой функции электронного облака p-электронов имеет значение + или – в разных частях.
Электронные облака d-электронов имеют еще более сложную форму, которая напоминает две сплюснутые с торцов восьмерки перпендикулярные друг другу и расположенные в одной плоскости (“черырехлепестковая” фигура). Знаки волновой функции в “лепестках” чередуются.
Магнитное квантовое число (m) – характеризует пространственную ориентацию электронного облака. Магнитное квантовое число может принимать любые целочисленные значения, как положительные, так и отрицательные в пределах от -l до +l (минус ель до плюс ель). Например для s-электрона l = 0, соответственно и значение магнитного квантового числа можеть быть равно только 0. Для p-электронов l = 1, тогда m = -1, 0, 1 (три значения m). Для d-электронов l = 2, m = -2, -1, 0, 1, 2 (пять значений m). Вообще, некоторому значению орбитального квантового числа соответствует 2l+1 возможных значений магнитного квантового числа – т.е. возможных расположений электронного облака в пространстве.
Магнитное квантовое число m получило свое название магнитного, поскольку от его значения зависит взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. В отсутствие внешнего магнитного поля энергия электрона в атоме не зависит от значения m. В этом случае электроны с одинаковыми значениями n и l, но разными значениями m обладают одинаковой энергией. Однако при действии на электрон внешнего магнитного поля энергия электрона в атоме изменяется, так что состояния электрона, различающиеся значением m, различаются и по энергии. Это происходит потому, что энергия взаимодействия магнитного поля электрона с внешним магнитным полем зависит от величины магнитного квантового числа. Именно по этому в магнитном поле происходит расщепление некоторых атомных спектральных линий: вместо одной линии в спектре атома появляются несколько (эффект Зеемана).
Состояние электрона в атоме, характеризующееся определенным изначениями квантовых чисел n, l, m, т.е. определенными размерами, формой и ориентацией в пространстве электронного облака, получило название атомной электронной орбитали
Спиновое квантовое число (s) – это собственный момент количества движения электрона. Эту величину, упрощенно можно рассматривать как результат вращения электрона вокруг своей оси. Спиновое квантовое число может принимать только два значения: +1/2 и -1/2.
Многоэлектронные атомы. В атоме водорода электрон находится в силовом поле, которое создается только ядром. В многоэлектронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако. В моногоэлектронных атомах энергетическое состояние электрона зависит не только от главного квантового числа, но и от орбитального квантового числа. Это связано с тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов расположенных между данным электроном и ядром. Внутренние электронные слои образуют как бы экран, ослбляющий притяжение электрона к ядру – экранируют внешний электрон от ядерного заряда. При этом, для электронов, которые различаются значением орбитального квантового числа экранирование не является одинаковым. В результате, енергия электрона в невозбужденном атоме, который находится на более высоком энергетическом уровне, например на s-орбитали оказывается ниже энергии электрона уровнем ниже, который находится на d-орбитали. Эту особенность описывает правило Клечковского:
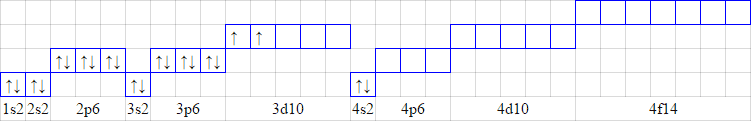
Заполнение электронами орбыталей происходит в порядке увеличения суммы главного квантового числа и орбитального квантового числа n + l При одинаковой сумме заполняется орбытальз меньшим значением n (1s2s2p3s3p4s3d4p5s).
Заполнение орбиталей электронами в пределах определенного энергетического уровня происходит в соответствии с правилом Ф. Хунда (1927 г.)
Атомные орбитали, которые принадлежат к одному подуровню, заполняются сначала одним электроном с одинаковым спиновым числом для каждой орбитали, а затем вторым электроном, с противоположным значением спинового числа для каждой орбитали
На последнем энергетическом уровне атома находятся внешние электроны. Внешних электронов не может быть больше восьми.
Пример:
Электронная формула: 22Ti=1s22s22p63s23p64s23d2
Схема размещения электронов: 22Ti