菹Įčéą░ą╗čīą┐ąĖčÅ čĆąĄą░ą║čåąĖąĖ – čŹč鹊 čĆą░ąĘąĮąŠčüčéčī ą╝ąĄąČą┤čā čüčāą╝ą╝ąŠą╣ 菹Įčéą░ą╗čīą┐ąĖą╣ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą┐čĆąŠą┤čāą║č鹊ą▓ čĆąĄą░ą║čåąĖąĖ ąĖ čüčāą╝ą╝ąŠą╣ 菹Įčéą░ą╗čīą┐ąĖą╣ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čĆąĄą░ą│ąĄąĮč鹊ą▓ čü čāč湥č鹊ą╝ čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖčģ ą║ąŠą╗ąĖč湥čüčéą▓ ą▓ąĄčēąĄčüčéą▓
╬öH = Ōłæ(n╬öH)ą┐čĆąŠą┤čāą║čéčŗ – Ōłæ(n╬öH)čĆąĄą░ą│ąĄąĮčéčŗ
ąöą╗čÅ ąĮąĄą║ąŠč鹊čĆąŠą╣ čĆąĄą░ą║čåąĖąĖ
nAA + nBB = nCC + nDD
čüčéą░ąĮą┤ą░čĆčéąĮą░čÅ čŹąĮčéą░ą╗čīą┐ąĖčÅ čĆąĄą░ą║čåąĖąĖ čĆą░ą▓ąĮą░:
╬öH┬░298 = (nC╬öH┬░298(ąĪ) + nD╬öH┬░298(D)) – (nA╬öH┬░298(A) + nB╬öH┬░298(B))
ą¤čĆąĖą╝ąĄčĆ. ąĪčéą░ąĮą┤ą░čĆčéąĮą░čÅ čŹąĮčéą░ą╗čīą┐ąĖčÅ čüą╗ąĄą┤čāčÄčēąĄą╣ čĆąĄą░ą║čåąĖąĖ:
4NH3(ą│) + 5O2(ą│) = 4NO(ą│) + 6H2O(ą│)╬öH┬░298 = (nNO┬Ę╬öH┬░298(NO) + nH2O┬Ę╬öH┬░298(H2O)) – (nNH3┬Ę╬öH┬░298(NH3) + nO2┬Ę╬öH┬░298(O2)) ┬Ā=┬Ā(4┬Ę(+91) + 6┬Ę(-242)) – (4┬Ę(-46) + 5┬Ę(0)) = -904 ą║ąöąČ
ąĀą░ąĘą┤ąĄą╗ čģąĖą╝ąĖąĖ, ą║ąŠč鹊čĆčŗą╣ ą┐ąŠčüą▓čÅčēąĄąĮ ą║ąŠą╗ąĖč湥čüčéą▓ąĄąĮąĮąŠą╝čā ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĖčÄ č鹥ą┐ą╗ąŠą▓čŗčģ čŹčäč乥ą║č鹊ą▓ čģąĖą╝ąĖč湥čüą║ąĖčģ čĆąĄą░ą║čåąĖą╣, ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ č鹥čĆą╝ąŠčģąĖą╝ąĖąĄą╣.
 ąĀą░čüč湥čé č鹥ą┐ą╗ąŠą▓čŗčģ čŹčäč乥ą║č鹊ą▓ čĆąĄą░ą║čåąĖą╣, ą▓ čćą░čüčéąĮąŠčüčéąĖ ą┐čĆąĖ p = const, ąŠčüąĮąŠą▓ą░ąĮ ąĮą░ ą┤ą▓čāčģ ąĘą░ą║ąŠąĮą░čģ č鹥čĆą╝ąŠčģąĖą╝ąĖąĖ.
ąĀą░čüč湥čé č鹥ą┐ą╗ąŠą▓čŗčģ čŹčäč乥ą║č鹊ą▓ čĆąĄą░ą║čåąĖą╣, ą▓ čćą░čüčéąĮąŠčüčéąĖ ą┐čĆąĖ p = const, ąŠčüąĮąŠą▓ą░ąĮ ąĮą░ ą┤ą▓čāčģ ąĘą░ą║ąŠąĮą░čģ č鹥čĆą╝ąŠčģąĖą╝ąĖąĖ.
ą┐ąĄčĆą▓čŗą╣ ąĘą░ą║ąŠąĮ č鹥čĆą╝ąŠčģąĖą╝ąĖąĖ: ą┐čĆąĖ čĆą░ąĘą╗ąŠąČąĄąĮąĖąĖ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ąĮą░ ą┐čĆąŠčüčéčŗąĄ ą▓ąĄčēąĄčüčéą▓ą░ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ąĖąĘą╝ąĄąĮąĄąĮąĖąĄ 菹Įčéą░ą╗čīą┐ąĖąĖ, čĆą░ą▓ąĮąŠąĄ (ąĮąŠ čü ą┐čĆąŠčéąĖą▓ąŠą┐ąŠą╗ąŠąČąĮčŗą╝ ąĘąĮą░ą║ąŠą╝) ąĖąĘą╝ąĄąĮąĄąĮąĖčÄ čŹąĮčéą░ą╗čīą┐ąĖąĖ ą┐čĆąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĖ čŹč鹊ą│ąŠ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ąĖąĘ č鹥čģ ąČąĄ ą┐čĆąŠčüčéčŗčģ ą▓ąĄčēąĄčüčéą▓
ą¤ąĄčĆą▓čŗą╣ ąĘą░ą║ąŠąĮ čéečĆą╝ąŠčģąĖą╝ąĖąĖ ąŠčéą║čĆčŗčé ą▓ ą║ąŠąĮčåąĄ XVIII ą▓. čäčĆą░ąĮčåčāąĘčüą║ąĖą╝ąĖ čāč湥ąĮčŗą╝ąĖ ąøą░ą▓čāą░ąĘčīąĄ ąĖ ąøą░ą┐ą╗ą░čüąŠą╝, ą▓č鹊čĆąŠąĄ ąĮą░ąĘą▓ą░ąĮąĖąĄ čŹč鹊ą│ąŠ ąĘą░ą║ąŠąĮą░ – ąĘą░ą║ąŠąĮ ąøą░ą▓čāą░ąĘčīąĄ-ąøą░ą┐ą╗ą░čüą░. ążą░ą║čéąĖč湥čüą║ąĖ čŹč鹊čé ąĘą░ą║ąŠąĮ ą▓čŗč鹥ą║ą░ąĄčé ąĖąĘ ąĘą░ą║ąŠąĮą░ čüąŠčģčĆą░ąĮąĄąĮąĖčÅ čŹąĮąĄčĆą│ąĖąĖ; ąĖą╝ąĄąĮąĮąŠ ąĮą░ čŹč鹊ą╝ ąĘą░ą║ąŠąĮąĄ ąŠčüąĮąŠą▓ą░ąĮą░ č乊čĆą╝čāą╗ą░ ą┤ą╗čÅ čĆą░čüč湥čéą░ 菹Įčéą░ą╗čīą┐ąĖąĖ čĆąĄą░ą║čåąĖąĖ ą┐ąŠ 菹Įčéą░ą╗čīą┐ąĖąĖ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ čāčćą░čüčéą▓čāčÄčēąĖčģ ą▓ ąĮąĄą╣ ą▓ąĄčēąĄčüčéą▓.
 ąŁąĮčéą░ą╗čīą┐ąĖčÄ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ąŠą┐čĆąĄą┤ąĄą╗ąĖčéčī 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠ ą╝ąŠąČąĮąŠ ąĮąĄ ą┤ą╗čÅ ą▓čüąĄčģ ą▓ąĄčēąĄčüčéą▓ ąĖąĘ-ąĘą░ čüą╗ąŠąČąĮąŠčüčéąĖ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĖčÅ ąĖą╗ąĖ ą┐čĆą░ą║čéąĖč湥čüą║ąŠą╣ ąĮąĄąŠčüčāčēąĄčüčéą▓ąĖą╝ąŠčüčéąĖ ą╝ąĮąŠą│ąĖčģ čĆąĄą░ą║čåąĖą╣. ąóą░ą▒ą╗ąĖčćąĮčŗąĄ ąĘąĮą░č湥ąĮąĖčÅ ╬öH┬░298 ą┤ą╗čÅ ą╝ąĮąŠą│ąĖčģ ą▓ąĄčēąĄčüčéą▓ ą┐ąŠą╗čāč湥ąĮčŗ čĆą░čüč湥čéąĮčŗą╝ čüą┐ąŠčüąŠą▒ąŠą╝, ąŠčüąĮąŠą▓ą░ąĮąĮąŠą╝ ąĮą░ ą▓č鹊čĆąŠą╝ ąĘą░ą║ąŠąĮąĄ č鹥čĆą╝ąŠčģąĖą╝ąĖąĖ, ąŠčéą║čĆčŗč鹊ą╝ ą▓ 1840 ą│. čĆčāčüčüą║ąĖą╝ čģąĖą╝ąĖą║ąŠą╝ ąō.ąś. ąōąĄčüčüąŠą╝ , ąĘą░ą║ąŠąĮ ąōąĄčüčüą░:
ąŁąĮčéą░ą╗čīą┐ąĖčÄ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ąŠą┐čĆąĄą┤ąĄą╗ąĖčéčī 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠ ą╝ąŠąČąĮąŠ ąĮąĄ ą┤ą╗čÅ ą▓čüąĄčģ ą▓ąĄčēąĄčüčéą▓ ąĖąĘ-ąĘą░ čüą╗ąŠąČąĮąŠčüčéąĖ ą┐čĆąŠą▓ąĄą┤ąĄąĮąĖčÅ ąĖą╗ąĖ ą┐čĆą░ą║čéąĖč湥čüą║ąŠą╣ ąĮąĄąŠčüčāčēąĄčüčéą▓ąĖą╝ąŠčüčéąĖ ą╝ąĮąŠą│ąĖčģ čĆąĄą░ą║čåąĖą╣. ąóą░ą▒ą╗ąĖčćąĮčŗąĄ ąĘąĮą░č湥ąĮąĖčÅ ╬öH┬░298 ą┤ą╗čÅ ą╝ąĮąŠą│ąĖčģ ą▓ąĄčēąĄčüčéą▓ ą┐ąŠą╗čāč湥ąĮčŗ čĆą░čüč湥čéąĮčŗą╝ čüą┐ąŠčüąŠą▒ąŠą╝, ąŠčüąĮąŠą▓ą░ąĮąĮąŠą╝ ąĮą░ ą▓č鹊čĆąŠą╝ ąĘą░ą║ąŠąĮąĄ č鹥čĆą╝ąŠčģąĖą╝ąĖąĖ, ąŠčéą║čĆčŗč鹊ą╝ ą▓ 1840 ą│. čĆčāčüčüą║ąĖą╝ čģąĖą╝ąĖą║ąŠą╝ ąō.ąś. ąōąĄčüčüąŠą╝ , ąĘą░ą║ąŠąĮ ąōąĄčüčüą░:
ą▓č鹊čĆąŠą╣ ąĘą░ą║ąŠąĮ č鹥čĆą╝ąŠčģąĖą╝ąĖąĖ: čüčāą╝ą╝ą░ 菹Įčéą░ą╗čīą┐ąĖą╣ ą┤ą▓čāčģ ąĖą╗ąĖ ą▒ąŠą╗ąĄąĄ ą┐čĆąŠą╝ąĄąČčāč鹊čćąĮčŗčģ čĆąĄą░ą║čåąĖą╣ (čüčéą░ą┤ąĖą╣) ą┐čĆąĖ ą┐ąĄčĆąĄčģąŠą┤ąĄ ąŠčé ąĖčüčģąŠą┤ąĮąŠą│ąŠ čüąŠčüč鹊čÅąĮąĖčÅ ą║ ą║ąŠąĮąĄčćąĮąŠą╝čā čüąŠčüč鹊čÅąĮąĖčÄ čĆą░ą▓ąĮą░ 菹Įčéą░ą╗čīą┐ąĖąĖ čĆąĄą░ą║čåąĖąĖ, ą║ąŠč鹊čĆą░čÅ ąĮąĄą┐ąŠčüčĆąĄą┤čüčéą▓ąĄąĮąĮąŠ ą▓ąĄą┤ąĄčé ąŠčé ąĖčüčģąŠą┤ąĮąŠą│ąŠ čüąŠčüč鹊čÅąĮąĖčÅ ą║ ą║ąŠąĮąĄčćąĮąŠą╝čā čüąŠčüč鹊čÅąĮąĖčÄ
ąóą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝, 菹Įčéą░ą╗čīą┐ąĖčÅ čĆąĄą░ą║čåąĖąĖ ąĘą░ą▓ąĖčüąĖčé č鹊ą╗čīą║ąŠ ąŠčé ą▓ąĖą┤ą░ ąĖ čüąŠčüč鹊čÅąĮąĖčÅ čĆąĄą░ą│ąĄąĮč鹊ą▓, ąĮąŠ ąĮąĄ ąĘą░ą▓ąĖčüąĖčé ąŠčé ą┐čĆąŠą╝ąĄąČčāč鹊čćąĮčŗčģ čüąŠčüč鹊čÅąĮąĖą╣ ąĖ ą┐čāčéąĖ ą┐ąĄčĆąĄčģąŠą┤ą░ ąŠčé čĆąĄą░ą│ąĄąĮč鹊ą▓ ą║ ą┐čĆąŠą┤čāą║čéą░ą╝ (čŹč鹊 ą▓č鹊čĆą░čÅ č乊čĆą╝čāą╗ąĖčĆąŠą▓ą║ą░ ąĘą░ą║ąŠąĮą░ ąōąĄčüčüą░). ąŚą░ą║ąŠąĮ ąōąĄčüčüą░ ą┐ąŠąĘą▓ąŠą╗čÅąĄčé čüą▓čÅąĘą░čéčī 菹Įčéą░ą╗čīą┐ąĖą╣ąĮčŗąĄ čŹčäč乥ą║čéčŗ ą┐čĆąŠčåąĄčüčüą░, ą║ąŠč鹊čĆčŗą╣ ą╝ąŠąČąĄčé ą┐čĆąŠč鹥ą║ą░čéčī ą▓ ąŠą┤ąĮčā ąĖą╗ąĖ ąĮąĄčüą║ąŠą╗čīą║ąŠ čüčéą░ą┤ąĖą╣, ąĖ č鹥ą╝ čüą░ą╝čŗą╝ čĆą░čüčüčćąĖčéą░čéčī 菹Įčéą░ą╗čīą┐ąĖčÄ (č鹥ą┐ą╗ąŠą▓ąŠą╣ čŹčäč乥ą║čé) č鹊ą╣ čĆąĄą░ą║čåąĖąĖ, ą║ąŠč鹊čĆčāčÄ čéčĆčāą┤ąĮąŠ ąŠčüčāčēąĄčüčéą▓ąĖčéčī ąĖą╗ąĖ ą┤ąŠą▓ąĄčüčéąĖ ą┤ąŠ ą║ąŠąĮčåą░.
ą¤čĆąĖą╝ąĄčĆ. ą¤čĆąŠčåąĄčüčü ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ą┤ąĖąŠą║čüąĖą┤ą░ čāą│ą╗ąĄčĆąŠą┤ą░ ą┐čĆąĖ čüąČąĖą│ą░ąĮąĖąĖ ą│čĆą░čäąĖčéą░ ą▓ ą║ąĖčüą╗ąŠčĆąŠą┤ąĄ ą╝ąŠąČąĄčé ą┐čĆąŠč鹥ą║ą░čéčī ą┤ą▓čāą╝čÅ ą┐čāčéčÅą╝ąĖ:
- 2C + O2 = 2CO
2CO + O2 = 2CO2 - C + O2 = CO2
ąŁą║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĖčéčī 菹Įčéą░ą╗čīą┐ąĖčÄ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ CO ą┐ąŠ ą┐ąĄčĆą▓ąŠą╣ čĆąĄą░ą║čåąĖąĖ ąĮąĄą▓ąŠąĘą╝ąŠąČąĮąŠ, čé.ą║. ąĖą┤ąĄčé ą▓č鹊čĆą░čÅ čĆąĄą░ą║čåąĖčÅ – ą┐čĆąĄą▓čĆą░čēąĄąĮąĖąĄ CO ą▓ CO2. ą×ą┤ąĮą░ą║ąŠ ą╝ąŠąČąĮąŠ 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĖčéčī 菹Įčéą░ą╗čīą┐ąĖčÄ čĆąĄą░ą║čåąĖąĖ ą┐čĆąĄą▓čĆą░čēąĄąĮąĖą╣ CO ą▓ CO2 ąĄčüą╗ąĖ ą┐ąŠą╗čāčćąĖčéčī (ą║ą░ą║ąĖą╝-ą╗ąĖą▒ąŠ ą┤čĆčāą│ąĖą╝ čüą┐ąŠčüąŠą▒ąŠą╝) čćąĖčüčéčŗą╣ CO, ą░ ąĘą░č鹥ą╝ ą┐ąĄčĆąĄą▓ąĄčüčéąĖ ąĄą│ąŠ ą▓ CO2 čüąČąĖą│ą░ąĮąĖąĄą╝ ą▓ ą║ąĖčüą╗ąŠčĆąŠą┤ąĄ. ąÜčĆąŠą╝ąĄ č鹊ą│ąŠ, ą╗ąĄą│ą║ąŠ ąĮą░čģąŠą┤ąĖčéčüčÅ ąĖ 菹Įčéą░ą╗čīą┐ąĖčÅ ą┐ąŠą╗ąĮąŠą│ąŠ čüą│ąŠčĆą░ąĮąĖčÅ ą│čĆą░čäąĖčéą░ (ą┐čāčéčī 2), čé.ąĄ. 菹Įčéą░ą╗čīą┐ąĖčÅ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ CO2. ą×čéčüčÄą┤ą░ ąĮą░ ąŠčüąĮąŠą▓ąĄ ąĘą░ą║ąŠąĮą░ ąōąĄčüčüą░ ą╗ąĄą│ą║ąŠ čĆą░čüčüčćąĖčéą░čéčī 菹Įčéą░ą╗čīą┐ąĖčÄ ą┐ąĄčĆąĄčģąŠą┤ą░ ą│čĆą░čäąĖčéą░ ą▓ CO, ąĖčüą┐ąŠą╗čīąĘčāčÅ čüčģąĄą╝čā:
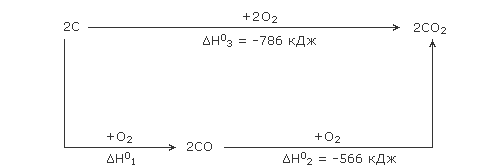
ą¤ąŠ ąĘą░ą║ąŠąĮčā ąōąĄčüčüą░ ╬öH┬░1 + ╬öH┬░2 = ╬öH┬░3; čüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ:
╬öH┬░(CO) =┬Ā╬öH┬░1 / n(CO) = (╬öH┬░3 – ╬öH┬░2) / n(CO) = ((-786) – (-566)) / 2 = -110 ą║ąöąČ/ą╝ąŠą╗čī
ą¤ąŠą╗čāč湥ąĮąĮąŠąĄ ąĘąĮą░č湥ąĮąĖąĄ č鹊čćąĮąŠ ąŠčéą▓ąĄčćą░ąĄčé čüą┐čĆą░ą▓ąŠčćąĮčŗą╝ ą┤ą░ąĮąĮčŗą╝.










