Мерой склонности веществ к окислению и восстановлению служит электродный потенциал. Если погрузить пластинку некоторого металла в водный раствор его собственной соли (Сu в раствор CuSO4 или Zn в раствор ZnSO4), то в такой системе принципиально возможно протекание двух противоположных электрохимических процессов:
- Катионы могут восстанавливаться и осаждаться в виде атомов из раствора соли на металл. Для компенсации заряда ионов в растворе расходуются электроны из погруженной в раствор металлической пластины, поэтому в атоме металла возникает недостаток электронов):
Men+ + ne– = Мe0
- Атомы металла могут окисляться и переходить в раствор, а электроны остаются в металле и обусловливают их избыток:
Me0 + ne- = Мen+
Склонность катионов к восстановлению обычно возрастает с повышением концентрации соли в растворе.
Склонность металлов к окислению зависит от химической природы металла.
Например, для цинка склонность к окислению значительно выше, чем для меди. Если представить, что концентрации веществ в растворе одинаковы, то цинк предоставит в раствор большее количество катионов, чем медь, а следовательно, на цинковой пластинке останется больше электронов. Благодаря электростатическому притяжению между катионами и электронами катионы удерживаются вблизи поверхности металла – образуется двойной электрический слой и появляется разность электрических потенциалов (или гальвани-потенциал). Подобная система, имеющая вид металла погруженного в раствор электролита, называется электродом.
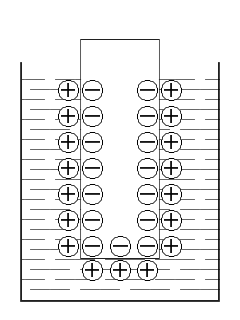
Электрод – это система из двух токопроводящих тел: проводников I и II рода.
Проводники I рода – это вещества в которых носителем электрического заряда являются электроны. К проводникам I рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит.
Проводники II рода – это вещества в которых носителем электрического заряда являются ионы. К проводникам второго рода относятся расплавы и растворы электролитов.
Устройство, состоящее из двух электродов, называется гальванический элемент. Абсолютное значение разности потенциалов которое возникает на границе металл | электролит, то есть гальвани-потенциал измерить нельзя никакими средствами, поскольку он возникает между двумя фазами различной природы (твердый металл | жидкий раствор). Однако можно измерить разницу гальвани потенциалов двух химически различных электродов, приняв один из электродов за электрод сравнения. В качестве электрода сравнения обычно используют электрод Н+/Н2 (газ) – водородный электрод, который предложил немецкий физико-химик Нернст.
Этот электрод состоит из платиновой пластины, покрытой платиновой чернью (для увеличения активной поверхности электрода), которая погружена в раствор, содержащий катионы водорода (катионы оксония) обычно раствор НСl или H2SO4. Через раствор непрерывно пропускают газообразный водород под постоянным давлением. Водородный электрод вводят в электрический контакт с исследуемым электродом с помощью соединительного токопроводящего мостика, в качестве которого используют стеклянную трубку, заполненную раствором электролита, обычно КСl. Таким образом получают гальванический элемент. Используя компенсационный метод, измеряют разность потенциалов между электродами, то есть электродвижущую силу этого элемента.
Чтобы можно было сравнивать значение разности потенциалов различных электродов, необходимо выполнять эксперименты в стандартных условиях. В качестве стандартных условий приняты условия: температура 25*С (298,15К), давление 101,325 кПа (1 атм), концентрация ионов 1 моль/дм3 (при точных расчетах вместо аналитической концентрации используют активность электролитов). В электроде сравнения, который называют стандартный водородный электрод, поддерживается концентрация катионов водорода 1 моль/cм3 и давление газообразного Н2 101,325 кПа (1 атм). Разность потенциалов стандартного водородного электрода и любого другого электрода (металл / раствор соли металла), измеренная при стандартных условиях, называется стандартный электродный потенциал (обозначение Е0).
Стандартный потенциал стандартного водородного электрода условно принят за ноль.
Стандартный водородный электрод сложно воспроизвести на практике. Необходим чистый водород с постоянной скоростью его подачи. Чаще всего вместо стандартного водородного электрода используют другие электроды сравнения, например каломельный электрод Hg/Hg2Cl2.
Таблица Стандартные потенциалы пар Мen+/Мe0 в электрохимическом ряду напряжений
|
Мen+/Мe0 |
E0, B |
|
Li+/Li |
-3,045 |
|
Rb+/Rb |
-2,925 |
|
K+/K |
-2,924 |
|
Cs+/Cs |
-2,923 |
|
Ra2+/Ra |
-2,916 |
|
Ba2+/Ba |
-2,905 |
|
Sr2+/Sr |
-2,888 |
|
Ca2+/Ca |
-2,864 |
|
Na+/Na |
-2,711 |
|
Ac3+/Ac |
-2,600 |
|
La3+/La |
-2,522 |
|
Y3+/Y |
-2,372 |
|
Mg2+/Mg |
-2,370 |
|
Sc3+/Sc |
-2,077 |
|
Th4+/Th |
-1,875 |
|
Be2+/Be |
-1,847 |
|
Al3+/Al |
-1,700 |
|
U3+/U |
-1,690 |
|
U4+/U |
-1,425 |
|
Ti3+/Ti |
-1,208 |
|
Mn2+/Mn |
-1,192 |
|
V2+/V |
-1,125 |
|
Cr2+/Cr |
-0,852 |
|
V3+/V |
-0,835 |
|
Zn2+/Zn |
-0,763 |
|
Ga3+/Ga |
-0,560 |
|
Fe2+/Fe |
-0,441 |
|
Cd2+/Cd |
-0,404 |
|
In3+/In |
-0,338 |
|
Tl+/Tl |
-0,336 |
|
Co2+/Co |
-0,277 |
|
Ni2+/Ni |
-0,234 |
|
Sn2+/Sn |
-0,141 |
|
Pb2+/Pb |
-0,126 |
|
Fe3+/Fe |
-0,037 |
|
H+/H2 |
0,000 |
|
BiIII/Bi |
+0,317 |
|
Cu2+/Cu |
+0,338 |
|
Cu+/Cu |
+0,518 |
|
Tl3+/Tl |
+0,741 |
|
Hg22+/Hg |
+0,796 |
|
Ag+/Ag |
+0,799 |
|
Hg2+/Hg |
+0,852 |
|
Pd2+/Pd |
+0,915 |
|
AuIII/Au |
+1,498 |
|
Au+/Au |
+1,691 |
Стандартные потенциалы Е0 распространенных металлов Мen+/Мe0 всегда относятся к определенному электродному процессу, то есть к определенному заряду и составу катиона металла в растворе. Так, для ртути это могут быть катионы Hg2+ и Hg22+, для железа – катионы Fe2+ и Fe3+.
В зависимости от того, положительно или отрицательно заряженным оказывается металлический электрод относительно стандартного электрода, стандартный потенциал пары Мen+/Мe0 также будет иметь положительное или отрицательное значение.
Пример.
Для цинк / водородного гальванического элемента, состоящего из цинкового Zn2+/Zn0 и водородного Н+/Н20 электродов, в стандартных условиях разность потенциалов составляет -0,763 В. Цинковый электрод является отрицательным полюсом гальванического элемента, а водородный электрод – положительным полюсом.
Поэтому, стандартный потенциал пары Zn2+/Zn0 будет иметь такое же значение (как по абсолютному числовому значению, так и по знаку):
Zn2+ + 2e– = Zn0; E0 = -0,763B
Для меди / водородного гальванического элемента, состоящего из медного Cu2+/Cu0 и водородного Н+/Н02 электродов, в стандартных условиях разность потенциалов составляет +0,338 В. Медный электрод является положительным полюсом гальванического элемента, а водородный электрод – отрицательным полюсом. Поэтому, стандартный потенциал пары Cu2+/Cu0 будет иметь такое же значение:
Сu2+ + 2е– = Сu0; E0 = + 0,338В
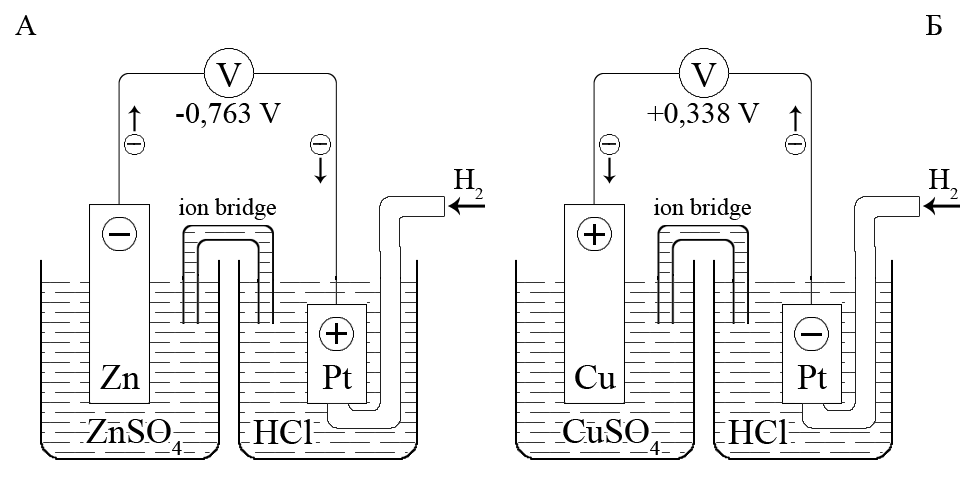
Схема гальванической цепи со стандартным водородным электродом для определения стандартного потенциала электродов: A – цинкового; Б – медного
Последовательность металлов по возрастанию стандартного потенциала Е0 (от больших отрицательных к большим положительным значениям) как раз и соответствует электрохимическому ряду напряжений. Такая последовательность называется ряд стандартных электродных потенциалов. Порядок расположения в этом ряду металлов основан на стандартных потенциалах конкретных пар Мen+/М0, а для неблагородных металлов таких пар может быть больше одной. Электродные процессы является видом окислительно-восстановительных реакций, которые отличаются тем, что полуреакции окисления и восстановления протекают не в одном растворе, а являются пространственно разобщенными.










