–£—Ç–≤–æ—Ä–µ–Ω–Ω—è –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–≥–æ –∑–≤’—è–∑–∫—É –º–æ–∂–Ω–∞ –æ–ø–∏—Å–∞—Ç–∏ –∑–∞ –¥–æ–ø–æ–º–æ–≥–æ—é –¥–≤–æ—Ö –º–µ—Ö–∞–Ω—ñ–∑–º—ñ–≤ – —Ä—ñ–≤–Ω–æ—Ü—ñ–Ω–Ω–æ–≥–æ —ñ –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–æ–≥–æ.
–Ý—ñ–≤–Ω–æ—Ü—ñ–Ω–Ω–∏–π –º–µ—Ö–∞–Ω—ñ–∑–º –ø–µ—Ä–µ–¥–±–∞—á–∞—î, —â–æ –∑–∞–≥–∞–ª—å–Ω–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω–Ω–∞ –ø–∞—Ä–∞ (–≤ –º–µ—Ç–æ–¥—ñ –≤–∞–ª–µ–Ω—Ç–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤) —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –∑ –Ω–µ—Å–ø–∞—Ä–µ–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤ –æ–±–æ—Ö –∞—Ç–æ–º—ñ–≤-–ø–∞—Ä—Ç–Ω–µ—Ä—ñ–≤ —è–∫—ñ —É—Ç–≤–æ—Ä—é—é—Ç—å –∑–≤‚Äô—è–∑–æ–∫.
–î–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–∏–π –º–µ—Ö–∞–Ω—ñ–∑–º —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–≥–æ –∑–≤’—è–∑–∫—É –ø–µ—Ä–µ–¥–±–∞—á–∞—î, —â–æ –æ–¥–∏–Ω –∑ –∞—Ç–æ–º—ñ–≤ –Ω–∞–¥–∞—î –¥–ª—è —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –∑–≤’—è–∑–∫—É –Ω–µ–ø–æ–¥—ñ–ª–µ–Ω—É (–≤–ª–∞—Å–Ω—É) –ø–∞—Ä—É –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤, –∞ —ñ–Ω—à–∏–π –∞—Ç–æ–º –Ω–∞–¥–∞—î –≤–∞–∫–∞–Ω—Ç–Ω—É (–ø–æ—Ä–æ–∂–Ω—é, –±–µ–∑ –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤) –∞—Ç–æ–º–Ω—É –æ—Ä–±—ñ—Ç–∞–ª—å.
–î–æ–Ω–æ—Ä – —Ü–µ –∞—Ç–æ–º, —è–∫–∏–π –Ω–∞–¥–∞—î –ø–∞—Ä—É –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤ –≤ –æ–±–ª–∞—Å—Ç—å —É—Ç–≤–æ—Ä–µ–Ω–Ω—è —Ö—ñ–º—ñ—á–Ω–æ–≥–æ –∑–≤’—è–∑–∫—É.
–ê–∫—Ü–µ–ø—Ç–æ—Ä – —Ü–µ –∞—Ç–æ–º, —â–æ –º–∞—î –≤–∞–∫–∞–Ω—Ç–Ω—É –æ—Ä–±—ñ—Ç–∞–ª—å, —è–∫–∏–π –ø—Ä–∏—Ç—è–≥—É—î —á–∞—Å—Ç–∏–Ω—É –µ–ª–µ–∫—Ç—Ä–æ–Ω–Ω–æ—ó –≥—É—Å—Ç–∏–Ω–∏ –≤—ñ–¥ –µ–ª–µ–∫—Ç—Ä–æ–Ω–Ω–æ—ó –ø–∞—Ä–∏ –¥–æ–Ω–æ—Ä–∞.
–ü—Ä–∏ —É—Ç–≤–æ—Ä–µ–Ω–Ω—ñ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–≥–æ –∑–≤’—è–∑–∫—É, –∞—Ç–æ–º–∏, —è–∫—ñ –π–æ–≥–æ —É—Ç–≤–æ—Ä—é—é—Ç—å –º–æ–∂—É—Ç—å –±—É—Ç–∏ —è–∫ –Ω–µ–π—Ç—Ä–∞–ª—å–Ω–∏–º–∏, —Ç–∞–∫ —ñ –∑–∞—Ä—è–¥–∂–µ–Ω–∏–º–∏; —è–∫ –≤—ñ–ª—å–Ω–∏–º–∏, —Ç–∞–∫ —ñ –≤–∂–µ —Ö—ñ–º—ñ—á–Ω–æ –ø–æ–≤’—è–∑–∞–Ω–∏–º–∏, —Ç–æ–±—Ç–æ —Ç–∞–∫–∏–º–∏, —â–æ –≤—Ö–æ–¥—è—Ç—å –¥–æ —Å–∫–ª–∞–¥—É –º–æ–ª–µ–∫—É–ª.
–ü—ñ—Å–ª—è —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –∑–≤’—è–∑–∫—É –∑–∞ –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–∏–º –º–µ—Ö–∞–Ω—ñ–∑–º–æ–º –≤–∂–µ –Ω–µ –º–æ–∂–Ω–∞ –≤–∏–∑–Ω–∞—á–∏—Ç–∏, —è–∫–∏–π –∞—Ç–æ–º –±—É–≤ –¥–æ–Ω–æ—Ä–æ–º, –∞ —è–∫–∏–π – –∞–∫—Ü–µ–ø—Ç–æ—Ä–æ–º –µ–ª–µ–∫—Ç—Ä–æ–Ω–Ω–æ—ó –ø–∞—Ä–∏.
–ù–∞–ø—Ä–∏–∫–ª–∞–¥, –º–æ–ª–µ–∫—É–ª–∞ H2 –∑—ñ –∑–≤’—è–∑–∫–æ–º H-H –º–æ–∂–µ —É—Ç–≤–æ—Ä—é–≤–∞—Ç–∏—Å—è (–≤ —Ä–∞–º–∫–∞—Ö –º–µ—Ç–æ–¥—É –≤–∞–ª–µ–Ω—Ç–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤) –∑ –¥–≤–æ—Ö –∞—Ç–æ–º—ñ–≤ –≥—ñ–¥—Ä–æ“ë–µ–Ω—É –ø—Ä–∏ –æ–±‚Äô—î–¥–Ω–∞–Ω–Ω—ñ –¥–≤–æ—Ö –Ω–µ—Å–ø–∞—Ä–µ–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤ (—Ä—ñ–≤–Ω–æ—Ü—ñ–Ω–Ω–∏–π –º–µ—Ö–∞–Ω—ñ–∑–º). –û–¥–Ω–∞–∫ —Ç–æ–π —Å–∞–º–∏–π —Ä–µ–∑—É–ª—å—Ç–∞—Ç –¥–æ—Å—è–≥–∞—î—Ç—å—Å—è, —è–∫—â–æ –≤–∏—Ö—ñ–¥–Ω–∏–º–∏ —î –∑–∞—Ä—è–¥–∂–µ–Ω—ñ –∞—Ç–æ–º–∏ H-1 —ñ H+1. –ê—Ç–æ–º H-1 –Ω–∞–¥–∞—î –¥–ª—è —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –∑–≤’—è–∑–∫—É H-H —Å–≤–æ—é –Ω–µ–ø–æ–¥—ñ–ª–µ–Ω—É –ø–∞—Ä—É –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤ 1s2, –∞ –∞—Ç–æ–º H+1 –Ω–∞–¥–∞—î –≤–∞–∫–∞–Ω—Ç–Ω—É 1s-–∞—Ç–æ–º–Ω—É –æ—Ä–±—ñ—Ç–∞–ª—å.
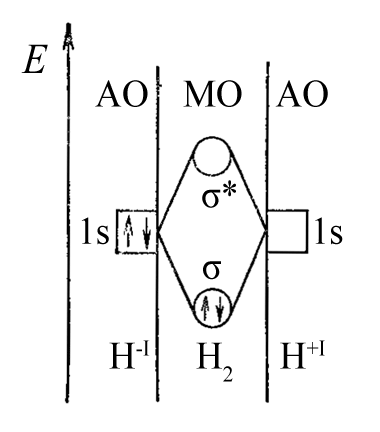
–ù–µ–ø–æ–¥—ñ–ª–µ–Ω—ñ –ø–∞—Ä–∏ –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤, –Ω–∞—è–≤–Ω—ñ —É —Ü–µ–Ω—Ç—Ä–∞–ª—å–Ω–∏—Ö –∞—Ç–æ–º–∞—Ö –±–∞–≥–∞—Ç—å–æ—Ö –º–æ–ª–µ–∫—É–ª (:SO2, :NH3), —Ç–∞–∫–æ–∂ –º–æ–∂—É—Ç—å —É—Ç–≤–æ—Ä—é–≤–∞—Ç–∏ –¥–æ–¥–∞—Ç–∫–æ–≤—ñ –∑–≤’—è–∑–∫–∏ –∑–∞ –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–∏–º –º–µ—Ö–∞–Ω—ñ–∑–º–æ–º. –ü–∞—Ä—Ç–Ω–µ—Ä–æ–º —Ç–∞–∫–∏—Ö —Ü–µ–Ω—Ç—Ä–∞–ª—å–Ω–∏—Ö –∞—Ç–æ–º—ñ–≤ –ø–æ–≤–∏–Ω–Ω–∞ –±—É—Ç–∏ —á–∞—Å—Ç–∏–Ω–∫–∞ (–∞–±–æ –∞—Ç–æ–º —Å–∫–ª–∞–¥–Ω–æ—ó —á–∞—Å—Ç–∏–Ω–∫–∏) –∑ –¥–µ—Ñ—ñ—Ü–∏—Ç–æ–º –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤.
Молекула SO2 приєднує до атому сульфуру за місцем її неподіленої пари атом оксиґену (2s22p4) і утворює молекулу SO3. Геометрична форма частинки-продукту стає більш симетричною (правильний трикутник) в порівнянні з незавершеною формою реагенту SO2.
–ú–æ–ª–µ–∫—É–ª–∞ –∞–º–æ–Ω—ñ–∞–∫—É NH3 –º—ñ—Å—Ç–∏—Ç—å –Ω–µ–ø–æ–¥—ñ–ª–µ–Ω—É –ø–∞—Ä—É –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤ —É –∞—Ç–æ–º–∞ –Ω—ñ—Ç—Ä–æ–≥–µ–Ω—É; –º–æ–ª–µ–∫—É–ª–∞ –≤–æ–¥–∏ H2O —Ç–∞–∫–æ–∂ –º–∞—î –Ω–µ–ø–æ–¥—ñ–ª–µ–Ω—É –ø–∞—Ä—É —É –∞—Ç–æ–º–∞ –æ–∫—Å–∏“ë–µ–Ω—É. –Ý–∞–∑–æ–º –∑ –∞–∫—Ç–∏–≤–Ω–∏–º –∞–∫—Ü–µ–ø—Ç–æ—Ä–æ–º – —ñ–æ–Ω–æ–º –≥—ñ–¥—Ä–æ–≥–µ–Ω—É H+ –ø–æ –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–æ–º—É –º–µ—Ö–∞–Ω—ñ–∑–º—É —É—Ç–≤–æ—Ä—é—é—Ç—å—Å—è –∫–∞—Ç—ñ–æ–Ω–∏ –∞–º–æ–Ω—ñ—é NH4+ —ñ –æ–∫—Å–æ–Ω—ñ—é H3O+.
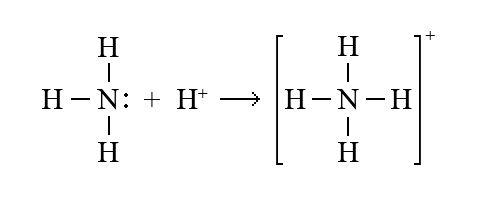

–§–æ—Ä–º–∞ –º–æ–ª–µ–∫—É–ª–∏ NH3 (–Ω–µ–∑–∞–≤–µ—Ä—à–µ–Ω–∏–π —Ç–µ—Ç—Ä–∞–µ–¥—Ä) —Å—Ç–∞—î –ø–æ–≤–Ω—ñ—Å—Ç—é —Å–∏–º–µ—Ç—Ä–∏—á–Ω–æ—é –≤ –∫–∞—Ç—ñ–æ–Ω—ñ NH4+ (–ø—Ä–∞–≤–∏–ª—å–Ω–∏–π —Ç–µ—Ç—Ä–∞–µ–¥—Ä); —Å–∏–º–µ—Ç—Ä–∏—á–Ω—ñ—Å—Ç—å –∫–∞—Ç—ñ–æ–Ω–∞ –æ–∫—Å–æ–Ω—ñ—è H3O+ —Ç–∞–∫–æ–∂ –≤–∏—â–µ, –Ω—ñ–∂ —É –º–æ–ª–µ–∫—É–ª–∏ –≤–æ–¥–∏ H2O. –í —ñ–æ–Ω–∞—Ö H3O+ —ñ NH4+ –≤—Å—ñ –∞—Ç–æ–º–∏ –≥—ñ–¥—Ä–æ–≥–µ–Ω—É —Ä–∞–≤–Ω–æ—Ü—ñ–Ω–Ω—ñ, —Ç–æ–±—Ç–æ –≤–∂–µ –Ω–µ –º–æ–∂–Ω–∞ –≤–∫–∞–∑–∞—Ç–∏ —Ç–æ–π –∞—Ç–æ–º –≥—ñ–¥—Ä–æ–≥–µ–Ω—É, —è–∫–∏–π –±—É–≤ –¥–æ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –∑–≤’—è–∑–∫—É —É –≤–∏–≥–ª—è–¥—ñ –ø—Ä–æ—Ç–æ–Ω–∞ H+ —ñ –≤–∏–∫–æ–Ω—É–≤–∞–≤ —Ä–æ–ª—å –∞–∫—Ü–µ–ø—Ç–æ—Ä–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω–Ω–æ—ó –ø–∞—Ä–∏. –¢–∏–ø –≥—ñ–±—Ä–∏–¥–∏–∑–∞—Ü—ñ—ó —Ü–µ–Ω—Ç—Ä–∞–ª—å–Ω–∏—Ö –∞—Ç–æ–º—ñ–≤ O-II (–≤ H3O+) —ñ N-III (–≤ NH4+) –∑–∞–ª–∏—à–∞—î—Ç—å—Å—è —Ç–∏–º —Å–∞–º–∏–º, —â–æ –±—É–≤ –≤ –º–æ–ª–µ–∫—É–ª–∞—Ö H2O —ñ NH3 (sp3-–≥—ñ–±—Ä–∏–¥–∏–∑–∞—Ü—ñ—è). –°–ª—ñ–¥ –∑–∞–∑–Ω–∞—á–∏—Ç–∏, —â–æ –∫–∞—Ç—ñ–æ–Ω NH4+ – —Ü–µ –ø–æ —Ñ–æ—Ä–º—ñ —Ç–∞–∫–∏–π —Å–∞–º–∏–π –ø—Ä–∞–≤–∏–ª—å–Ω–∏–π —Ç–µ—Ç—Ä–∞–µ–¥—Ä, —è–∫ —ñ –º–æ–ª–µ–∫—É–ª–∞ CCl4 –∞–±–æ –º–æ–ª–µ–∫—É–ª–∞ –º–µ—Ç–∞–Ω—É CH4.
–£ —Å—Ç–∞—Ä—ñ–π –ª—ñ—Ç–µ—Ä–∞—Ç—É—Ä—ñ –±—É–≤ –ø—Ä–∏–π–Ω—è—Ç–∏–π —Å–ø–æ—Å—ñ–± –≤—ñ–¥–∑–Ω–∞—á–∞—Ç–∏ –∑–≤’—è–∑–æ–∫ —è–∫–∏–π —É—Ç–≤–æ—Ä—é–≤–∞–≤—Å—è –ø–æ –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–æ–º—É –º–µ—Ö–∞–Ω—ñ–∑–º—É —Å—Ç—Ä—ñ–ª–∫–æ—é (–Ω–∞ –≤—ñ–¥–º—ñ–Ω—É –≤—ñ–¥ —Ä–∏—Å–∫–∏ –¥–ª—è –ø–æ–∑–Ω–∞—á–µ–Ω–Ω—è –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–≥–æ –∑–≤’—è–∑–∫—É —â–æ–¥–æ —Ä—ñ–≤–Ω–æ—Ü—ñ–Ω–Ω–æ–≥–æ –º–µ—Ö–∞–Ω—ñ–∑–º—É), –Ω–∞–ø—Ä–∏–∫–ª–∞–¥:
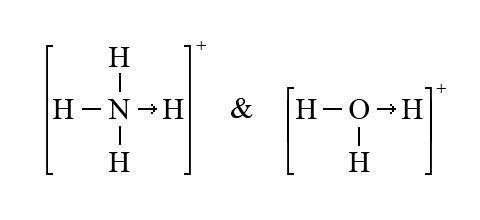
–ö—Ä—ñ–º —Ç–æ–≥–æ, –¥–ª—è —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–æ–≥–æ –º–µ—Ö–∞–Ω—ñ–∑–º—É –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ–≥–æ –∑–≤’—è–∑–∫—É –±—É–ª–∏ –ø—Ä–∏–π–Ω—è—Ç—ñ –Ω–∞–∑–≤–∏ –¥–ª—è –ø—Ä–æ—Å—Ç–∏—Ö —Å–ø–æ–ª—É–∫ ‚Äì —Å–µ–º–∏–ø–æ–ª—è—Ä–Ω–∏–π –∑–≤‚Äô—è–∑–æ–∫, –≤ –∫–æ–º–ø–ª–µ–∫—Å–Ω–∏—Ö —Å–ø–æ–ª—É–∫–∞—Ö – –¥–æ–Ω–æ—Ä–Ω–æ-–∞–∫—Ü–µ–ø—Ç–æ—Ä–Ω–∏–π, –∞–±–æ –∫–æ–æ—Ä–¥–∏–Ω–∞—Ü—ñ–π–Ω–∏–π –∑–≤’—è–∑–æ–∫. –û—Å–∫—ñ–ª—å–∫–∏ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω—ñ –∑–≤’—è–∑–∫–∏, —â–æ —É—Ç–≤–æ—Ä—é—é—Ç—å—Å—è –∑–∞ –æ–±–æ–º–∞ –º–µ—Ö–∞–Ω—ñ–∑–º–∞–º–∏, –∑–∞ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—è–º–∏ –Ω–µ —Ä–æ–∑—Ä—ñ–∑–Ω—è—é—Ç—å—Å—è, –∑–∞–∑–Ω–∞—á–µ–Ω—ñ –Ω–∞–∑–≤–∏ –∑–∞—Å—Ç–æ—Å–æ–≤—É–≤–∞—Ç–∏ –Ω–µ–¥–æ—Ü—ñ–ª—å–Ω–æ.










