Фосфор P відкритий в 1669 році (Бранд, Німеччина) в результаті алхімічних пошуків філософського каменю (фосфор виявлено в залишках сечі після її випарювання).
Поширення фосфору в природі. Зустрічається тільки в хімічно зв’язаному вигляді в організмах і мінералах. В живих організмах фосфор міститься в формі фосфоліпідів (наприклад, лецитин в нервовій і мозковій речовині), фосфопротеїдів (ферменти), різних ефірів ортофосфорної кислоти і кальцій ортофосфату (в кістках і зубах). Екскременти птахів утворюють природну фосфоровмісну речовину – гуано.
Мінерали фосфору: фосфорит 2Ca3(PO4)2*Ca(OH)2; апатит 3Ca3(PO4)2*Ca(Cl, OH, F)2; монацит CePO4.
Фосфати містяться також в деяких рудах заліза.
Фізіологічна дія фосфору. Фосфор – життєво важливий елемент для всіх організмів. Білий фосфор отруйний.
Властивості фосфору. Відомо кілька алотропних модифікацій фосфору, серед яких найбільш поширені білий, червоний і чорний фосфор.
Таблиця. Властивості алотропних модифікацій фосфору.
|
Білий фосфор |
Червоний фосфор |
Чорний фосфор |
|
|
Колір |
Білий |
Від червоного до фіолетового |
Сіро-чорний |
|
Запах |
Чесночний |
Немає |
Немає |
|
За ступенем твердості |
Воскоподібний |
Твердий |
Відносно м’який |
|
Характер модифікації |
Нематалічні |
Металічний |
|
|
Температура плавлення, *С |
44 |
Плавляться тільки під надлишковим тиском; вище 280*С переходять в пар білого фосфору |
|
|
Температура возгонки, *С |
60 |
Вище 400 |
Вище 400 |
|
Щільність при 20*С, г./см3 |
1,82 |
2,36 |
2,70 |
|
Розчинність |
Мало розчинний в H2O, хорошо – в CS2 |
Нерозчинний |
|
|
Реакційна здатність |
Висока |
Низька |
Средня |
|
Люмінесценція |
Присутня |
Відсутня |
Відсутня |
Між модифікаціями фосфору здійснюються такі переходи:
- білий фосфор → червоний фосфор; процес протікає повільно при кімнатній температурі, прискорюється при нагріванні в закритій посудині при 330*С;
- червоний фосфор → білий фосфор; вище 280*С червоний фосфор переганяється при нормальному атмосферному тиску і конденсується у вигляді білого фосфору;
- білий фосфор → чорний фосфор; перехід протікає при ударному пресуванні під тиском 10000 МПа або при нормальному атмосферному тиску і 380*С на каталізаторі (дрібнодисперсна ртуть).
Білий фосфор отримують з кальцій фосфату Ca3(PO4)2 (фосфорита) при нагріванні з піском (SiO2) і коксом (C):
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Газоподібну суміш (фосфор і карбон(II) оксид) пропускають через воду, при цьому білий фосфор конденсується. Білий фосфор складається з молекул P4. У темряві на повітрі він виявляє зеленувате світіння (люмінесценція), що супроводжується виділенням теплоти; це явище обумовлено повільним окисненням фосфору киснем повітря
P4 + 3O2 = P4O6
теплота, яка виділяється в процесі повільного окиснення фосфору, може розплавити фосфор і привести до його займання (тому білий фосфор зберігають під водою). При згорянні фосфору утворюється білий дим – дрібні частинки тетрафосфор декаоксиду P4O10. Палаючий фосфор не можна гасити водою, його слід засипати піском!
У розчині лугу фосфор диспропорціонує, утворюючи сполуки фосфору (+1) і фосфору (-III):
P4 + 3KOH + 3H2O = 3K(PH2O2) + PH3
Білий фосфор застосовують для отримання інших його алотропних модифікацій, фосфорних кислот і фосфатів, як бойову запалювальну речовину (використання білого фосфору в якості бойової запалювальної речовини заборонено міжнародним договором).
Білий фосфор надзвичайно отруйний, смертельна доза становить 50 – 500 мг, він може потрапляти в організм через органи дихання і травлення, всмоктується через шкіру (в місцях її пошкодження). Хронічне отруєння фосфором проявляється в ураженні кісток і схудненні.
Червоний фосфор більш стійкий і менш реакційноздатний, ніж білий фосфор. Червоний фосфор не отруйний, але зразки, які надходять у продаж, часто містять відчутні кількості білого фосфору, що слід враховувати при роботі з товарними зразками червоного фосфору. Застосовують при виготовленні сірників і як наповнювач (пара) в лампах розжарювання. Робоча поверхня (намазка) сірникової коробки містить суміш червоного фосфору, стибій(III) сульфіду Sb2S3 і скляного порошку, суміш закріплюється на коробку декстриновим клеєм; до складу сірникової головки входять калій хлорат KClO3, сірка та ін. При швидкому проведенні голівкою сірника по робочій поверхні коробка калій хлорат окиснює фосфор, що супроводжується запаленням сірки, а потім і деревної основи сірника. До складу головки універсальних (петрових, мисливських) сірників входить P4S3, такі сірники не гаснуть під вітром.
Чорний фосфор має, як і графіт, шарувату решітку; проводить електричний струм. Не отруйний.
Фосфатні кислоти. Фосфати
Фосфор(V) оксид P2O5 (точніше, P4O10) – кислотний оксид, якому відповідають фосфорні кислоти. Біла гігроскопічна порошкоподібна (при повній відсутності вологи) речовина. Переганяється при 359*С. Взаємодіє з водою з утворенням фосфорних кислот. Застосовують в якості ефективного водопоглинаючого засобу (в ексикаторах і т.п.).
Залежно від кількості води, що реагує з фосфор(V) оксидом, утворюються такі фосфорні кислоти:
Метафосфатна кислота
P4O10 + 2H2O = 4HPO3 точніше (HPO3)n
Дифосфатна кислота (стара назва – пірофосфорна кислота)
P4O10 + 4H2O = 2H4P2O7
Ортофосфатна кислота (або просто фосфатна кислота)
P4O10 + 6H2O = 4H3PO4
Відомі солі цих кислот: мета-, ді-і ортофосфати (або просто фосфати).
Ортофосфатна кислота H3PO4 – безбарвні кристали; з невеликою кількістю води утворює сиропоподібний, не отруйний розчин з сильним кислим смаком.
Спосіб виявлення ортофосфатної кислоти полягає в додаванні розчину кислоти (або ортофосфату будь-якого металу) в сильно підкислений нітратною кислотою розчин амоній молібдату, при нагріванні – утворюється жовтий порошкоподібний осад амоній молібдофосфату.
Ортофосфатну кислоту застосовують для одержання ортофосфатів, для фосфатування заліза і цинку, в приготуванні електролітичних і хімічних полірувальних сумішей для металів (разом із сульфатною і хроматною кислотами), в технології безалкогольних напоїв, для виробництва каталізаторів і лікарських засобів.
Ортофосфати утворюються в процесі ступінчастої нейтралізації ортофосфатної кислоти. Оскільки ця кислота триосновна, вона утворює три ряди солей: середні і два типи кислих солей, наприклад:
NaH2PO4 – натрій дигідроортофосфат
Na2HPO4 – натрій гідроортофосфат
Na3PO4 – натрій ортофосфат
Ca(H2PO4)2 – кальцій дигідроортофосфат (розчинний у воді)
CaHPO4 – кальцій гідроортофосфат (не розчинний у воді, розчиняється в розчині лимонної кислоти)
Ca3(PO4)2 – кальцій ортофосфат (не розчиняється у воді і в розчині лимонної кислоти)
Добре розчинні у воді наступні ортофосфати:
- середні ортофосфати лужних елементів (крім літію і амонію);
- моногідроортофосфати лужних елементів; дигідроортофосфати лужних і деяких (особливо двовалентних) важких металів.
Всі інші ортофосфати в воді практично нерозчинні.
Застосування ортофосфатів дуже різноманітне. Їх використовують як мінеральні добрива, як пом’якшувачі води (Na3PO4) і для вогнестійкого просочення (сіль (NH4)2HPO4), для виготовлення фармацевтичних і косметичних препаратів, як складову частину живильного середовища для дріжджів і в сироварінні (запобігають відокремленню сироватки і жиру), для процесу фосфатування.
Дифосфати утворюються при нагріванні моногідроортофосфатів, наприклад:
2Na2HPO4 = Na4P2O7 + H2O
Конденсовані фосфати в якості аніонів містять ланцюги і цикли типу
-P(O2)-O-P(O2)-O-
Метафосфати, точна формула яких MeIn(PO3)n (n = 3, 4 і більше), складаються з низькомолекулярних циклів, наприклад натрій триметафосфат Na3P3O9. Поліфосфати з тією самою формулою MeIn(PO3)n містять середньо- і високомолекулярні ланцюги; так звані ультрафосфати мають просторову сітчасту будову. Високомолекулярний натрій поліфосфат утворюється у формі розчинної у воді солі Грема (поряд з незначними кількостями мета- і ультрафосфатів) при відщепленні води від натрій дигідроортофосфату при його плавленні. Сіль Грема (раніше називалася натрій гексаметафосфатом) має будову:
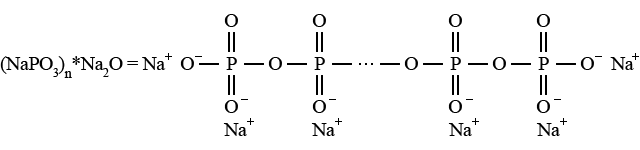
Сіль Грема використовується як засіб усунення жорсткості води: ця сіль виконує іонообмінну функію і зв’язує іони Са2+ і Mg2+, видаляючи їх з розчину (аналогічні властивості мають середньомолекулярні поліфосфати, наприклад пентанатрій триполіфосфат Na5P3O10. Сіль Грема проявляє хорошу миючю дію.
Фосфатування – створення на поверхні металу (заліза, цинку, алюмінію) фосфатного шару, який оберігає метал від корозії і від злипання листів металу один з одним (фосфатний лак). Фосфатування поверхні металу досягається зануренням виробу в гарячий розчин цинк(II) дигідроортофосфату Zn(H2PO4)2 та манган(II) дигідроортофосфату Mn(H2PO4)2, що містить вільну фосфатну кислоту і іноді каталізатори.
Сполуки фосфору
Крім зазначених вище фосфатних кислот відомі й інші кислоти, що містять фосфор.
Фосфітна кислота H3PO3, або H2(HPO3) і гіпофосфітна кислота H3PO2, або H(PH2O2). Ці сполуки виявляють у водному розчині кислотні властивості; перша кислота – двохосновна, а друга – одноосновна. Зазначені кислоти утворюють такі солі: фосфіти MeI2HPO3 і гіпофосфіти MeIH2PO2.
Натрій гіпофосфіт Na(PH2O2) кристалізується з однією молекулою води; утворюється при кип’ятінні суспензії білого фосфору в розчині натрій гідроксиду. Цю сіль застосовують при хімічному (безструмовому) кобальтуванні і нікелюванні.
Фосфін PH3 – безбарвний газ з рибно-часниковим запахом, з температурою кипіння -87,7*С. Дуже отруйний! Утворюється (в чистому вигляді) при гідролізі фосфідів, наприклад:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Діфосфан P2H4 – безбарвна рідина, з температурою кипіння 51,7*С. Самозаймається на повітрі і викликає самозаймання фосфіну PH3 (при отриманні PH3 шляхом кип’ятіння суспензії білого фосфору в розчині лугу P2H4 утворюється як домішка).
Фосфор трихлорид PCl3 – безбарвна речовина, у вологому повітрі має характерний запах, з температурою кипіння 74,5*С. При гідролізі утворює фосфітну кислоту:
PCl3 + 3H2O = H2(PHO3) + 3HCl
Фосфор пентахлорид PCl5 – біла тверда речовина. При нестачі води фосфор пентахлорид утворює фосфор оксид-трихлорид PCl3O (часто з домішкою метафосфатної кислоти):
PCl5 + H2O = PCl3O + 2HCl
а при надлишку води – ортофосфатну кислоту:
PCl5 + 4H2O = H3PO4 + 5HCl
Фосфорні добрива. Містять фосфор в якості основного живильного елемента. Фосфорні і апатитові руди розкривають сухим або мокрим способом, при цьому фосфор перетворюється на такі форми, які легко засвоюються рослинами з грунту.
Простий суперфосфат (16-20% P2O5; вміст фосфору в добривах за традицією перераховується на вміст P2O5) утворюється при обробці руди (фосфорит Ca3(PO4)2) 60% сульфатною кислотою. Містить 35% Ca(H2PO4)2, 50% CaSO4, 8% H3PO4, і 7% інших речовин. Спрощене рівняння реакції, що відбувається при обробці фосфориту сульфатною кислотою:
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
(Якщо вихідною сировиною є фторапатит 3Ca3(PO4)2*CaF2, то утворюється гідроген фторид HF, який при взаємодії з піском (SiO2) утворює летючий силіцій тетрафторид SiF4).
Подвійний суперфосфат (46-49% P2O5) утворюється при взаємодії руди з 40% ортофосфатною кислотою. Містить Ca(H2PO4)2, трохи CaHPO4 і не має баластного CaSO4. Спрощене рівняння реакції, що протікає при обробці фосфориту фосфатною кислотою:
Ca3(PO4)2 + 4H3PO4 = 3Ca(HPO4)2
Магнієвий плавлений фосфат (20% P2O5) утворюється внаслідок сплаву руди з кізериту MgSO4*H2O з піском SiO2. Містить кальцій ортофосфати, а також Mg3(PO4)2 і CaSO4.
Лужний плавлений фосфат (25% P2O5) утворюється при прожарюванні (1100 – 1200*С) руди з содою Na2CO3 і піском SiO2. Містить в якості цінного компоненту кальцій-натрій ортофосфат NaCaPO4. Спрощене рівняння реакції, що протікає при обробці руди:
2Ca3(PO4)2 + 2Na2CO3 + SiO2 = 4NaCaPO4 + Ca2SiO4 + 2CO2
Мартенівський фосфатшлак – дрібнорозмолоті відходи (шлак) мартенівського способу переробки фосфоровмісних чавунів в сталь.
Змішані добрива, азотно-фосфорно-калійні добрива, містять основні поживні елементи в масовому співвідношенні N : P : K = 1 : 0,85 : 1,7. Для отримання змішаних добрив фосфоритно-апатитову руду обробляють послідовно нітратною кислотою і амоній сульфатом (осад CaSO4 фільтрують), потім розчин нейтралізують водним амоніаком і до суміші додають KCl або K2SO4; тверде добриво отримують спільною кристалізацією і гранулюванням.










