Чисто іонним зв’язком називається хімічно зв’язаний стан атомів, при якому стійке електронне оточення досягається шляхом повного переходу загальної електронної густини до атому більш електронегативного елемента.
Чисто іонний зв’язок є граничним випадком ковалентного зв’язку.
Практично, повний перехід від одного атома до іншого атома-партнера по зв’язку не реалізується, оскільки кожен елемент має більшу чи меншу (але не нульову) електронегативність, і будь-який хімічний зв’язок буде в деякій мірі ковалентним.
Якщо ступінь ковалентності зв’язку досить високий, то такий хімічний зв’язок є полярним ковалентним зв’язком з тим або іншим ступенем іонності (H+0,17-Cl-0,17 – ковалентний зв’язок зі ступенем іонності 17%, тобто зі ступенем ковалентності 83%). Якщо ступінь ковалентності зв’язку менший в порівнянні зі ступенем його іонності, то такий зв’язок вважається іонним.
Іонний зв’язок можливий тільки між атомами електропозитивних і електронегативнх елементів, які знаходяться в стані протилежно заряджених іонів.
Процес утворення іонного зв’язку дозволяє пояснити електростатична модель, тобто розгляд хімічної взаємодії між негативно і позитивно зарядженими іонами.
Іони – це електрично заряджені частинки, які утворюються з нейтральних атомів або молекул шляхом віддачі або прийому електронів.
При віддачі або прийомі електронів молекулами утворюються молекулярні, або багатоатомні іони, наприклад, O2+ – катіон діоксігеніла, NO2– – нітрит-іон.
Одноатомні позитивні іони, або одноатомні катіони, і одноатомні негативні іони, або одноатомні аніони, утворюються в процесі хімічної реакції між нейтральними атомами шляхом обміну електронами. При цьому атом електропозитивного елемента, що має невелике число зовнішніх електронів (один – два, рідше три – чотири), переходить в більш стійкий стан одноатомного катіона шляхом зменшення числа цих електронів (віддача електронів). Навпаки, атом електронегативного елемента, що має велике число зовнішніх електронів (від трьох до семи), переходить в більш стійкий для нього стан одноатомного іона шляхом збільшення числа електронів (прийом чужих електронів). Одноатомні катіони утворюються, як правило, металами, а одноатомні аніони – неметалами.
При передачі електронів атоми металічних і неметалічних елементів прагнуть сформувати навколо своїх ядер стійку конфігурацію електронної оболонки. Атом неметалічного елемента створює навколо свого ядра зовнішню оболонку притаманну подальшому благородному газу (електронний октет), тоді як атом металічного елемента після віддачі зовнішніх електронів отримує стійку октетну конфігурацію попереднього благородного газу.
Наприклад, атом натрію Na (IA-група, електронна конфігурація 1s22s22p63s1) має один зовнішній електрон (електрон третього енергетичного рівня), а атом хлору Cl (VII-група, електронна конфігурація 1s22s22p63s23p5) – сім зовнішніх електронів. При переході від атома натрію Na зовнішнього 3s-електрона до атома хлору Cl електронна оболонка атома хлору стає зовнішньою електронною оболонкою атома аргону (3s23p6), а електронна оболонка натрію – зовнішньою оболонкою атома неону (2s22p6), тому, що на третьому енергетичному рівні натрію не залишається жодного електрона. При цьому атом натрію втрачає один негативний заряд і стає катіоном Na+, а атом хлору набуває один негативний заряд і стає аніоном Cl–.
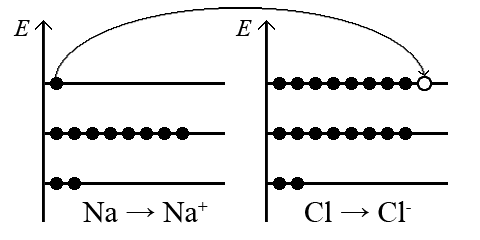
Оцінка зарядів на атомах натрію і хлору в стані іонів здійснюється з порівняння числа протонів в їх ядрах і загального числа електронів на їх оболонках. Так, спочатку, атом натрію містить 11 позитивно заряджених протонів в ядрі атома і 11 негативно заряджених електронів в оболонці атома, після віддачі одного електрона, атом натрію набуває заряд +1, тому що містить 11 позитивно заряджених протонів в ядрі, і 10 негативно заряджених електронів в оболонці. Атом хлору містить 17 позитивно заряджених протонів в ядрі і 17 негативно заряджених електронів в оболонці атома, після прийому одного електрона, атом хлору набуває негативний заряд, тому що містить 17 позитивно заряджених протонів і 18 негативно заряджених електронів в оболонці атома хлору.
В межах орбітальної моделі атома утворення іонів Na+ і Cl– пояснюється наступним чином
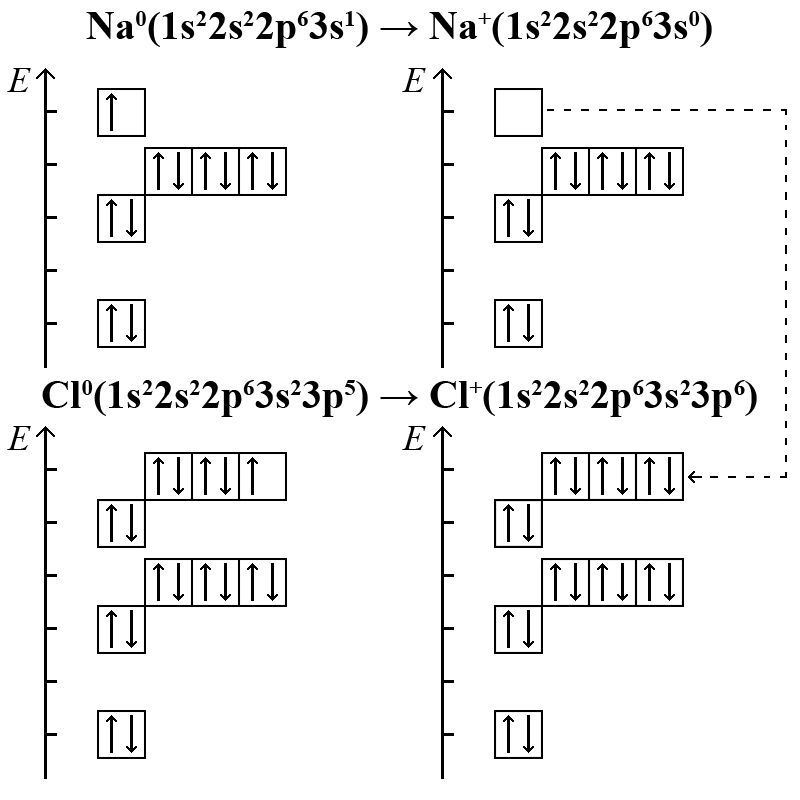
Перехід 3s-електрона атома натрію на 3p-підрівень хлору показаний пунктиром праворуч. Третій енергетичний рівень має ще п’ять 3d-атомних орбіталей, але тому що 3d-підрівень починає заповнюватися тільки у атомів елементів четвертого періоду, він не показаний на схемі; іон Cl- знаходиться в проміжному стійкому стані благородного газу (ns2np6).
За методом молекулярних орбіталей утворення іонного зв’язку для NaCl з часткою ковалентності, за наближеною оцінкою Полінга 33%, за експериментальними даними ≈20%, можна описати, вважаючи, що атом Na і атом Cl комбінують свої 3s- і 3p-атомні орбіталі, які містять по одному електрону. Виникає зв’язуюча молекулярна орбіталь, яка містить два електрони. Таким чином, електронна густина на атомі хлору більша на 0,8e– в порівнянні з атомом натрію, тобто іонний зв’язок в NaCl – це ковалентний зв’язок Na0,8+-Cl0,8-, а при чисто іонному зв’язку було б Na1+-Cl1-.
Для спрощення, замість ефективних зарядів зазвичай вказують цілочисельні заряди іонів (Na+) (Cl–), маючи на увазі, що саме такі іони утворюються при електролітичній дисоціації іонної сполуки NaCl у водному розчині або в розплаві: NaCl = Na+ + Cl–.
Для того, щоб вирішити, чи є даний хімічний зв’язок переважно ковалентним або переважно іонним (і відповідним чином інтерпретувати властивості сполук), можна вдатися до оцінки по методу Полінга. Хімічний зв’язок з 50% іонністю відповідає різниці Δχ = 1,7; при Δχ > 1,7 зв’язок буде переважно іонним.
Наприклад для NaCl (Δχ = 2,1), CsCl (Δχ = 2,3), BaCl2 (Δχ = 2,1), MgCl2 (Δχ = 1,8), AlCl3 (Δχ = 1,5), SnCl2 (Δχ = 1,2), BiCl3 (Δχ = 1,1). Очевидно, що CsCl, NaCl, BaCl2, MgCl2 – іонні сполуки, інші хлориди AlCl3, SnCl2, BiCl3 – ковалентні, а ось флуориди останніх будуть вже іонними сполуками.
Заряд іонів позначається цифрою і знаком в верхньому індексі після формули частки, наприклад:
Na+, Ca2+, Al3+, Cl–, S2-, NO3–, SO42-, PO43-
У старій літературі можна зустріти позначення заряду іонів відповідною кількістю знаків заряду, наприклад:
Ca++, Al+++, S—, SO4—, PO4—
Для іонів у водному розчині, де вони гідратовані, раніше були прийняті позначення точками і косими рисками в верхньому індексі:
Na•, Ca••, Al••• (катіони) і Cl/, S//, PO4/// (аніони)
У сучасній літературі подібні позначення не застосовуються.
Щоб зобразити утворення іонів в хімічній реакції між нейтральними атомами, рівняння хімічної реакції записують за допомогою позначення валентних електронів навколо атомів, що беруть участь в реакції:
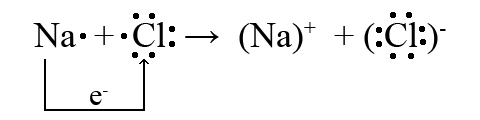
При цьому слід керуватися правилом відповідності чисел електронів, переданих в реакції:
Число відданих електронів має дорівнювати числу прийнятих електронів.
Відповідно до цього правила підбираються стехіометричні коефіцієнти в рівнянні реакції:
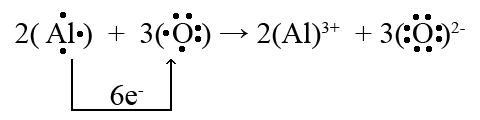
Іонні кристали
При взаємодії металічних і неметалічних простих речовин, яке супроводжується віддачею і прийомом електронів, утворюються солі.
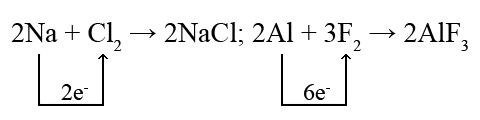
Іонний зв’язок характерний не тільки для солей похідних безоксиґенових і оксиґенвмісних кислот (NaCl, AlF3, NaNO3, Al2(SO4)3), але і для інших класів неорганічних сполук – основних оксидів і гідроксидів (Na2O, NaOH), бінарних сполук (Li3N, CaC2).
Між іонами з протилежними за знаком зарядами проявляються електростатичні сили тяжіння (кулонівські сили тяжіння). Такі сили тяжіння ізотропні, тобто діють однаково в усіх напрямках. В результаті, розташування іонів в твердих солях упорядковується в просторі певним чином.
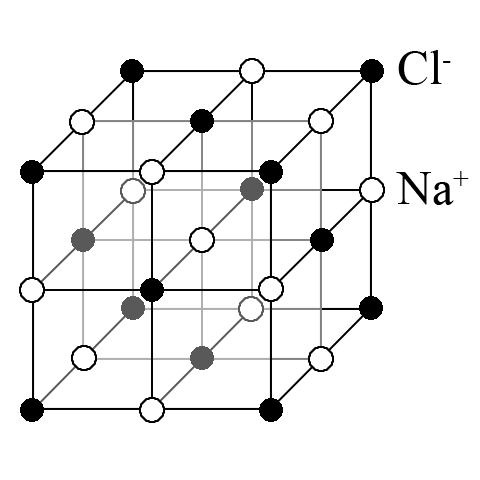
Іонна кристалічна решітка – це система впорядковано розташованих катіонів та аніонів.
Речовини, що мають іонну кристалічну решітку (солі, основні оксиди, гідроксиди) називають іонні кристали.
Всі іонні кристали мають солеподібний характер.
Солеподібний характер – це певний набір властивостей, які відрізняють іонні кристали від кристалічних речовин з іншими типами решіток. Відміною ознакою іонної кристалічної решітки є чергування катіонів та аніонів в просторі іонного кристала.
Внаслідок того, що кулонівські сили тяжіння поширюються однаково в усіх напрямках, іони в вузлах кристалічної решітки пов’язані доволі міцно, хоча кожен з іонів не є нерухомим, а безперервно здійснює теплові коливання навколо свого положення в решітці. Поступальний рух іонів уздовж решітки відсутній, тому всі речовини з іонними зв’язками при кімнатній температурі – тверді (кристалічні). Амплітуда теплових коливань може бути збільшена нагріванням іонного кристала, або опроміненням, яке призводить до руйнування решітки і переходу твердої речовини в рідкий стан (при температурі плавлення). Температура плавлення (т. пл.) іонних кристалів відносно висока, а температура кипіння (т. кип.), при якій здійснюється перехід рідкої речовини в газоподібний стан, має дуже великі значення.
Наприклад, NaCl т. пл. 801*С, т. кип. 1465*С; NaOH т. пл. 321*С, т. кип. 1390*С; BaF2 т. пл. 1368*С, т. кип. 2260*С.
Багато солей, особливо багатоелементних, комплексних, а також солей органічних кислот розкладаються при температурах (т. розкл.) більш низьких, ніж т. кип. і навіть т. пл.
Типовою властивістю багатьох сполук з іонним зв’язком (які не взаємодіють з водою і не розкладаються при т. пл.) є їх здатність до дисоціації (тобто розщеплення) на складові іони. Внаслідок рухливості іонів, водні розчини і (або) розплави іонних кристалів проводять електричний струм.
Всі катіони і аніони в іонному кристалі пов’язані один з одним.
В іонних кристалах, побудованих з катіонів та аніонів, молекули відсутні.
Хімічні формули іонних сполук передають тільки співвідношення катіонів та аніонів в кристалічній решітці; в цілому зразок іонної речовини електронейтральний. Наприклад, відповідно до формули іонного кристала Al2O3 співвідношення катіонів Al3+ і аніонів O2- в решітці дорівнює 2 : 3; ця речовина є електронейтральною – шість позитивних зарядів (2Al3+) нейтралізуються шістьма негативними зарядами (3O2-).
Хоча реальних молекул в іонних кристалах не існує, прийнято, за допомогою хімічних формул типу NaCl, Al2O3 передавати склад умовних молекул, отже характеризувати іонні речовини певними значеннями відносної молекулярної маси. Це тим більше виправдано, оскільки перехід від ковалентного зв’язку до іонного відбувається поступово і має лише умовну (по Полингу) межу, яка дорівнює Δχ = 1,7.










