
Для початку проведемо дві хімічні реакції.
Перша доволі проста. Додайте до розчину арґентум нітрату (ляпісу) у воді краплю розчину кухонної солі (натрій хлориду). Негайно утворюється білий осад арґентум хлориду.
Друга хімічна реакція складніша. Додайте в пробірку кілька крапель концентрованої сульфатної кислоти і обережно додайте до них по краплях таку саму кількість концентрованої нітратної кислоти. Охолодіть отриману суміш в каструлі з холодною водою і додайте в пробірку кілька крапель бензену. Закрийте пробірку пробкою в яку вставлена довга скляна трубка.
Нагрівайте пробірку в каструлі з гарячою водою при температурі не вище 50*С. Через кілька хвилин злийте верхній шар рідини в іншу пробірку і додайте до цієї рідини одну-дві чайні ложки води. Речовина яка утворилася важча за воду і вона опуститься на дно пробірки. Ви отримали нітробензен – замістили в кільцевій молекулі бензену один атом гідрогену на групу NO2.
Реакції, як бачимо, розрізняються досить істотно. Якщо перша протікає за частки секунди при звичайній температурі, то друга вимагає нагрівання протягом декількох хвилин.
Справа тут ось у чому. У першій реакції зустрічаються два іони – іон арґентуму Ag+ і іон хлору Cl–, і миттєво утворюється нерозчинна у воді сполука арґентум хлорид AgCl. Майже всі реакції неорганічних іонів протікають достатньо швидко.
У другій реакції відбувається нітрування бензену нітратною кислотою в присутності сульфатної кислоти. Коли ми змішуємо ці дві кислоти, між ними відбувається хімічна реакція, в результаті якої утворюється так званий нітроній-катіон NO2+:
HNO3 + 2H2SO4 = H3O+ + 2HSO4– + NO2+
У нашому реакційному розчині присутній бензен. В молекулі бензену рівномірно локалізовані шість π-електронів. Ці електрони взаємодіють з нітроній-катіоном, утворюючи π-комплекс.
Зверніть увагу на енергетичну діаграму. Вертикальна ось діаграми показує енергію системи частинок. Очевидно, якщо з однієї точки діаграми ми переходимо в іншу знизу вгору, то система звідкись бере енергію (наприклад, із запасів енергії хаотичного руху частинок в їх взаємних зіткненнях). А перехід зверху вниз може відбуватися за рахунок власних, внутрішніх енергетичних запасів системи. Звідси ясно: чим вище точка на діаграмі, тим нестійкіше відповідний стан системи – з такого стану система може вийти самодовільно, без зовнішніх впливів.
Послідовні ділянки горизонтальної осі діаграми показують стадії реакції. Рух уздовж горизонтальної осі, від однієї стадії реакції до іншої, можна розуміти як переміщення реагуючих частинок, що призводять до утворення проміжних або кінцевих продуктів реакції.
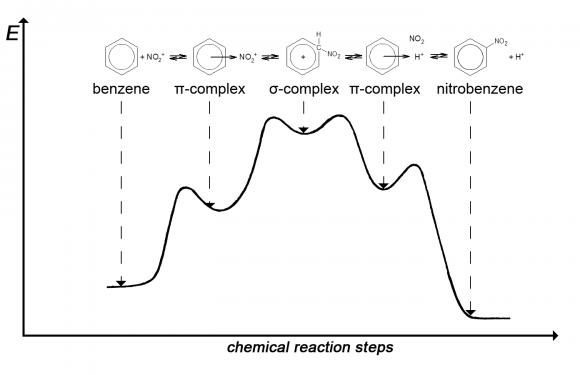
На початку цієї хімічної реакції, зближуючись здалеку, реагуючі частинки спочатку взаємно відштовхуються, і крива на діаграмі йде вгору. Після взаємодії, частинки утворюють відносно стійку сполуку – енергетична крива дещо знизилася – утворився π-комплекс бензену з нітроній-катіоном. Їх комбінація не дуже стійка і може легко розпадатися на вихідні компоненти. Але може статися і інший процес – перебудова молекули і утворення σ-комплексу. При цьому нітроніевая частка приєднується до одного з атомів карбону бензенового кільця.
Наступна стадія реакції – відщеплення протона H+ від атому карбону і утворення π-комплексу. Протон в π-комплексі довго не затримується, відщеплюється, а його місце займає нітрогрупа – утворюється нітробензен.
Ось так складно протікає проста на перший погляд реакція заміщення атома гідрогену в бензені на нітрогрупу. Ця реакція належить до сімейства реакцій електрофільного заміщення. Тут електрофільною ( «любить електрони») часткою виступає нітроній-катіон, а бензен – речовина, що віддає електрони. До електрофільних реакцій відносяться такі реакції як хлорування, бромування, сульфування бензену і його аналогів. Електрофільними частками в таких реакціях можуть бути іони меркурія, і навіть атом чотиривалентної платини здатний заміщувати гідроген в органічних сполуках типу бензену.
Ми розглянули послідовність перетворень, які відбуваються перш, ніж утворюється нітропохідна сполука. Але звідки нам відомо, які це перетворення, які проміжні речовини утворюються на шляху реакції? Адже ми маємо вихідні речовини, бензен і нітратну кислоту, отримуємо кінцеву речовину – нітробензен. Кожну з них можна побачити, зважити, проаналізувати. А що ж відбувається між початковими і кінцевою речовиною? Проміжні сполуки доволі нестійкі, їх складно виявити.
Уявіть, що ви проводите хімічну реакцію і по її ходу вимірюєте концентрацію вихідних і кінцевих речовин. Іноді буває, що через деякий час після початку реакції концентрація вихідної речовини суттєво знижується, а концентрація кінцевого продукту незначна. Отже, в реакційній суміші в цей момент знаходиться якась проміжна речовина.
Як встановити структуру проміжної сполуки, концентрація якої зазвичай мізерна? Тут допомагають фізичні методи дослідження – наприклад, ядерний магнітний резонанс, інфрачервона та електронна спектроскопія. Ці методи надають інформацію про наявність в речовині тих чи інших функціональних груп, про порядок, в якому пов’язані атоми в молекулах.
Іноді проміжні сполуки можна виявити навіть візуально. На склі, до краплі концентрованої сульфатної кислоти (увага, обережно!) додайте нафталін, або фенол (отрута!), або анізол (метиловий ефір фенолу) і потім кристалик натрій або калій нітрату (можна використовувати селітру або ляпіс). Розчин набуде досить інтенсивний жовтий, зелений або червоний колір (залежно від вихідних реагентів). Припускають, що забарвлені речовини – це проміжні σ-комплекси, які утворюються в процесі нітрування. Дослідники встановили, що подібні сполуки представляють собою продукт перенесення електрона від, скажімо, нафталіну до іона NO2+. В такому випадку механізм, що включає π- і σ-комплекси, виявляється ще більш складним.
А тепер поставимо собі запитання: що вивчає хімія? У шкільному підручнику сказано, що хімія – наука про речовини та їх перетворення. Але речовини досліджує і фізика і біологія … Фізика цікавиться і перетворенням речовин, наприклад графіту в алмаз. Справа в тому, що хімічні перетворення на відміну від інших характеризуються руйнуванням одних зв’язків між атомами, які складають ту чи іншу молекулу, і утворенням нових хімічних зв’язків між атомами, з утворенням нової молекули, нової речовини.
Хімія цікавиться не стільки самими сполуками, скільки процесами їх перетворень, хімічними реакціями. Вивчаючи хімічні реакції, вчені прагнуть якомога точніше з’ясувати, як вони протікають, які їхні механізми. Щоб використовуючи знання про хімічні перетворення, створювати нові, корисні в побуті і техніці речовини, використовуючи які, інженери створюватимуть нові товари.










