
–ö–æ–∂–Ω–æ–º—É, –º–∞–±—É—Ç—å, –≤—ñ–¥–æ–º–æ –ø–æ—Ö–æ–¥–∂–µ–Ω–Ω—è —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–Ω–æ—ó —à–∫–∞–ª–∏ –¶–µ–ª—å—Å—ñ—è: –∑–∞ —ó—ó –æ—Å–Ω–æ–≤—É –ø—Ä–∏–π–Ω—è—Ç–æ —ñ–Ω—Ç–µ—Ä–≤–∞–ª –º—ñ–∂ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞–º–∏ –∫–∏–ø—ñ–Ω–Ω—è —ñ –∑–∞–º–µ—Ä–∑–∞–Ω–Ω—è –≤–æ–¥–∏, –ø–æ–¥—ñ–ª–µ–Ω–∏–π –Ω–∞ —Å—Ç–æ —Ä—ñ–≤–Ω–∏—Ö —á–∞—Å—Ç–∏–Ω – –≥—Ä–∞–¥—É—Å—ñ–≤.
–í–æ–¥–∞ –±—É–ª–∞ –æ–±—Ä–∞–Ω–∞ –¥–ª—è —Ç–∞–∫–æ—ó –º–µ—Ç–∏ —è–∫ –æ–¥–Ω–∞ –∑ –Ω–∞–π–ø–æ—à–∏—Ä–µ–Ω—ñ—à–∏—Ö –Ω–∞ –ó–µ–º–ª—ñ —Ä–µ—á–æ–≤–∏–Ω. –ó–∞–º—ñ–Ω–∏—Ç–∏ —ó—ó –≤ —Ü—å–æ–º—É –≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ –º–æ–≥–ª–æ –± –±–µ–∑–ª—ñ—á —ñ–Ω—à–∏—Ö —Å–ø–æ–ª—É–∫ –∞–±–æ –ø—Ä–æ—Å—Ç–∏—Ö —Ä–µ—á–æ–≤–∏–Ω, –≤–∞—Ä—Ç–æ –±—É–ª–æ, –≤–∑—è–≤—à–∏ —è–∫—É—Å—å –∑ –Ω–∏—Ö, –≤–∏–∑–Ω–∞—á–∏—Ç–∏ –¥–ª—è –Ω–µ—ó –¥–≤—ñ —Ç–æ—á–∫–∏: –ø–ª–∞–≤–ª–µ–Ω–Ω—è —ñ –ø–∞—Ä–æ—É—Ç–≤–æ—Ä–µ–Ω–Ω—è, —è–∫—ñ –≤–∫–∞–∑—É—é—Ç—å –¥–ª—è –æ–±—Ä–∞–Ω–æ—ó —Å–ø–æ–ª—É–∫–∏ —Ç—Ä–∏ —ñ–Ω—Ç–µ—Ä–≤–∞–ª–∏ –Ω–∞ –æ—Å—ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä, –¥–µ –≤–æ–Ω–∞ –∑–Ω–∞—Ö–æ–¥–∏—Ç—å—Å—è –≤ –æ–¥–Ω–æ–º—É –∑ —Ç—Ä—å–æ—Ö –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏—Ö —Å—Ç–∞–Ω—ñ–≤ – —Ç–≤–µ—Ä–¥–æ–º—É, —Ä—ñ–¥–∫–æ–º—É –∞–±–æ –≥–∞–∑–æ–ø–æ–¥—ñ–±–Ω–æ–º—É.
–í –æ–¥–Ω–æ–º—É –∑ —Ç—Ä—å–æ—Ö… –ß–∏ –Ω–µ –∑–∞–º–∏—Å–ª—é–≤–∞–ª–∏—Å—è –≤–∏, —á–æ–º—É —Ç—Ä–∏, –∞ –Ω–µ –¥–≤–∞ —á–∏, —Å–∫–∞–∂—ñ–º–æ, –ø’—è—Ç—å? –©–æ–± –≤—ñ–¥–ø–æ–≤—ñ—Å—Ç–∏ –Ω–∞ —Ü–µ –ø–∏—Ç–∞–Ω–Ω—è, –∑–≤–µ—Ä–Ω–µ–º–æ—Å—è –¥–æ —Ç–µ–æ—Ä—ñ—ó –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ—ó –±—É–¥–æ–≤–∏ —Ä–µ—á–æ–≤–∏–Ω–∏.
–ú–æ–∂–Ω–∞ —É—è–≤–∏—Ç–∏ —Å–æ–±—ñ –¥–≤–∞ –≥—Ä–∞–Ω–∏—á–Ω–∏—Ö –≤–∞—Ä—ñ–∞–Ω—Ç–∏ –≤–∑–∞—î–º–æ–¥—ñ—ó –º–æ–ª–µ–∫—É–ª: –ø–µ—Ä—à–∏–π – –∫–æ–ª–∏ –º–æ–ª–µ–∫—É–ª–∏ –∂–æ—Ä—Å—Ç–∫–æ –ø–æ–≤’—è–∑–∞–Ω—ñ –æ–¥–∏–Ω–∞ –∑ –æ–¥–Ω–æ—é; –¥—Ä—É–≥–∏–π – –∫–æ–ª–∏ –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ –≤—ñ–¥—Å—É—Ç–Ω—ñ –±—É–¥—å-—è–∫—ñ –∑–≤’—è–∑–∫–∏.
–£ –ø–µ—Ä—à–æ–º—É –≤–∏–ø–∞–¥–∫—É –º–æ–ª–µ–∫—É–ª–∏, –∑–∞–π–º–∞—é—Ç—å –ø–µ–≤–Ω—ñ –ø–æ–ª–æ–∂–µ–Ω–Ω—è –≤ –ø—Ä–æ—Å—Ç–æ—Ä—ñ —ñ –º–∞–ª–æ —Å—Ö–∏–ª—å–Ω—ñ –¥–æ –¥—ñ—ó –∑–æ–≤–Ω—ñ—à–Ω—ñ—Ö —É–º–æ–≤. –©–æ–± –∑–º—ñ–Ω–∏—Ç–∏ –ø–æ—Ä—è–¥–æ–∫ —ó—Ö –≤–∑–∞—î–º–æ—Ä–æ–∑—Ç–∞—à—É–≤–∞–Ω–Ω—è, –¥–æ–≤–æ–¥–∏—Ç—å—Å—è –¥–æ–∫–ª–∞–¥–∞—Ç–∏ –¥–æ—Å–∏—Ç—å –∑–Ω–∞—á–Ω—ñ –∑—É—Å–∏–ª–ª—è. –¶–µ —ñ —î —Ö–∞—Ä–∞–∫—Ç–µ—Ä–∏—Å—Ç–∏–∫–∞ —Ç–≤–µ—Ä–¥–æ–≥–æ –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–≥–æ —Å—Ç–∞–Ω—É.
–£ –¥—Ä—É–≥–æ–º—É –≤–∏–ø–∞–¥–∫—É –º–æ–ª–µ–∫—É–ª–∏, –æ—á–µ–≤–∏–¥–Ω–æ, –º–æ–∂—É—Ç—å –ø–µ—Ä–µ–±—É–≤–∞—Ç–∏ –æ–¥–∏–Ω–∞ –≤—ñ–¥ –æ–¥–Ω–æ—ó –Ω–∞ —è–∫–∏—Ö –∑–∞–≤–≥–æ–¥–Ω–æ –≤–µ–ª–∏–∫–∏—Ö –≤—ñ–¥—Å—Ç–∞–Ω—è—Ö, —ñ, –æ—Ç–∂–µ, –≤ –∑–∞–ª–µ–∂–Ω–æ—Å—Ç—ñ –≤—ñ–¥ –∑–æ–≤–Ω—ñ—à–Ω—ñ—Ö —É–º–æ–≤ —Ä–µ—á–æ–≤–∏–Ω–∞, –Ω–∏–º–∏ —É—Ç–≤–æ—Ä–µ–Ω–∞, –º–æ–∂–µ –∑–∞–π–º–∞—Ç–∏ –Ω–∞–π—Ä—ñ–∑–Ω–æ–º–∞–Ω—ñ—Ç–Ω—ñ—à—ñ –æ–±’—î–º–∏, –ø—Ä–∏—á–æ–º—É –∑–∞ –±–∞–∂–∞–Ω–Ω—è–º –º–∏ –º–æ–∂–µ–º–æ –∑–º—ñ–Ω—é–≤–∞—Ç–∏ —Ü–µ–π –æ–±’—î–º. –¶–µ —î —Ö–∞—Ä–∞–∫—Ç–µ—Ä–∏—Å—Ç–∏–∫–∞ –≥–∞–∑–æ–ø–æ–¥—ñ–±–Ω–æ–≥–æ —Å—Ç–∞–Ω—É.
–ú–æ–∂–ª–∏–≤–∏–π —ñ –ø—Ä–æ–º—ñ–∂–Ω–∏–π –≤–∞—Ä—ñ–∞–Ω—Ç, –∫–æ–ª–∏ —Å–∏–ª–∏ –º—ñ–∂–º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ—ó –≤–∑–∞—î–º–æ–¥—ñ—ó —Ç–∞–∫—ñ, —â–æ —ó—Ö –≤–∏—è–≤–ª—è—î—Ç—å—Å—è –¥–æ—Å–∏—Ç—å –¥–ª—è —Ç–æ–≥–æ, —â–æ–± —É—Ç—Ä–∏–º–∞—Ç–∏ —Å–∞–º—ñ –º–æ–ª–µ–∫—É–ª–∏ –≤ —Å–∫—É–ø—á–µ–Ω–Ω—ñ, –∞–ª–µ —ó—Ö –Ω–µ –≤–∏—Å—Ç–∞—á–∞—î –¥–ª—è —Ç–æ–≥–æ, —â–æ–± –Ω–∞–¥–∞—Ç–∏ —Ç–∞–∫–æ–º—É —Å–∫—É–ø—á–µ–Ω–Ω—é –º–æ–ª–µ–∫—É–ª –≤–ø–æ—Ä—è–¥–∫–æ–≤–∞–Ω–æ—Å—Ç—ñ. –£ –ø–æ–¥—ñ–±–Ω–æ–º—É —Å—Ç–∞–Ω—ñ —Ä–µ—á–æ–≤–∏–Ω–∞ –∑–∞–π–º–∞—î –ø–µ–≤–Ω–∏–π –æ–±’—î–º (–æ—Å–∫—ñ–ª—å–∫–∏ –º–æ–ª–µ–∫—É–ª–∏ –æ–¥–∏–Ω–∞ –≤—ñ–¥ –æ–¥–Ω–æ—ó —Ä–æ–∑–±—ñ–≥—Ç–∏—Å—è –Ω–µ –º–æ–∂—É—Ç—å), —Ä—É—Ö–ª–∏–≤—ñ—Å—Ç—å –º–æ–ª–µ–∫—É–ª –≤ —Ç–∞–∫–æ–º—É —Å–∫—É–ø—á–µ–Ω–Ω—ñ –±—ñ–ª—å—à–∞ –Ω—ñ–∂ –≤ —Ç–≤–µ—Ä–¥–æ–º—É —Å—Ç–∞–Ω—ñ, —Ç–æ–º—É —Ä–µ—á–æ–≤–∏–Ω–∞ –∑–∞–π–º–∞—î –±—É–¥—å-—è–∫—É –æ–±–º–µ–∂–µ–Ω—É —Ñ–æ—Ä–º—É, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥ —Å—É–¥–∏–Ω–∏, –≤ —è–∫—ñ–π –∑–Ω–∞—Ö–æ–¥–∏—Ç—å—Å—è. –¶–µ —Ä—ñ–¥–∫–∏–π –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏–π —Å—Ç–∞–Ω.
–Ø–∫—â–æ —Ä–æ–∑–≥–ª—è–¥–∞—Ç–∏ –∑–º—ñ–Ω—É –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏—Ö —Å—Ç–∞–Ω—ñ–≤ –∑ –ø–æ–∑–∏—Ü—ñ—ó –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—è —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ —Ä–µ—á–æ–≤–∏–Ω–∏, —Ç–æ –ø–æ—á–∞—Ç–∏, –æ—á–µ–≤–∏–¥–Ω–æ, —Ç—Ä–µ–±–∞ –∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å—Ç–∞–Ω—É, –≤ —è–∫–æ–º—É –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ –≤ —ó—Ö –≤–∑–∞—î–º–æ–¥—ñ—ó —Ä–µ–∞–ª—ñ–∑—É—î—Ç—å—Å—è –ø–æ–≤–Ω–∏–π –ø–æ—Ä—è–¥–æ–∫.
–¢–≤–µ—Ä–¥–∏–π –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏–π —Å—Ç–∞–Ω
–¢–≤–µ—Ä–¥–∏–π –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏–π —Å—Ç–∞–Ω —Å–ø—ñ–≤—ñ—Å–Ω—É–≤–∞–Ω–Ω—è –º–æ–ª–µ–∫—É–ª, —Ü–µ —Ç–∞–∫–∏–π —Å—Ç–∞–Ω, –ø—Ä–∏ —è–∫–æ–º—É, –∫–æ–∂–µ–Ω —É—á–∞—Å–Ω–∏–∫ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–≥–æ —Å–∫—É–ø—á–µ–Ω–Ω—è –∑–∞–π–º–∞—î —Ñ—ñ–∫—Å–æ–≤–∞–Ω–µ –ø–æ–ª–æ–∂–µ–Ω–Ω—è –≤ –ø—Ä–æ—Å—Ç–æ—Ä—ñ. –ü—Ä–∏ –¥–æ—Å—Ç–∞—Ç–Ω—å–æ–º—É –æ—Ö–æ–ª–æ–¥–∂–µ–Ω–Ω—ñ —Ü—å–æ–≥–æ –º–æ–∂–Ω–∞ –¥–æ–º–æ–≥—Ç–∏—Å—è –¥–ª—è –±—É–¥—å-—è–∫–æ—ó —Ä–µ—á–æ–≤–∏–Ω–∏.
–í–∏—è–≤–ª—è—î—Ç—å—Å—è, —Ä–µ—á–æ–≤–∏–Ω–∏ –∑ —Ç–∞–∫–∏–º —Ç–∏–ø–æ–º –≤–∑–∞—î–º–æ–¥—ñ—ó –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ –º–æ–∂—É—Ç—å –±—É—Ç–∏ –ø–æ–¥—ñ–ª–µ–Ω—ñ –Ω–∞ –¥–≤—ñ –≤–µ–ª–∏–∫—ñ –≥—Ä—É–ø–∏:
- –ø–µ—Ä—à–∞ – –∫–æ–ª–∏, –∑–Ω–∞—é—á–∏ —Å—Ç–∞–Ω–æ–≤–∏—â–µ –≤ –ø—Ä–æ—Å—Ç–æ—Ä—ñ –ø–µ–≤–Ω–æ—ó —ñ –ø—Ä–∏—Ç–æ–º—É –≤—ñ–¥–Ω–æ—Å–Ω–æ –Ω–µ–≤–µ–ª–∏–∫–æ—ó –≥—Ä—É–ø–∏ –º–æ–ª–µ–∫—É–ª (–∞–±–æ –∞—Ç–æ–º—ñ–≤), –º–æ–∂–Ω–∞ —Ç–æ—á–Ω–æ –ø–µ—Ä–µ–¥–±–∞—á–∏—Ç–∏ —ñ –ø–æ–ª–æ–∂–µ–Ω–Ω—è —ñ–Ω—à–∏—Ö —á–ª–µ–Ω—ñ–≤ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ–≥–æ —Å–∫—É–ø—á–µ–Ω–Ω—è;
- –¥—Ä—É–≥–∞ – –∫–æ–ª–∏ –ø–æ–¥—ñ–±–Ω–µ –ø–µ—Ä–µ–¥–±–∞—á–µ–Ω–Ω—è –≤–∏—è–≤–ª—è—î—Ç—å—Å—è –Ω–µ–º–æ–∂–ª–∏–≤–∏–º.
–î–ª—è –ø–µ—Ä—à–æ—ó –≥—Ä—É–ø–∏ —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–æ —Ç–µ, —â–æ –ø–æ—Ä—è–¥–æ–∫ —Å–ø—ñ–≤—Ä–æ–∑—Ç–∞—à—É–≤–∞–Ω–Ω—è –º–æ–ª–µ–∫—É–ª –∞–±–æ –∞—Ç–æ–º—ñ–≤ –≤ –º–∞–ª–æ–º—É –æ–±’—î–º—ñ —Ä–µ—á–æ–≤–∏–Ω–∏ –ø–æ—à–∏—Ä—é—î—Ç—å—Å—è –Ω–∞ –≤—Å—é –π–æ–≥–æ —Ç–æ–≤—â—É. –¢—É—Ç –ø–∞–Ω—É—î, —è–∫—â–æ –≤–¥–∞—Ç–∏—Å—è –¥–æ —Å—É–≤–æ—Ä–æ–≥–æ —Ç–µ—Ä–º—ñ–Ω—É, –≥–ª–∏–±–æ–∫–∏–π –ø–æ—Ä—è–¥–æ–∫. –£ —Ä–µ—á–æ–≤–∏–Ω –¥—Ä—É–≥–æ—ó –≥—Ä—É–ø–∏ –≥–ª–∏–±–æ–∫–æ–≥–æ –ø–æ—Ä—è–¥–∫—É –Ω–µ–º–∞—î. –£ –ø–µ—Ä—à–æ–º—É –≤–∏–ø–∞–¥–∫—É –≥–æ–≤–æ—Ä—è—Ç—å, —â–æ —Ä–µ—á–æ–≤–∏–Ω–∞ –≤–æ–ª–æ–¥—ñ—î —Ç—ñ—î—é –∞–±–æ —ñ–Ω—à–æ—é –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—é —Ä–µ—à—ñ—Ç–∫–æ—é. –á—ó –Ω–∞–π–º–µ–Ω—à–∏–π —Ñ—Ä–∞–≥–º–µ–Ω—Ç, –ø–æ–≤—Ç–æ—Ä–µ–Ω–Ω—è–º —è–∫–æ–≥–æ –º–æ–∂–Ω–∞ –≤—ñ–¥—Ç–≤–æ—Ä–∏—Ç–∏ —ó—ó –≤—Å—é, –Ω–∞–∑–∏–≤–∞—î—Ç—å—Å—è –æ—Å–µ—Ä–µ–¥–∫ —Ä–µ—à—ñ—Ç–∫–∏.
–õ–æ–≥—ñ—á–Ω–æ –ø—Ä–∏–ø—É—Å—Ç–∏—Ç–∏, —â–æ —Ä–µ—á–æ–≤–∏–Ω–∏ –ø–µ—Ä—à–æ–≥–æ —Ç–∏–ø—É –ø—Ä–∏ –ø–µ—Ä–µ—Ö–æ–¥—ñ –≤ —Ç–≤–µ—Ä–¥–∏–π —Å—Ç–∞–Ω –Ω–∞–±—É–≤–∞—é—Ç—å –ø–µ–≤–Ω—ñ, —á—ñ—Ç–∫—ñ —Ñ–æ—Ä–º–∏ (–ø–æ–≤’—è–∑–∞–Ω—ñ –∑ –±—É–¥–æ–≤–æ—é —Ä–µ—à—ñ—Ç–∫–∏) – –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—ñ —Ä–µ—á–æ–≤–∏–Ω–∏; —Ä–µ—á–æ–≤–∏–Ω–∏ –¥—Ä—É–≥–æ–≥–æ —Ç–∏–ø—É —á—ñ—Ç–∫–∏—Ö —Ñ–æ—Ä–º –Ω–µ —É—Ç–≤–æ—Ä—é—é—Ç—å —ñ —à–≤–∏–¥—à–µ –∑–∞ –≤—Å–µ –º–∞—Ç–∏–º—É—Ç—å –≤–∏–≥–ª—è–¥ –±–µ–∑—Ñ–æ—Ä–º–Ω–∏—Ö –º–∞—Å – –∞–º–æ—Ä—Ñ–Ω—ñ —Ä–µ—á–æ–≤–∏–Ω–∏.
–ü—Ä–∏–∫–ª–∞–¥–∞–º–∏ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω –º–æ–∂—É—Ç—å –±—É—Ç–∏ –∫—É—Ö–æ–Ω–Ω–∞ —Å—ñ–ª—å —ñ –≥–∞–ª—É–Ω, —â–æ –∫—Ä–∏—Å—Ç–∞–ª—ñ–∑—É—é—Ç—å—Å—è –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ –≤ —Ñ–æ—Ä–º—ñ –∫—É–±—ñ–≤ —ñ –æ–∫—Ç–∞–µ–¥—Ä—ñ–≤; –ø—Ä–∏–∫–ª–∞–¥–∏ —Ä–µ—á–æ–≤–∏–Ω –¥—Ä—É–≥–æ–≥–æ —Ç–∏–ø—É – –∫–ª–µ–π, –∫–∞—É—á—É–∫, —Å–∫–ª–æ.
–ß–∫—â–æ –Ω–∞–≥—Ä—ñ–≤–∞—Ç–∏ —Ä–µ—á–æ–≤–∏–Ω–∏ –æ–±–æ—Ö —Ç–∏–ø—ñ–≤, —Ç–æ –≤ –ø–µ—Ä—à–æ–º—É –≤–∏–ø–∞–¥–∫—É –∑–≤’—è–∑–∫–∏ –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ (–∞ –æ—Ç–∂–µ, —ñ –≤—Å—è –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∞ —Ä–µ—à—ñ—Ç–∫–∞) –≤ —Ä—ñ–∑–Ω–∏—Ö –º—ñ—Å—Ü—è—Ö –±—É–¥—É—Ç—å —Ä—É–π–Ω—É–≤–∞—Ç–∏—Å—è –æ–¥–Ω–æ—á–∞—Å–Ω–æ, –æ—Å–∫—ñ–ª—å–∫–∏ –≤–æ–Ω–∏ –∞–±—Å–æ–ª—é—Ç–Ω–æ –µ–∫–≤—ñ–≤–∞–ª–µ–Ω—Ç–Ω—ñ, —ñ –ø–µ—Ä–µ—Ö—ñ–¥ –∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å—Ç–∞–Ω—É –≤ —Ä—ñ–¥–∫–∏–π –≤—ñ–¥–±—É–¥–µ—Ç—å—Å—è –ø—Ä–∏ –ø–µ–≤–Ω—ñ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ. –£ –¥—Ä—É–≥–æ–º—É –≤–∏–ø–∞–¥–∫—É –ø—Ä–∏ –ø–µ–≤–Ω—ñ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ –ª–∏—à–µ —á–∞—Å—Ç–∏–Ω–∞ –º–æ–ª–µ–∫—É–ª –Ω–∞–±—É–≤–∞—î –∑–¥–∞—Ç–Ω–æ—Å—Ç—ñ –¥–æ –±—ñ–ª—å—à-–º–µ–Ω—à –≤—ñ–ª—å–Ω–æ–≥–æ –ø–µ—Ä–µ–º—ñ—â–µ–Ω–Ω—è, –∞ —Ä–µ—à—Ç–∞ –∑–∞–ª–∏—à–∞—î—Ç—å—Å—è –Ω–µ—Ä—É—Ö–æ–º–∏–º–∏ (—á–µ—Ä–µ–∑ –≤—ñ–¥—Å—É—Ç–Ω—ñ—Å—Ç—å —á—ñ—Ç–∫–∏—Ö –∑–∞–∫–æ–Ω–æ–º—ñ—Ä–Ω–æ—Å—Ç–µ–π –≤ –ø—Ä–æ—Å—Ç–æ—Ä–æ–≤—ñ–π –æ—Ä—ñ—î–Ω—Ç–∞—Ü—ñ—ó), —ñ –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ –ø–µ—Ä–µ—Ö—ñ–¥ –∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å—Ç–∞–Ω—É –≤ —Ä—ñ–¥–∫–∏–π —Ä–æ–∑—Ç—è–≥—É—î—Ç—å—Å—è –Ω–∞ –ø–µ–≤–Ω–∏–π –¥—ñ–∞–ø–∞–∑–æ–Ω —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä. –£ –∞–º–æ—Ä—Ñ–Ω–∏—Ö —Ç—ñ–ª –Ω–µ –º–æ–∂–Ω–∞ —á—ñ—Ç–∫–æ —Ä–æ–∑–¥—ñ–ª–∏—Ç–∏ –¥–≤–∞ —Ç–∏–ø–∏ –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏—Ö —Å—Ç–∞–Ω—ñ–≤.
–°–∫–∞–∂—ñ–º–æ, –ø—Ä–∏ 1200*–° –≤—ñ–∫–æ–Ω–Ω–µ —Å–∫–ª–æ —Å—Ö–æ–∂–µ –Ω–∞ —Ü—É–∫—Ä–æ–≤–∏–π —Å–∏—Ä–æ–ø, –ø—Ä–∏ 900*–° –ø–æ—á–∏–Ω–∞—î —Ç—è–≥–Ω—É—Ç–∏—Å—è –≤ –Ω–∏—Ç–∫–∏, –∞ –ø—Ä–∏ 800*–° –Ω–∞–≥–∞–¥—É—î —Å–∏–ª—å–Ω–æ –∑–∞–≥—É—Å–ª–∏–π –º–µ–¥.
–°–ª—ñ–¥ –∑–∞–∑–Ω–∞—á–∏—Ç–∏, —â–æ –¥–µ—è–∫—ñ —Ä–µ—á–æ–≤–∏–Ω–∏ –∑–∞–ª–µ–∂–Ω–æ –≤—ñ–¥ —É–º–æ–≤ –ø–µ—Ä–µ—Ö–æ–¥—É –≤ —Ç–≤–µ—Ä–¥–∏–π —Å—Ç–∞–Ω –º–æ–∂—É—Ç—å –±—É—Ç–∏ –æ—Ç—Ä–∏–º–∞–Ω—ñ —è–∫ –≤ –æ–¥–Ω–æ–º—É, —Ç–∞–∫ —ñ –≤ —ñ–Ω—à–æ–º—É –≤–∞—Ä—ñ–∞–Ω—Ç—ñ. –°–∫–∞–∂—ñ–º–æ, SiO2 –≤ –ø—Ä–∏—Ä–æ–¥—ñ –∑—É—Å—Ç—Ä—ñ—á–∞—î—Ç—å—Å—è —É –≤–∏–≥–ª—è–¥—ñ –∫—Ä–∞—Å–∏–≤–∏—Ö –¥—Ä—É–∑ –≥—ñ—Ä—Å—å–∫–æ–≥–æ –∫—Ä–∏—à—Ç–∞–ª—é, –æ–¥–Ω–∞–∫ –ø—Ä–∏ –æ—Ö–æ–ª–æ–¥–∂–µ–Ω–Ω—ñ –π–æ–≥–æ –∑ —Ä–æ–∑–ø–ª–∞–≤—É —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è —ñ –∞–º–æ—Ä—Ñ–Ω–∞ –º–∞—Å–∞, –≤ —è–∫—ñ–π –Ω–µ–≤–∞–∂–∫–æ –≤–ø—ñ–∑–Ω–∞—Ç–∏ –≤—Å—ñ–º –≤—ñ–¥–æ–º–µ —Å–∫–ª–æ.
–ü—Ä–∏ –ø–æ–¥—ñ–±–Ω—ñ–π –ø–æ–¥–≤—ñ–π–Ω–æ—Å—Ç—ñ, —è–∫—ñ –º–∏ —Å–ø–æ—Å—Ç–µ—Ä—ñ–≥–∞—î–º–æ –∑ –∫—Ä–∏—à—Ç–∞–ª–µ–º, —â—ñ–ª—å–Ω—ñ—Å—Ç—å –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω –≤–∏—è–≤–ª—è—î—Ç—å—Å—è –≤–∏—â–æ—é –∑–∞ —â—ñ–ª—å–Ω—ñ—Å—Ç—å –∞–º–æ—Ä—Ñ–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω. –£ —á–æ–º—É —Ç—É—Ç —Å–ø—Ä–∞–≤–∞? –©–æ–± —Ä–æ–∑—ñ–±—Ä–∞—Ç–∏—Å—è –≤ —Ü—å–æ–º—É –ø–∏—Ç–∞–Ω–Ω—ñ, –ø—Ä–∏–≥–∞–¥–∞–π—Ç–µ, —è–∫ –≤ –æ—Å—Ç–∞–Ω–Ω—ñ–π —Ä–∞–∑ –≤–∏ –Ω–∞–≤–æ–¥–∏–ª–∏ –ª–∞–¥ –≤ —Å–≤–æ—ó–π –∫–Ω–∏–∂–∫–æ–≤—ñ–π —à–∞—Ñ—ñ. –©—ñ–ª—å–Ω–æ —Å–∫–ª–∞–¥–∞—é—á–∏ –∫–Ω–∏–≥–∏ –≤ —Å—Ç—Ä—É–Ω–∫—ñ —à–µ—Ä–µ–Ω–≥–∏, –≤–∏ –¥–æ—Å—è–≥–∞–ª–∏ –∑–Ω–∞—á–Ω–æ–≥–æ –≤–∏–≥—Ä–∞—à—É –≤ –ø—Ä–æ—Å—Ç–æ—Ä—ñ, —á–∏ –Ω–µ —Ç–∞–∫? –¢–∞–∫ —Å–∞–º–æ —ñ –≤ —Å–≤—ñ—Ç—ñ –º–æ–ª–µ–∫—É–ª: –≤ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—ñ–π —Ñ–æ—Ä–º—ñ –º–æ–ª–µ–∫—É–ª–∏ —Ä–µ—á–æ–≤–∏–Ω–∏ —É–ø–∞–∫–æ–≤–∞–Ω—ñ –±—ñ–ª—å—à —â—ñ–ª—å–Ω–æ –Ω—ñ–∂ –≤ –∞–º–æ—Ä—Ñ–Ω—ñ–π —Ñ–æ—Ä–º—ñ: –æ–¥–∏–Ω–∞ —ñ —Ç–∞ –∂ —ó—Ö –∫—ñ–ª—å–∫—ñ—Å—Ç—å –∑–∞–π–º–∞—î –º–µ–Ω—à–µ –º—ñ—Å—Ü—è, –∞ –≤–Ω–∞—Å–ª—ñ–¥–æ–∫ —Ü—å–æ–≥–æ —ñ —â—ñ–ª—å–Ω—ñ—Å—Ç—å —Ä–µ—á–æ–≤–∏–Ω–∏ –≤–∏—â–µ, –Ω—ñ–∂ —Ç–æ–¥—ñ, –∫–æ–ª–∏ –º–æ–ª–µ–∫—É–ª–∏ –æ—Ä—ñ—î–Ω—Ç–æ–≤–∞–Ω—ñ –±–µ–∑–ª–∞–¥–Ω–æ.
–ú–æ–ª–µ–∫—É–ª–∏ –ø—Ä–∞–≥–Ω—É—Ç—å —É–ø–æ—Ä—è–¥–∫—É–≤–∞—Ç–∏ —Å–≤–æ—é –æ—Ä—ñ—î–Ω—Ç–∞—Ü—ñ—é –≤ –ø—Ä–æ—Å—Ç–æ—Ä—ñ. –í—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è —Ü–µ –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ –¥–æ –∑–∞–≥–∞–ª—å–Ω–æ–≥–æ –∑–∞–∫–æ–Ω—É —Ñ—ñ–∑–∏–∫–∏, –∑–≥—ñ–¥–Ω–æ –∑ —è–∫–∏–º, –±—ñ–ª—å—à —É–ø–æ—Ä—è–¥–∫–æ–≤–∞–Ω–∞ —Å–∏—Å—Ç–µ–º–∞ –º–∞—î —ñ –Ω–∞–π–º–µ–Ω—à—É –µ–Ω–µ—Ä–≥—ñ—é —Å–µ—Ä–µ–¥ –≤—Å—ñ—Ö –º–æ–∂–ª–∏–≤–∏—Ö —Å–∏—Å—Ç–µ–º –æ—Ä—ñ—î–Ω—Ç–∞—Ü—ñ—ó –º–æ–ª–µ–∫—É–ª. –ü–µ—Ä–µ–±—ñ–≥ –ø—Ä–∏—Ä–æ–¥–Ω–∏—Ö –ø—Ä–æ—Ü–µ—Å—ñ–≤ –ø—Ä–∞–≥–Ω–µ –¥–æ –∑–º–µ–Ω—à–µ–Ω–Ω—è –µ–Ω–µ—Ä–≥—ñ—ó. –¢–æ–º—É –∞–º–æ—Ä—Ñ–Ω—ñ —Ç—ñ–ª–∞ –≤ –±—ñ–ª—å—à–æ—Å—Ç—ñ –≤–∏–ø–∞–¥–∫—ñ–≤ –ø–µ—Ä–µ—Ö–æ–¥—è—Ç—å –∑ —á–∞—Å–æ–º –≤ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—ñ. –Ü–Ω–æ–¥—ñ —Ü–µ —Ç—Ä–∞–ø–ª—è—î—Ç—å—Å—è –ø–æ—Ä—ñ–≤–Ω—è–Ω–æ —à–≤–∏–¥–∫–æ: –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, –∞–º–æ—Ä—Ñ–Ω–∞ –ø–ª–∞—Å—Ç–∏—á–Ω–∞ —Å—ñ—Ä–∫–∞, –æ–¥–µ—Ä–∂—É–≤–∞–Ω–∞ –ø—Ä–∏ –≤–ª–∏–≤–∞–Ω–Ω—ñ —Ä—ñ–¥–∫–æ—ó —Å—ñ—Ä–∫–∏ –≤ —Ö–æ–ª–æ–¥–Ω—É –≤–æ–¥—É —ñ –º–∞—î –≤–∏–≥–ª—è–¥ –≥—É–º–æ–ø–æ–¥—ñ–±–Ω–æ—ó –º–∞—Å–∏, –ø–µ—Ä–µ—Ö–æ–¥–∏—Ç—å –≤ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∏–π —Å—Ç–∞–Ω —á–µ—Ä–µ–∑ –¥–≤—ñ-—Ç—Ä–∏ –≥–æ–¥–∏–Ω–∏. –ê–ª–µ —ñ–Ω–æ–¥—ñ —Ç–∞–∫–µ –ø–µ—Ä–µ—Ç–≤–æ—Ä–µ–Ω–Ω—è —Ä–æ–∑—Ç—è–≥—É—î—Ç—å—Å—è –Ω–∞ –Ω–µ–≤–∏–∑–Ω–∞—á–µ–Ω–æ –¥–æ–≤–≥–∏–π —á–∞—Å. –ù–∞–ø—Ä–∏–∫–ª–∞–¥ —Å–∫–ª–æ. –°—Ç–∞—Ä–æ–¥–∞–≤–Ω—ñ –ø—Ä–∏–∫—Ä–∞—Å–∏ –∑—ñ —Å–∫–ª–∞, —è–∫—ñ –∑–±–µ—Ä–µ–≥–ª–∏ —Å–≤—ñ–π –ø—Ä–∏–≤–∞–±–ª–∏–≤–∏–π –≤–∏–≥–ª—è–¥, –¥–æ–≤–æ–¥—è—Ç—å —Ç–∏–º —Å–∞–º–∏–º, —â–æ –∑–∞ —Å—Ç–æ–ª—ñ—Ç—Ç—è —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ —Å–∫–ª–∞ –∑–∞–ª–∏—à–∏–ª–∞—Å—è –Ω–µ–∑–º—ñ–Ω–Ω–æ—é. –ê–ª–µ —ñ–Ω–æ–¥—ñ –≤—ñ–¥ —É–¥–∞—Ä—É –∞–±–æ –ø–æ–¥—ñ–±–Ω–∏—Ö –≤–ø–ª–∏–≤—ñ–≤ —Å–∫–ª–æ –º—É—Ç–Ω—ñ—î, —è–∫ –∫–∞–∂—É—Ç—å: –≤ –Ω—å–æ–º—É —É—Ç–≤–æ—Ä—é—é—Ç—å—Å—è –∫—Ä–∏—Å—Ç–∞–ª–∏, –±–µ–∑–ª–∞–¥–Ω–æ –æ—Ä—ñ—î–Ω—Ç–æ–≤–∞–Ω—ñ –æ–¥–∏–Ω –¥–æ –æ–¥–Ω–æ–≥–æ, —Ç–∞–∫—ñ —Ö–∞–æ—Ç–∏—á–Ω–æ —Ä–æ–∑—Ç–∞—à–æ–≤–∞–Ω—ñ –∫—Ä–∏—Å—Ç–∞–ª–∏ —Å–∫–ª–∞ —Ö–∞–æ—Ç–∏—á–Ω–æ —Ä–æ–∑—Å—ñ—é—é—Ç—å —Å–≤—ñ—Ç–ª–æ, —â–æ —ñ —Å—Ç–≤–æ—Ä—é—î –µ—Ñ–µ–∫—Ç –ø–æ–º—É—Ç–Ω—ñ–Ω–Ω—è.
–ó–∞–ª–µ–∂–Ω–æ –≤—ñ–¥ —É–º–æ–≤ –∫—Ä–∏—Å—Ç–∞–ª—ñ–∑–∞—Ü—ñ—ó —Ä—è–¥ —Ä–µ—á–æ–≤–∏–Ω –º–æ–∂–µ –±—É—Ç–∏ –≤–∏–¥—ñ–ª–µ–Ω–∏–π –Ω–µ –≤ –æ–¥–Ω–∏–Ω, –∞ –≤ –¥–≤–∞ –∞–±–æ –Ω–∞–≤—ñ—Ç—å –±—ñ–ª—å—à—É –∫—ñ–ª—å–∫—ñ—Å—Ç—å –≤–∏–¥—ñ–≤. –ù–∞–ø—Ä–∏–∫–ª–∞–¥, –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ –∫—Ä–∏—Å—Ç–∞–ª—ñ–∑–∞—Ü—ñ—ó (114*–°) —Å—ñ—Ä–∫–∞ –≤–∏–¥—ñ–ª—è—î—Ç—å—Å—è —É –≤–∏–≥–ª—è–¥—ñ –±–ª—ñ–¥–æ-–∂–æ–≤—Ç–∏—Ö –∫—Ä–∏—Å—Ç–∞–ª—ñ–≤, –∞ –ø—Ä–∏ –æ—Ö–æ–ª–æ–¥–∂–µ–Ω–Ω—ñ –¥–æ 96*–° —É—Ç–≤–æ—Ä—é—é—Ç—å—Å—è –∫—Ä–∏—Å—Ç–∞–ª–∏ —è—Å–∫—Ä–∞–≤–æ-–∂–æ–≤—Ç–æ–≥–æ –∫–æ–ª—å–æ—Ä—É —ñ –¥–µ—â–æ —ñ–Ω—à–æ—ó —Ñ–æ—Ä–º–∏ (—Ü—é —ó—Ö –º–æ–¥–∏—Ñ—ñ–∫–∞—Ü—ñ—é –Ω–∞–∑–∏–≤–∞—é—Ç—å —Ä–æ–º–±—ñ—á–Ω–æ—é – –Ω–∞ –≤—ñ–¥–º—ñ–Ω—É –≤—ñ–¥ –ø–æ–ø–µ—Ä–µ–¥–Ω—å–æ—ó, –º–æ–Ω–æ–∫–ª—ñ–Ω–Ω–æ—ó). –©–µ –±—ñ–ª—å—à –Ω–∞–æ—á–Ω—ñ –ø—Ä–∏–∫–ª–∞–¥–∏ —Ç–æ–≥–æ –∂ —Ä–æ–¥—É – –≥—Ä–∞—Ñ—ñ—Ç —ñ –∞–ª–º–∞–∑. –ó–¥–∞—Ç–Ω—ñ—Å—Ç—å —Ä–µ—á–æ–≤–∏–Ω —ñ—Å–Ω—É–≤–∞—Ç–∏ —É –≤–∏–≥–ª—è–¥—ñ –∫—ñ–ª—å–∫–æ—Ö –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∏—Ö —Ñ–æ—Ä–º –æ—Ç—Ä–∏–º–∞–ª–∞ –Ω–∞–∑–≤—É –ø–æ–ª—ñ–º–æ—Ä—Ñ—ñ–∑–º.
–ü—Ä–∏ –ø–µ—Ä–µ–±—É–¥–æ–≤—ñ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏ –Ω–µ—Ä—ñ–¥–∫–æ –∑–º—ñ–Ω—é—î—Ç—å—Å—è —ñ –∑–∞–±–∞—Ä–≤–ª–µ–Ω–Ω—è —Ä–µ—á–æ–≤–∏–Ω–∏. –¶–µ —á–∞—Å–æ–º –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è –Ω–∞ –ø—Ä–∞–∫—Ç–∏—Ü—ñ –ø—Ä–∏ –≤–∏–≥–æ—Ç–æ–≤–ª–µ–Ω–Ω—ñ —Å–ø–µ—Ü—ñ–∞–ª—å–Ω–∏—Ö —ñ–Ω–¥–∏–∫–∞—Ç–æ—Ä—ñ–≤ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏: –∫–æ–ª–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –¥–æ—Å—è–≥–∞—î –ø–µ–≤–Ω–æ–≥–æ –∑–Ω–∞—á–µ–Ω–Ω—è, –∑–º—ñ–Ω–∞ –∫–æ–ª—å–æ—Ä—É –Ω–∞–æ—á–Ω–æ “–¥–æ–ø–æ–≤—ñ–¥–∞—î” –ø—Ä–æ —Ü–µ.
–ü—Ä–∏—á–∏–Ω–æ—é –æ–ø–∏—Å–∞–Ω–æ—ó —Ä—ñ–∑–Ω–æ–º–∞–Ω—ñ—Ç–Ω–æ—Å—Ç—ñ —î —Ç–µ, —â–æ –∫–æ–º—ñ—Ä–∫–∞ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏ —É –¥–µ—è–∫–∏—Ö —Ä–µ—á–æ–≤–∏–Ω –º–æ–∂–µ –Ω–∞–ª–µ–∂–∞—Ç–∏ –¥–æ —Ä—ñ–∑–Ω–∏—Ö —Ç–∏–ø—ñ–≤. –Ø–∫–∏–π –∑ –Ω–∏—Ö —Ä–µ–∞–ª—ñ–∑–æ–≤–∞–Ω–∏–π –≤ –∫–æ–Ω–∫—Ä–µ—Ç–Ω–æ–º—É –∑—Ä–∞–∑–∫—É —Ä–µ—á–æ–≤–∏–Ω–∏, –Ω–∞–π–ª–µ–≥—à–µ –≤–∏–∑–Ω–∞—á–∏—Ç–∏ —à–ª—è—Ö–æ–º —Ä–µ–Ω—Ç–≥–µ–Ω–æ—Å—Ç—Ä—É–∫—Ç—É—Ä–Ω–æ–≥–æ –∞–Ω–∞–ª—ñ–∑—É. –í—Å—å–æ–≥–æ —Ç–∞–∫–∏—Ö —Ç–∏–ø—ñ–≤ 230. –í–ø–µ—Ä—à–µ, —à–ª—è—Ö–æ–º –º–∞—Ç–µ–º–∞—Ç–∏—á–Ω–æ–≥–æ —Ä–æ–∑—Ä–∞—Ö—É–Ω–∫—É —ó—Ö —Ä–æ–∑—Ä–∞—Ö—É–≤–∞–≤ –≤ 1890 —Ä–æ—Ü—ñ –∫—Ä–∏—Å—Ç–∞–ª–æ–∑–Ω–∞–≤–µ—Ü—å –ï.–°. –§–µ–¥–æ—Ä–æ–≤. –î–µ—â–æ —Ä–∞–Ω—ñ—à–µ —Ñ—Ä–∞–Ω—Ü—É–∑—å–∫–∏–π –∫—Ä–∏—Å—Ç–∞–ª–æ–∑–Ω–∞–≤–µ—Ü—å –û. –ë—Ä–∞–≤–µ –≤–∏—è–≤–∏–≤, —â–æ —ñ—Å–Ω—É—î –≤—Å—å–æ–≥–æ 14 –≤–∞—Ä—ñ–∞–Ω—Ç—ñ–≤ –æ—Ä—ñ—î–Ω—Ç–∞—Ü—ñ—ó –∞—Ç–æ–º—ñ–≤ —É –≤—É–∑–ª–∞—Ö –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏. –ó–∞—É–≤–∞–∂–∏–º–æ, —â–æ –æ–±–∏–¥–≤—ñ —Ü—ñ —Ä–æ–±–æ—Ç–∏: –∑’—è–≤–∏–ª–∏—Å—è –≤ —Ç–æ–π —á–∞—Å, –∫–æ–ª–∏ –Ω–µ —ñ—Å–Ω—É–≤–∞–ª–æ –Ω–µ —Ç—ñ–ª—å–∫–∏ —Ä–µ–Ω—Ç–≥–µ–Ω–æ—Å—Ç—Ä—É–∫—Ç—É—Ä–Ω–æ–≥–æ –∞–Ω–∞–ª—ñ–∑—É, –∞–ª–µ —ñ –≤ —á–∞—Å–∏, –∫–æ–ª–∏ –±–∞–≥–∞—Ç–æ –≤—á–µ–Ω–∏—Ö –≤–≤–∞–∂–∞–ª–∏ —Å—É–º–Ω—ñ–≤–Ω–∏–º, —Å–∞–º–µ —ñ—Å–Ω—É–≤–∞–Ω–Ω—è –∞—Ç–æ–º—ñ–≤ —ñ –º–æ–ª–µ–∫—É–ª!

–ö—É—Ö–æ–Ω–Ω–∞ —Å—ñ–ª—å –º–∞—î –∫—É–±—ñ—á–Ω—É –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—É —Ä–µ—à—ñ—Ç–∫—É, –≤ —è–∫—ñ–π —ñ–æ–Ω–∏ –Ω–∞—Ç—Ä—ñ—é —ñ —Ö–ª–æ—Ä—É —Ä–æ–∑—Ç–∞—à–æ–≤—É—é—Ç—å—Å—è –≤ –≤–µ—Ä—à–∏–Ω–∞—Ö –∫—É–±–∞. –í –∞–ª–º–∞–∑—ñ –∞—Ç–æ–º–∏ –∫–∞—Ä–±–æ–Ω—É —Ä–æ–∑—Ç–∞—à–æ–≤–∞–Ω—ñ —ñ –≤–µ—Ä—à–∏–Ω–∞—Ö —Ç–µ—Ç—Ä–∞–µ–¥—Ä–∞. –¢–µ—Ç—Ä–∞–µ–¥—Ä – —Ñ—ñ–≥—É—Ä–∞ —è–∫–∞ –º–∞—î —Å—Ç—ñ–π–∫—É –∫–æ–Ω—Ñ—ñ–≥—É—Ä–∞—Ü—ñ—é, —ó—ó –Ω–µ –º–æ–∂–Ω–∞ –∑–º—ñ–Ω–∏—Ç–∏ —á–∏ –¥–µ—Ñ–æ—Ä–º—É–≤–∞—Ç–∏ –≥–µ–æ–º–µ—Ç—Ä–∏—á–Ω–æ (–Ω–∞ –≤—ñ–¥–º—ñ–Ω—É, —Å–∫–∞–∂—ñ–º–æ, –≤—ñ–¥ –∫—É–±–∞, —è–∫–∏–π –º–æ–∂–µ –±—É—Ç–∏ –ª–µ–≥–∫–æ –¥–µ—Ñ–æ—Ä–º–æ–≤–∞–Ω–∏–π –≤ –ø–∞—Ä–∞–ª–µ–ª–µ–ø—ñ–ø–µ–¥). –ù–µ –¥–∏–≤–Ω–æ, —â–æ –∞–ª–º–∞–∑ —î —á–µ–º–ø—ñ–æ–Ω–æ–º –ø–æ —Ç–≤–µ—Ä–¥–æ—Å—Ç—ñ –≤ —Å–≤—ñ—Ç—ñ –∫—Ä–∏—Å—Ç–∞–ª—ñ–≤. –¢–µ—Ç—Ä–∞–µ–¥—Ä–∏—á–Ω—É —Å—Ç—Ä—É–∫—Ç—É—Ä—É —Ä–µ—à—ñ—Ç–∫–∏ –º–∞—é—Ç—å –±–∞–≥–∞—Ç–æ –Ω–∞–¥—Ç–≤–µ—Ä–¥–∏—Ö —Ä–µ—á–æ–≤–∏–Ω, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥ –±–æ—Ä–∞–∑–æ–Ω BN, –∫–∞—Ä–±–æ—Å—ñ–ª—ñ—Ü—ñ–π SiC. –î–æ —Ä–µ—á—ñ –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ –º—ñ–Ω—É—Å -150*–° —ñ –Ω–∏–∂—á–µ —ñ—Å–Ω—É—î –∫—É–±—ñ—á–Ω–∏–π –ª—ñ–¥, –≤ —è–∫–æ–º—É –∑–≤’—è–∑–∫–∏ –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ –≤–æ–¥–∏ —Ç–∞–∫—ñ —Å–∞–º—ñ, —è–∫ —ñ –º—ñ–∂ –∞—Ç–æ–º–∞–º–∏ –∫–∞—Ä–±–æ–Ω—É –≤ –∞–ª–º–∞–∑—ñ. –¢–∞–∫–∏–π –ª—ñ–¥ –∑–Ω–∞—á–Ω–æ —Ç–≤–µ—Ä–¥—ñ—à–∏–π –∑–∞ –∑–≤–∏—á–∞–π–Ω–∏–π –ª—ñ–¥.
–¢—Ä–µ–±–∞ —Å–∫–∞–∑–∞—Ç–∏, —â–æ —Å–∫–ª–∞–¥–æ–≤—ñ –µ–ª–µ–º–µ–Ω—Ç–∏ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∏—Ö —Ä–µ—à—ñ—Ç–æ–∫, –±—É–¥—å —Ç–æ –∞—Ç–æ–º–∏ (—è–∫ –≤ –∞–ª–º–∞–∑—ñ), —ñ–æ–Ω–∏ (–≤ –≥–∞–ª—É–Ω—ñ) –∞–±–æ –∂ –º–æ–ª–µ–∫—É–ª–∏ (–≤ –≤–æ–¥—ñ), –Ω–µ –∑–∞–∫—Ä—ñ–ø–ª–µ–Ω—ñ –Ω–∞ —Å–≤–æ—ó—Ö –º—ñ—Å—Ü—è—Ö –∞–±—Å–æ–ª—é—Ç–Ω–æ –∂–æ—Ä—Å—Ç–∫–æ, –≤–æ–Ω–∏ –∑–∞–≤–∂–¥–∏ –∑–Ω–∞—Ö–æ–¥—è—Ç—å—Å—è –≤ –∫–æ–ª–∏–≤–∞–ª—å–Ω–æ–º—É —Ä—É—Å—ñ, –ø–æ–¥—ñ–±–Ω–æ –¥–æ —á–∞—Å–æ–≤–æ–≥–æ –º–∞—è—Ç–Ω–∏–∫—É, –ø—Ä–∏—á–æ–º—É —Ü–µ–π —Ä—É—Ö –Ω–µ –∑–∞–≤–º–∏—Ä–∞—î –Ω–∞–≤—ñ—Ç—å –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ –∞–±—Å–æ–ª—é—Ç–Ω–æ–≥–æ –Ω—É–ª—è (-273,15*–°). –ü—Ä–∏—Ä–æ–¥–Ω–æ, —â–æ –∑ –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—è–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –∞–º–ø–ª—ñ—Ç—É–¥–∞ —Ç–∞–∫–∏—Ö –∫–æ–ª–∏–≤–∞–Ω—å –∑—Ä–æ—Å—Ç–∞—î, –∞ —Ç–æ–º—É –º–æ–∂–Ω–∞ –æ—á—ñ–∫—É–≤–∞—Ç–∏, —â–æ —ñ –∞—Ä—Ö—ñ—Ç–µ–∫—Ç—É—Ä–∞ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∏—Ö —Ä–µ—à—ñ—Ç–æ–∫ —Ç–µ–∂ –±—É–¥–µ –∑–º—ñ–Ω—é–≤–∞—Ç–∏—Å—è. –û–¥–∏–Ω –∑ —Ç–∞–∫–∏—Ö –ø—Ä–∏–∫–ª–∞–¥—ñ–≤ –ø—Ä–µ–¥—Å—Ç–∞–≤–ª–µ–Ω–∏–π –º–∞–ª—é–Ω–∫–æ–º –≤–Ω–∏–∑—É.
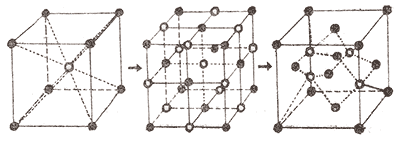
–ó –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—è–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∞ —Ä–µ—à—ñ—Ç–∫–∞ –ø–µ—Ä–µ–±—É–¥–æ–≤—É—î—Ç—å—Å—è —Ç–∞–∫–∏–º —á–∏–Ω–æ–º, —â–æ —É –∫–æ–∂–Ω–æ–≥–æ –æ–∫—Ä–µ–º–æ–≥–æ –∞—Ç–æ–º–∞ –∑–º–µ–Ω—à—É—î—Ç—å—Å—è –∫—ñ–ª—å–∫—ñ—Å—Ç—å —Å—É—Å—ñ–¥–Ω—ñ—Ö –∞—Ç–æ–º—ñ–≤, —è–∫—ñ –∑ –Ω–∏–º –∑–≤’—è–∑–∞–Ω—ñ. –ù–∞ –º–∞–ª—é–Ω–∫—É –≤–∏—â–µ, —Ü–µ–Ω—Ç—Ä–∞–ª—å–Ω–∏–π –∞—Ç–æ–º –º–∞—î –Ω–∞–≤–∫–æ–ª–æ, –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ 8, 6, 4 —Å—É—Å—ñ–¥–Ω—ñ—Ö, –∑–≤’—è–∑–∞–Ω–∏—Ö –∑ –Ω–∏–º –∞—Ç–æ–º–∞.
–Ý–æ–∑–º—ñ—Ä –º–æ–ª–µ–∫—É–ª —Ç–∞–∫–æ–∂ –≤–ø–ª–∏–≤–∞—î –Ω–∞ –ø—Ä–æ—Ü–µ—Å –∫—Ä–∏—Å—Ç–∞–ª—ñ–∑–∞—Ü—ñ—ó. –ù–µ–≤–µ–ª–∏–∫–∏–º –º–æ–ª–µ–∫—É–ª–∞–º, –æ—á–µ–≤–∏–¥–Ω–æ, –ª–µ–≥—à–µ –≤–∏—à–∏–∫—É–≤–∞—Ç–∏—Å—è –≤ —É–ø–æ—Ä—è–¥–∫–æ–≤–∞–Ω—ñ —Å—Ç—Ä—É–∫—Ç—É—Ä–∏ – –≤ —Å–≤–æ—î–º—É —Ä—É—Å—ñ –≤–æ–Ω–∏ –º–µ–Ω—à–µ –∑–∞–≤–∞–∂–∞—é—Ç—å –æ–¥–Ω–∞ –æ–¥–Ω—ñ–π —ñ —Ç–æ–º—É –±—ñ–ª—å—à —Ä—É—Ö–ª–∏–≤—ñ. –û—Å—å —á–æ–º—É –¥–ª—è –Ω–∏–∑—å–∫–æ–º–æ–ª–µ–∫—É–ª—è—Ä–Ω–∏—Ö —Å–ø–æ–ª—É–∫ –∞–º–æ—Ä—Ñ–Ω–∏–π —Å—Ç–∞–Ω –Ω–µ —î —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–∏–º. –Ü–Ω—à–∞ —Ä—ñ—á – –≤–∏—Å–æ–∫–æ–º–æ–ª–µ–∫—É–ª—è—Ä–Ω—ñ —Å–ø–æ–ª—É–∫–∏. –ó–≤–∏—á–∞–π–Ω–æ, —ñ —ó—Ö –º–æ–ª–µ–∫—É–ª–∞–º –≤–ª–∞—Å—Ç–∏–≤–∞ —Ç–µ–Ω–¥–µ–Ω—Ü—ñ—è –¥–æ –º—ñ–Ω—ñ–º—É–º—É –µ–Ω–µ—Ä–≥—ñ—ó, –¥–æ –≤–ø–æ—Ä—è–¥–∫—É–≤–∞–Ω–Ω—è, –∞–ª–µ –≤–æ–Ω–∏ —á–∞—Å—Ç–æ –º–∞—é—Ç—å –Ω–∞—Å—Ç—ñ–ª—å–∫–∏ —Ö–∏–º–µ—Ä–Ω–æ —ñ –ø–æ-—Ä—ñ–∑–Ω–æ–º—É –≤–∏–≥–Ω—É—Ç—ñ —Ñ–æ—Ä–º–∏, —â–æ –Ω–µ –≤ –∑–º–æ–∑—ñ —É—Ç–≤–æ—Ä–∏—Ç–∏ —á—ñ—Ç–∫—É –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—É —Ä–µ—à—ñ—Ç–∫—É.
–ù–∞–ø—Ä–∏–∫–ª–∞–¥, –º–æ–ª–µ–∫—É–ª–∏ —á–µ—Ä–≤–æ–Ω–æ–≥–æ —Ñ–æ—Å—Ñ–æ—Ä—É –º–∞—é—Ç—å –ø–æ–ª—ñ–º–µ—Ä–Ω—É —Å—Ç—Ä—É–∫—Ç—É—Ä—É, –∞ –º–æ–ª–µ–∫—É–ª–∏ –±—ñ–ª–æ–≥–æ —Ñ–æ—Å—Ñ–æ—Ä—É —Å–∫–ª–∞–¥–∞—é—Ç—å—Å—è –≤—Å—å–æ–≥–æ –∑ —á–æ—Ç–∏—Ä—å–æ—Ö –∞—Ç–æ–º—ñ–≤, –æ—Ä—ñ—î–Ω—Ç–æ–≤–∞–Ω–∏—Ö –≤ –≤–µ—Ä—à–∏–Ω–∞—Ö —Ç–µ—Ç—Ä–∞–µ–¥—Ä–∞. –¢–æ–º—É —á–µ—Ä–≤–æ–Ω–∏–π —Ñ–æ—Å—Ñ–æ—Ä – –∞–º–æ—Ä—Ñ–Ω–∞ —Ä–µ—á–æ–≤–∏–Ω–∞, —Ç–æ–¥—ñ —è–∫ –±—ñ–ª–∏–π —Ñ–æ—Å—Ñ–æ—Ä –ª–µ–≥–∫–æ –∫—Ä–∏—Å—Ç–∞–ª—ñ–∑—É—î—Ç—å—Å—è.
–Ý—ñ–¥–∫–∏–π –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏–π —Å—Ç–∞–Ω
–ß–∏–º –º—ñ—Ü–Ω—ñ—à–µ –∑—á–µ–ø–ª–µ–Ω—ñ –æ–¥–∏–Ω –∑ –æ–¥–Ω–∏–º –º–æ–ª–µ–∫—É–ª–∏ (–∞–±–æ –∞—Ç–æ–º–∏, –∞–±–æ —ñ–æ–Ω–∏) –≤ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—ñ–π —Ä–µ—à—ñ—Ç—Ü—ñ, —Ç–∏–º, –≤–∞–∂—á–µ —Ç–∞–∫–∏–π –∫—Ä–∏—Å—Ç–∞–ª –ø–µ—Ä–µ–≤–µ—Å—Ç–∏ –≤ —Ä—ñ–¥–∏–Ω—É —à–ª—è—Ö–æ–º –Ω–∞–≥—Ä—ñ–≤–∞–Ω–Ω—è. –í—ñ–∑—å–º–µ–º–æ –¥–ª—è –ø—Ä–∏–∫–ª–∞–¥—É –∫—Ä–∏—Å—Ç–∞–ª–∏, –ø–æ–±—É–¥–æ–≤–∞–Ω—ñ –∑ —ñ–æ–Ω—ñ–≤. –°–∏–ª–∏ –≤–∑–∞—î–º–æ–¥—ñ—ó –º—ñ–∂ –Ω–∏–º–∏ –Ω–æ—Å—è—Ç—å –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–Ω–∏–π —Ö–∞—Ä–∞–∫—Ç–µ—Ä, –æ—Ç–∂–µ, –ø—Ä–æ–ø–æ—Ä—Ü—ñ–π–Ω—ñ –≤–µ–ª–∏—á–∏–Ω—ñ –≤–∑–∞—î–º–æ–¥—ñ—é—á–∏—Ö –∑–∞—Ä—è–¥—ñ–≤. –ú–æ–∂–Ω–∞ –æ—á—ñ–∫—É–≤–∞—Ç–∏, —â–æ –ø—Ä–∏ –æ–¥–Ω–æ–º—É —ñ —Ç–æ–º—É –∂ —Ç–∏–ø—ñ —Ä–µ—à—ñ—Ç–∫–∏ –±—ñ–ª—å—à —Ç—É–≥–æ–ø–ª–∞–≤–∫–∏–º–∏ –±—É–¥—É—Ç—å —Ç—ñ —ñ–æ–Ω–Ω—ñ —Å–ø–æ–ª—É–∫–∏, —É —è–∫–∏—Ö –∑–∞—Ä—è–¥–∏ —ñ–æ–Ω—ñ–≤ –≤–∏—â–µ. –¢–∞–∫ –≤–æ–Ω–æ —ñ —î. –°–∫–∞–∂—ñ–º–æ, –±–µ—Ä–∏–ª—ñ–π —Ñ–ª—É–æ—Ä–∏–¥ (–∑–∞—Ä—è–¥–∏ —ñ–æ–Ω—ñ–≤ —Ñ–ª—É–æ—Ä—É —ñ –±–µ—Ä–∏–ª—ñ—é –¥–æ—Ä—ñ–≤–Ω—é—é—Ç—å –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ 1- —ñ 2+) –ø–ª–∞–≤–∏—Ç—å—Å—è –ø—Ä–∏ 821*–°, –∞ —Å—ñ–ª—ñ—Ü—ñ–π(IV) –æ–∫—Å–∏–¥, —â–æ —É—Ç–≤–æ—Ä—é—î —Ä–µ—à—ñ—Ç–∫—É —Ü—å–æ–≥–æ –∂ —Ç–∏–ø—É (–∑–∞—Ä—è–¥–∏ —ñ–æ–Ω—ñ–≤ –æ–∫—Å–∏–≥–µ–Ω—É —ñ —Å—ñ–ª—ñ—Ü—ñ—é 2- —ñ 4+) –º–∞—é—Ç—å —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –ø–ª–∞–≤–ª–µ–Ω–Ω—è 1723*–°. –Ø–∫ –≤–∏–¥–Ω–æ, –∑–±—ñ–ª—å—à–µ–Ω–Ω—è –∑–∞—Ä—è–¥—É —ñ–æ–Ω—ñ–≤ –≤–¥–≤—ñ—á—ñ –ø—Ä–∏–∑–≤–æ–¥–∏—Ç—å –¥–æ –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—è —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –ø–ª–∞–≤–ª–µ–Ω–Ω—è –Ω–∞ —Ç–∏—Å—è—á—É –≥—Ä–∞–¥—É—Å—ñ–≤ –∑–∞ –¶–µ–ª—å—Å—ñ—î–º. –ó–∞—Ä—è–¥ —ñ–æ–Ω–∞ —Ü–µ, –ª–∏—à–µ –æ–¥–∏–Ω –∑ —Ñ–∞–∫—Ç–æ—Ä—ñ–≤, —â–æ –≤–∏–∑–Ω–∞—á–∞—é—Ç—å —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –ø–ª–∞–≤–ª–µ–Ω–Ω—è.
–Ø–∫ –∑–º—ñ–Ω—é—é—Ç—å—Å—è —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –ø–ª–∞–≤–ª–µ–Ω–Ω—è –≤ —Ä—è–¥—É –≥—ñ–¥—Ä–æ–≥–µ–Ω–≥–∞–ª–æ–≥–µ–Ω—ñ–¥—ñ–≤ – –≤—ñ–¥ –≥—ñ–¥—Ä–æ–≥–µ–Ω —Ö–ª–æ—Ä–∏–¥—É –¥–æ –≥—ñ–¥—Ä–æ–≥–µ–Ω –π–æ–¥–∏–¥—É? –ü–æ-–ø–µ—Ä—à–µ, —Ç—É—Ç –∑—Ä–æ—Å—Ç–∞—é—Ç—å —Ä–æ–∑–º—ñ—Ä–∏ –∞—Ç–æ–º—ñ–≤ –≥–∞–ª–æ–≥–µ–Ω—ñ–≤ —ñ, –æ—Ç–∂–µ, –∑’—è–≤–ª—è—é—Ç—å—Å—è —Ä–µ–∑–µ—Ä–≤–∏ –¥–ª—è —Ä–æ–∑–º—ñ—â–µ–Ω–Ω—è –Ω–∞–≤–∫–æ–ª–æ —Å–µ–±–µ –±—ñ–ª—å—à–æ—ó –∫—ñ–ª—å–∫–æ—Å—Ç—ñ —Å—É—Å—ñ–¥–Ω—ñ—Ö –∞—Ç–æ–º—ñ–≤. –ë—ñ–ª—å—à–µ —Å—É—Å—ñ–¥—ñ–≤ – –±—ñ–ª—å—à–µ –∑–≤’—è–∑–∫—ñ–≤, –º—ñ—Ü–Ω—ñ—à–µ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∞ —Ä–µ—à—ñ—Ç–∫–∞. –ü–æ-–¥—Ä—É–≥–µ, –∑—Ä–æ—Å—Ç–∞—î —ñ –º—ñ—Ü–Ω—ñ—Å—Ç—å —Å–∞–º–∏—Ö –∑–≤’—è–∑–∫—ñ–≤ –º—ñ–∂ –≥—ñ–¥—Ä–æ–≥–µ–Ω–æ–º —ñ –≥–∞–ª–æ–≥–µ–Ω–æ–º, —Å—Ç—É–ø—ñ–Ω—å —ó—ó –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—ñ. –û–±–∏–¥–≤–∞ —Ü—ñ —á–∏–Ω–Ω–∏–∫–∏ –ø—Ä–∞—Ü—é—é—Ç—å –≤ –æ–¥–Ω–æ–º—É –Ω–∞–ø—Ä—è–º–∫—É. –ê–ª–µ –æ—Å—å —â–æ –¥–∏–≤–Ω–æ; –æ–¥–∏–Ω –∑ –≥—ñ–¥—Ä–æ–≥–µ–Ω–≥–∞–ª–æ–≥–µ–Ω–∏–¥—ñ–≤, –≥—ñ–¥—Ä–æ–≥–µ–Ω —Ñ–ª—É–æ—Ä–∏–¥, –∑ —Ü—å–æ–≥–æ —Ä—è–¥—É –≤–∏–ø–∞–¥–∞—î (–¥–∏–≤. –≥—Ä–∞—Ñ—ñ–∫); –≤—ñ–Ω –ø–ª–∞–≤–∏—Ç—å—Å—è –ø—Ä–∏ -83*–°, –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ –Ω–µ —Ç—ñ–ª—å–∫–∏ –±—ñ–ª—å—à –≤–∏—Å–æ–∫—ñ–π, –Ω—ñ–∂ –≥—ñ–¥—Ä–æ–≥–µ–Ω —Ö–ª–æ—Ä–∏–¥, –∞–ª–µ –Ω–∞–≤—ñ—Ç—å –≤–∏—â–æ—é, –Ω—ñ–∂ –≥—ñ–¥—Ä–æ–≥–µ–Ω –±—Ä–æ–º–∏–¥, —Ö–æ—á–∞, —Å—É–¥—è—á–∏ –∑ –ø—Ä–æ–¥–æ–≤–∂–µ–Ω–Ω—è –≥—Ä–∞—Ñ—ñ–∫–∞ (–ø—É–Ω–∫—Ç–∏—Ä–Ω–∞ –ª—ñ–Ω—ñ—è), –π–æ–≥–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –ø–ª–∞–≤–ª–µ–Ω–Ω—è –ø–æ–≤–∏–Ω–Ω–∞ –±—É—Ç–∏ –º—ñ–∂ -120*–° —ñ -150*–°.
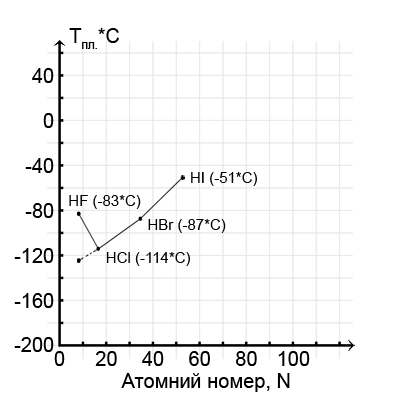
–°–µ–∫—Ä–µ—Ç —Ü—ñ—î—ó –∞–Ω–æ–º–∞–ª—ñ—ó –∫—Ä–∏—î—Ç—å—Å—è –≤–∂–µ –≤ –æ—Å–æ–±–ª–∏–≤–æ—Å—Ç—è—Ö –∑–≤’—è–∑–∫—ñ–≤ –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ —Ü—ñ—î—ó —Ä–µ—á–æ–≤–∏–Ω–∏: –≤–æ–Ω–∏ –æ–±’—î–¥–Ω—É—é—Ç—å—Å—è –ø–æ–ø–∞—Ä–Ω–æ, —Ç–∞–∫ —â–æ –≥—ñ–¥—Ä–æ–≥–µ–Ω —ñ–æ–Ω–∏ –æ–¥–Ω—ñ—î—ó –º–æ–ª–µ–∫—É–ª–∏ —É—Ç–≤–æ—Ä—é—é—Ç—å –∑ —ñ–æ–Ω–∞–º–∏ —Ñ–ª—É–æ—Ä—É —ñ–Ω—à–æ—ó –º–æ–ª–µ–∫—É–ª–∏ –æ—Å–æ–±–ª–∏–π —Ö—ñ–º—ñ—á–Ω–∏–π –∑–≤’—è–∑–æ–∫ – –≥—ñ–¥—Ä–æ–≥–µ–Ω–æ–≤–∏–π —Ö—ñ–º—ñ—á–Ω–∏–π –∑–≤’—è–∑–æ–∫. –Ü–æ–Ω –≥—ñ–¥—Ä–æ–≥–µ–Ω—É – —Ü–µ –ø—Ä–æ—Ç–æ–Ω, —è–∫–∏–π –∑–±–ª–∏–∂—É—é—á–∏—Å—å –∑ –µ–ª–µ–∫—Ç—Ä–æ–Ω–Ω–æ—é –æ–±–æ–ª–æ–Ω–∫–æ—é —ñ–æ–Ω–∞ —Ñ–ª—É–æ—Ä—É, –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–Ω–æ –ø—Ä–∏—Ç—è–≥—É—î—Ç—å—Å—è –Ω–µ—é. –Ü —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –¥–æ–¥–∞—Ç–∫–æ–≤–∏–π –∑–≤’—è–∑–æ–∫, —è–∫–∏–π –æ–±—É–º–æ–≤–ª—é—î –±—ñ–ª—å—à –≤–∏—Å–æ–∫–∏–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–Ω–∏–π –ø–µ—Ä–µ—Ö—ñ–¥ —Ä–µ—á–æ–≤–∏–Ω–∏ –∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å—Ç–∞–Ω—É –≤ —Ä—ñ–¥–∫–∏–π.
–î–µ—è–∫—ñ —Ç–≤–µ—Ä–¥—ñ —Ä–µ—á–æ–≤–∏–Ω–∏ –ø—Ä–∏ –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –ø–µ—Ä–µ—Ö–æ–¥—è—Ç—å –≤—ñ–¥—Ä–∞–∑—É –≤ –≥–∞–∑–æ–ø–æ–¥—ñ–±–Ω–∏–π —Å—Ç–∞–Ω, –º–∏–Ω–∞—é—á–∏ —Ä—ñ–¥–∫–∏–π —Å—Ç–∞–Ω. –ù–∞–ø—Ä–∏–∫–ª–∞–¥, –ø—Ä–∏ –Ω–æ—Ä–º–∞–ª—å–Ω–æ–º—É –∞—Ç–º–æ—Å—Ñ–µ—Ä–Ω–æ–º—É —Ç–∏—Å–∫—É –π–æ–¥ –Ω–µ –≤–¥–∞—î—Ç—å—Å—è –æ—Ç—Ä–∏–º–∞—Ç–∏ –≤ —Ä—ñ–¥–∫–æ–º—É —Å—Ç–∞–Ω—ñ – –≤—ñ–Ω –æ–¥—Ä–∞–∑—É –ø–µ—Ä–µ—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –≤ –≥–∞–∑. –ó–≤–∏—á–Ω—ñ —Å–Ω—ñ–≥ —ñ –ª—ñ–¥ –∑–∞ –∑–∏–º—É –≤–∏–ø–∞—Ä–æ–≤—É—é—Ç—å—Å—è –ø—Ä–∏–±–ª–∏–∑–Ω–æ –Ω–∞ —Ç—Ä–µ—Ç–∏–Ω—É –±–µ–∑ –ø–µ—Ä–µ—Ö–æ–¥—É –≤ —Ä—ñ–¥–∫–∏–π —Å—Ç–∞–Ω. –¢–∞–∫–æ–≥–æ —Ä–æ–¥—É –ø–µ—Ä–µ—Ö—ñ–¥ –æ—Ç—Ä–∏–º–∞–≤ –Ω–∞–∑–≤—É —Å—É–±–ª—ñ–º–∞—Ü—ñ—è.
–î—ñ–∞–ø–∞–∑–æ–Ω —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä, –ø—Ä–∏ —è–∫–æ–º—É —Ä–µ—á–æ–≤–∏–Ω–∞ –ø–µ—Ä–µ–±—É–≤–∞—î —É –≤–∏–≥–ª—è–¥—ñ —Ä—ñ–¥–∏–Ω–∏, –º–æ–∂–µ –±—É—Ç–∏ –Ω–∞–π—Ä—ñ–∑–Ω–æ–º–∞–Ω—ñ—Ç–Ω—ñ—à–∏–º. –ù–∞–ø—Ä–∏–∫–ª–∞–¥, —É –≥—ñ–¥—Ä–æ–≥–µ–Ω —Ü—ñ–∞–Ω—ñ–¥—É –≤—ñ–Ω —Å—Ç–∞–Ω–æ–≤–∏—Ç—å —Ç—Ä–æ—Ö–∏ –±—ñ–ª—å—à–µ 10*–° (—Ç–æ—á–∫–∞ –ø–ª–∞–≤–ª–µ–Ω–Ω—è -14*–°, —Ç–æ—á–∫–∞ –∫–∏–ø—ñ–Ω–Ω—è 25*–°). –ê –æ—Å—å –º–µ—Ç–∞–ª –≥–∞–ª—ñ–π –ø–ª–∞–≤–∏—Ç—å—Å—è –≤–∂–µ –Ω–∞ –¥–æ–ª–æ–Ω—ñ (–ø—Ä–∏ 28*–°), –∑–∞—Ç–µ –∫–∏–ø–∏—Ç—å –ø—Ä–∏ 2200*–°. –¢–∞–∫–∏–π –≤–µ–ª–∏—á–µ–∑–Ω–∏–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–Ω–∏–π —ñ–Ω—Ç–µ—Ä–≤–∞–ª —Ä—ñ–¥–∫–æ–≥–æ —Å—Ç–∞–Ω—É, –∑–≤–∏—á–∞–π–Ω–æ, –Ω–µ –∑–∞–ª–∏—à–∏–≤—Å—è –±–µ–∑ —É–≤–∞–≥–∏ —ñ–Ω–∂–µ–Ω–µ—Ä—ñ–≤ —ñ –∑–Ω–∞–π—à–æ–≤ –∑–∞—Å—Ç–æ—Å—É–≤–∞–Ω–Ω—è: –≥–∞–ª—ñ–π –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è –≤ —Ä—ñ–¥–∏–Ω–Ω–∏—Ö —Ç–µ—Ä–º–æ–º–µ—Ç—Ä–∞—Ö –¥–ª—è –≤–∏–º—ñ—Ä—é–≤–∞–Ω–Ω—è –≤–∏—Å–æ–∫–∏—Ö —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä. –ß–æ–º—É –∂ –≥–∞–ª—ñ–π –º–∞—î —Ç–∞–∫—É –Ω–∏–∑—å–∫—É —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –ø–ª–∞–≤–ª–µ–Ω–Ω—è, —Ç–∏–º –±—ñ–ª—å—à–µ —â–æ –π–æ–≥–æ —Å—É—Å—ñ–¥–∏ –ø–æ —Ç–∞–±–ª–∏—Ü—ñ –ú–µ–Ω–¥–µ–ª—î—î–≤–∞ – –∞–ª—é–º—ñ–Ω—ñ–π —ñ —ñ–Ω–¥—ñ–π – –ø–ª–∞–≤–ª—è—Ç—å—Å—è –ø—Ä–∏ –±—ñ–ª—å—à –≤–∏—Å–æ–∫–∏—Ö —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞—Ö? –ó—è—Å—É–≤–∞–ª–æ—Å—è, —â–æ –≥–∞–ª—ñ–π —É—Ç–≤–æ—Ä—é—î –º–æ–ª–µ–∫—É–ª—è—Ä–Ω—É —Ä–µ—à—ñ—Ç–∫—É, –≤ –≤—É–∑–ª–∞—Ö —è–∫–æ—ó –∑–Ω–∞—Ö–æ–¥—è—Ç—å—Å—è –º–æ–ª–µ–∫—É–ª–∏ Ga2, –≤ —Ç–æ–π —á–∞—Å —è–∫ —É –π–æ–≥–æ –≤–∏—â–µ–∑–∞–∑–Ω–∞—á–µ–Ω–∏—Ö —Å—É—Å—ñ–¥—ñ–≤ –≤ –≤—É–∑–ª–∞—Ö —Ä–µ—à—ñ—Ç–∫–∏ –∑–Ω–∞—Ö–æ–¥—è—Ç—å—Å—è –∞–±–æ —ñ–æ–Ω–∏, –∞–±–æ –∞—Ç–æ–º–∏ –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ–≥–æ –º–µ—Ç–∞–ª—É. –ú—ñ—Ü–Ω—ñ—Å—Ç—å –∑–≤’—è–∑–∫—ñ–≤ –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ –≥–∞–ª—ñ—é –≤–∏–∑–Ω–∞—á–∞—î—Ç—å—Å—è —Ç—ñ–ª—å–∫–∏ –≤—ñ–¥–Ω–æ—Å–Ω–æ —Å–ª–∞–±–∫–æ—é –º—ñ–∂–º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ—é –≤–∑–∞—î–º–æ–¥—ñ—î—é, —Ç–æ–¥—ñ —è–∫ –º—ñ–∂ —ñ–æ–Ω–∞–º–∏ – –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–Ω–æ—é, –∞ –º—ñ–∂ –∞—Ç–æ–º–∞–º–∏ – —ñ–æ–Ω–Ω–æ-–∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–æ—é –≤–∑–∞—î–º–æ–¥—ñ—î—é; –æ–±–∏–¥–≤–∞ –≤–∏–¥–∏ –≤–∑–∞—î–º–æ–¥—ñ—ó —É—Ç–≤–æ—Ä—é—é—Ç—å –±—ñ–ª—å—à –º—ñ—Ü–Ω—ñ –∑–≤’—è–∑–∫–∏. –¢–æ–º—É –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∞ —Ä–µ—à—ñ—Ç–∫–∞ –≥–∞–ª—ñ—é –ª–µ–≥—à–µ —Ä—É–π–Ω—É—î—Ç—å—Å—è, –Ω—ñ–∂ –∞–Ω–∞–ª–æ–≥—ñ—á–Ω—ñ —É –∞–ª—é–º—ñ–Ω—ñ—é —Ç–∞ —ñ–Ω–¥—ñ—é.
–ü—Ä–∏—Ä–æ–¥–∞ –ø–µ—Ä–µ–¥–±–∞—á–∏–ª–∞ –≤ —Å–≤–æ—ó—Ö —Ç–≤–æ—Ä—ñ–Ω–Ω—è—Ö —â–µ –æ–¥–∏–Ω, –≤–µ–ª—å–º–∏ —Ü—ñ–∫–∞–≤–∏–π –≤–∞—Ä—ñ–∞–Ω—Ç –º—ñ–∂–º–æ–ª–µ–∫—É–ª—è—Ä–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤. –£—è–≤—ñ—Ç—å –¥–æ–≤–≥—É –æ—Ä–≥–∞–Ω—ñ—á–Ω—É –º–æ–ª–µ–∫—É–ª—É, –±—É–¥–æ–≤–∞ —è–∫–æ—ó —î —Ç–∞–∫–æ—é, —â–æ –∫—ñ–Ω—Ü–µ–≤—ñ —ó—ó –≥—Ä—É–ø–∏ –∑–¥–∞—Ç–Ω—ñ –ª–∏—à–µ –¥–æ —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –¥—É–∂–µ —Å–ª–∞–±–∫–∏—Ö –∑–≤’—è–∑–∫—ñ–≤, –∞ –±—ñ—á–Ω—ñ – –¥–æ –∑–Ω–∞—á–Ω–æ —Å–∏–ª—å–Ω—ñ—à–∏—Ö. –¢–æ–¥—ñ –º–æ–∂–Ω–∞ –±—É–¥–µ –æ—á—ñ–∫—É–≤–∞—Ç–∏, —â–æ –ø—Ä–∏ –ø–ª–∞–≤–ª–µ–Ω–Ω—ñ —Ä–µ—á–æ–≤–∏–Ω–∏ —É—Ç–≤–æ—Ä–µ–Ω–æ—ó –∑ —Ç–∞–∫–∏—Ö –º–æ–ª–µ–∫—É–ª —Å–ø–æ—á–∞—Ç–∫—É –Ω–∞—Å—Ç–∞–Ω–µ —Ç–∞–∫–∏–π –º–æ–º–µ–Ω—Ç, –∫–æ–ª–∏ –±—ñ—á–Ω—ñ –∑–≤’—è–∑–∫–∏ –±—É–¥—É—Ç—å —â–µ –¥–æ—Å–∏—Ç—å –º—ñ—Ü–Ω–æ —É—Ç—Ä–∏–º—É–≤–∞—Ç–∏ –º–æ–ª–µ–∫—É–ª–∏ –≤ —î–¥–∏–Ω–æ–º—É –∞–Ω—Å–∞–º–±–ª—ñ, –∞ –∫—ñ–Ω—Ü–µ–≤—ñ –∑–≤’—è–∑–∫–∏ –±—É–¥—É—Ç—å —Ä–æ–∑—ñ—Ä–≤–∞–Ω—ñ. –í–∏–π–¥–µ —â–æ—Å—å –Ω–∞ –∑—Ä–∞–∑–æ–∫ –ø–∞—Ä–∞–ª–µ–ª—å–Ω–æ —Ä–æ–∑—Ç–∞—à–æ–≤–∞–Ω–∏—Ö –∫–æ—Ä–æ–±–æ–∫, —â—ñ–ª—å–Ω–æ –∑–∞–ø–æ–≤–Ω–µ–Ω–∏—Ö –æ–ª—ñ–≤—Ü—è–º–∏, –ø—Ä–∏—á–æ–º—É —Å–∞–º—ñ “–∫–æ—Ä–æ–±–∫–∏” –º–æ–∂—É—Ç—å –ø–µ—Ä–µ–º—ñ—â—É–≤–∞—Ç–∏—Å—è –æ–¥–Ω–∞ –≤—ñ–¥–Ω–æ—Å–Ω–æ –æ–¥–Ω–æ—ó, –∞ “–æ–ª—ñ–≤—Ü—ñ” –Ω–µ –º–æ–∂—É—Ç—å —Ä–æ–∑’—î–¥–Ω–∞—Ç–∏—Å—è (–¥–∏–≤. –º–∞–ª—é–Ω–æ–∫).
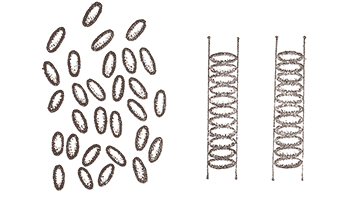
–Ý–µ—á–æ–≤–∏–Ω–∞ –≤ —Ç–∞–∫–æ–º—É —Å—Ç–∞–Ω—ñ –±—É–¥–µ –ø—Ä–æ—è–≤–ª—è—Ç–∏ —è–∫ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—ñ —Ä—ñ–¥–∏–Ω–∏, —Ç–∞–∫ —ñ –¥–µ—è–∫—ñ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—ñ –∫—Ä–∏—Å—Ç–∞–ª–∞ (–∑–æ–∫—Ä–µ–º–∞, –º–∞—Ç–∏–º–µ —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω—É –¥–ª—è —Ä—ñ–¥–∏–Ω–∏ –ø–ª–∏–Ω–Ω—ñ—Å—Ç—å —ñ —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω—É –¥–ª—è –∫—Ä–∏—Å—Ç–∞–ª—ñ–≤ —Å—Ç—ñ–π–∫—ñ—Å—Ç—å –∑–∞ —Ä—ñ–∑–Ω–∏–º–∏ –Ω–∞–ø—Ä—è–º–∫–∞–º–∏ – –∞–Ω—ñ–∑–æ—Ç—Ä–æ–ø—ñ—è). –¢–∞–∫–∞ —Ä–µ—á–æ–≤–∏–Ω–∞ –Ω–∞–∑–∏–≤–∞—î—Ç—å—Å—è —Ä—ñ–¥–∫–∏–π –∫—Ä–∏—Å—Ç–∞–ª. –í–ø–µ—Ä—à–µ –π–æ–≥–æ —Å–ø–æ—Å—Ç–µ—Ä—ñ–≥–∞–≤ –≤ 1888 —Ä –∞–≤—Å—Ç—Ä—ñ–π—Å—å–∫–∏–π —Ö—ñ–º—ñ–∫ –§. –Ý–µ–π–Ω–∏—Ç—Ü–µ—Ä –Ω–∞ –ø—Ä–∏–∫–ª–∞–¥—ñ —Ö–æ–ª–µ—Å—Ç–µ—Ä–∏–ª–±–µ–Ω–∑–æ–∞—Ç—É. –ó’—è—Å—É–≤–∞–ª–æ—Å—è, —â–æ –ø—Ä–∏ 145*–°, –≤ –º–æ–º–µ–Ω—Ç –ø–ª–∞–≤–ª–µ–Ω–Ω—è —Ü—ñ—î—ó —Å–ø–æ–ª—É–∫–∏, —Å–ø–æ—á–∞—Ç–∫—É —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –∫–∞–ª–∞–º—É—Ç–Ω–∞ —Ä—ñ–¥–∏–Ω–∞, —è–∫–∞ –ø—Ä–æ—è–≤–ª—è—î –≤—Å—ñ –≤–∏—â–µ–∑–≥–∞–¥–∞–Ω—ñ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—ñ —Ä—ñ–¥–∫–æ–≥–æ –∫—Ä–∏—Å—Ç–∞–ª–∞, —ñ –ª–∏—à–µ –ø—Ä–∏ 179*–°, —Ä–æ–∑–ø–ª–∞–≤ —Å—Ç–∞—î –∞–±—Å–æ–ª—é—Ç–Ω–æ –ø—Ä–æ–∑–æ—Ä–∏–º —ñ –ø–æ–≤–æ–¥–∏—Ç—å—Å—è, —è–∫ –∑–≤–∏—á–∞–π–Ω–∞ —Ä—ñ–¥–∏–Ω–∞.
–û–±–ª–∞—Å—Ç—å —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä, –ø—Ä–∏ —è–∫—ñ–π —Ä–µ–∞–ª—ñ–∑—É—î—Ç—å—Å—è —Ä—ñ–¥–∫–æ–∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∏–π —Å—Ç–∞–Ω, –æ—Ç—Ä–∏–º–∞–ª–∞ –Ω–∞–∑–≤—É –º–µ–∑–æ–ø–∞—É–∑–∞: —É —Ö–æ–ª–µ—Å—Ç–µ—Ä–∏–ª–±–µ–Ω–∑–æ–∞—Ç—É –º–µ–∑–æ–ø–∞—É–∑–∞, —Å—Ç–∞–Ω–æ–≤–∏—Ç—å 34*–°. –í—ñ–¥–æ–º–æ –ø–æ–Ω–∞–¥ —Ç—Ä–∏ —Ç–∏—Å—è—á—ñ –ø–æ–¥—ñ–±–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω, –ø—Ä–∏—á–æ–º—É –∑ –º–µ–∑–æ–ø–∞—É–∑–∞–º–∏ –≤—ñ–¥ 0,01 –¥–æ 100*–° —ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–æ—é –ø–ª–∞–≤–ª–µ–Ω–Ω—è –≤—ñ–¥ -20* –¥–æ 400*–°.
–î–æ–±—Ä–µ –≤—ñ–¥–æ–º–æ, —â–æ —Ä—ñ–¥–∏–Ω–∏ –º–∞–π–∂–µ –Ω–µ —Å—Ç–∏—Å–∫–∞—é—Ç—å—Å—è. –Ø–∫—â–æ –≤–æ–¥—É –Ω–∞–ª–∏—Ç–∏ –≤ –¥–æ—Å–∏—Ç—å –º—ñ—Ü–Ω–∏–π —Ü–∏–ª—ñ–Ω–¥—Ä–∏—á–Ω–∏–π —Å—Ç–∞–∫–∞–Ω —ñ —Å—Ç–∏—Å–∫–∞—Ç–∏ –ø–æ—Ä—à–Ω–µ–º, –±–∞–∂–∞—é—á–∏ –∑–º–µ–Ω—à–∏—Ç–∏ —ó—ó –æ–±’—î–º, —Å–∫–∞–∂—ñ–º–æ, –Ω–∞ –æ–¥–Ω—É –¥–µ—Å—è—Ç—É –≤–¥ –ø–æ—á–∞—Ç–∫–æ–≤–æ–≥–æ, —Ç–æ –¥–ª—è —Ü—å–æ–≥–æ –¥–æ–≤–µ–¥–µ—Ç—å—Å—è –¥–æ–∫–ª–∞—Å—Ç–∏ –≤–µ–ª–∏—á–µ–∑–Ω–∏–π —Ç–∏—Å–∫ – –±–ª–∏–∑—å–∫–æ —á–æ—Ç–∏—Ä—å–æ—Ö —Ç–∏—Å—è—á –∞—Ç–º–æ—Å—Ñ–µ—Ä. –¶–µ –≤—Å—å–æ–≥–æ –ª–∏—à–µ –≤ –¥–≤–∞ —Ä–∞–∑–∏ –º–µ–Ω—à–µ, –Ω—ñ–∂ –≤ —Ç–æ–º—É –≤–∏–ø–∞–¥–∫—É, —è–∫—â–æ –± –∑–∞–º—ñ—Å—Ç—å –≤–æ–¥–∏ –≤ —Å–∫–ª—è–Ω—Ü—ñ –ø–µ—Ä–µ–±—É–≤–∞–≤ –ª—ñ–¥. –ó–æ–≤—Å—ñ–º —ñ–Ω–∞–∫—à–∞ —Å–ø—Ä–∞–≤–∞, —è–∫—â–æ –± –≤ —Å–∫–ª—è–Ω—Ü—ñ –±—É–≤ –≤–æ–¥—è–Ω–∏–π –ø–∞—Ä –ø—Ä–∏ –Ω–æ—Ä–º–∞–ª—å–Ω–æ–º—É –∞—Ç–º–æ—Å—Ñ–µ—Ä–Ω–æ–º—É —Ç–∏—Å–∫—É: —Ç–æ–¥—ñ –¥–ª—è –∑–º–µ–Ω—à–µ–Ω–Ω—è –π–æ–≥–æ –æ–±’—î–º—É –Ω–∞ –æ–¥–Ω—É –¥–µ—Å—è—Ç—É —Ç–∏—Å–∫ –ø–æ—Ç—Ä—ñ–±–Ω–æ –±—É–ª–æ –± –∑–±—ñ–ª—å—à–∏—Ç–∏ –ø—Ä–∏–±–ª–∏–∑–Ω–æ –≤ —Ç—ñ–π –∂–µ –º—ñ—Ä—ñ – –Ω–∞ –¥–µ—Å—è—Ç—å –≤—ñ–¥—Å–æ—Ç–∫—ñ–≤.
–û–ø–∏—Å–∞–Ω–∏–π —É—è–≤–Ω–∏–π –µ–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç –ø–æ–∫–∞–∑—É—î, —è–∫ –±–ª–∏–∑—å–∫–æ —Ä–æ–∑—Ç–∞—à–æ–≤—É—é—Ç—å—Å—è –º–æ–ª–µ–∫—É–ª–∏ —Ä—ñ–¥–∏–Ω–∏. –¶—ñ–∫–∞–≤–æ, —â–æ –±–ª–∏–∑—å–∫–µ –æ—Ç–æ—á–µ–Ω–Ω—è –∫–æ–∂–Ω–æ—ó –º–æ–ª–µ–∫—É–ª–∏ –ø—Ä–æ—Ç—è–≥–æ–º –ø–µ–≤–Ω–æ—ó –º–∏—Ç—ñ, –¥—É–∂–µ –º–∞–ª–æ–≥–æ –ø—Ä–æ–º—ñ–∂–∫—É —á–∞—Å—É —Å—Ç–∞—î –Ω–∞—Å—Ç—ñ–ª—å–∫–∏ –∂ –≤–ø–æ—Ä—è–¥–∫–æ–≤–∞–Ω–∏–º, —è–∫ —ñ –≤ —Ç–≤–µ—Ä–¥–∏—Ö —Ç—ñ–ª–∞—Ö. –ú–∏—Ç—å – —ñ —Ü—è —Å—Ç—Ä—É–Ω–∫—ñ—Å—Ç—å –∑—Ä—É–π–Ω–æ–≤–∞–Ω–∞, —ñ –º–æ–ª–µ–∫—É–ª–∞ –Ω–∞ —è–∫–∏–π—Å—å —á–∞—Å —É—Ç–≤–æ—Ä—é—î –≤–ø–æ—Ä—è–¥–∫–æ–≤–∞–Ω—É —Å—Ç—Ä—É–∫—Ç—É—Ä—É –∑ —ñ–Ω—à–∏–º–∏ –º–æ–ª–µ–∫—É–ª–∞–º–∏… –¢–∞–∫–∞ —Å–≤–æ—î—Ä—ñ–¥–Ω–∞ –æ—Ä–≥–∞–Ω—ñ–∑–æ–≤–∞–Ω—ñ—Å—Ç—å, —è–∫–∞ –ø—Ä–æ—Å—Ç–µ–∂—É—î—Ç—å—Å—è –≤ –¥–µ—è–∫–æ–º—É –º–∞–ª–æ–º—É —Å–∫—É–ø—á–µ–Ω–Ω—ñ –º–æ–ª–µ–∫—É–ª –Ω–∞ –¥–µ—è–∫–æ–º—É –º–∞–ª–æ–º—É –ø—Ä–æ–º—ñ–∂–∫—É —á–∞—Å—É, –Ω–∞–∑–∏–≤–∞—î—Ç—å—Å—è –±–ª–∏–∂–Ω—ñ–π –ø–æ—Ä—è–¥–æ–∫. –í—ñ–Ω —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–∏–π –¥–ª—è —Ä—ñ–¥–∏–Ω —ñ –∑–∞–±–µ–∑–ø–µ—á—É—é—á–∏ —ó—Ö –ø–ª–∏–Ω–Ω—ñ—Å—Ç—å. –¢–≤–µ—Ä–¥–∏–º –∞–º–æ—Ä—Ñ–Ω–∏–º —Ç—ñ–ª–∞–º —Ç–∞–∫–æ–∂ –ø—Ä–∏—Ç–∞–º–∞–Ω–Ω–∏–π –±–ª–∏–∂–Ω—ñ–π –ø–æ—Ä—è–¥–æ–∫ –≤ —Å–ø—ñ–≤—Ä–æ–∑—Ç–∞—à—É–≤–∞–Ω–Ω—ñ —á–∞—Å—Ç–∏–Ω–æ–∫ – –∑—Ä–æ–∑—É–º—ñ–ª–æ, –±—ñ–ª—å—à —Å—Ç—ñ–π–∫–∏–π –≤ —á–∞—Å—ñ.
–ö–æ—Ä–∏—Å—Ç—É—é—á–∏—Å—å –Ω–æ–≤–∏–º —Ç–µ—Ä–º—ñ–Ω–æ–º, –º–∏ –º–æ–∂–µ–º–æ –±—ñ–ª—å—à –∑–∞–≥–∞–ª—å–Ω–æ –≤–∏–∑–Ω–∞—á–∏—Ç–∏ –ø–æ–Ω—è—Ç—Ç—è —Ä—ñ–¥–∫–æ–≥–æ –∫—Ä–∏—Å—Ç–∞–ª–∞: —è–∫ —ñ –≤ —Ä—ñ–¥–∏–Ω–∞—Ö, —Ä–æ–∑—Ç–∞—à—É–≤–∞–Ω–Ω—è –π–æ–≥–æ –º–æ–ª–µ–∫—É–ª –ø—ñ–¥–ø–æ—Ä—è–¥–∫–æ–≤–∞–Ω–µ –ª–∏—à–µ –±–ª–∏–∂–Ω—å–æ–≥–æ –ø–æ—Ä—è–¥–∫—É, –ø—Ä–æ—Ç–µ –≤ –æ—Ä—ñ—î–Ω—Ç–∞—Ü—ñ—ó –æ—Å–µ–π —Å–∏–º–µ—Ç—Ä—ñ—ó –º–æ–ª–µ–∫—É–ª —î –¥–∞–ª—å–Ω—ñ–π –ø–æ—Ä—è–¥–æ–∫, —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–∏–π –¥–ª—è –∫—Ä–∏—Å—Ç–∞–ª—ñ–≤.
–û—Ä—ñ—î–Ω—Ç—É–≤–∞—Ç–∏ –æ—Å—ñ –º–æ–ª–µ–∫—É–ª –º–æ–∂–Ω–∞, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏–º –ø–æ–ª–µ–º. –°–∞–º–µ —Ü—é –≤–ª–∞—Å—Ç–∏–≤—ñ—Å—Ç—å –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—é—Ç—å —â–æ–± –∫–µ—Ä—É–≤–∞—Ç–∏ –∑–æ–±—Ä–∞–∂–µ–Ω–Ω—è–º –Ω–∞ —Ä—ñ–¥–∫–æ–∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–∏—Ö –¥–∏—Å–ø–ª–µ—è—Ö.
–®–≤–∏–¥–∫—ñ—Å—Ç—å –≤—ñ–ª—å–Ω–æ–≥–æ –ø–µ—Ä–µ–º—ñ—â–µ–Ω–Ω—è —á–∞—Å—Ç–∏–Ω–æ–∫ —Ä—ñ–¥–∏–Ω–∏ –Ω–µ –∑–∞–ª–µ–∂–∏—Ç—å –≤—ñ–¥ —Ç–∏—Å–∫—É —ñ –≤–∏–∑–Ω–∞—á–∞—î—Ç—å—Å—è –ª–∏—à–µ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–æ—é. –û—Å—å —á–æ–º—É, —Å—Ç–∏—Å–∫–∞—é—á–∏ —Ä—ñ–¥–∏–Ω—É, –Ω–µ –≤–¥–∞—î—Ç—å—Å—è –∑–∞—Ñ—ñ–∫—Å—É–≤–∞—Ç–∏ —ó—ó –º–æ–ª–µ–∫—É–ª–∏ –Ω–∞ –ø–µ–≤–Ω–∏—Ö –º—ñ—Å—Ü—è—Ö —ñ —Ç–∏–º —Å–∞–º–∏–º –ø–µ—Ä–µ—Ç–≤–æ—Ä–∏—Ç–∏ —ó—ó –≤ —Ç–≤–µ—Ä–¥–µ —Ç—ñ–ª–æ. –û–¥–Ω–æ–º—É –ª–∏—à–µ —Ç–∏—Å–∫—É –±–µ–∑ –¥–æ–ø–æ–º–æ–≥–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ —Ç–∞–∫–µ –∑–∞–≤–¥–∞–Ω–Ω—è –Ω–µ –ø—ñ–¥ —Å–∏–ª—É – –≤ –π–æ–≥–æ —Å–∏–ª–∞—Ö –ª–∏—à–µ —Ç—Ä—ñ—à–∫–∏ –ø–æ—Ç—ñ—Å–Ω–∏—Ç–∏ –º–æ–ª–µ–∫—É–ª–∏, –∞–ª–µ –∞–∂ –Ω—ñ—è–∫ –Ω–µ –∑—ñ–±—Ä–∞—Ç–∏ —ó—Ö –≤ —É–ø–æ—Ä—è–¥–∫–æ–≤–∞–Ω–∏–π –∞–Ω—Å–∞–º–±–ª—å.
–Ü–Ω—à–∞ —Å–ø—Ä–∞–≤–∞ –≥–∞–∑, —è–∫–∏–π –ø—Ä–∏ –¥–æ—Å–∏—Ç—å –Ω–∏–∑—å–∫—ñ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ, –±–µ–∑ –±—É–¥—å-—è–∫–æ–≥–æ —ó—ó –ø–æ–¥–∞–ª—å—à–æ–≥–æ –∑–Ω–∏–∂–µ–Ω–Ω—è, –æ–¥–Ω–∏–º –ª–∏—à–µ –Ω–∞—Ä–æ—â—É–≤–∞–Ω–Ω—è–º —Ç–∏—Å–∫—É –º–æ–∂–Ω–∞ –ø–µ—Ä–µ—Ç–≤–æ—Ä–∏—Ç–∏ –≤ —Ä—ñ–¥–∏–Ω—É. –í—ñ–¥—Ä—ñ–∑–Ω—è—î—Ç—å—Å—è –≤ —Ü—å–æ–º—É –≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ —Ä—ñ–¥–∏–Ω–∞ —ñ –≤—ñ–¥ —Ç–≤–µ—Ä–¥–æ–≥–æ —Ç—ñ–ª–∞: –≤ –Ω—å–æ–º—É –ø—ñ–¥ –¥—ñ—î—é –≤–∏—Å–æ–∫–æ–≥–æ —Ç–∏—Å–∫—É –º–æ–∂–µ —Å—Ç–∞—Ç–∏—Å—è —Ä—É–π–Ω—É–≤–∞–Ω–Ω—è –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏. –ù–∞–ø—Ä–∏–∫–ª–∞–¥, –ø—ñ–¥ –¥—ñ—î—é —Ç–∏—Å–∫—É –≤ –¥–µ—Å—è—Ç–∫–∏ —Ç–∏—Å—è—á –∞—Ç–º–æ—Å—Ñ–µ—Ä –∑–≤–∏—á–∞–π–Ω–∏–π –ª—ñ–¥ –Ω–∞–±—É–≤–∞—î –∑–¥–∞—Ç–Ω–æ—Å—Ç—ñ –ø–ª–∞–≤–∏—Ç–∏—Å—è –ª–∏—à–µ –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ 85*–° (—Ç–∞–∫ –∑–≤–∞–Ω–∏–π –≥–∞—Ä—è—á–∏–π –ª—ñ–¥), –∞ –º’—è–∫–∏–π –≥—Ä–∞—Ñ—ñ—Ç –ø–µ—Ä–µ—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –≤ –∞–ª–º–∞–∑.
–í–∞–∂–ª–∏–≤–∏–π —Ç–µ—Ä–º—ñ–Ω: —Ñ–∞–∑–æ–≤–∏–π –ø–µ—Ä–µ—Ö—ñ–¥. –î–æ —Ñ–∞–∑–æ–≤–∏—Ö –ø–µ—Ä–µ—Ö–æ–¥—ñ–≤ –≤—ñ–¥–Ω–æ—Å—è—Ç—å—Å—è —ñ –∑–º—ñ–Ω–∏ –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–≥–æ —Å—Ç–∞–Ω—É —Ä–µ—á–æ–≤–∏–Ω–∏ —ñ –ø–µ—Ä–µ–±—É–¥–æ–≤–∏ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏ —Ç–≤–µ—Ä–¥–æ–≥–æ —Ç—ñ–ª–∞. –í—Å–µ —Ü–µ – —Ñ–∞–∑–æ–≤—ñ –ø–µ—Ä–µ—Ö–æ–¥–∏ –ø–µ—Ä—à–æ–≥–æ —Ä–æ–¥—É. –Ñ —â–µ —ñ —Ñ–∞–∑–æ–≤—ñ –ø–µ—Ä–µ—Ö–æ–¥–∏ –¥—Ä—É–≥–æ–≥–æ —Ä–æ–¥—É. –Ø—Å–∫—Ä–∞–≤–∏–π —ó—Ö –ø—Ä–∏–∫–ª–∞–¥, –≤ –∫—ñ–Ω—Ü—ñ —Ç—Ä–∏–¥—Ü—è—Ç–∏—Ö —Ä–æ–∫—ñ–≤ 20 —Å—Ç–æ–ª—ñ—Ç—Ç—è, –±—É–≤ –ø–æ–∫–∞–∑–∞–Ω–∏–π –≤ –µ–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç–∞—Ö —Ñ—ñ–∑–∏–∫–∞ –ü. –õ. –ö–∞–ø—ñ—Ü–∏ – —Ä—ñ–¥–∫–∏–π –≥–µ–ª—ñ–π. –í —É–º–æ–≤–∞—Ö –Ω–æ—Ä–º–∞–ª—å–Ω–æ–≥–æ –∞—Ç–º–æ—Å—Ñ–µ—Ä–Ω–æ–≥–æ —Ç–∏—Å–∫—É –≥–µ–ª—ñ–π —Å–∫—Ä–∞–ø–ª—é—î—Ç—å—Å—è –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ 4,3–ö (-268,8*–°). –Ø–∫—â–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –∑–Ω–∏–∂—É–≤–∞—Ç–∏ —ñ –¥–∞–ª—ñ, —Ç–æ –ø—Ä–∏ 2,2*–ö –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—ñ —Ä—ñ–¥–∫–æ–≥–æ –≥–µ–ª—ñ—é —Ä–∞–ø—Ç–æ–º —Ä—ñ–∑–∫–æ –∑–º—ñ–Ω—é—é—Ç—å—Å—è – –∑–æ–∫—Ä–µ–º–∞, –ø–æ–≤–Ω—ñ—Å—Ç—é –∑–Ω–∏–∫–∞—î –≤’—è–∑–∫—ñ—Å—Ç—å. (–û–¥–Ω–æ–≥–æ —Ä–∞–∑—É –æ—Ö–æ–ª–æ–¥–∂–µ–Ω–∏–π –¥–æ —Ç–∞–∫–æ—ó —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ —Ä—ñ–¥–∫–∏–π –≥–µ–ª—ñ–π –Ω–∞–ª–∏–ª–∏ –≤ –ø–æ—Å—É–¥–∏–Ω—É –∑ –Ω–∞–π—Ç–æ–Ω—à–∏–º–∏ –º—ñ–∫—Ä–æ–ø–æ—Ä–∞–º–∏, —á–µ—Ä–µ–∑ —è–∫—ñ –≤–æ–¥–∞ –º–æ–≥–ª–∞ –± –ø—Ä–æ—Å–æ—á–∏—Ç–∏—Å—è –ª–∏—à–µ –∑–∞ –º—ñ–ª—å—è—Ä–¥–∏ —Ä–æ–∫—ñ–≤; —Ä—ñ–¥–∫–∏–π –≥–µ–ª—ñ–π, –Ω–∞ –ø–æ–¥–∏–≤ –µ–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç–∞—Ç–æ—Ä—ñ–≤, –ø—Ä–æ—Å–æ—á–∏–≤—Å—è –≤—Å—å–æ–≥–æ –∑–∞ –∫—ñ–ª—å–∫–∞ —Å–µ–∫—É–Ω–¥.) –¢–∞–∫ —Å–∞–º–æ, —Å—Ç—Ä–∏–±–∫–æ–º, –∑–º—ñ–Ω—é—é—Ç—å—Å—è —Ç–µ–ø–ª–æ—î–º–Ω—ñ—Å—Ç—å —ñ —Å—Ç–∏—Å–ª–∏–≤—ñ—Å—Ç—å —Ä—ñ–¥–∫–æ–≥–æ –≥–µ–ª—ñ—é, –∫–æ–µ—Ñ—ñ—Ü—ñ—î–Ω—Ç –π–æ–≥–æ —Ç–µ–ø–ª–æ–≤–æ–≥–æ —Ä–æ–∑—à–∏—Ä–µ–Ω–Ω—è. –°—Ç—Ä–∏–±–∫–æ–ø–æ–¥—ñ–±–Ω–∞ –∑–º—ñ–Ω–∞ –Ω–∞–∑–≤–∞–Ω–∏—Ö —Ö–∞—Ä–∞–∫—Ç–µ—Ä–∏—Å—Ç–∏–∫ —Ä–µ—á–æ–≤–∏–Ω–∏ —ñ —î –≤—ñ–¥–º—ñ–Ω–Ω–æ—é —Ä–∏—Å–æ—é —Ñ–∞–∑–æ–≤–∏—Ö –ø–µ—Ä–µ—Ö–æ–¥—ñ–≤ –¥—Ä—É–≥–æ–≥–æ —Ä–æ–¥—É.
–ü–µ—Ä–µ—Ö—ñ–¥ —Ä—ñ–¥–∫–æ–≥–æ –≥–µ–ª—ñ—é –≤ –Ω–∞–¥—Ç–µ–∫—É—á–∏–π —Å—Ç–∞–Ω –Ω–µ —î–¥–∏–Ω–∏–π –ø—Ä–∏–∫–ª–∞–¥ –ø–æ–¥—ñ–±–Ω–∏—Ö –ø–µ—Ä–µ—Ç–≤–æ—Ä–µ–Ω—å. –°–ø–æ—Å—Ç–µ—Ä—ñ–≥–∞—é—Ç—å—Å—è –≤–æ–Ω–∏ —ñ –≤ —Ç–≤–µ—Ä–¥–∏—Ö —Ç—ñ–ª–∞—Ö – —Ü–µ, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, –ø–µ—Ä–µ—Ö—ñ–¥ –∑–∞–ª—ñ–∑–∞ –∑ —Ñ–µ—Ä–æ–º–∞–≥–Ω—ñ—Ç–Ω–æ–≥–æ —Å—Ç–∞–Ω—É –≤ –ø–∞—Ä–∞–º–∞–≥–Ω—ñ—Ç–Ω–µ (–∑ –Ω–∞–º–∞–≥–Ω—ñ—á–µ–Ω–∏–º –∑–∞–ª—ñ–∑–æ–º —Ü–µ —Ç—Ä–∞–ø–ª—è—î—Ç—å—Å—è –ø—Ä–∏ –Ω–∞–≥—Ä—ñ–≤–∞–Ω–Ω—ñ –¥–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ 770*–° – —Ç–æ—á–∫–∞ –ö—é—Ä—ñ).
–§–∞–∑–æ–≤—ñ –ø–µ—Ä–µ—Ö–æ–¥–∏ –¥—Ä—É–≥–æ–≥–æ —Ä–æ–¥—É –≤–∏–≤—á–∞—î –∫–≤–∞–Ω—Ç–æ–≤–∞ —Ñ—ñ–∑–∏–∫–∞.
–ì–∞–∑–æ–ø–æ–¥—ñ–±–Ω–∏–π –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏–π —Å—Ç–∞–Ω
–Ø–∫—â–æ —Ä–µ—á–æ–≤–∏–Ω–∞ —Å–∫–ª–∞–¥–∞—î—Ç—å—Å—è –∑ —ñ–æ–Ω—ñ–≤, —Ç–æ –∑ —Ä–æ—Å—Ç–æ–º —ó—Ö –∑–∞—Ä—è–¥—É –±—É–¥–µ –ø—ñ–¥–≤–∏—â—É–≤–∞—Ç–∏—Å—è —ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –∫–∏–ø—ñ–Ω–Ω—è —Ä–µ—á–æ–≤–∏–Ω–∏. –°–ø—Ä–∞–≤–¥—ñ, —ñ–æ–Ω–∏ –æ–∫—Å–∏–≥–µ–Ω—É —ñ –º–∞–≥–Ω—ñ—é –º–∞—é—Ç—å –ø—Ä–∏–±–ª–∏–∑–Ω–æ —Ç—ñ –∂ —Ä–æ–∑–º—ñ—Ä–∏, —â–æ —ñ —ñ–æ–Ω–∏ —Ñ–ª—É–æ—Ä—É —ñ –ª—ñ—Ç—ñ—é, –∞–ª–µ –º–∞—é—Ç—å –≤–¥–≤—ñ—á—ñ –±—ñ–ª—å—à—ñ –∑–∞—Ä—è–¥–∏, —ñ, —è–∫ –Ω–∞—Å–ª—ñ–¥–æ–∫, –ª—ñ—Ç—ñ–π —Ñ–ª—É–æ—Ä–∏–¥ –∫–∏–ø–∏—Ç—å –ø—Ä–∏ 1681*–°, –∞ –º–∞–≥–Ω—ñ–π –æ–∫—Å–∏–¥ – –ø—Ä–∏ 3600*–°, –Ω–∞ –¥–≤—ñ —Ç–∏—Å—è—á—ñ –≥—Ä–∞–¥—É—Å—ñ–≤ –≤–∏—â–µ!
–Ø–∫ —ñ –≤ –≤–∏–ø–∞–¥–∫—É –ø–ª–∞–≤–ª–µ–Ω–Ω—è, –≤–∏–ø–∞—Ä–æ–≤—É–≤–∞–Ω–Ω—è —Ç–∞–∫–æ–∂ –≤–∏–º–∞–≥–∞—î –ø–µ–≤–Ω–∏—Ö –≤–∏—Ç—Ä–∞—Ç –µ–Ω–µ—Ä–≥—ñ—ó, —è–∫–∞ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è –¥–ª—è —Ä—É–π–Ω—É–≤–∞–Ω–Ω—è –º—ñ–∂–º–æ–ª–µ–∫—É–ª—è—Ä–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤. –¢–æ–º—É, –¥–æ –ø–æ–≤–Ω–æ–≥–æ –ø–µ—Ä–µ—Ö–æ–¥—É —Ä—ñ–¥–∏–Ω–∏ –≤ –≥–∞–∑ —ó—ó —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –Ω–µ –∑–º—ñ–Ω—é—î—Ç—å—Å—è, –ø–æ–¥—ñ–±–Ω–æ –¥–æ —Ç–æ–≥–æ, —è–∫ —Ü–µ —Å–ø–æ—Å—Ç–µ—Ä—ñ–≥–∞—î—Ç—å—Å—è —ñ –ø—Ä–∏ –ø–µ—Ä–µ—Ö–æ–¥—ñ –∑ —Ç–≤–µ—Ä–¥–æ–≥–æ —Å—Ç–∞–Ω—É –≤ —Ä—ñ–¥–∫–µ. –Ý–µ—á–æ–≤–∏–Ω–∞ —è–∫–∞ –ø–µ—Ä–µ–π—à–ª–∞ –≤ –ø–∞—Ä –º—ñ—Å—Ç–∏—Ç—å –≤ —Å–æ–±—ñ –ø–µ–≤–Ω–∏–π –Ω–∞–¥–ª–∏—à–æ–∫ –µ–Ω–µ—Ä–≥—ñ—ó –≤ –ø–æ—Ä—ñ–≤–Ω—è–Ω–Ω—ñ –∑ —Ä—ñ–¥–∏–Ω–æ—é —Ç—ñ—î—ó –∂ —Å–∞–º–æ—ó —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ (–æ—Å—å —á–æ–º—É –æ–ø—ñ–∫ –≤–æ–¥—è–Ω–æ—é –ø–∞—Ä–æ—é, —â–æ –º–∞—î —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É 100*–°, –Ω–∞–±–∞–≥–∞—Ç–æ –Ω–µ–±–µ–∑–ø–µ—á–Ω—ñ—à–µ –æ–ø—ñ–∫—É –≥–∞—Ä—è—á–æ—é –≤–æ–¥–æ—é —Ç—ñ—î—ó –∂ —Å–∞–º–æ—ó —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏).
–ù—É, –∞ —è–∫ –ø–æ–≤–æ–¥—è—Ç—å—Å—è –≤ —Ü—å–æ–º—É –≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ –∞–º–æ—Ä—Ñ–Ω—ñ —Ä–µ—á–æ–≤–∏–Ω–∏? –í–∂–µ –∑–∞–∑–Ω–∞—á–∞–ª–æ—Å—è, —â–æ —ó—Ö –º–æ–ª–µ–∫—É–ª–∏, —è–∫ –ø—Ä–∞–≤–∏–ª–æ, –ø–æ–ª—ñ–º–µ—Ä–Ω—ñ. –¢–µ—Ä–º—ñ—á–Ω–∞ —Å—Ç—ñ–π–∫—ñ—Å—Ç—å —Ç–∞–∫–∏—Ö –∑–≤’—è–∑–∫—ñ–≤ –∑–∞–∑–≤–∏—á–∞–π –Ω–∏–∂—á–∞, –Ω—ñ–∂ —É –Ω–∏–∑—å–∫–æ–º–æ–ª–µ–∫—É–ª—è—Ä–Ω–∏—Ö —Ä–µ—á–æ–≤–∏–Ω, —ñ —Ç–æ–º—É –≤ –ø–µ—Ä–µ–≤–∞–∂–Ω—ñ–π –±—ñ–ª—å—à–æ—Å—Ç—ñ —ó—Ö –º–æ–ª–µ–∫—É–ª–∏ –Ω–µ “–¥–æ–∂–∏–≤–∞—é—Ç—å” –ø—Ä–∏ –Ω–∞–≥—Ä—ñ–≤–∞–Ω–Ω—ñ –Ω–µ —Ç–µ —â–æ –¥–æ —Ç–æ—á–∫–∏ –∫–∏–ø—ñ–Ω–Ω—è, –∞–ª–µ –Ω–∞–≤—ñ—Ç—å —ñ –¥–æ —Ç–æ—á–∫–∏ –ø–ª–∞–≤–ª–µ–Ω–Ω—è. –¢–∞–∫—ñ, –∑–æ–∫—Ä–µ–º–∞, –≤—Å—ñ –Ω–∞–π–≤–∞–∂–ª–∏–≤—ñ—à—ñ —Å–∫–ª–∞–¥–æ–≤—ñ –Ω–∞—à–æ–≥–æ –æ—Ä–≥–∞–Ω—ñ–∑–º—É – –≤—É–≥–ª–µ–≤–æ–¥–∏, –∂–∏—Ä–∏, –±—ñ–ª–∫–∏.
–Ø–∫—â–æ –ø—ñ–¥–≤–∏—â—É–≤–∞—Ç–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –≥–∞–∑—É, —Ç–æ –º–æ–∂–Ω–∞ –±—É–¥–µ –≤–∏—è–≤–∏—Ç–∏ —â–µ –æ–¥–∏–Ω, —Ç–∞–∫ –±–∏ –º–æ–≤–∏—Ç–∏, ¬´–ø—ñ–¥ —Å—Ç–∞–Ω¬ª. –¶–µ–π “–ø—ñ–¥ —Å—Ç–∞–Ω” –ø—Ä–æ—è–≤–ª—è—î—Ç—å—Å—è –≤ –ø—Ä–æ—Ü–µ—Å—ñ –ø–µ—Ä–µ—Ö–æ–¥—É –≤—ñ–¥ –≥–∞–∑–æ–ø–æ–¥—ñ–±–Ω–æ–≥–æ —Å—Ç–∞–Ω—É –¥–æ —Ä—ñ–¥–∫–æ–≥–æ.
–Ø–∫ –ø–µ—Ä–µ–≤–µ—Å—Ç–∏ –≥–∞–∑ –≤ —Ä—ñ–¥–∏–Ω—É? –û—á–µ–≤–∏–¥–Ω–æ, —Ç—Ä–µ–±–∞ –∑–Ω–∏–∑–∏—Ç–∏ –π–æ–≥–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –Ω–∏–∂—á–µ —Ç–æ—á–∫–∏ –∫–∏–ø—ñ–Ω–Ω—è –ø—Ä–∏ –¥–∞–Ω–æ–º—É —Ç–∏—Å–∫—É (–¥–ª—è –ø–æ—á–∞—Ç–∫—É, –ø—Ä–∏–ø—É—Å—Ç–∏–º–æ, –π–æ–≥–æ –Ω–æ—Ä–º–∞–ª—å–Ω–∏–º, –∞—Ç–º–æ—Å—Ñ–µ—Ä–Ω–∏–º). –ü—Ä–∞–≤–¥–∞, —Ç–∞–∫–∏–π —à–ª—è—Ö —î –Ω–µ –¥—É–∂–µ –ø—Ä–∞–≤–∏–ª—å–Ω–∏–º, –∫–æ–ª–∏ –º–æ–≤–∞ –π–¥–µ –ø—Ä–æ —Å–∫—Ä–∞–ø–ª–µ–Ω–Ω—è –Ω–∏–∑—å–∫–æ–∫–∏–ø–ª—è—á–∏—Ö —Ä–µ—á–æ–≤–∏–Ω, —Ç–∞–∫–∏—Ö, —è–∫ –∞–∑–æ—Ç, –≤–æ–¥–µ–Ω—å, –≤—É–≥–ª–µ–∫–∏—Å–ª–∏–π –≥–∞–∑, —è–∫—ñ –º–∞—é—Ç—å –∑–∞–Ω–∞–¥—Ç–æ –Ω–∏–∑—å–∫—ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –∫–∏–ø—ñ–Ω–Ω—è. –í–∏—è–≤–∏–ª–æ—Å—è, —â–æ —Å–∫—Ä–∞–ø–ª—é–≤–∞—Ç–∏ –≥–∞–∑–∏ –º–æ–∂–Ω–∞ —à–ª—è—Ö–æ–º –∑–±—ñ–ª—å—à–µ–Ω–Ω—è –∑–æ–≤–Ω—ñ—à–Ω—ñ—à–Ω—å–æ–≥–æ —Ç–∏—Å–∫—É. –Ø–∫ –≤–∂–µ –≥–æ–≤–æ—Ä–∏–ª–æ—Å—è, –ø—ñ–¥ –π–æ–≥–æ –≤–ø–ª–∏–≤–æ–º –º–æ–ª–µ–∫—É–ª–∏ —Ä–µ—á–æ–≤–∏–Ω–∏ –ø–æ—á–∏–Ω–∞—é—Ç—å –Ω—ñ–±–∏ “–ø—Ä–∏–ª–∏–ø–∞—Ç–∏” –æ–¥–Ω–∞ –¥–æ –æ–¥–Ω–æ—ó, —É—Ç–≤–æ—Ä—é—é—á–∏ —Ä—ñ–¥–∏–Ω—É. –û—Ç–∂–µ, —Å–ø—Ä–∞–≤–∞ –ª–∏—à–µ –∑–∞ —Ç–∏—Å–∫–æ–º?
–í–∏—è–≤–∏–ª–æ—Å—è, —â–æ –Ω—ñ. –ù–µ –≤—Å–µ –≥–∞–∑–∏ –≤–¥–∞–≤–∞–ª–æ—Å—è –ø–µ—Ä–µ—Ç–≤–æ—Ä–∏—Ç–∏ –Ω–∞ —Ä—ñ–¥–∏–Ω—É –ø–æ–¥—ñ–±–Ω–∏–º —Å–ø–æ—Å–æ–±–æ–º. –•–ª–æ—Ä, –∞–º–æ–Ω—ñ–∞–∫, –≤—É–≥–ª–µ–∫–∏—Å–ª–∏–π –≥–∞–∑ —Ö–æ—á —ñ –∑ —Ç—Ä—É–¥–Ω–æ—â–∞–º–∏, –∞–ª–µ –ø—ñ–¥–¥–∞–ª–∏—Å—è —Å–∫—Ä–∞–ø–ª–µ–Ω–Ω—é –ø—ñ–¥ —Ç–∏—Å–∫–æ–º, –∞ –æ—Å—å –∫–∏—Å–µ–Ω—å, –∞–∑–æ—Ç, –∫–∞—Ä–±–æ–Ω(–Ü–Ü) –æ–∫—Å–∏–¥, –≤–æ–¥–µ–Ω—å, –≥–µ–ª—ñ–π –Ω–µ –±–∞–∂–∞–ª–∏ —Å–∫—Ä–∞–ø–ª—é–≤–∞—Ç–∏—Å—è.
–ü—Ä–∏—á–∏–Ω—É —Ü—å–æ–≥–æ –∑–∞–≥–∞–¥–∫–æ–≤–æ–≥–æ —è–≤–∏—â–∞ —Ä–æ–∑–∫—Ä–∏–≤ –î.–Ü. –ú–µ–Ω–¥–µ–ª—î—î–≤. –í—ñ–Ω –∑’—è—Å—É–≤–∞–≤, —â–æ —É –±—É–¥—å-—è–∫–æ–≥–æ –≥–∞–∑—É, –ø–æ—á–∏–Ω–∞—é—á–∏ –∑ –¥–µ—è–∫–æ—ó, —Ç–∞–∫ –∑–≤–∞–Ω–æ—ó –∫—Ä–∏—Ç–∏—á–Ω–æ—ó, —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏, —à–≤–∏–¥–∫—ñ—Å—Ç—å —Ä—É—Ö—É –º–æ–ª–µ–∫—É–ª –∑—Ä–æ—Å—Ç–∞—î –¥–æ —Ç–∞–∫–∏—Ö –≤–µ–ª–∏—á–∏–Ω, —â–æ –≤–∂–µ –Ω—ñ—è–∫–∏–º —Ç–∏—Å–∫–æ–º –∑–∑–æ–≤–Ω—ñ –∑—ñ–±—Ä–∞—Ç–∏ —ó—Ö –≤ —î–¥–∏–Ω–∏–π –∞–Ω—Å–∞–º–±–ª—å –Ω–µ –≤–¥–∞—Å—Ç—å—Å—è. –°–∏–ª –∑—á–µ–ø–ª–µ–Ω–Ω—è, —è–∫—ñ –≤–∏–Ω–∏–∫–∞—é—Ç—å –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ –∑–∞ —Ä–∞—Ö—É–Ω–æ–∫ —Ä—ñ–∑–Ω–∏—Ö —Ö—ñ–º—ñ—á–Ω–∏—Ö —ñ —Ñ—ñ–∑–∏–∫–æ-—Ö—ñ–º—ñ—á–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤, –Ω–µ –≤–∏—Å—Ç–∞—á–∏—Ç—å –¥–ª—è —Ç–æ–≥–æ, —à–æ —Å—Ç—Ä–∏–º–∞—Ç–∏ –º–æ–ª–µ–∫—É–ª–∏. –í–∏—â–µ —Ü—ñ—î—ó —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –≥–∞–∑ –Ω–µ —Å–∫—Ä–∞–ø–ª—é—î—Ç—å—Å—è –≤ —Ä—ñ–¥–∏–Ω—É –≤–∂–µ –Ω—ñ –ø—Ä–∏ —è–∫–æ–º—É —Ç–∏—Å–∫—É. –û—Ç–∂–µ, –¥–ª—è —Å–∫—Ä–∞–ø–ª–µ–Ω–Ω—è —Ç–∞–∫–æ–≥–æ –≥–∞–∑—É, –π–æ–≥–æ –Ω–µ–æ–±—Ö—ñ–¥–Ω–æ –æ—Ö–æ–ª–æ–¥–∏—Ç–∏ –π–æ–≥–æ –¥–æ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –Ω–∏–∂—á–µ –∫—Ä–∏—Ç–∏—á–Ω–æ—ó. –£ –≥–∞–∑—ñ–≤, —è–∫—ñ –Ω—ñ—è–∫ –Ω–µ –±–∞–∂–∞–ª–∏ —Å–∫—Ä–∞–ø–ª—é–≤–∞—Ç–∏—Å—è, –≤–æ–Ω–∞ –≤–∏—è–≤–∏–ª–∞—Å—è –¥—É–∂–µ –Ω–∏–∑—å–∫–æ—é (-118*–° —É –∫–∏—Å–Ω—é, -140*–° —É –∫–∞—Ä–±–æ–Ω(–Ü–Ü) –æ–∫—Å–∏–¥—É, -240*–° —É –≤–æ–¥–Ω—é; –¥–ª—è –ø–æ—Ä—ñ–≤–Ω—è–Ω–Ω—è —Å–∫–∞–∂–µ–º–æ, —â–æ —É –≤–æ–¥–∏ —Ü—è –∫—Ä–µ—Ç–∏—á–Ω–∞ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –¥–æ—Ä—ñ–≤–Ω—é—î 373*–°) .
–î–æ—Ä–µ—á–Ω–æ —Å–∫–∞–∑–∞—Ç–∏ –∫—ñ–ª—å–∫–∞ —Å–ª—ñ–≤ –ø—Ä–æ —ñ–Ω–µ—Ä—Ç–Ω—ñ –≥–∞–∑–∏. –ó–≥–æ–¥–æ–º —ó—Ö –≤—Å–µ –∂ —Ç–∞–∫–∏ –≤–¥–∞–ª–æ—Å—è –ø–µ—Ä–µ–≤–µ—Å—Ç–∏ —Å–ø–æ—á–∞—Ç–∫—É –≤ —Ä—ñ–¥–∫–∏–π, –∞ –ø–æ—Ç—ñ–º —ñ –≤ —Ç–≤–µ—Ä–¥–∏–π —Å—Ç–∞–Ω. –ó–∞–ª–∏—à–∞–ª–æ—Å—è, –æ–¥–Ω–∞–∫, –Ω–µ–∑—Ä–æ–∑—É–º—ñ–ª–∏–º, –∑–∞ —Ä–∞—Ö—É–Ω–æ–∫ —è–∫–∏—Ö —Å–∏–ª —Ü—ñ —Å—Ç–∞–Ω–∏ —Ä–µ–∞–ª—ñ–∑—É—é—Ç—å—Å—è – –∞–¥–∂–µ –Ω—ñ —ñ–æ–Ω–Ω–∏—Ö, –Ω—ñ –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–∏—Ö –∑–≤’—è–∑–∫—ñ–≤ –º—ñ–∂ –∞—Ç–æ–º–∞–º–∏ —ñ–Ω–µ—Ä—Ç–Ω–∏—Ö –≥–∞–∑—ñ–≤ –Ω–µ –≤–∏–Ω–∏–∫–∞—î. –ü—Ä–∏—Ä–æ–¥—É –≤–ª–∞—Å—Ç–∏–≤–∏—Ö —ó–º —Å–∏–ª –∑—á–µ–ø–ª–µ–Ω–Ω—è (–≤–æ–Ω–∏ –æ—Ç—Ä–∏–º–∞–ª–∏ –Ω–∞–∑–≤—É –¥–∏—Å–ø–µ—Ä—Å—ñ–π–Ω—ñ —Å–∏–ª–∏) –≤–¥–∞–ª–æ—Å—è –∑’—è—Å—É–≤–∞—Ç–∏ –ª–∏—à–µ –∑–æ–≤—Å—ñ–º –Ω–µ–¥–∞–≤–Ω–æ. –í–∏—è–≤–∏–ª–æ—Å—è, —â–æ –≤ –¥–∞–Ω–æ–º—É –≤–∏–ø–∞–¥–∫—É –∞—Ç–æ–º–∏ –ø–æ–ª—è—Ä–∏–∑—É—é—Ç—å—Å—è, –≤—Å–µ—Ä–µ–¥–∏–Ω—ñ –Ω–∏—Ö –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è –ø–æ–¥—ñ–ª –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏—Ö –∑–∞—Ä—è–¥—ñ–≤: —É —Ü—ñ–ª–æ–º—É –∫–æ–∂–µ–Ω –∞—Ç–æ–º –∑–∞–ª–∏—à–∞—î—Ç—å—Å—è –Ω–µ–π—Ç—Ä–∞–ª—å–Ω–∏–º, –∞–ª–µ –≤ –æ–¥–Ω—ñ–π –π–æ–≥–æ —á–∞—Å—Ç–∏–Ω—ñ –Ω–∞ –∫–æ—Ä–æ—Ç–∫–∏–π —á–∞—Å —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –Ω–∞–¥–ª–∏—à–æ–∫ –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤, —ñ –æ–¥–Ω–∞ —á–∞—Å—Ç–∏–Ω–∞ –∑–∞—Ä—è–¥–∂–∞—î—Ç—å—Å—è –Ω–µ–≥–∞—Ç–∏–≤–Ω–æ, —ñ–Ω—à–∞ –∂ —á–∞—Å—Ç–∏–Ω–∞, –¥–µ –≤–∏–Ω–∏–∫–∞—î –¥–µ—Ñ—ñ—Ü–∏—Ç –µ–ª–µ–∫—Ç—Ä–æ–Ω—ñ–≤, –∑–∞—Ä—è–¥–∂–∞—î—Ç—å—Å—è –ø–æ–∑–∏—Ç–∏–≤–Ω–æ. –í —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ —Ç–∞–∫–æ—ó –æ—Å—å –ø–æ–ª—è—Ä–∏–∑–∞—Ü—ñ—ó –≤–∏–Ω–∏–∫–∞—é—Ç—å —Å–ª–∞–±–∫—ñ –≤–∑–∞—î–º–æ–¥—ñ—ó –º—ñ–∂ –∞—Ç–æ–º–∞–º–∏ –∑–∞ —Ä–∞—Ö—É–Ω–æ–∫ –≤–∑–∞—î–º–æ—Ç—è–∂—ñ–Ω–Ω—è —ó—Ö —á–∞—Å—Ç–∏–Ω, –∑–∞—Ä—è–¥–∂–µ–Ω–∏—Ö —Ä—ñ–∑–Ω–æ–π–º–µ–Ω–Ω–æ.
–ö–æ–ª–∏ –¥–æ—Å–ª—ñ–¥–∂—É–≤–∞–ª–æ—Å—è —Å–∫—Ä–∞–ø–ª–µ–Ω–Ω—è —ñ –∑–∞—Ç–≤–µ—Ä–¥—ñ–Ω–Ω—è —ñ–Ω–µ—Ä—Ç–Ω–∏—Ö –≥–∞–∑—ñ–≤, –∑’—è—Å—É–≤–∞–ª–∞—Å—è —Ü—ñ–∫–∞–≤–∞ –ø–æ–¥—Ä–æ–±–∏—Ü—è: —Ä—ñ–¥–∫–∏–π –≥–µ–ª—ñ–π –Ω–µ –±–∞–∂–∞—î –∫—Ä–∏—Å—Ç–∞–ª—ñ–∑—É–≤–∞—Ç–∏—Å—è –Ω–∞–≤—ñ—Ç—å –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ, —è–∫–∞ –¥–æ—Ä—ñ–≤–Ω—é–≤–∞–ª–∞ –º–∞–π–∂–µ –∞–±—Å–æ–ª—é—Ç–Ω–æ–º—É –Ω—É–ª—é: 0,0001*–ö! –ê–ª–µ —è–∫—â–æ –Ω–∞ –¥–æ–ø–æ–º–æ–≥—É –Ω–∞—Å—Ç—ñ–ª—å–∫–∏ –∂–æ—Ä—Å—Ç–æ–∫–æ–º—É —Ö–æ–ª–æ–¥—É –∑–∞–∫–ª–∏–∫–∞—Ç–∏ –≤–∏—Å–æ–∫–∏–π —Ç–∏—Å–∫ –Ω–µ –º–µ–Ω—à–µ –∑–∞ 25 –∞—Ç–º–æ—Å—Ñ–µ—Ä, –≥–µ–ª—ñ–π –ø–µ—Ä–µ—Ö–æ–¥–∏—Ç—å —É —Ç–≤–µ—Ä–¥–∏–π —Å—Ç–∞–Ω. –Ø–∫ —Ç—ñ–ª—å–∫–∏ —Ç–∏—Å–∫ –∑–Ω–∏–∂—É—é—Ç—å, –≥–µ–ª—ñ–π –∑–Ω–æ–≤—É –ø–æ–≤–µ—Ä—Ç–∞—î—Ç—å—Å—è –≤ —Ä—ñ–¥–∫–∏–π —Å—Ç–∞–Ω… –ù–∞—Å—Ç—ñ–ª—å–∫–∏ —Ü—ñ–∫–∞–≤–∞ –æ—Å–æ–±–ª–∏–≤—ñ—Å—Ç—å –ø–æ–≤’—è–∑–∞–Ω–∞ –∑ —Ç–∏–º, —â–æ –Ω–∞–≤—ñ—Ç—å –ø—Ä–∏ –∞–±—Å–æ–ª—é—Ç–Ω–æ–º—É –Ω—É–ª—ñ –Ω–µ –ø—Ä–∏–ø–∏–Ω—è—î—Ç—å—Å—è —Ä—É—Ö, —Ç–∞–∫ –∑–≤–∞–Ω—ñ –Ω—É–ª—å–æ–≤—ñ –∫–æ–ª–∏–≤–∞–Ω–Ω—è –º–æ–ª–µ–∫—É–ª, —è–∫—ñ —Ö–æ—á —ñ —Å–ª–∞–±–∫—ñ, –∞–ª–µ –ø—Ä–∏ —Å–ª–∞–±–∫–∏—Ö —Å–∏–ª–∞—Ö –≤–∑–∞—î–º–æ–¥—ñ—ó –º—ñ–∂ –º–æ–ª–µ–∫—É–ª–∞–º–∏ —ñ–Ω–µ—Ä—Ç–Ω–∏—Ö –≥–∞–∑—ñ–≤ –º–æ–∂—É—Ç—å –ø–µ—Ä–µ—à–∫–æ–¥–∏—Ç–∏ —É—Ç–≤–æ—Ä–µ–Ω–Ω—é –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω–æ—ó —Ä–µ—à—ñ—Ç–∫–∏.
–ó–∞—Ä–∞–∑ –¥–ª—è –±–∞–≥–∞—Ç—å–æ—Ö —Ä–µ—á–æ–≤–∏–Ω –≤–∂–µ –¥–æ—Å–∏—Ç—å –¥–æ–±—Ä–µ –æ—Ö–∞—Ä–∞–∫—Ç–µ—Ä–∏–∑–æ–≤–∞–Ω—ñ —Ç—ñ —É–º–æ–≤–∏, –ø—Ä–∏ —è–∫–∏—Ö –≤–æ–Ω–∏ —ñ—Å–Ω—É—é—Ç—å –≤ —Ç–æ–º—É —á–∏ —ñ–Ω—à–æ–º—É –∞–≥—Ä–µ–≥–∞—Ç–Ω–æ–º—É —Å—Ç–∞–Ω—ñ. –°—É–∫—É–ø–Ω—ñ—Å—Ç—å —Ü–∏—Ö —É–º–æ–≤ –≤—ñ–¥–æ–±—Ä–∞–∂–∞—î –¥—ñ–∞–≥—Ä–∞–º–∞ –∞–≥—Ä–µ–≥–∞—Ç–Ω–∏—Ö —Å—Ç–∞–Ω—ñ–≤, –¥–µ –ø–æ –æ—Å—ñ –∞–±—Å—Ü–∏—Å –≤—ñ–¥–∫–ª–∞–¥–∞—î—Ç—å—Å—è —Ç–∏—Å–∫, –∞ –ø–æ –æ—Å—ñ –æ—Ä–¥–∏–Ω–∞—Ç – —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞. –î–µ—è–∫—ñ –∑ —Ü–∏—Ö –¥—ñ–∞–≥—Ä–∞–º –Ω–∞–≤–µ–¥–µ–Ω—ñ –Ω–∞ –º–∞–ª—é–Ω–∫—É.
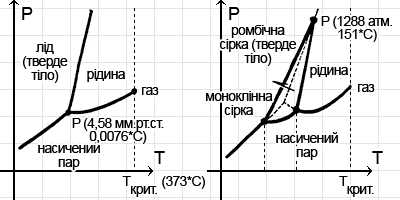
–ö–æ–∂–Ω–∞ —Ç–∞–∫–∞ –¥—ñ–∞–≥—Ä–∞–º–∞ —Å—Ö–æ–∂–∞ –Ω–∞ —Ö–∏–º–µ—Ä–Ω—É-–∫—Ä–∏–≤—É —Ä–æ–≥–∞—Ç–∫—É. –Ø–∫—â–æ –∂ –≤—ñ–¥–æ–±—Ä–∞–∂–∞—Ç–∏ –Ω–∞ —Ç–∞–∫–∏–π –¥—ñ–∞–≥—Ä–∞–º—ñ –≤—Å—ñ –º–æ–∂–ª–∏–≤—ñ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—ñ —Ä–µ—à—ñ—Ç–∫–∏, —â–æ —Ä–µ–∞–ª—ñ–∑—É—é—Ç—å—Å—è –≤ —Ç–≤–µ—Ä–¥–æ–º—É —Å—Ç–∞–Ω—ñ, —Å—ñ—Ç–∫–∞ –ª—ñ–Ω—ñ–π —É—Å–∫–ª–∞–¥–Ω—é—î—Ç—å—Å—è.
–°—ñ—Ä–∫–∞ —ñ—Å–Ω—É—î —É –≤–∏–≥–ª—è–¥—ñ –¥–≤–æ—Ö –º–æ–¥–∏—Ñ—ñ–∫–∞—Ü—ñ–π – —Ä–æ–º–±—ñ—á–Ω–æ—ó —ñ –º–æ–Ω–æ–∫–ª—ñ–Ω–Ω–æ—ó, —ñ –∑–∞–º–∫–Ω—É—Ç–∏–π –∫–æ–Ω—Ç—É—Ä –Ω–∞ –¥—ñ–∞–≥—Ä–∞–º—ñ —ó—ó —Å—Ç–∞–Ω—ñ–≤ —è–∫—Ä–∞–∑ —ñ –ø–æ–∫–∞–∑—É—î —Ç—É –æ–±–ª–∞—Å—Ç—å —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä —ñ —Ç–∏—Å–∫—ñ–≤, –≤ —è–∫–∏—Ö –º–æ–∂–µ —ñ—Å–Ω—É–≤–∞—Ç–∏ –º–æ–Ω–æ–∫–ª—ñ–Ω–Ω–∞ —Å—ñ—Ä–∫–∞. –î—É–∂–µ —Å–∫–ª–∞–¥–Ω–æ—é –≤–∏—Ö–æ–¥–∏—Ç—å –¥—ñ–∞–≥—Ä–∞–º–∞ —Å—Ç–∞–Ω—ñ–≤ –≤–æ–¥–∏: —É –ª—å–æ–¥—É, –≤–∏—è–≤–ª—è—î—Ç—å—Å—è, –≤—ñ–¥–æ–º–æ —à—ñ—Å—Ç—å –º–æ–¥–∏—Ñ—ñ–∫–∞—Ü—ñ–π.
–ü–µ—Ä–µ—Ö—ñ–¥ –∑ –æ–¥–Ω–æ–≥–æ —Å—Ç–∞–Ω—É –≤ —ñ–Ω—à–∏–π –≤ —Ä–µ—á–æ–≤–∏–Ω—ñ –≤–∏–∫–ª–∏–∫–∞—î—Ç—å—Å—è, —è–∫ –ø—Ä–∞–≤–∏–ª–æ, –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—è–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏. –ê —â–æ –±—É–¥–µ, —è–∫—â–æ, –¥–æ–≤—ñ–≤—à–∏ –¥–æ –≥–∞–∑–æ–ø–æ–¥—ñ–±–Ω–æ–≥–æ —Å—Ç–∞–Ω—É, –ø—ñ–¥–≤–∏—â—É–≤–∞—Ç–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É —Ä–µ—á–æ–≤–∏–Ω–∏ —ñ –¥–∞–ª—ñ?
–ß–∏–º –≤–∏—â–µ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞, —Ç–∏–º —Å—Ç—Ä—ñ–º–∫—ñ—à–µ —Ä—É—Ö —á–∞—Å—Ç–∏–Ω–æ–∫ —Ä–µ—á–æ–≤–∏–Ω–∏. –ó –Ω–∞–≥—Ä—ñ–≤–∞–Ω–Ω—è–º —Ä–∞–Ω–æ —á–∏ –ø—ñ–∑–Ω–æ –º–æ–ª–µ–∫—É–ª–∏ —É –≤–∑–∞—î–º–Ω–∏—Ö –∑—ñ—Ç–∫–Ω–µ–Ω–Ω—è—Ö, –≤—Å–µ –±—ñ–ª—å—à –µ–Ω–µ—Ä–≥—ñ–π–Ω–∏—Ö, —Å—Ç–∞–Ω—É—Ç—å —Ä–æ–∑–ø–∞–¥–∞—Ç–∏—Å—è –Ω–∞ –∞—Ç–æ–º–∏, –∞ –ø—Ä–∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞—Ö –≤ –¥–µ–∫—ñ–ª—å–∫–∞ –¥–µ—Å—è—Ç–∫—ñ–≤ —Ç–∏—Å—è—á –≥—Ä–∞–¥—É—Å—ñ–≤ –∞—Ç–æ–º–∏ –±—É–¥—É—Ç—å —Ä–æ–∑—Å–∏–ø–∞—Ç–∏—Å—è –Ω–∞ —ñ–æ–Ω–∏ —ñ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∏. –í–∏–Ω–∏–∫–Ω–µ –ø–ª–∞–∑–º–∞, —è–∫—É –Ω–∞–∑–∏–≤–∞—é—Ç—å —á–µ—Ç–≤–µ—Ä—Ç–∏–º —Å—Ç–∞–Ω–æ–º —Ä–µ—á–æ–≤–∏–Ω–∏…










