–ö–æ–∂–Ω–∞ —Å–∫–ª–∞–¥–Ω–∞ –∞–±–æ –ø—Ä–æ—Å—Ç–∞ —Ä–µ—á–æ–≤–∏–Ω–∞ —Å–∫–ª–∞–¥–∞—î—Ç—å—Å—è –∑ –µ–ª–µ–º–µ–Ω—Ç—Ä–∞—Ä–Ω–∏—Ö —á–∞—Å—Ç–∏–Ω–æ–∫ – –∞—Ç–æ–º—ñ–≤ —ñ –º–æ–ª–µ–∫—É–ª, —è–∫—ñ –º–∞—é—Ç—å –æ–¥–Ω–∞–∫–æ–≤–∏–π –∞—Ç–æ–º–Ω–∏–π —Å–∫–ª–∞–¥ —ñ —Å—Ç—Ä—É–∫—Ç—É—Ä–Ω—É –±—É–¥–æ–≤—É.
–•—ñ–º—ñ—á–Ω–∞ —Ñ–æ—Ä–º—É–ª–∞ – —Ü–µ –∑–æ–±—Ä–∞–∂–µ–Ω–Ω—è —è–∫—ñ—Å–Ω–æ–≥–æ —ñ –∫—ñ–ª—å–∫—ñ—Å–Ω–æ–≥–æ —Å–∫–ª–∞–¥—É —Ä–µ—á–æ–≤–∏–Ω–∏ –∑–∞ –¥–æ–ø–æ–º–æ–≥–æ—é —Å–∏–º–≤–æ–ª—ñ–≤ —Ö—ñ–º—ñ—á–Ω–∏—Ö –µ–ª–µ–º–µ–Ω—Ç—ñ–≤, –∞ —Ç–∞–∫–æ–∂ —á–∏—Å–ª–æ–≤–∏—Ö, –ª—ñ—Ç–µ—Ä–Ω–∏—Ö —Ç–∞ —ñ–Ω—à–∏—Ö –∑–Ω–∞–∫—ñ–≤.
–•—ñ–º—ñ—á–Ω—ñ —Ñ–æ—Ä–º—É–ª–∏ –º–∞—é—Ç—å —ñ–Ω—Ç–µ—Ä–Ω–∞—Ü—ñ–æ–Ω–∞–ª—å–Ω—ñ –∑–æ–±—Ä–∞–∂–µ–Ω–Ω—è.
–•—ñ–º—ñ—á–Ω–∞ —Ñ–æ—Ä–º—É–ª–∞ –¥–∞—î –Ω–∞—Å—Ç—É–ø–Ω—É —ñ–Ω—Ñ–æ—Ä–º–∞—Ü—ñ—é –ø—Ä–æ —Ä–µ—á–æ–≤–∏–Ω—É: —è–∫—ñ –µ–ª–µ–º–µ–Ω—Ç–∏ –≤—Ö–æ–¥—è—Ç—å –¥–æ —Å–∫–ª–∞–¥—É —Ä–µ—á–æ–≤–∏–Ω–∏ —ñ —è–∫–µ —Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—è –∞—Ç–æ–º—ñ–≤ —Ü–∏—Ö –µ–ª–µ–º–µ–Ω—Ç—ñ–≤, —ñ –æ—Ç–∂–µ, —è–∫–∏–π —Å–∫–ª–∞–¥ –º–æ–ª–µ–∫—É–ª–∏ –¥–ª—è –∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–∏—Ö —Å–ø–æ–ª—É–∫ –∞–±–æ —Å–∫–ª–∞–¥ —ñ —Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—è —ñ–æ–Ω—ñ–≤ –≤ –∫—Ä–∏—Å—Ç–∞–ª—ñ—á–Ω—ñ–π —Ä–µ—à—ñ—Ç—Ü—ñ –¥–ª—è —ñ–æ–Ω–Ω–∏—Ö —Å–ø–æ–ª—É–∫.
–ü—Ä–∏–∫–ª–∞–¥. –§–æ—Ä–º—É–ª–∞ H2O –ø–æ–∫–∞–∑—É—î, —â–æ –≤–æ–¥–∞ (–∫–æ–≤–∞–ª–µ–Ω—Ç–Ω–∞ —Ä–µ—á–æ–≤–∏–Ω–∞) –≤–∫–ª—é—á–∞—î –µ–ª–µ–º–µ–Ω—Ç–∏ –≤–æ–¥–µ–Ω—å H —ñ –∫–∏—Å–µ–Ω—å O –≤ —Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ —ó—Ö –∞—Ç–æ–º—ñ–≤ 2 : 1, –∞ —Ñ–æ—Ä–º—É–ª–∞ Na2SO4 – –Ω–∞—Ç—Ä—ñ—é —Å—É–ª—å—Ñ–∞—Ç (—ñ–æ–Ω–Ω–∞ —Ä–µ—á–æ–≤–∏–Ω–∞) –≤–∫–ª—é—á–∞—î –µ–ª–µ–º–µ–Ω—Ç–∏ –Ω–∞—Ç—Ä—ñ–π Na, —Å—ñ—Ä–∫—É S —ñ –∫–∏—Å–µ–Ω—å –≤ —Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ —ó—Ö –∞—Ç–æ–º—ñ–≤ 2 : 1 : 4 –∞–±–æ –≤ —Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ —ñ–æ–Ω—ñ–≤ Na+ —ñ SO42-, —â–æ –¥–æ—Ä—ñ–≤–Ω—é—î 2 : 1. –°–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—è –¥–ª—è —ñ–æ–Ω—ñ–≤ —Å–ø–æ—Å—Ç–µ—Ä—ñ–≥–∞—î—Ç—å—Å—è –Ω–µ —Ç—ñ–ª—å–∫–∏ –¥–ª—è —Ä–µ—á–æ–≤–∏–Ω —É —Ç–≤–µ—Ä–¥–æ–º—É —Å—Ç–∞–Ω—ñ, –∞–ª–µ —ñ –≤ —Ä–æ–∑–≤–µ–¥–µ–Ω–æ–º—É –≤–æ–¥–Ω–æ–º—É —Ä–æ–∑—á–∏–Ω—ñ, –¥–µ Na2SO4 –µ–ª–µ–∫—Ç—Ä–æ–ª—ñ—Ç–∏—á–Ω–æ –¥–∏—Å–æ—Ü—ñ—é—î –Ω–∞ –∫–∞—Ç—ñ–æ–Ω–∏ Na+ —ñ –∞–Ω—ñ–æ–Ω–∏ SO42- —É —Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ 2 : 1.
–•—ñ–º—ñ—á–Ω—ñ —Ñ–æ—Ä–º—É–ª–∏ –≤–∏–¥—É H2O, Na2SO4, C2H2 –Ω–∞–∑–∏–≤–∞—é—Ç—å—Å—è —Å—É–º–∞—Ä–Ω–∏–º–∏ —Ñ–æ—Ä–º—É–ª–∞–º–∏. –ß–∏—Å–ª–æ –∞—Ç–æ–º—ñ–≤ –∫–æ–∂–Ω–æ–≥–æ –µ–ª–µ–º–µ–Ω—Ç–∞ —É —Ñ–æ—Ä–º—É–ª—ñ –≤–∫–∞–∑—É—î—Ç—å—Å—è –Ω–∏–∂–Ω—ñ–º —á–∏—Å–ª–æ–≤–∏–º —ñ–Ω–¥–µ–∫—Å–æ–º –ø—Ä–∞–≤–æ—Ä—É—á –≤—ñ–¥ —Å–∏–º–≤–æ–ª—É –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ–≥–æ –µ–ª–µ–º–µ–Ω—Ç–∞.
–ö—Ä—ñ–º —Å—É–º–∞—Ä–Ω–∏—Ö —Ñ–æ—Ä–º—É–ª –≤ —Ö—ñ–º—ñ—ó –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—é—Ç—å—Å—è —Å—Ç—Ä—É–∫—Ç—É—Ä–Ω—ñ —Ñ–æ—Ä–º—É–ª–∏ –º–æ–ª–µ–∫—É–ª, —è–∫—ñ –ø–æ–∫–∞–∑—É—é—Ç—å –≤—ñ–¥–Ω–æ—Å–Ω–µ –≤–∑–∞—î–º–Ω–µ —Ä–æ–∑—Ç–∞—à—É–≤–∞–Ω–Ω—è –∞—Ç–æ–º—ñ–≤ –≤ –º–æ–ª–µ–∫—É–ª—ñ.
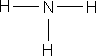
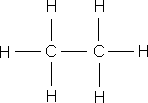
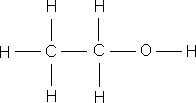
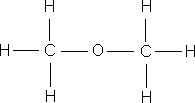
–ó–≤–µ—Ä–Ω—ñ—Ç—å —É–≤–∞–≥—É –Ω–∞ —Å—É–º–∞—Ä–Ω—ñ —Ñ–æ—Ä–º—É–ª–∏ –µ—Ç–∞–Ω–æ–ª—É —ñ –¥–∏–º–µ—Ç–∏–ª–æ–≤–æ–≥–æ –µ—Ñ—ñ—Ä—É – –≤–æ–Ω–∏ –æ–¥–Ω–∞–∫–æ–≤—ñ, —â–æ –≥–æ–≤–æ—Ä–∏—Ç—å –ø—Ä–æ –æ–¥–Ω–∞–∫–æ–≤–∏–π –∞—Ç–æ–º–∞—Ä–Ω–∏–π —ñ –∫—ñ–ª—å–∫—ñ—Å–Ω–∏–π —Å–∫–ª–∞–¥, –∞–ª–µ –≤–∑–∞—î–º–Ω–µ —Ä–æ–∑—Ç–∞—à—É–≤–∞–Ω–Ω—è –∞—Ç–æ–º—ñ–≤ –≤ –º–æ–ª–µ–∫—É–ª–∞—Ö —Ü–∏—Ö —Ä–µ—á–æ–≤–∏–Ω —Ä—ñ–∑–Ω–µ, —Ç–æ–º—É –µ—Ç–∞–Ω–æ–ª —ñ –¥–∏–º–µ—Ç–∏–ª–æ–≤–∏–π –µ—Ñ—ñ—Ä – —Ä—ñ–∑–Ω—ñ —Ä–µ—á–æ–≤–∏–Ω–∏ –∑ —Ä—ñ–∑–Ω–∏–º–∏ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—è–º–∏. –í –æ—Ä–≥–∞–Ω—ñ—á–Ω—ñ–π —Ö—ñ–º—ñ—ó, –¥–ª—è –∑–æ–±—Ä–∞–∂–µ–Ω–Ω—è –º–æ–ª–µ–∫—É–ª —è–∫ –ø—Ä–∞–≤–∏–ª–æ –∫–æ—Ä–∏—Å—Ç—É—é—Ç—å—Å—è —Å—Ç—Ä—É–∫—Ç—É—Ä–Ω–∏–º–∏ —Ñ–æ—Ä–º—É–ª–∞–º–∏.
–ü—Ä–∞–≤–∏–ª–∞ –ø–æ–±—É–¥–æ–≤–∏ —Å—É–º–∞—Ä–Ω–∏—Ö —Ñ–æ—Ä–º—É–ª –¥–≤–æ–µ–ª–µ–º–µ–Ω—Ç–Ω–∏—Ö –∞–±–æ –¥–≤—É—Ö—ñ–æ–Ω–Ω–∏—Ö –Ω–µ–æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Å–ø–æ–ª—É–∫
1. –ó–∞–ø–∏—Å—É—é—Ç—å —Å–∏–º–≤–æ–ª–∏ –µ–ª–µ–º–µ–Ω—Ç—ñ–≤ –∞–±–æ —Ñ–æ—Ä–º—É–ª–∏ —ñ–æ–Ω—ñ–≤, –¥–ª—è –µ–ª–µ–º–µ–Ω—Ç—ñ–≤ –ø–æ–≤–∏–Ω–Ω—ñ –±—É—Ç–∏ –≤—ñ–¥–æ–º—ñ –∞–±–æ –∑–∞–¥–∞–Ω—ñ —ó—Ö —Å—Ç–µ—Ö—ñ–æ–º–µ—Ç—Ä–∏—á–Ω—ñ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—ñ, –∞ –¥–ª—è —ñ–æ–Ω—ñ–≤ – —ó—Ö –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏–π –∑–∞—Ä—è–¥.
–ü—Ä–∏–∫–ª–∞–¥. –î–ª—è —Ñ–æ—Ä–º—É–ª –æ–∫—Å–∏–¥—É –º–∏—à’—è–∫—É(V) —ñ –æ—Ä—Ç–æ—Ñ–æ—Å—Ñ–∞—Ç–∞ –∫–∞–ª—å—Ü—ñ—é, –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–∏–º–∏ –µ–ª–µ–º–µ–Ω—Ç–∞–º–∏ —ñ —ñ–æ–Ω–∞ –º–∏ –±—É–¥—É—Ç—å
AsVOII—ñ ¬Ý ¬ÝCa2+PO43-
2. Знаходять найменше спільне кратне зазначених чисел валентності або заряду. У даному прикладі для першої речовини воно дорівнює 10 = 2 · 5, а для другої 6 = 2 · 3.
3. –î—ñ–ª—è—Ç—å –Ω–∞–π–º–µ–Ω—à–µ —Å–ø—ñ–ª—å–Ω–µ –∫—Ä–∞—Ç–Ω–µ –Ω–∞ –≤–∞–ª–µ–Ω—Ç–Ω—ñ—Å—Ç—å –µ–ª–µ–º–µ–Ω—Ç–∞ –∞–±–æ –Ω–∞ –∑–∞—Ä—è–¥ —ñ–æ–Ω–∞ (–±–µ–∑ —É—Ä–∞—Ö—É–≤–∞–Ω–Ω—è –∑–Ω–∞–∫–∞) —ñ —Ç–∞–∫–∏–º —á–∏–Ω–æ–º –∑–Ω–∞—Ö–æ–¥—è—Ç—å —á–∏—Å–ª–æ –∞—Ç–æ–º—ñ–≤ –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ–≥–æ –µ–ª–µ–º–µ–Ω—Ç–∞ –∞–±–æ –∫—ñ–ª—å–∫—ñ—Å—Ç—å –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–∏—Ö —ñ–æ–Ω—ñ–≤ —É —Ñ–æ—Ä–º—É–ª—ñ —Å–ø–æ–ª—É–∫–∏
AsVOII ¬Ý ¬Ý ¬Ý¬ÝCa2+PO43-
2 ¬Ý ¬Ý5 ¬Ý ¬Ý ¬Ý ¬Ý 3 ¬Ý ¬Ý ¬Ý2
4. –¶—ñ —á–∏—Å–ª–∞ –∑–∞–ø–∏—Å—É—é—Ç—å —É –≤–∏–≥–ª—è–¥—ñ –Ω–∏–∂–Ω—ñ—Ö —ñ–Ω–¥–µ–∫—Å—ñ–≤ –ø—Ä–∞–≤–æ—Ä—É—á –≤—ñ–¥ —Å–∏–º–≤–æ–ª—ñ–≤ –µ–ª–µ–º–µ–Ω—Ç—ñ–≤ –∞–±–æ —Ñ–æ—Ä–º—É–ª —ñ–æ–Ω—ñ–≤ (–æ–ø—É—Å–∫–∞—é—á–∏ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—ñ –µ–ª–µ–º–µ–Ω—Ç—ñ–≤ —ñ –∑–∞—Ä—è–¥–∏ —ñ–æ–Ω—ñ–≤) —ñ –æ—Ç—Ä–∏–º—É—é—Ç—å —Å—É–º–∞—Ä–Ω—ñ —Ñ–æ—Ä–º—É–ª–∏ —Ä–µ—á–æ–≤–∏–Ω
As2O5 ¬Ý ¬Ý ¬Ý¬ÝCa3(PO4)2
–§–æ—Ä–º—É–ª–∏ –±–∞–≥–∞—Ç–æ–µ–ª–µ–º–µ–Ω—Ç–Ω–∏—Ö —ñ–æ–Ω—ñ–≤ –±–µ—Ä—É—Ç—å —É –∫—Ä—É–≥–ª—ñ –¥—É–∂–∫–∏, —â–æ–± –±—É–ª–æ –æ—á–µ–≤–∏–¥–Ω–æ, —â–æ —á–∏—Å–ª–æ–≤–∏–π —ñ–Ω–¥–µ–∫—Å –≤—ñ–¥–Ω–æ—Å–∏—Ç—å—Å—è –¥–æ –≤—Å—ñ—î—ó —Ñ–æ—Ä–º—É–ª–∏ —ñ–æ–Ω–∞ (Ca3(PO4)2).










