Існування великої кількості органічних сполук в значній мірі обумовлено двома особливими властивостями атома карбону. Кожен атом карбону може утворювати чотири ковалентних зв’язки і брати участь у формуванні спільних електронних пар. Крім того, атом карбону має схильність (більше за всі інші хімічні елементи) утворювати гомоядерні зв’язки, створюючи так звані карбонові ланцюги (замкнуті, незамкнуті, розгалужені).
В основному стані атом карбону C(2s22p2) має два неспарених електрона, які можуть утворювати тільки дві спільні електронні пари. Щоб мати можливість взяти участь в утворенні чотирьох спільних електронних пар, атом карбону повинен мати чотири неспарених електрона. Такий стан атома карбону, при якому він має чотири неспарених електрона досягається переходом атома в збуджений стан (C*) при промотуванні (перенесенні) одного 2s-електрона на 2p-підрівень.

У збуджений стан атом карбону переходить під впливом певної кількості енергії, яку називають енергією збудження. Енергія збудження згодом перетворюється в енергію утворення зв’язків. Після збудження 2s- і 2p-атомні орбіталі карбону гибрідизуються трьома різними способами: sp3-гібридизація (тетраедричне розташування осей чотирьох гібридних атомних орбіталей); sp2-гібридизація (трігональне розташування осей трьох гібридних атомних орбіталей); sp-гібридизація (лінійне розташування осей двох гібридних атомних обіталей).
При sp2- і sp-гібридизації тільки три або дві атомні орбіталі карбону беруть участь в утворенні σ-зв’язків. Решта атомних орбіталей (і електрони в них) мають можливість формувати π-складові кратних зв’язків вуглець – вуглець.
Кратність хімічного зв’язку (з точки зору методу валентних зв’язків, МВЗ) – це число загальних електронних пар, що утворюють хімічний зв’язок між двома атомами.
Правильність наведеної моделі утворення чотирьох ковалентних зв’язків (чотирьох σ-зв’язків при sp3-гібридизації, трьох σ- і одного π-зв’язку при sp2-гібридизації, двох σ- і двох π-зв’язків при sp-гібридизації) підтверджується не тільки складом і геометричною формою молекул сполук карбону, а й чотирьохвалентним станом атома карбону в утворених ним простих речовинах, таких як алмаз, графіт і ін.
Приклади утворення хімічних зв’язків в сполуках карбону з трьома типами гібридизації орбіталей його атомів.
1. У молекулі метану CH4 атом карбону (sp3-гібридизація) знаходиться в оточенні чотирьох атомів гідрогену, які знаходяться в вершинах тетраедра. У молекулі метану присутні чотири σ-зв’язки карбон – гідроген.
Метан це найпростіша з органічних сполук карбону, він не містить зв’язків карбон – карбон.
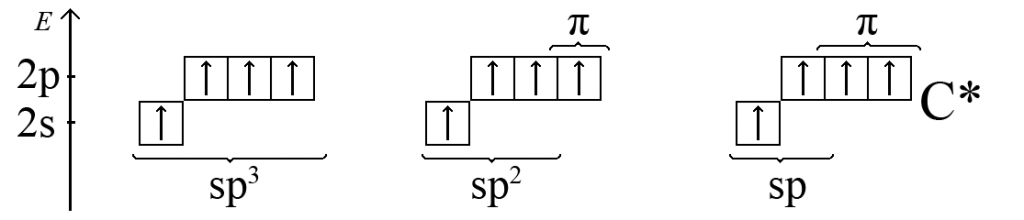
2. У молекулі етану C2H6 кожен атом карбону (sp3-гібридизація) знаходиться в оточенні трьох атомів гідрогену і одного атома карбону, які пов’язані σ-зв’язками. Три sp3-гібридних атомних орбіталі карбону перекриваються (створюють відповідні зв’язуючі молекулярні орбіталі з точки зору ММО) з трьома 1s-атомними орбіталями гідрогену, а четверта sp3-гібридна атомна орбіталь карбону утворює чисто ковалентний одинарний зв’язок C-C з іншим атомом карбону в тому ж стані.
Етан є другим (після метану) членом гомологічного ряду алканів – насичених ациклічних вуглеводнів.
Одинарний зв’язок карбон – карбон зображується рискою «-».
Атоми карбону можуть утворювати ланцюг з одинарним хімічним зв’язком між ними.
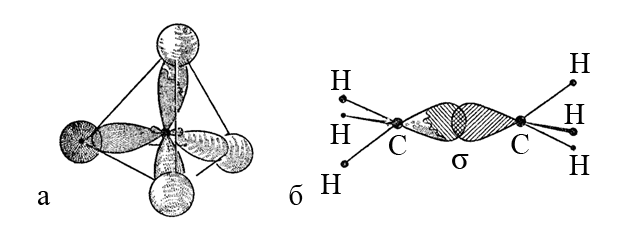
3. У молекулі етену C2H4 атом карбону (sp2-гібридизація) знаходиться в тригональному (трикутному) оточенні, і утворює два σ-зв’язки C-H і один σ, π-зв’язок C=C.
Дві sp2-гібридні атомні орбіталі карбону перекриваються з двома 1s-атомними орбіталями гідрогену, формуючи два σ-зв’язки C-H. Третя sp2-гібридна орбіталь одного атома карбону і така ж орбіталь іншого атома карбону утворюють σ-складову, а негібридні p-орбіталі тих самих атомів утворюють π-складову подвійного зв’язку C=C.
Етен – початковий член гомологічного ряду алкенів ациклічних вуглеводнів, які містять один подвійний зв’язок C=C.
Розділення подвійного зв’язку на σ- і π-складові є умовним, хоча внесок σ-складової в загальну енергію подвійного зв’язку вважається більшим, ніж внесок π-складової. Думка про подвійний зв’язку як про суму двох одинарних зв’язків на практиці не підтверджується і є помилковою.
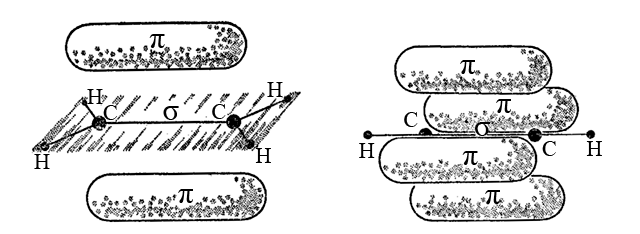
4. У молекулі етіну C2H2 атом карбону (sp-гібридизація) знаходиться в лінійному (дигональному) оточенні і утворює один σ-зв’язок C-H і один σ,π,π-зв’язок C≡C. Одна sp-гібридна атомна орбіталь карбону перекривається з 1s-атомною орбіталью гідрогену і формується σ-зв’язок C-H. Друга sp-гібридна орбіталь одного атома карбону і така ж орбіталь другого атома карбону утворюють σ-складову, а негібридні p-орбіталі тих самих атомів – дві π-складові потрійного зв’язку C≡C.
Як і для подвійного зв’язку, розділення потрійного зв’язку на σ- і π-складові є умовним.
Енергія одинарного, подвійного і потрійного зв’язку карбон-карбон в органічних сполуках має значення 346, 602, 835 кДж/моль відповідно.
Очевидно, що подвійний зв’язок не є енергетичною сумою двох зв’язків C-C (602 < 2 * 346 = 692), а потрійний зв’язок не є сумою трьох зв’язків C-C (835 < 3 * 346 = 1038). Пряме перекривання орбіталей і утворення σ-зв’язку енергетично більш вигідно, ніж бічне перекривання орбіталей і формування π-зв’язку. Це підтверджується тим, що σ-складова подвійних і потрійних зв’язків утворюється в першу чергу і тому визначає геометричну форму молекул, а формування π-складової, якщо воно можливе, лише зміцнює хімічний зв’язок і на геометричну форму молекул не впливає.
Для органічних сполук, які володіють тільки одинарними σ-зв’язками карбон-карбон, наприклад метану і етану, характерні реакції заміщення. До реакцій приєднання без розриву зв’язку C-C (в етані та інших гомологах метану) такі речовини не здатні.
Для органічних сполук, які містять подвійні (σ,π-) і потрійні (σ,π,π-) зв’язки карбон-карбон, наприклад етен та етін, характерні реакції приєднання за місцем розриву π-складових кратних зв’язків (σ-складова, як більш стійка, при цьому зберігається). Реакції заміщення для цих речовин також можливі.
В органічних сполуках карбон може знаходиться також в особливому стані, який називають ароматичним станом. Це особливий вид зв’язування атомів карбону в плоскі цикли (замкнуті ланцюги), в яких всі атоми циклу беруть участь в утворенні єдиної π-електронної системи.
Найвідоміша ароматична сполука – бензен C6H6
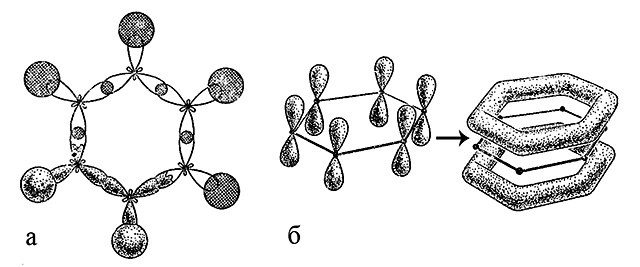
Бензен містить шість атомів карбону, пов’язаних один з одним в цикл (бензенове кільце). Кожен атом карбону знаходиться в sp2-гібридизації, оскільки має три пов’язаних з ним сусідніх атома – атом H і два атоми C; утворюються три σ-зв’язки – один C-H і два C-C. У кожного атома карбону в sp2-гібридизації є ще одна, негібридна 2p-орбіталь з неспареним електроном, яка може утворювати π-зв’язок. Вісь в такій p-орбіталі розташована перпендикулярно площині осей орбіталей, які формують σ-зв’язок. На відміну від молекули етену, при утворенні якої π-зв’язки формуються між двома атомами карбону, в молекулі бензену всі шість 2p-орбіталей комбінуються разом, утворюючи загальну для них зв’язуючу молекулярну π-орбіталь, а шість електронів об’єднуються в π-електронний секстет.
Метод молекулярних орбіталей завжди розглядає утворення зв’язків як усуспільнення електронів в об’ємі простору, що вміщує всі ядра атомів даної молекули. Особливо це вірно для утворення багатоцентрових π-зв’язків. У молекулі бензену утворюється шестичленна молекулярна π-система (6e– в шестицентровой π-молекулярної орбіталі), яка визначає властивості всіх ароматичних сполук.
Електронна хмара π-електронів молекули C6H6 делокалізована по всім шести атомам карбону, тобто по всій молекулі. Утворення багатоцентрових молекулярних орбіталей також особливо вигідно в енергетичному відношенні, що надає стійкості всій системі.
Для бензенового кільця характерні реакції заміщення. При цьому ароматична система залишається незмінною. У реакціях приєднання π-електронний секстет руйнується, через що кожен електрон стає здатним до утворення додаткового σ-зв’язку.










