Атомы водорода, которые ковалентно связаны с атомом элемента, имеющего высокую электроотрицательность (чаще всего F, O, N, а также Cl, S, C), несут на себе относительно высокий эффективный заряд. Вследствие этого такие атомы водорода могут электростатически взаимодействовать с атомами указанных элементов. Так, атом Hδ+ одной молекулы воды ориентируется и соответственно взаимодействует (такое взаимодействие обозначается тремя точками) с атомом Oδ- другой молекулы воды
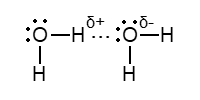
В твердой воде (лед) каждым атом O тетраэдрически окружен четырьмя атомами H (два из них связаны ковалентно, два других – электростатически); получается соответствующая кристаллическая решетка льда. В жидкой воде практически отсутствуют свободные молекулы H2O, они за счет электростатическиго взаимодействия указанного типа об’эдиняются в агрегаты (H2O)n; при комнатной температуре среднее значение n равно 4. Этим объясняется меньшая летучесть воды (т. кип. +100*С), чем у ее аналогов, в частности, у сероводорода H2S (т. кип. -60*С).
Водородная связь – это связь, образуемая атомом H, находящимся между двумя атомами более электроотрицательных элементов
Aδ--Hδ+···Bδ-
Энергия ковалентной составляющей водородной связи A-H имеет значение порядка 1000 кДж/моль (F-H 565, O-H 459, N-H 386 кДж/моль), а электростатическая составляющая – порядка 10 кДж/моль (т.е. она намного менее прочная). Однако силы Ван-дер-Ваальса значительно слабее (≈1 кДж/моль), чем электростатическая составляющая водородной связи.
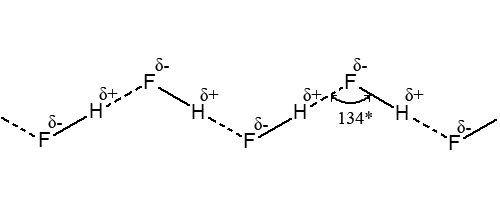
Например, агрегации молекул за счет водородных связей в виде зигзагообразных цепей в жидком фтороводороде HF
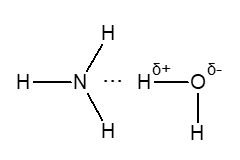
Образование гидрата аммиака NH3*H2O при растворении аммиака в воде
Водородные связи имеют большое значение в химии белка. Многочисленные процессы обмена в живых организмах обусловливаются достаточными (хотя и небольшими) значениями энергии электростатических составляющих водородной связи; они легко образуются и легко разрушаются. Водородные связи, возникающие между соседними цепными молекулами в полимерах, повышают прочность материалов, особенно химических волокон.
Электростатическая модель образования водородных связей верна только в первом приближении, поскольку энергетически дополнительное связывание атома водорода должно иметь химическую природу. Метод валентных связей не может объяснить образование дополнительной связи атома H, т.к. атом водорода одновалентен. Метод молекулярных орбиталей в его многоцентровом варианте дает следующее объяснение образования водородной связи. При сближении атома H, ковалентно связанного с атомом более электроотрицательного элемента Aδ--Hδ+, с другим атомом также более электроотрицательного элемента Bδ- возникает трехцентровая связывающая молекулярная орбиталь, пребывание в которой электронной пары атома Bδ- более выгодно, чем на атомной орбитали этого же атома.










