Метали і сплави металів кристалізуються у формі металічних решіток. Вузли в металічній решітці зайняті позитивними іонами металів. Всі метали, за рідкісним винятком, кристалізуються в одному з трьох типів решіток.

Гранецентрована кубічна решітка з кубічною компактною упаковкою.
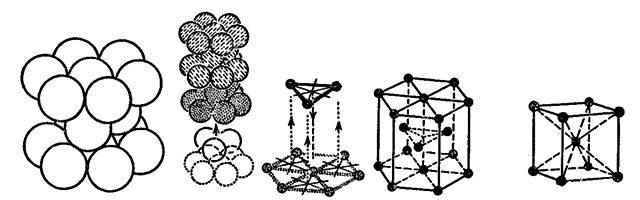
Гексагональна решітка з гексагональною компактною упаковкою і об’ємно центрована кубічна решітка (останнє зображення праворуч, характерна для кристалів лужних металів, барію і деяких перехідних металів).
Назви решіток відповідають упаковці атомів в вершинах і серединах граней елементарного куба; у вигляді гексагональної призми; в вершинах і геометричному центрі елементарного куба.
Заповнення гранецентрованої кубічної і гексагональної решітки атомами металів є максимально компактним за даних геометричних форм, тому такі види упаковок атомів називаються компактними. Компактним упаковкам атомів відповідає і максимальне координаційне число решітки, тобто число найближчих сусідніх атомів, які оточують даний атом в просторі. Для кубічної і гексагональної компактних упаковок координаційне число дорівнює 12, в об’ємно центрованій кубічній решітці координаційне число дорівнює 8.
Валентні електрони, які відокремилися від атомів металів і залишили в вузлах решітки відповідні катіони, більш-менш вільно переміщуються в просторі між катіонами і обумовлюють металеву електричну провідність металів. За аналогією з молекулами газоподібних речовин, які здійснюють хаотичний рух, рухливі електрони розглядають як електронний газ в металі.
Можливість існування металевої решітки забезпечується наявністю електростатичного тяжіння між позитивно зарядженими атомами і негативно зарядженими рухливими електронами. Зв’язуючі кулонівські сили діють на всі сусідні атоми рівномірно і тому вони менш міцні, ніж сили спрямованого хімічного зв’язування в атомних кристалічних решітках. Внаслідок цього більшість металевих простих речовин, на відміну від алмазоподібних речовин, мають відносно низькі температури плавлення. Наприклад, Cs (т. пл. 29*С), Na (т. пл. 98*С), Sn (т. пл. 232*С), Pb (т. пл. 328*С), Al (т. пл. 660*С), Ba (т. пл. 727*С), Ag (т. пл. 962*С), Cu (т. пл. 985*С), Fe (т. пл. 1539*С) . Існує небагато металів, які мають великі температури плавлення, найважливіші з них це Mo (т. пл. 2620*С), Re (т. пл. 3190*С), W (т. пл. 3387*С).
Подібно атомам в атомних решітках і іонам в іонних решітках, катіони в металевих решітках, постійно здійснюють коливання навколо положення вузлів решітки. Амплітуда цих коливань при нагріванні зростає, і при досягненні температури плавлення металу решітка руйнується. Температура плавлення металів, як правило, зростає зі збільшенням числа валентних електронів в їх атомах і зі зменшенням відстані між атомами в решітці (цей параметр решітки позначимо буквою а). Наприклад, натрій Na має 1 валентний електрон, параметр а = 4,3e-10 м, т. пл. 98*С; калій K має, так само як і натрій, 1 валентний електрон, але відстань між атомами в решітці більша, параметр а = 5,3e-10 м, т. пл. 64*С; кальцій Ca має 2 валентних електрони, відстань між атомами в решітці, близька до значення параметра а калію, а = 5,5e-10 м, а ось т. пл. вже набагато більша -842*С.
Від упаковки кристалічних решіток залежить здатність до пластичної деформації (ковкість) металів. Вона тим вища, чим більше в металевій решітці компактних шарів (площин трансляції, тобто площин паралельного перенесення шарів) і чим менше пустот, які гальмують ковзання шарів. Найменша гнучкість у металів з гексагональною решіткою, проміжна – з об’ємно центрованою кубічною решіткою і найбільша – з гранецентрованою кубічною решіткою.
Наприклад, при нагріванні заліза до 911*С низькотемпературна об’ємно центрована кубічна решітка (так зване альфа залізо) переходить в гранецентровану кубічну решітку (так зване гамма залізо) з цієї причини розпечене залізо значно легше піддається куванню.
При затвердінні металевих розплавів відбувається масова кристалізація і виникає одночасно безліч дрібних кристаликів, вони називаються кристаліти. Збільшення розміру кристалітів протікає в оточенні подібних дрібних кристалів; при цьому виключається значне збільшення розмірів кристалітів і тому їх не видно візуально на зламі металу, зразок металу здається монолітним.
Сплав – це суміш двох або більше індивідуальних металів.
У сплавах можуть бути присутні не тільки метали, а й включення неметалічної природи, так звані легуючі елементи, наприклад C, Si, S. Поширеним методом отримання сплавів є спільне нагрівання їх складових частин до повного розплавлення суміші і утворення сплаву складових металів. Однак є метали, що не сплавляються один з одним в будь-яких співвідношеннях.
Металеві сплави можна класифікувати так:
– тверді розчини вкорінення;
– тверді розчини заміщення;
– суміші індивідуальних кристалів металів;
– суміші кристалів інтерметалічних сполук.
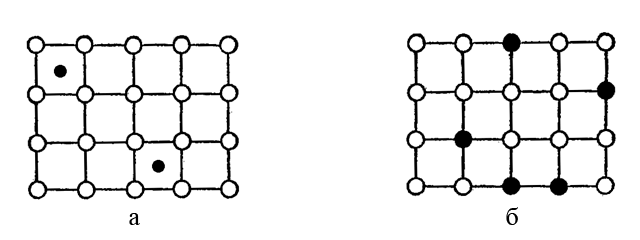
В сплавах, що представляють собою твердий розчин вкорінення (мал. а), частина міжвузлових порожнин металічної кристалічної решітки зайнята атомами іншого елемента (наприклад, карбону). Сплави з домішками вкорінення, наприклад, чавун, сталь, що містять домішкові атоми карбону, значно твердіші, ніж чисте залізо.
У сплавах – твердих розчинах заміщення (мал. б) частина атомів основної речовини замінена на атоми домішкового елемента. Сплави, що складаються з суміші індивідуальних кристалічних компонентів, утворюються при дотриманні певного співвідношення; такі сплави називають також евтектичні суміші. Евтектичною сумішшю є широко відомий олов’яний припій – третнік (64% Sn і 36% Pb) з т. пл. 181*С.
Сплавлені метали можуть утворювати між собою хімічні сполуки – інтерметаліди. Наприклад, в бронзі (сплав на основі Cu і Sn, з домішками Al, Be, Pb і ін.) Присутня інтерметалічна сполука, яка має склад Cu3Sn, а в латуні (сплаві на основі Cu і Zn, з домішками Al, Fe, Mn і ін. ) присутня інтерметалічна сполука складу CuZn3. Найважливішою складовою частиною сталі є ферум карбід Fe2C (цементит), який також є інтерметалічною сполукою. Склад інтерметалідів зазвичай не відповідає стехіометричній валентності елементів.
Інтерметаліди – це нестехіометричні сполуки, які складають великий клас неорганічних речовин з нестехіометричним складом.
Багато елементів утворюють кілька нестехіометричних сполук; так, взаємодія заліза з фосфором утворює фосфіди складу Fe3P, Fe2P, FeP, FeP2. Формули цих сполук вказують лише на те, що для кристалічних решіток характерним є певне співвідношення компонентів, наприклад в Fe3C на кожні три атома Fe – один атом C.
Провідники, діелектрики, напівпровідники
У кристалічній решітці електрони розташовуються на певних енергетичних рівнях так само, як і в атомі. Відповідно до принципу Паулі в одному кристалі кожні два електрона (з антипаралельними спинами) знаходяться в чітко визначеному енергетичному стані. Отже, для безлічі пар електронів в кристалі має бути безліч енергетичних станів. Тому в кристалі замість окремих енергетичних підрівнів виділяють групи енергетично близьких станів – енергетичні зони. Зони можуть бути відокремлені одна від одної, але можуть і перекриватися. Викладені вище положення складають основу Зоїної теорії електронної будови кристалів.
На малюнку показані енергетичні зони, характерні для кристала натрію (зонна модель металу натрію), які утворюються з атомних енергетичних рівнів натрію. Енергетичні 1s-, 2s-, 2p-зони заповнені 1s22s22p6-електронами кожного атома натрію, 3s-зона – валентними 3s1-електронами, 3p-зона залишається вакантною.
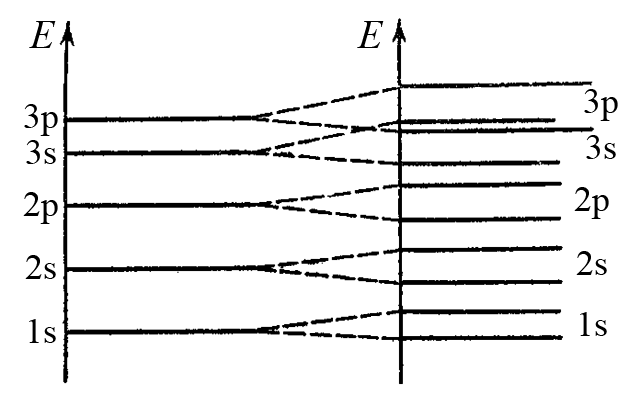
Зона, в якій знаходяться валентні електрони, називається валентна зона, а вакантна зона (що знаходиться над валентною зоною) – це зона провідності електричного струму. У кристалі натрію валентною зоною є 3s-зона, а зоною провідності – 3p-зона.
Відповідно до зонної теорії електрична провідність кристала обумовлена тим, що, по-перше, в межах неповністю зайнятої валентної зони є багато вільних енергетичних станів, між якими можлива міграція валентних електронів, і, по-друге, валентні електрони здатні залишати валентну зону і переходити в зону провідності.
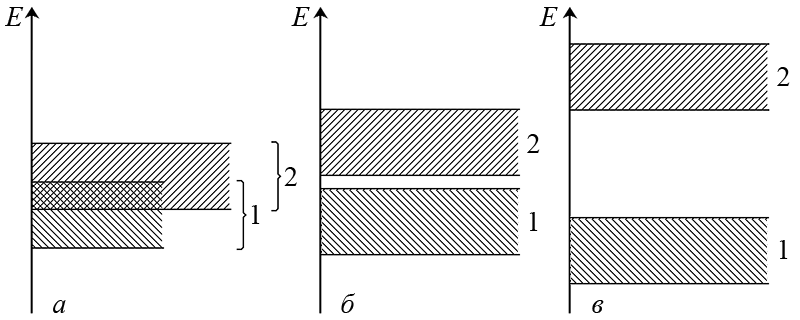
Перехід електронів з валентної зони в зону провідності протікає майже без труднощів, якщо ці зони перекриваються (мал. а). Таке розташування зон характерно для металів, яким завдяки цьому властива електронна провідність. Тому метали – провідники (проводять електричний струм).
Якщо між валентною зоною і зоною провідності є великий енергетичний зазор (мал. в), який має назву, в межах квантово-механічних термінів, заборонена зона, то перехід електронів є неможливим, і такі речовини називають – діелектрики (ізолятори, не проводять електричний струм). Зазвичай діелектриками є ковалентні сполуки, іонні кристали і алмазоподібні неметалеві прості речовини. Наприклад фосфор(ІІІ) йодид PI3, NaCl і алмаз, на відміну від якого графіт – провідник.
При наявності незначного енергетичного зазору (мал. б) валентні електрони, які отримують під зовнішнім впливом, наприклад, теплового або світлового опромінення додаткову енергію (збуджуються, так само як в атомі), і здатні долати заборонену зону – перестрибують в зону провідності. В результаті виникає електронна провідність речовини, що використовується в техніці (наприклад, фотодіоди, сонячні батареї і ін.).
Напівпровідники – це речовини, електронна будова яких характеризується вузькими забороненими енергетичними зонами.
У старій фізичній літературі, прості речовини з напівпровідниковими властивостями називали напівметал, або металоїдами. Сьогодні такі назви вважаються застарілими.
До напівпровідників відносяться кремній, германій, селен і телур. Також напівпровідникові властивості мають і деякі сполуки, наприклад GaAs, InP, ZnTe.
Електронну провідність можна створити або збільшити штучним шляхом – введенням домішкових атомів інших елементів в основну речовину.
Легування напівпровідника – це процес вкорінення домішкових атомів в основну речовину з метою збільшення електричної провідності.
Наприклад, напівпровідникові властивості кремнію (атом якого має 4 валентних електрони) можна поліпшити введенням в кристал домішкових атомів бору (3 валентних електрона) або домішкових атомів фосфору (5 валентних електронів). Кожен атом P вводить в кристалічну решітку кремнію один надлишковий валентний електрон, а кожен атом B виводить один електрон. Нестача одного електрона відповідає так званій позитивно зарядженій «дірці».
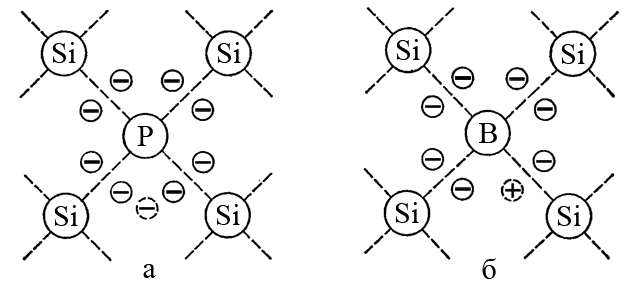
«Дірки» це позитивно заряджені зони відсутності електронів. Атоми фосфору забезпечують додаткову електронну провідність, характерну для напівпровідників n-типу; атоми бору створюють «дірку» провідність, характерну для напівпровідників p-типу.
Надлишкові електрони (наприклад за рахунок введення атомів фосфору) знаходяться на енергетичному рівні, який лежить трохи нижче зони провідності основної речовини (наприклад, кремнію) і називається домішковий донорний рівень (мал. а).
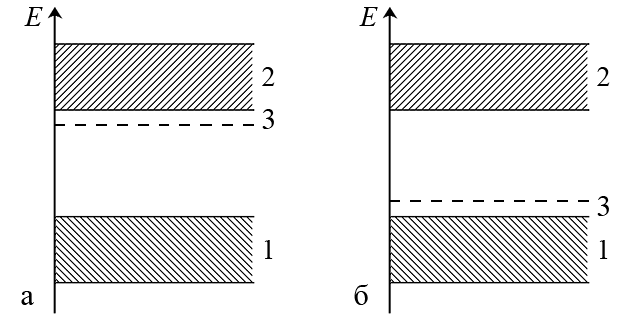
З огляду на малу ширину забороненої зони між донорним рівнем і зоною провідності домішкові електрони легко переходять в зону провідності і таким чином покращують властивості напівпровідника n-типу.
При нестачі електронів, викликаній домішковими атомами (наприклад, бору), тобто при виникненні позитивних «дірок», утворюється домішковий акцепторний рівень (мал. б). Цей рівень розташовується трохи вище рівня валентної зони основної речовини (наприклад, кремнію). Електрони основної речовини легко переходять на акцепторний рівень, а у валентній зоні з’являються додаткові позитивні «дірки», які заповнюються іншими електронами. Такий зустрічний рух «дірок» і електронів створює електричний струм в напівпровіднику p-типу.
Шляхом легування можна отримувати напівпровідники (наприклад методом фотолітографії) з наперед заданими властивостями. Це дозволяє створювати електронні елементи, такі як транзистори, діоди, фотоелементи та ін. І використовувати їх для конструювання мікросхем, мікропроцесорів, різних типів датчиків (термоелектронні датчики, світлочутливі матриці в цифрових фотоапаратах) використовуваних в сучасних комп’ютерах, смартфонах, планшетах та інших електронних пристроях .










