ą£ąĄčéą░ą╗ą╗čŗ ąĖ čüą┐ą╗ą░ą▓čŗ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ą║čĆąĖčüčéą░ą╗ą╗ąĖąĘčāčÄčéčüčÅ ą▓ č乊čĆą╝ąĄ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ čĆąĄčłąĄč鹊ą║. ąŻąĘą╗čŗ ą▓ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĄ ąĘą░ąĮčÅčéčŗ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗą╝ąĖ ąĖąŠąĮą░ą╝ąĖ ą╝ąĄčéą░ą╗ą╗ąŠą▓ (ą░č鹊ą╝ąĮčŗą╝ąĖ ąŠčüč鹊ą▓ą░ą╝ąĖ ą╝ąĄčéą░ą╗ą╗ąŠą▓). ąÆčüąĄ ą╝ąĄčéą░ą╗ą╗čŗ, ąĘą░ čĆąĄą┤ą║ąĖą╝ ąĖčüą║ą╗čÄč湥ąĮąĖąĄą╝, ą║čĆąĖčüčéą░ą╗ą╗ąĖąĘčāčÄčéčüčÅ ą▓ ąŠą┤ąĮąŠą╝ ąĖąĘ čéčĆąĄčģ čéąĖą┐ąŠą▓ čĆąĄčłąĄč鹊ą║, čüčéčĆąŠąĄąĮąĖąĄ ą║ąŠč鹊čĆčŗčģ ą┐ąŠą║ą░ąĘą░ąĮąŠ ąĮą░ čĆąĖčüčāąĮą║ąĄ.

ąōčĆą░ąĮąĄčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮą░čÅ ą║čāą▒ąĖč湥čüą║ą░čÅ čĆąĄčłąĄčéą║ą░ čü ą║čāą▒ąĖč湥čüą║ąŠą╣ ą┐ą╗ąŠčéąĮąĄą╣čłąĄą╣ čāą┐ą░ą║ąŠą▓ą║ąŠą╣.
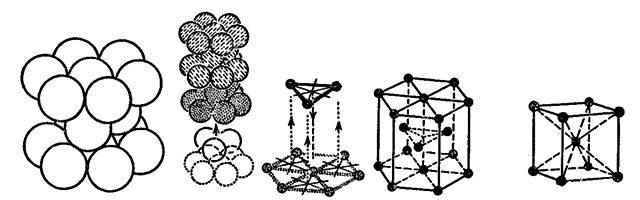
ąōąĄą║čüą░ą│ąŠąĮą░ą╗čīąĮą░čÅ čĆąĄčłąĄčéą║ą░ čü ą│ąĄą║čüą░ą│ąŠąĮą░ą╗čīąĮąŠą╣ ą┐ą╗ąŠčéąĮąĄą╣čłąĄą╣ čāą┐ą░ą║ąŠą▓ą║ąŠą╣ ąĖ ąŠą▒čŖąĄą╝ąĮąŠ čåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮą░čÅ ą║čāą▒ąĖč湥čüą║ą░čÅ čĆąĄčłąĄčéą║ą░ (ą┐ąŠčüą╗ąĄą┤ąĮąĄąĄ ąĖąĘąŠą▒čĆą░ąČąĄąĮąĖąĄ čüą┐čĆą░ą▓ą░, čģą░čĆą░ą║č鹥čĆąĮą░ ą┤ą╗čÅ ą║čĆąĖčüčéą░ą╗ą╗ąŠą▓ čēąĄą╗ąŠčćąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓, ą▒ą░čĆąĖčÅ ąĖ ąĮąĄą║ąŠč鹊čĆčŗčģ ą┐ąĄčĆąĄčģąŠą┤ąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓).
ąØą░ąĘą▓ą░ąĮąĖčÅ čĆąĄčłąĄč鹊ą║ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčé čāą┐ą░ą║ąŠą▓ą║ąĄ ą░č鹊ą╝ąĮčŗčģ ąŠčüč鹊ą▓ąŠą▓ ą▓ ą▓ąĄčĆčłąĖąĮą░čģ ąĖ čüąĄčĆąĄą┤ąĖąĮą░čģ ą│čĆą░ąĮąĄą╣ 菹╗ąĄą╝ąĄąĮčéą░čĆąĮąŠą│ąŠ ą║čāą▒ą░; ą▓ ą▓ąĖą┤ąĄ ą│ąĄą║čüą░ą│ąŠąĮą░ą╗čīąĮąŠą╣ ą┐čĆąĖąĘą╝čŗ; ą▓ ą▓ąĄčĆčłąĖąĮą░čģ ąĖ ą│ąĄąŠą╝ąĄčéčĆąĖč湥čüą║ąŠą╝ čåąĄąĮčéčĆąĄ 菹╗ąĄą╝ąĄąĮčéą░čĆąĮąŠą│ąŠ ą║čāą▒ą░.
ąŚą░ą┐ąŠą╗ąĮąĄąĮąĖąĄ ą│čĆą░ąĮąĄčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą║čāą▒ąĖč湥čüą║ąŠą╣ ąĖ ą│ąĄą║čüą░ą│ąŠąĮą░ą╗čīąĮąŠą╣ čĆąĄčłąĄč鹊ą║ ą░č鹊ą╝ąĮčŗą╝ąĖ ąŠčüč鹊ą▓ą░ą╝ąĖ čÅą▓ą╗čÅąĄčéčüčÅ ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮąŠ ą▓ąŠąĘą╝ąŠąČąĮčŗą╝ ą┐čĆąĖ ą┤ą░ąĮąĮčŗčģ ą│ąĄąŠą╝ąĄčéčĆąĖč湥čüą║ąĖčģ čĆą░ąĘą╝ąĄčĆą░čģ ą░č鹊ą╝ąĮčŗčģ ąŠčüč鹊ą▓ąŠą▓ ą╝ąĄčéą░ą╗ą╗ąŠą▓, ą┐ąŠčŹč鹊ą╝čā čéą░ą║ąĖąĄ ą▓ąĖą┤čŗ čāą┐ą░ą║ąŠą▓ąŠą║ ą░č鹊ą╝ąŠą▓ ąĮą░ąĘčŗą▓ą░čÄčéčüčÅ ą┐ą╗ąŠčéąĮąĄą╣čłąĖą╝ąĖ. ą¤ą╗ąŠčéąĮąĄą╣čłąĖą╝ čāą┐ą░ą║ąŠą▓ą║ą░ą╝ ą░č鹊ą╝ąŠą▓ čüąŠąŠčéą▓ąĄčéčüčéą▓čāąĄčé ąĖ ą╝ą░ą║čüąĖą╝ą░ą╗čīąĮąŠąĄ ą║ąŠąŠčĆą┤ąĖąĮą░čåąĖąŠąĮąĮąŠąĄ čćąĖčüą╗ąŠ čĆąĄčłąĄčéą║ąĖ, čé.ąĄ. čćąĖčüą╗ąŠ ą▒ą╗ąĖąČą░ą╣čłąĖčģ čüąŠčüąĄą┤ąĄą╣, ąŠą║čĆčāąČą░čÄčēąĖčģ ą┤ą░ąĮąĮčŗą╣ ą░č鹊ą╝ąĮčŗą╣ ąŠčüč鹊ą▓ ą▓ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄ. ąöą╗čÅ ą║čāą▒ąĖč湥čüą║ąŠą╣ ąĖ ą│ąĄą║čüą░ą│ąŠąĮą░ą╗čīąĮąŠą╣ ą┐ą╗ąŠčéąĮąĄą╣čłąĖčģ čāą┐ą░ą║ąŠą▓ąŠą║ ą║ąŠąŠčĆą┤ąĖąĮą░čåąĖąŠąĮąĮąŠąĄ čćąĖčüą╗ąŠ čĆą░ą▓ąĮąŠ 12, ą▓ ąŠą▒čŖąĄą╝ąĮąŠ čåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą║čāą▒ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĄ ą║ąŠąŠčĆą┤ąĖąĮą░čåąĖąŠąĮąĮąŠąĄ čćąĖčüą╗ąŠ čĆą░ą▓ąĮąŠ 8.
ąÆą░ą╗ąĄąĮčéąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ, ąŠčéą┤ąĄą╗ąĖą▓čłąĖąĄčüčÅ ąŠčé ą░č鹊ą╝ąŠą▓ ą╝ąĄčéą░ą╗ą╗ąŠą▓ ąĖ ąŠčüčéą░ą▓ąĖą▓čłąĖąĄ ą▓ čāąĘą╗ą░čģ čĆąĄčłąĄčéą║ąĖ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĖąĄ ą░č鹊ą╝ąĮčŗąĄ ąŠčüč鹊ą▓čŗ (ą║ą░čéąĖąŠąĮčŗ), ą▒ąŠą╗ąĄąĄ ąĖą╗ąĖ ą╝ąĄąĮąĄąĄ čüą▓ąŠą▒ąŠą┤ąĮąŠ ą┐ąĄčĆąĄą╝ąĄčēą░čÄčéčüčÅ ą▓ ą┐čĆąŠčüčéčĆą░ąĮčüčéą▓ąĄ ą╝ąĄąČą┤čā ą║ą░čéąĖąŠąĮą░ą╝ąĖ ąĖ ąŠą▒čāčüą╗ąŠą▓ą╗ąĖą▓ą░čÄčé ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║čāčÄ čŹą╗ąĄą║čéčĆąĖč湥čüą║čāčÄ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéčī ą╝ąĄčéą░ą╗ą╗ąŠą▓. ą¤ąŠ ą░ąĮą░ą╗ąŠą│ąĖąĖ čü ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ ą│ą░ąĘąŠąŠą▒čĆą░ąĘąĮąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░, čüąŠą▓ąĄčĆčłą░čÄčēąĖą╝ąĖ čģą░ąŠčéąĖč湥čüą║ąŠąĄ ą┤ą▓ąĖąČąĄąĮąĖąĄ, ą┐ąŠą┤ą▓ąĖąČąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ čĆą░čüčüą╝ą░čéčĆąĖą▓ą░čÄčé ą║ą░ą║ 菹╗ąĄą║čéčĆąŠąĮąĮčŗą╣ ą│ą░ąĘ ą▓ ą╝ąĄčéą░ą╗ą╗ąĄ.
ąŻčüč鹊ą╣čćąĖą▓ąŠčüčéčī ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĖ ąŠą▒ąĄčüą┐ąĄčćąĖą▓ą░ąĄčéčüčÅ ąĮą░ą╗ąĖčćąĖąĄą╝ 菹╗ąĄą║čéčĆąŠčüčéą░čéąĖč湥čüą║ąŠą│ąŠ ą┐čĆąĖčéčÅąČąĄąĮąĖčÅ ą╝ąĄąČą┤čā ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗą╝ąĖ ą░č鹊ą╝ąĮčŗą╝ąĖ ąŠčüč鹊ą▓ą░ą╝ąĖ ąĖ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗą╝ąĖ ą┐ąŠą┤ą▓ąĖąČąĮčŗą╝ąĖ 菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ. ąĪą▓čÅąĘčŗą▓ą░čÄčēąĖąĄ ą║čāą╗ąŠąĮąŠą▓čüą║ąĖąĄ čüąĖą╗čŗ ą┤ąĄą╣čüčéą▓čāčÄčé ąĮą░ ą▓čüąĄ čüąŠčüąĄą┤ąĮąĖąĄ ą░č鹊ą╝ąĮčŗąĄ ąŠčüč鹊ą▓čŗ čĆą░ą▓ąĮąŠą╝ąĄčĆąĮąŠ ąĖ ą┐ąŠčŹč鹊ą╝čā ąŠąĮąĖ ą╝ąĄąĮąĄąĄ ą┐čĆąŠčćąĮčŗąĄ, č湥ą╝ čüąĖą╗čŗ ąĮą░ą┐čĆą░ą▓ą╗ąĄąĮąĮąŠą│ąŠ čģąĖą╝ąĖč湥čüą║ąŠą│ąŠ čüą▓čÅąĘčŗą▓ą░ąĮąĖčÅ ą▓ ą░č鹊ą╝ąĮčŗčģ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ čĆąĄčłąĄčéą║ą░čģ. ąÆčüą╗ąĄą┤čüčéą▓ąĖąĄ čŹč鹊ą│ąŠ ą▒ąŠą╗čīčłąĖąĮčüčéą▓ąŠ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą┐čĆąŠčüčéčŗčģ ą▓ąĄčēąĄčüčéą▓, ą▓ ąŠčéą╗ąĖčćąĖąĄ ąŠčé ą░ą╗ą╝ą░ąĘąŠą┐ąŠą┤ąŠą▒ąĮčŗčģ ą▓ąĄčēąĄčüčéą▓, ąĖą╝ąĄčÄčé ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮąŠ ąĮąĖąĘą║ąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ą┐ą╗ą░ą▓ą╗ąĄąĮąĖčÅ. ąØą░ą┐čĆąĖą╝ąĄčĆ, Cs (čé. ą┐ą╗. 29*ąĪ), Na (čé. ą┐ą╗. 98*ąĪ), Sn (čé. ą┐ą╗. 232*ąĪ), Pb (čé. ą┐ą╗. 328*ąĪ), Al (čé. ą┐ą╗. 660*ąĪ), Ba (čé. ą┐ą╗. 727*ąĪ), Ag (čé. ą┐ą╗. 962*ąĪ), Cu (čé. ą┐ą╗. 985*ąĪ), Fe (čé. ą┐ą╗. 1539*ąĪ). ąĪčāčēąĄčüčéą▓čāąĄčé ąĮąĄą╝ąĮąŠą│ąŠ ą╝ąĄčéą░ą╗ą╗ąŠą▓, ą║ąŠč鹊čĆčŗąĄ ąĖą╝ąĄčÄčé ą▒ąŠą╗čīčłąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ą┐ą╗ą░ą▓ą╗ąĄąĮąĖčÅ, ą▓ą░ąČąĮąĄą╣čłąĖąĄ ąĖąĘ ąĮąĖčģ čŹč鹊 Mo (čé. ą┐ą╗. 2620*ąĪ), Re (čé. ą┐ą╗. 3190*ąĪ), W (čé. ą┐ą╗. 3387*ąĪ).
ą¤ąŠą┤ąŠą▒ąĮąŠ ą░č鹊ą╝ą░ą╝ ą▓ ą░č鹊ą╝ąĮčŗčģ čĆąĄčłąĄčéą║ą░čģ ąĖ ąĖąŠąĮą░ą╝ ą▓ ąĖąŠąĮąĮčŗčģ čĆąĄčłąĄčéą║ą░čģ, ą║ą░čéąĖąŠąĮčŗ ą▓ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ čĆąĄčłąĄčéą║ą░čģ, ąĮąĄ ąŠą▒ą╗ą░ą┤ą░čÄčēąĖąĄ ą┐ąŠčüčéčāą┐ą░č鹥ą╗čīąĮčŗą╝ ą┤ą▓ąĖąČąĄąĮąĖąĄą╝, ą┐ąŠčüč鹊čÅąĮąĮąŠ čüąŠą▓ąĄčĆčłą░čÄčé ą║ąŠą╗ąĄą▒ą░ąĮąĖčÅ ą▓ąŠą║čĆčāą│ ą┐ąŠą╗ąŠąČąĄąĮąĖčÅ čāąĘą╗ąŠą▓ čĆąĄčłąĄčéą║ąĖ. ąÉą╝ą┐ą╗ąĖčéčāą┤ą░ čŹčéąĖčģ ą║ąŠą╗ąĄą▒ą░ąĮąĖą╣ ą┐čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ ą▓ąŠąĘčĆą░čüčéą░ąĄčé, ąĖ ą┐čĆąĖ ą┤ąŠčüčéąĖąČąĄąĮąĖąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ą┐ą╗ą░ą▓ą╗ąĄąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ą░ čĆąĄčłąĄčéą║ą░ čĆą░ąĘčĆčāčłą░ąĄčéčüčÅ. ąóąĄą╝ą┐ąĄčĆą░čéčāčĆą░ ą┐ą╗ą░ą▓ą╗ąĄąĮąĖčÅ ą╝ąĄčéą░ą╗ą╗ąŠą▓, ą║ą░ą║ ą┐čĆą░ą▓ąĖą╗ąŠ, ą▓ąŠąĘčĆą░čüčéą░ąĄčé čü čāą▓ąĄą╗ąĖč湥ąĮąĖąĄą╝ čćąĖčüą╗ą░ ą▓ą░ą╗ąĄąĮčéąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ą▓ ąĖčģ ą░č鹊ą╝ą░čģ ąĖ čü čāą╝ąĄąĮčīčłąĄąĮąĖąĄą╝ čĆą░čüčüč鹊čÅąĮąĖčÅ ą╝ąĄąČą┤čā ą░č鹊ą╝ąĮčŗą╝ąĖ ąŠčüč鹊ą▓ą░ą╝ąĖ ą▓ čĆąĄčłąĄčéą║ąĄ (čŹč鹊čé ą┐ą░čĆą░ą╝ąĄčéčĆ čĆąĄčłąĄčéą║ąĖ ąŠą▒ąŠąĘąĮą░čćą░ąĄčéčüčÅ ą▒čāą║ą▓ąŠą╣ ą░). ąØą░ą┐čĆąĖą╝ąĄčĆ, ąĮą░čéčĆąĖą╣ Na ąĖą╝ąĄąĄčé 1 ą▓ą░ą╗ąĄąĮčéąĮčŗą╣ 菹╗ąĄą║čéčĆąŠąĮ, ą┐ą░čĆą░ą╝ąĄčéčĆ ą░ = 4,3e-10 ą╝, čé. ą┐ą╗. 98*ąĪ; ą║ą░ą╗ąĖą╣ K ąĖą╝ąĄąĄčé čéą░ą║ąČąĄ ą║ą░ą║ ąĖ ąĮą░čéčĆąĖą╣ – 1 ą▓ą░ą╗ąĄąĮčéąĮčŗą╣ 菹╗ąĄą║čéčĆąŠąĮ, ąĮąŠ čĆą░čüčüč鹊čÅąĮąĖąĄ ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ ą▓ čĆąĄčłąĄčéą║ąĄ ą▒ąŠą╗čīčłąĄ, ą┐ą░čĆą░ą╝ąĄčéčĆ ą░ = 5,3e-10 ą╝, čé. ą┐ą╗. 64*ąĪ; ą║ą░ą╗čīčåąĖą╣ Ca ąĖą╝ąĄąĄčé 2 ą▓ą░ą╗ąĄąĮčéąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮą░, čĆą░čüčüč鹊čÅąĮąĖąĄ ą╝ąĄąČą┤čā ą░č鹊ą╝ą░ą╝ąĖ ą▓ čĆąĄčłąĄčéą║ąĄ, ą▒ą╗ąĖąĘą║ąŠ ą║ ąĘąĮą░č湥ąĮąĖčÄ ą┐ą░čĆą░ą╝ąĄčéčĆą░ ą░ ą║ą░ą╗ąĖčÅ, ą░ = 5,5e-10 ą╝, ą░ ą▓ąŠčé čé. ą┐ą╗. čāąČąĄ ąĮą░ą╝ąĮąŠą│ąŠ ą▒ąŠą╗čīčłąĄ – 842*ąĪ.
ą×čé čāą┐ą░ą║ąŠą▓ą║ąĖ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ čĆąĄčłąĄč鹊ą║ ąĘą░ą▓ąĖčüąĖčé ą┐ą╗ą░čüčéąĖč湥čüą║ą░čÅ ą┤ąĄč乊čĆą╝ąĖčĆčāąĄą╝ąŠčüčéčī (ą║ąŠą▓ą║ąŠčüčéčī) ą╝ąĄčéą░ą╗ą╗ąŠą▓. ą×ąĮą░ č鹥ą╝ ą▓čŗčłąĄ, č湥ą╝ ą▒ąŠą╗čīčłąĄ ą▓ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĄ ą┐ą╗ąŠčéąĮąĄą╣čłąĖčģ čłą░čĆąŠą▓čŗčģ čüą╗ąŠąĄą▓ (ą┐ą╗ąŠčüą║ąŠčüč鹥ą╣ čéčĆą░ąĮčüą╗čÅčåąĖąĖ, čé.ąĄ. ą┐ą╗ąŠčüą║ąŠčüč鹥ą╣ ą┐ą░čĆą░ą╗ą╗ąĄą╗čīąĮąŠą│ąŠ ą┐ąĄčĆąĄąĮąŠčüą░ čüą╗ąŠąĄą▓) ąĖ č湥ą╝ ą╝ąĄąĮčīčłąĄ ą┐čāčüč鹊čé, č鹊čĆą╝ąŠąĘčÅčēąĖčģ čüą║ąŠą╗čīąČąĄąĮąĖąĄ čüą╗ąŠąĄą▓. ąØą░ąĖą╝ąĄąĮčīčłą░čÅ ą║ąŠą▓ą║ąŠčüčéčī čā ą╝ąĄčéą░ą╗ą╗ąŠą▓ čü ą│ąĄą║čüą░ą│ąŠąĮą░ą╗čīąĮąŠą╣ čĆąĄčłąĄčéą║ąŠą╣, ą┐čĆąŠą╝ąĄąČčāč鹊čćąĮą░čÅ ŌĆō čü ąŠą▒čŖąĄą╝ąĮąŠ čåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą║čāą▒ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąŠą╣ ąĖ ąĮą░ąĖą▒ąŠą╗čīčłą░čÅ ŌĆō čü ą│čĆą░ąĮąĄčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮąŠą╣ ą║čāą▒ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąŠą╣.
ąØą░ą┐čĆąĖą╝ąĄčĆ, ą┐čĆąĖ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĖ ąČąĄą╗ąĄąĘą░ ą┤ąŠ 911*ąĪ ąĮąĖąĘą║ąŠč鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮą░čÅ ąŠą▒čŖąĄą╝ąĮąŠ čåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮą░čÅ ą║čāą▒ąĖč湥čüą║ą░čÅ čĆąĄčłąĄčéą║ą░ (čéą░ą║ ąĮą░ąĘčŗą▓ą░ąĄą╝ąŠąĄ ą░ą╗čīčäą░ ąČąĄą╗ąĄąĘąŠ) ą┐ąĄčĆąĄčģąŠą┤ąĖčé ą▓ ą│čĆą░ąĮąĄčåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮčāčÄ ą║čāą▒ąĖč湥čüą║čāčÄ čĆąĄčłąĄčéą║čā (čéą░ą║ ąĮą░ąĘčŗą▓ą░ąĄą╝ąŠąĄ ą│ą░ą╝ą╝ą░ ąČąĄą╗ąĄąĘąŠ) ą┐ąŠ čŹč鹊ą╣ ą┐čĆąĖčćąĖąĮąĄ čĆą░čüą║ą░ą╗čæąĮąĮąŠąĄ ąČąĄą╗ąĄąĘąŠ ąĘąĮą░čćąĖč鹥ą╗čīąĮąŠ ą╗ąĄą│č湥 ą┐ąŠą┤ą┤ą░ąĄčéčüčÅ ą║ąŠą▓ą║ąĄ.
ą¤čĆąĖ ąĘą░čéą▓ąĄčĆą┤ąĄą▓ą░ąĮąĖąĖ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ čĆą░čüą┐ą╗ą░ą▓ąŠą▓ ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą╝ą░čüčüąŠą▓ą░čÅ ą║čĆąĖčüčéą░ą╗ą╗ąĖąĘą░čåąĖčÅ ąĖ ą▓ąŠąĘąĮąĖą║ą░ąĄčé ąŠą┤ąĮąŠą▓čĆąĄą╝ąĄąĮąĮąŠ ą╝ąĮąŠąČąĄčüčéą▓ąŠ ą╝ąĄą╗ą║ąĖčģ ą║čĆąĖčüčéą░ą╗ą╗ąĖą║ąŠą▓, ąŠąĮąĖ ąĮą░ąĘčŗą▓ą░čÄčéčüčÅ ą║čĆąĖčüčéą░ą╗ą╗ąĖčéą░ą╝ąĖ. ąĀąŠčüčé ą║čĆąĖčüčéą░ą╗ą╗ąĖč鹊ą▓ ą┐čĆąŠč鹥ą║ą░ąĄčé ą▓ ąŠą║čĆčāąČąĄąĮąĖąĖ ą┐ąŠą┤ąŠą▒ąĮčŗčģ ą╝ąĄą╗ą║ąĖčģ ą║čĆąĖčüčéą░ą╗ą╗ąŠą▓; ą┐čĆąĖ čŹč鹊ą╝ ąĖčüą║ą╗čÄčćą░ąĄčéčüčÅ ąĘąĮą░čćąĖč鹥ą╗čīąĮąŠąĄ čāą▓ąĄą╗ąĖč湥ąĮąĖąĄ čĆą░ąĘą╝ąĄčĆąŠą▓ ą║čĆąĖčüčéą░ą╗ą╗ąĖč鹊ą▓ ąĖ ą┐ąŠčŹč鹊ą╝čā ąŠąĮąĖ ąĮąĄ ą▓ąĖą┤ąĮčŗ ą▓ąĖąĘčāą░ą╗čīąĮąŠ ąĮą░ ąĖąĘą╗ąŠą╝ąĄ ą╝ąĄčéą░ą╗ą╗ą░ ąĖ ąŠą▒čĆą░ąĘąĄčå ą╝ąĄčéą░ą╗ą╗ą░ ą║ą░ąČąĄčéčüčÅ ą╝ąŠąĮąŠą╗ąĖčéąĮčŗą╝.
ąĪą┐ą╗ą░ą▓ ŌĆō čŹč鹊 čüą╝ąĄčüčī ą┤ą▓čāčģ ąĖą╗ąĖ ą▒ąŠą╗ąĄąĄ ąĖąĮą┤ąĖą▓ąĖą┤čāą░ą╗čīąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓.
ąÆ čüą┐ą╗ą░ą▓ą░čģ ą╝ąŠą│čāčé ą┐čĆąĖčüčāčéčüčéą▓ąŠą▓ą░čéčī ąĮąĄ č鹊ą╗čīą║ąŠ ą╝ąĄčéą░ą╗ą╗čŗ, ąĮąŠ ąĖ ą▓ą║ą╗čÄč湥ąĮąĖčÅ ąĮąĄą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ ą┐čĆąĖčĆąŠą┤čŗ, čéą░ą║ ąĮą░ąĘčŗą▓ą░ąĄą╝čŗąĄ ą╗ąĄą│ąĖčĆčāčÄčēąĖąĄ 菹╗ąĄą╝ąĄąĮčéčŗ, ąĮą░ą┐čĆąĖą╝ąĄčĆ čéą░ą║ąĖąĄ ą║ą░ą║ C, Si, S. ąĀą░čüą┐čĆąŠčüčéčĆą░ąĮčæąĮąĮčŗą╝ ą╝ąĄč鹊ą┤ąŠą╝ ą┐ąŠą╗čāč湥ąĮąĖčÅ čüą┐ą╗ą░ą▓ąŠą▓ čÅą▓ą╗čÅąĄčéčüčÅ čüąŠą▓ą╝ąĄčüčéąĮąŠąĄ ąĮą░ą│čĆąĄą▓ą░ąĮąĖąĄ ąĖčģ čüąŠčüčéą░ą▓ąĮčŗčģ čćą░čüč鹥ą╣ ą┤ąŠ ą┐ąŠą╗ąĮąŠą│ąŠ čĆą░čüą┐ą╗ą░ą▓ą╗ąĄąĮąĖčÅ čüą╝ąĄčüąĖ – čüą┐ą╗ą░ą▓ą╗ąĄąĮąĖčÅ čüąŠčüčéą░ą▓ąĮčŗčģ ą╝ąĄčéą░ą╗ą╗ąŠą▓. ą×ą┤ąĮą░ą║ąŠ ąĄčüčéčī ą╝ąĄčéą░ą╗ą╗čŗ, ą║ąŠč鹊čĆčŗąĄ ąĮąĄ čüą┐ą╗ą░ą▓ą╗čÅčÄčéčüčÅ ą┤čĆčāą│ čü ą┤čĆčāą│ąŠą╝ ą▓ ą╗čÄą▒čŗčģ čüąŠąŠčéąĮąŠčłąĄąĮąĖčÅčģ.
ą£ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖąĄ čüą┐ą╗ą░ą▓čŗ ą╝ąŠąČąĮąŠ ą║ą╗ą░čüčüąĖčäąĖčåąĖčĆąŠą▓ą░čéčī čéą░ą║:
– čéą▓čæčĆą┤čŗąĄ čĆą░čüčéą▓ąŠčĆčŗ ą▓ąĮąĄą┤čĆąĄąĮąĖčÅ;
– čéą▓čæčĆą┤čŗąĄ čĆą░čüčéą▓ąŠčĆčŗ ąĘą░ą╝ąĄčēąĄąĮąĖčÅ;
– čüą╝ąĄčüąĖ ąĖąĮą┤ąĖą▓ąĖą┤čāą░ą╗čīąĮčŗčģ ą║čĆąĖčüčéą░ą╗ą╗ąŠą▓ ą╝ąĄčéą░ą╗ą╗ąŠą▓;
– čüą╝ąĄčüąĖ ą║čĆąĖčüčéą░ą╗ą╗ąŠą▓ ąĖąĮč鹥čĆą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣.
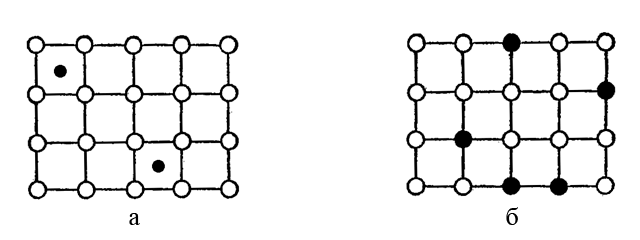
ąÆ čüą┐ą╗ą░ą▓ą░čģ, ą┐čĆąĄą┤čüčéą░ą▓ą╗čÅčÄčēąĖčģ čüąŠą▒ąŠą╣ čéą▓čæčĆą┤čŗą╣ čĆą░čüčéą▓ąŠčĆ ą▓ąĮąĄą┤čĆąĄąĮąĖčÅ (čĆąĖčü. ą░), čćą░čüčéčī ą╝ąĄąČčāąĘą╗ąŠą▓čŗčģ ą┐ąŠą╗ąŠčüč鹥ą╣ ą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĖ ąĘą░ąĮčÅčéą░ ą░č鹊ą╝ą░ą╝ąĖ ą┤čĆčāą│ąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░ (ąĮą░ą┐čĆąĖą╝ąĄčĆ, čāą│ą╗ąĄčĆąŠą┤ą░). ąĪą┐ą╗ą░ą▓čŗ čü ą┐čĆąĖą╝ąĄčüčÅą╝ąĖ ą▓ąĮąĄą┤čĆąĄąĮąĖčÅ, ąĮą░ą┐čĆąĖą╝ąĄčĆ, čćčāą│čāąĮ, čüčéą░ą╗čī, čüąŠą┤ąĄčƹȹ░čēąĖąĄ ą┐čĆąĖą╝ąĄčüąĮčŗąĄ ą░č鹊ą╝čŗ čāą│ą╗ąĄčĆąŠą┤ą░, ąĘąĮą░čćąĖč鹥ą╗čīąĮąŠ čéą▓čæčƹȹĄ, č湥ą╝ čćąĖčüč鹊ąĄ ąČąĄą╗ąĄąĘąŠ.
ąÆ čüą┐ą╗ą░ą▓ą░čģ ŌĆō čéą▓čæčĆą┤čŗčģ čĆą░čüčéą▓ąŠčĆą░čģ ąĘą░ą╝ąĄčēąĄąĮąĖčÅ (čĆąĖčü. ą▒) čćą░čüčéčī ą░č鹊ą╝ąŠą▓ ąŠčüąĮąŠą▓ąĮąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░ ąĘą░ą╝ąĄąĮąĄąĮą░ ąĮą░ ą░č鹊ą╝čŗ ą┐čĆąĖą╝ąĄčüąĮąŠą│ąŠ 菹╗ąĄą╝ąĄąĮčéą░. ąĪą┐ą╗ą░ą▓čŗ, čüąŠčüč鹊čÅčēąĖąĄ ąĖąĘ čüą╝ąĄčüąĖ ąĖąĮą┤ąĖą▓ąĖą┤čāą░ą╗čīąĮčŗčģ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ ą║ąŠą╝ą┐ąŠąĮąĄąĮč鹊ą▓, ąŠą▒čĆą░ąĘčāčÄčéčüčÅ ą┐čĆąĖ čüąŠą▒ą╗čÄą┤ąĄąĮąĖąĖ čüčéčĆąŠą│ąŠ ąŠą┐čĆąĄą┤ąĄą╗čæąĮąĮąŠą│ąŠ čüąŠąŠčéąĮąŠčłąĄąĮąĖčÅ; čéą░ą║ąĖąĄ čüą┐ą╗ą░ą▓čŗ ąĮą░ąĘčŗą▓ą░čÄčéčüčÅ čéą░ą║ąČąĄ 菹▓č鹥ą║čéąĖč湥čüą║ąĖą╝ąĖ čüą╝ąĄčüčÅą╝ąĖ. ąŁą▓č鹥ą║čéąĖč湥čüą║ąŠą╣ čüą╝ąĄčüčīčÄ čÅą▓ą╗čÅąĄčéčüčÅ čłąĖčĆąŠą║ąŠ ąĖąĘą▓ąĄčüčéąĮčŗą╣ ąŠą╗ąŠą▓čÅąĮąĮčŗą╣ ą┐čĆąĖą┐ąŠą╣ – čéčĆąĄčéąĮąĖą║ (64% Sn ąĖ 36% Pb) čü čé. ą┐ą╗. 181*ąĪ.
ąĪą┐ą╗ą░ą▓ą╗čÅąĄą╝čŗąĄ ą╝ąĄčéą░ą╗ą╗čŗ ą╝ąŠą│čāčé ąŠą▒čĆą░ąĘąŠą▓čŗą▓ą░čéčī ą╝ąĄąČą┤čā čüąŠą▒ąŠą╣ čģąĖą╝ąĖč湥čüą║ąĖąĄ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ ŌĆō ąĖąĮč鹥čĆą╝ąĄčéą░ą╗ą╗ąĖą┤čŗ. ąØą░ą┐čĆąĖą╝ąĄčĆ, ą▓ ą▒čĆąŠąĮąĘąĄ (čüą┐ą╗ą░ą▓ ąĮą░ ąŠčüąĮąŠą▓ąĄ Cu ąĖ Sn, čüąŠą┤ąĄčƹȹ░čēąĖą╣ čéą░ą║ąČąĄ Al, Be, Pb ąĖ ą┤čĆ.) ą┐čĆąĖčüčāčéčüčéą▓čāąĄčé ąĖąĮč鹥čĆą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąŠąĄ čüąŠąĄą┤ąĖąĮąĄąĮąĖąĄ čüąŠčüčéą░ą▓ą░ Cu3Sn, ą░ ą▓ ą╗ą░čéčāąĮąĖ (čüą┐ą╗ą░ą▓ąĄ ąĮą░ ąŠčüąĮąŠą▓ąĄ Cu ąĖ Zn, čüąŠą┤ąĄčƹȹ░čēąĄą╝ čéą░ą║ąČąĄ Al, Fe, Mn ąĖ ą┤čĆ.) ą┐čĆąĖčüčāčéčüčéą▓čāąĄčé ąĖąĮč鹥čĆą╝ąĄčéą░ą╗ą╗ąĖą┤ CuZn3. ąÆą░ąČąĮąĄą╣čłąĄą╣ čüąŠčüčéą░ą▓ąĮąŠą╣ čćą░čüčéčīčÄ čüčéą░ą╗ąĖ čÅą▓ą╗čÅąĄčéčüčÅ ą║ą░čĆą▒ąĖą┤ ąČąĄą╗ąĄąĘą░ Fe2C (čåąĄą╝ąĄąĮčéąĖčé), ą║ąŠč鹊čĆčŗą╣ čéą░ą║ąČąĄ ąŠčéąĮąŠčüčÅčé ą║ ąĖąĮč鹥čĆą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖą╝ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅą╝. ąĪąŠčüčéą░ą▓ ąĖąĮč鹥čĆą╝ąĄčéą░ą╗ą╗ąĖą┤ąŠą▓ ąŠą▒čŗčćąĮąŠ ąĮąĄ ąŠčéą▓ąĄčćą░ąĄčé čüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąŠą╣ ą▓ą░ą╗ąĄąĮčéąĮąŠčüčéąĖ 菹╗ąĄą╝ąĄąĮč鹊ą▓; ąĖąĮč鹥čĆą╝ąĄčéą░ą╗ą╗ąĖą┤čŗ ŌĆō čŹč鹊 ąĮąĄčüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖąĄ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ, čüąŠčüčéą░ą▓ą╗čÅčÄčēąĖąĄ ąŠą▒čłąĖčĆąĮčŗą╣ ą║ą╗ą░čüčü ąĮąĄąŠčĆą│ą░ąĮąĖč湥čüą║ąĖčģ ą▓ąĄčēąĄčüčéą▓ čü ąĮąĄčüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖą╝ čüąŠčüčéą░ą▓ąŠą╝. ą£ąĮąŠą│ąĖąĄ 菹╗ąĄą╝ąĄąĮčéčŗ ąŠą▒čĆą░ąĘčāčÄčé ąĮąĄčüą║ąŠą╗čīą║ąŠ ąĮąĄčüč鹥čģąĖąŠą╝ąĄčéčĆąĖč湥čüą║ąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣; čéą░ą║, ąČąĄą╗ąĄąĘąŠ čü č乊čüč乊čĆąŠą╝ ą┤ą░ąĄčé č乊čüčäąĖą┤čŗ čüąŠčüčéą░ą▓ą░ Fe3P, Fe2P, FeP, FeP2. ążąŠčĆą╝čāą╗čŗ čŹčéąĖčģ čüąŠąĄą┤ąĖąĮąĄąĮąĖą╣ čāą║ą░ąĘčŗą▓ą░čÄčé ą╗ąĖčłčī ąĮą░ č鹊, čćč鹊 ą┤ą╗čÅ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąĖčģ čĆąĄčłąĄč鹊ą║ čģą░čĆą░ą║č鹥čĆąĮąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĮąŠąĄ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĄ ą║ąŠą╝ą┐ąŠąĮąĄąĮč鹊ą▓, ąĮą░ą┐čĆąĖą╝ąĄčĆ ą▓ Fe3C ąĮą░ ą║ą░ąČą┤čŗąĄ čéčĆąĖ ą░č鹊ą╝ą░ Fe ą┐čĆąĖčģąŠą┤ąĖčéčüčÅ ąŠą┤ąĖąĮ ą░č鹊ą╝ C.
ą¤čĆąŠą▓ąŠą┤ąĮąĖą║ąĖ, ą┤ąĖ菹╗ąĄą║čéčĆąĖą║ąĖ ąĖ ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąĖ
ąÆ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čĆąĄčłąĄčéą║ąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ čĆą░čüą┐ąŠą╗ą░ą│ą░čÄčéčüčÅ ąĮą░ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĮčŗčģ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖčģ čāčĆąŠą▓ąĮčÅčģ čéą░ą║ ąČąĄ, ą║ą░ą║ ąĖ ą▓ ą░č鹊ą╝ąĄ. ąÆ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĖąĖ čü ą┐čĆąĖąĮčåąĖą┐ąŠą╝ ą¤ą░čāą╗ąĖ ą▓ ąŠą┤ąĮąŠą╝ ą║čĆąĖčüčéą░ą╗ą╗ąĄ ą║ą░ąČą┤čŗąĄ ą┤ą▓ą░ 菹╗ąĄą║čéčĆąŠąĮą░ (čü ą░ąĮčéąĖą┐ą░čĆą░ą╗ą╗ąĄą╗čīąĮčŗą╝ąĖ čüą┐ąĖąĮą░ą╝ąĖ) ąĮą░čģąŠą┤čÅčéčüčÅ ą▓ čüčéčĆąŠą│ąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĄąĮąĮąŠą╝ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą╝ čüąŠčüč鹊čÅąĮąĖąĖ. ąĪą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīąĮąŠ, ą┤ą╗čÅ ą╝ąĮąŠąČąĄčüčéą▓ą░ ą┐ą░čĆ čŹą╗ąĄą║čéčĆąŠąĮąŠą▓ ą▓ ą║čĆąĖčüčéą░ą╗ą╗ąĄ ą┤ąŠą╗ąČąĮąŠ ą▒čŗčéčī čéą░ą║ąŠąĄ ąČąĄ ą╝ąĮąŠąČąĄčüčéą▓ąŠ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖčģ čüąŠčüč鹊čÅąĮąĖą╣. ą¤ąŠčŹč鹊ą╝čā ą▓ ą║čĆąĖčüčéą░ą╗ą╗ąĄ ą▓ą╝ąĄčüč鹊 ąŠčéą┤ąĄą╗čīąĮčŗčģ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖčģ ą┐ąŠą┤čāčĆąŠą▓ąĮąĄą╣ ą▓čŗą┤ąĄą╗čÅčÄčé ą│čĆčāą┐ą┐čŗ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖ ą▒ą╗ąĖąĘą║ąĖčģ čüąŠčüč鹊čÅąĮąĖą╣ ŌĆō 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖąĄ ąĘąŠąĮčŗ. ąŚąŠąĮčŗ ą╝ąŠą│čāčé ą▒čŗčéčī ąŠčéą┤ąĄą╗ąĄąĮčŗ ąŠą┤ąĮą░ ąŠčé ą┤čĆčāą│ąŠą╣, ąĮąŠ ą╝ąŠą│čāčé ąĖ ą┐ąĄčĆąĄą║čĆčŗą▓ą░čéčīčüčÅ. ąśąĘą╗ąŠąČąĄąĮąĮčŗąĄ ą▓čŗčłąĄ ą┐ąŠą╗ąŠąČąĄąĮąĖčÅ čüąŠčüčéą░ą▓ą╗čÅčÄčé ąŠčüąĮąŠą▓čā ąŚąŠąĮąĮąŠą╣ č鹥ąŠčĆąĖąĖ 菹╗ąĄą║čéčĆąŠąĮąĮąŠą│ąŠ čüčéčĆąŠąĄąĮąĖčÅ ą║čĆąĖčüčéą░ą╗ą╗ąŠą▓.
ąØą░ čĆąĖčüčāąĮą║ąĄ ą┐ąŠą║ą░ąĘą░ąĮčŗ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖąĄ ąĘąŠąĮčŗ, čģą░čĆą░ą║č鹥čĆąĮčŗąĄ ą┤ą╗čÅ ą║čĆąĖčüčéą░ą╗ą╗ą░ ąĮą░čéčĆąĖčÅ (ąĘąŠąĮąĮą░čÅ ą╝ąŠą┤ąĄą╗čī ą╝ąĄčéą░ą╗ą╗ą░ ąĮą░čéčĆąĖčÅ), ąŠą▒čĆą░ąĘčāčÄčēąĖąĄčüčÅ ąĖąĘ ą░č鹊ą╝ąĮčŗčģ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖčģ čāčĆąŠą▓ąĮąĄą╣ ąĮą░čéčĆąĖčÅ. ąŁąĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖąĄ 1s-, 2s-, 2p-ąĘąŠąĮčŗ ąĘą░ą┐ąŠą╗ąĮąĄąĮčŗ 1s22s22p6-菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ ą║ą░ąČą┤ąŠą│ąŠ ą░č鹊ą╝ą░ ąĮą░čéčĆąĖčÅ, 3s-ąĘąŠąĮą░ ŌĆō ą▓ą░ą╗ąĄąĮčéąĮčŗą╝ąĖ 3s1-菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ, 3p-ąĘąŠąĮą░ ąŠčüčéą░ąĄčéčüčÅ ą▓ą░ą║ą░ąĮčéąĮąŠą╣.
ąŚąŠąĮą░, ą▓ ą║ąŠč鹊čĆąŠą╣ ąĮą░čģąŠą┤čÅčéčüčÅ ą▓ą░ą╗ąĄąĮčéąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ, ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ ą▓ą░ą╗ąĄąĮčéąĮąŠą╣, ą░ ą▓ą░ą║ą░ąĮčéąĮą░čÅ ąĘąŠąĮą░ (ąĮą░čģąŠą┤čÅčēą░čÅčüčÅ ąĮą░ą┤ ą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ąĘąŠąĮąŠą╣) ŌĆō ąĘąŠąĮąŠą╣ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ 菹╗ąĄą║čéčĆąĖč湥čüą║ąŠą│ąŠ č鹊ą║ą░. ąÆ ą║čĆąĖčüčéą░ą╗ą╗ąĄ ąĮą░čéčĆąĖčÅ ą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ąĘąŠąĮąŠą╣ čÅą▓ą╗čÅąĄčéčüčÅ 3s-ąĘąŠąĮą░, ą░ ąĘąŠąĮąŠą╣ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ – 3p-ąĘąŠąĮą░.
ąÆ čüąŠąŠčéą▓ąĄčéčüčéą▓ąĖąĖ čü ąĘąŠąĮąĮąŠą╣ č鹥ąŠčĆąĖąĄą╣ 菹╗ąĄą║čéčĆąĖč湥čüą║ą░čÅ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéčī ą║čĆąĖčüčéą░ą╗ą╗ą░ ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮą░ č鹥ą╝, čćč鹊, ą▓ąŠ-ą┐ąĄčĆą▓čŗčģ, ą▓ ą┐čĆąĄą┤ąĄą╗ą░čģ ąĮąĄą┐ąŠą╗ąĮąŠčüčéčīčÄ ąĘą░ąĮčÅč鹊ą╣ ą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ąĘąŠąĮčŗ ąĖą╝ąĄąĄčéčüčÅ ą╝ąĮąŠą│ąŠ čüą▓ąŠą▒ąŠą┤ąĮčŗčģ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖčģ čüąŠčüč鹊čÅąĮąĖą╣, ą╝ąĄąČą┤čā ą║ąŠč鹊čĆčŗą╝ąĖ ą▓ąŠąĘą╝ąŠąČąĮą░ ą╝ąĖą│čĆą░čåąĖčÅ ą▓ą░ą╗ąĄąĮčéąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓, ąĖ, ą▓ąŠ-ą▓č鹊čĆčŗčģ, ą▓ą░ą╗ąĄąĮčéąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ čüą┐ąŠčüąŠą▒ąĮčŗ ą┐ąŠą║ąĖą┤ą░čéčī ą▓ą░ą╗ąĄąĮčéąĮčāčÄ ąĘąŠąĮčā ąĖ ą┐ąĄčĆąĄčģąŠą┤ąĖčéčī ą▓ ąĘąŠąĮčā ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ.
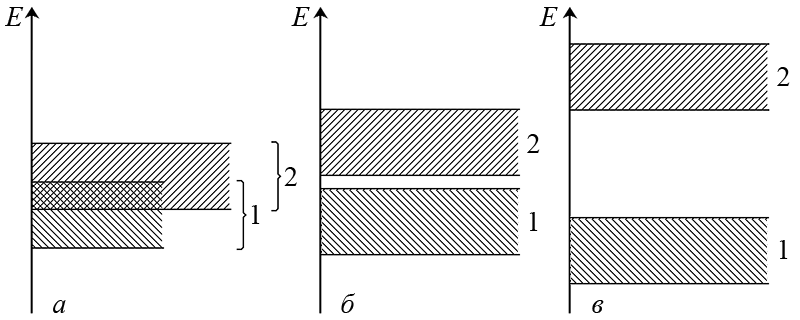
ą¤ąĄčĆąĄčģąŠą┤ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĖąĘ ą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ąĘąŠąĮčŗ ą▓ ąĘąŠąĮčā ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ ą┐čĆąŠč鹥ą║ą░ąĄčé ą┐ąŠčćčéąĖ ą▒ąĄąĘ ąĘą░čéčĆčāą┤ąĮąĄąĮąĖą╣, ąĄčüą╗ąĖ čŹčéąĖ ąĘąŠąĮčŗ ą┐ąĄčĆąĄą║čĆčŗą▓ą░čÄčéčüčÅ (čĆąĖčü. ą░). ąóą░ą║ąŠąĄ čĆą░čüą┐ąŠą╗ąŠąČąĄąĮąĖąĄ ąĘąŠąĮ čģą░čĆą░ą║č鹥čĆąĮąŠ ą┤ą╗čÅ ą╝ąĄčéą░ą╗ą╗ąŠą▓, ą║ąŠč鹊čĆčŗą╝ ą▒ą╗ą░ą│ąŠą┤ą░čĆčÅ čŹč鹊ą╝čā čüą▓ąŠą╣čüčéą▓ąĄąĮąĮą░ 菹╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéčī. ą¤ąŠčŹč鹊ą╝čā ą╝ąĄčéą░ą╗ą╗čŗ ŌĆō ą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąĖ (ą┐čĆąŠą▓ąŠą┤čÅčé 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ č鹊ą║).
ąĢčüą╗ąĖ ąČąĄ ą╝ąĄąČą┤čā ą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ąĘąŠąĮąŠą╣ ąĖ ąĘąŠąĮąŠą╣ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ ąĖą╝ąĄąĄčéčüčÅ ą▒ąŠą╗čīčłąŠą╣ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖą╣ ąĘą░ąĘąŠčĆ (čĆąĖčü. ą▓), ąĮą░ąĘčŗą▓ą░ąĄą╝čŗą╣ ą▓ čĆą░ą╝ą║ą░čģ ą║ą▓ą░ąĮč鹊ą▓ąŠ-ą╝ąĄčģą░ąĮąĖč湥čüą║ąĖčģ č鹥čĆą╝ąĖąĮąŠą▓ ąĘą░ą┐čĆąĄčēąĄąĮąĮąŠą╣ ąĘąŠąĮąŠą╣, č鹊 ą┐ąĄčĆąĄčģąŠą┤ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ ąĮąĄą▓ąŠąĘą╝ąŠąČąĄąĮ, ąĖ čéą░ą║ąĖąĄ ą▓ąĄčēąĄčüčéą▓ą░ ąĮą░ąĘčŗą▓ą░čÄčé ŌĆō ą┤ąĖ菹╗ąĄą║čéčĆąĖą║ąĖ (ąĖąĘąŠą╗čÅč鹊čĆčŗ, ąĮąĄ ą┐čĆąŠą▓ąŠą┤čÅčé 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ č鹊ą║). ą×ą▒čŗčćąĮąŠ ą┤ąĖ菹╗ąĄą║čéčĆąĖą║ą░ą╝ąĖ čÅą▓ą╗čÅčÄčéčüčÅ ą║ąŠą▓ą░ą╗ąĄąĮčéąĮčŗąĄ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ, ąĖąŠąĮąĮčŗąĄ ą║čĆąĖčüčéą░ą╗ą╗čŗ ąĖ ą░ą╗ą╝ą░ąĘąŠą┐ąŠą┤ąŠą▒ąĮčŗąĄ ąĮąĄą╝ąĄčéą░ą╗ą╗ąĖč湥čüą║ąĖąĄ ą┐čĆąŠčüčéčŗąĄ ą▓ąĄčēąĄčüčéą▓ą░. ąØą░ą┐čĆąĖą╝ąĄčĆ čéčĆąĖąĖąŠą┤ąĖą┤ č乊čüč乊čĆą░ PI3, NaCl ąĖ čüą░ą╝ ą░ą╗ą╝ą░ąĘ, ą▓ ąŠčéą╗ąĖčćąĖąĖ ąŠčé ą║ąŠč鹊čĆąŠą│ąŠ ą│čĆą░čäąĖčé ŌĆō ą┐čĆąŠą▓ąŠą┤ąĮąĖą║.
ą¤čĆąĖ ąĮą░ą╗ąĖčćąĖąĖ ą╝ą░ą╗ąŠą│ąŠ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą│ąŠ ąĘą░ąĘąŠčĆą░ (čĆąĖčü. ą▒) ą▓ą░ą╗ąĄąĮčéąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ, ą┐čĆąĖąŠą▒čĆąĄčéą░čÄčēąĖąĄ ą┐ąŠą┤ ą▓ąĮąĄčłąĮąĖą╝ ą▓ąŠąĘą┤ąĄą╣čüčéą▓ąĖąĄą╝, ąĮą░ą┐čĆąĖą╝ąĄčĆ, č鹥ą┐ą╗ąŠą▓ąŠą│ąŠ ąĖą╗ąĖ čüą▓ąĄč鹊ą▓ąŠą│ąŠ ąŠą▒ą╗čāč湥ąĮąĖčÅ ą┤ąŠą┐ąŠą╗ąĮąĖč鹥ą╗čīąĮčāčÄ čŹąĮąĄčĆą│ąĖčÄ (ą▓ąŠąĘą▒čāąČą┤ą░čÄčéčüčÅ, čéą░ą║ ąČąĄ ą║ą░ą║ ą▓ ą░č鹊ą╝ąĄ), ąŠą║ą░ąĘčŗą▓ą░čÄčéčüčÅ čüą┐ąŠčüąŠą▒ąĮčŗą╝ąĖ ą┐čĆąĄąŠą┤ąŠą╗ąĄą▓ą░čéčī ąĘą░ą┐čĆąĄčēąĄąĮąĮčāčÄ ąĘąŠąĮčā – ą┐čĆąŠąĖčüčģąŠą┤ąĖčé ą┐ąĄčĆąĄčüą║ąŠą║ ą▓ ąĘąŠąĮčā ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ. ąÆ čĆąĄąĘčāą╗čīčéą░č鹥 ą▓ąŠąĘąĮąĖą║ą░ąĄčé 菹╗ąĄą║čéčĆąŠąĮąĮą░čÅ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéčī ą▓ąĄčēąĄčüčéą▓ą░, čćč鹊 ąĖčüą┐ąŠą╗čīąĘčāąĄčéčüčÅ ą▓ č鹥čģąĮąĖą║ąĄ (ąĮą░ą┐čĆąĖą╝ąĄčĆ, č乊č鹊ą┤ąĖąŠą┤čŗ, čüąŠą╗ąĮąĄčćąĮčŗąĄ ą▒ą░čéą░čĆąĄąĖ ąĖ ą┤čĆ.).
ą¤ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąĖ ŌĆō čŹč鹊 ą▓ąĄčēąĄčüčéą▓ą░, 菹╗ąĄą║čéčĆąŠąĮąĮąŠąĄ čüčéčĆąŠąĄąĮąĖąĄ ą║ąŠč鹊čĆčŗčģ čģą░čĆą░ą║č鹥čĆąĖąĘčāąĄčéčüčÅ čāąĘą║ąĖą╝ąĖ ąĘą░ą┐čĆąĄčēąĄąĮąĮčŗą╝ąĖ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąĖą╝ąĖ ąĘąŠąĮą░ą╝ąĖ.
ąÆ čüčéą░čĆąŠą╣ čäąĖąĘąĖč湥čüą║ąŠą╣ ą╗ąĖč鹥čĆą░čéčāčĆąĄ, ą┐čĆąŠčüčéčŗąĄ ą▓ąĄčēąĄčüčéą▓ą░ čü ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąŠą▓čŗą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ ąĮą░ąĘčŗą▓ą░ą╗ąĖ ą┐ąŠą╗čāą╝ąĄčéą░ą╗ą╗ą░ą╝ąĖ, ąĖą╗ąĖ ą╝ąĄčéą░ą╗ą╗ąŠąĖą┤ą░ą╝ąĖ. ąĪąĄą│ąŠą┤ąĮčÅ čéą░ą║ąĖąĄ ąĮą░ąĘą▓ą░ąĮąĖčÅ čüčćąĖčéą░čÄčéčüčÅ čāčüčéą░čĆąĄą▓čłąĖą╝ąĖ.
ąÜ ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ą░ą╝ ąŠčéąĮąŠčüčÅčéčüčÅ ą║čĆąĄą╝ąĮąĖą╣, ą│ąĄčĆą╝ą░ąĮąĖą╣, čüąĄą╗ąĄąĮ ąĖ č鹥ą╗ą╗čāčĆ. ąóą░ą║ąČąĄ ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąŠą▓čŗą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ ą╝ąŠą│čāčé ąŠą▒ą╗ą░ą┤ą░čéčī ąĖ ąĮąĄą║ąŠč鹊čĆčŗąĄ čüąŠąĄą┤ąĖąĮąĄąĮąĖčÅ, ąĮą░ą┐čĆąĖą╝ąĄčĆ GaAs, InP, ZnTe.
ąŁą╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéčī ą╝ąŠąČąĮąŠ čüąŠąĘą┤ą░čéčī ąĖą╗ąĖ čāą▓ąĄą╗ąĖčćąĖčéčī ąĖčüą║čāčüčüčéą▓ąĄąĮąĮčŗą╝ ą┐čāč鹥ą╝ ŌĆō ą▓ą▓ąĄą┤ąĄąĮąĖąĄą╝ ą┐čĆąĖą╝ąĄčüąĮčŗčģ ą░č鹊ą╝ąŠą▓ ą┤čĆčāą│ąĖčģ 菹╗ąĄą╝ąĄąĮč鹊ą▓ ą▓ ąŠčüąĮąŠą▓ąĮąŠąĄ ą▓ąĄčēąĄčüčéą▓ąŠ.
ąøąĄą│ąĖčĆąŠą▓ą░ąĮąĖąĄ ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ą░ ŌĆō čŹč鹊 ą┐čĆąŠčåąĄčüčü ą▓ąĮąĄą┤čĆąĄąĮąĖčÅ ą┐čĆąĖą╝ąĄčüąĮčŗčģ ą░č鹊ą╝ąŠą▓ ą▓ ąŠčüąĮąŠą▓ąĮąŠąĄ ą▓ąĄčēąĄčüčéą▓ąŠ čü čåąĄą╗čīčÄ čāą▓ąĄą╗ąĖč湥ąĮąĖčÅ čŹą╗ąĄą║čéčĆąĖč湥čüą║ąŠą╣ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ.
ąØą░ą┐čĆąĖą╝ąĄčĆ, ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąŠą▓čŗąĄ čüą▓ąŠą╣čüčéą▓ą░ ą║čĆąĄą╝ąĮąĖčÅ (ą░č鹊ą╝ ą║ąŠč鹊čĆąŠą│ąŠ ąĖą╝ąĄąĄčé 4 ą▓ą░ą╗ąĄąĮčéąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮą░) ą╝ąŠąČąĮąŠ čāą╗čāčćčłąĖčéčī ą▓ą▓ąĄą┤ąĄąĮąĖąĄą╝ ą▓ ą║čĆąĖčüčéą░ą╗ą╗ ą┐čĆąĖą╝ąĄčüąĮčŗčģ ą░č鹊ą╝ąŠą▓ ą▒ąŠčĆą░ (3 ą▓ą░ą╗ąĄąĮčéąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮą░) ąĖą╗ąĖ ą┐čĆąĖą╝ąĄčüąĮčŗčģ ą░č鹊ą╝ąŠą▓ č乊čüč乊čĆą░ (5 ą▓ą░ą╗ąĄąĮčéąĮčŗčģ 菹╗ąĄą║čéčĆąŠąĮąŠą▓). ąÜą░ąČą┤čŗą╣ ą░č鹊ą╝ č乊čüč乊čĆą░ ą▓ą▓ąŠą┤ąĖčé ą▓ ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║čāčÄ čĆąĄčłąĄčéą║čā ą║čĆąĄą╝ąĮąĖčÅ ąŠą┤ąĖąĮ ąĖąĘą▒čŗč鹊čćąĮčŗą╣ ą▓ą░ą╗ąĄąĮčéąĮčŗą╣ 菹╗ąĄą║čéčĆąŠąĮ, ą░ ą║ą░ąČą┤čŗą╣ ą░č鹊ą╝ B ą║ą░ą║ ą▒čŗ ą▓čŗą▓ąŠą┤ąĖčé ąŠą┤ąĖąĮ 菹╗ąĄą║čéčĆąŠąĮ. ąØąĄą┤ąŠčüčéą░č鹊ą║ ąŠą┤ąĮąŠą│ąŠ 菹╗ąĄą║čéčĆąŠąĮą░ čüąŠąŠčéą▓ąĄčéčüčéą▓čāąĄčé čéą░ą║ ąĮą░ąĘčŗą▓ą░ąĄą╝ąŠą╣ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮąŠą╣ ┬½ą┤čŗčĆą║ąĄ┬╗.
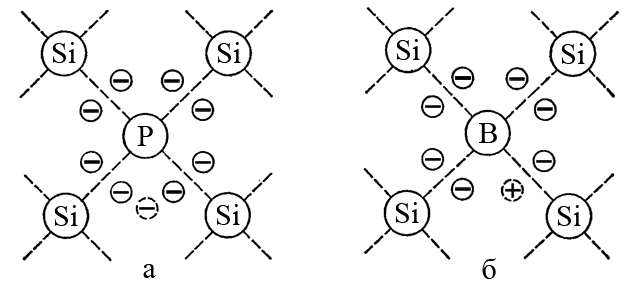
┬½ąöčŗčĆą║ąĖ┬╗ ą▓ąĄą┤čāčé čüąĄą▒čÅ čéą░ą║, ą║ą░ą║ ąĄčüą╗ąĖ ą▒čŗ ąĮą░ ąĖčģ ą╝ąĄčüč鹥 ąĮą░čģąŠą┤ąĖą╗ąĖčüčī 菹╗ąĄą║čéčĆąŠąĮčŗ, ąĮąŠ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠ ąĘą░čĆčÅąČąĄąĮąĮčŗąĄ. ąÉč鹊ą╝čŗ č乊čüč乊čĆą░ ąŠą▒ąĄčüą┐ąĄčćąĖą▓ą░čÄčé ą┤ąŠą┐ąŠą╗ąĮąĖč鹥ą╗čīąĮčāčÄ čŹą╗ąĄą║čéčĆąŠąĮąĮčāčÄ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéčī, čģą░čĆą░ą║č鹥čĆąĮčāčÄ ą┤ą╗čÅ ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąŠą▓ n-čéąĖą┐ą░; ą░č鹊ą╝čŗ ą▒ąŠčĆą░ čüąŠąĘą┤ą░čÄčé ą┤čŗčĆąŠčćąĮčāčÄ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéčī, čģą░čĆą░ą║č鹥čĆąĮčāčÄ ą┤ą╗čÅ ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąŠą▓ p-čéąĖą┐ą░.
ąśąĘą▒čŗč鹊čćąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ (ąĮą░ą┐čĆąĖą╝ąĄčĆ ąĘą░ čüč湥čé ą▓ą▓ąĄą┤ąĄąĮąĖčÅ ą░č鹊ą╝ąŠą▓ č乊čüč乊čĆą░) ąĮą░čģąŠą┤čÅčéčüčÅ ąĮą░ 菹ĮąĄčĆą│ąĄčéąĖč湥čüą║ąŠą╝ čāčĆąŠą▓ąĮąĄ, ą║ąŠč鹊čĆčŗą╣ ą╗ąĄąČąĖčé ąĮąĄčüą║ąŠą╗čīą║ąŠ ąĮąĖąČąĄ ąĘąŠąĮčŗ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ ąŠčüąĮąŠą▓ąĮąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░ (ąĮą░ą┐čĆąĖą╝ąĄčĆ, ą║čĆąĄą╝ąĮąĖčÅ) ąĖ ąĮą░ąĘčŗą▓ą░ąĄčéčüčÅ ą┤ąŠąĮąŠčĆąĮčŗą╣ čāčĆąŠą▓ąĄąĮčī ą┐čĆąĖą╝ąĄčüąĖ (čĆąĖčü. ą░).
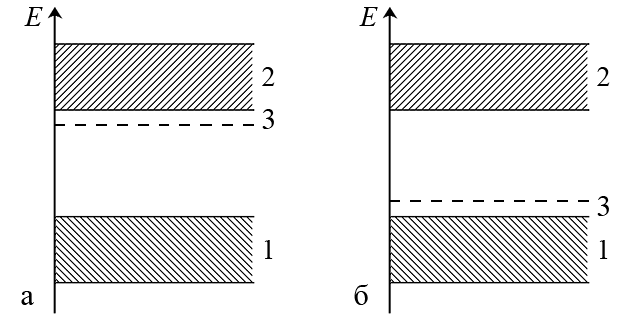
ąÆą▓ąĖą┤čā ą╝ą░ą╗ąŠą╣ čłąĖčĆąĖąĮčŗ ąĘą░ą┐čĆąĄčēąĄąĮąĮąŠą╣ ąĘąŠąĮčŗ ą╝ąĄąČą┤čā ą┤ąŠąĮąŠčĆčŗą╝ čāčĆąŠą▓ąĮąĄą╝ ąĖ ąĘąŠąĮąŠą╣ ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ ą┐čĆąĖą╝ąĄčüąĮčŗąĄ 菹╗ąĄą║čéčĆąŠąĮčŗ ą╗ąĄą│ą║ąŠ ą┐ąĄčĆąĄčģąŠą┤čÅčé ą▓ ąĘąŠąĮčā ą┐čĆąŠą▓ąŠą┤ąĖą╝ąŠčüčéąĖ ąĖ čéą░ą║ąĖą╝ ąŠą▒čĆą░ąĘąŠą╝ čāą╗čāčćčłą░čÄčé čüą▓ąŠą╣čüčéą▓ą░ ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ą░ n-čéąĖą┐ą░.
ą¤čĆąĖ ąĮąĄą┤ąŠčüčéą░čéą║ąĄ 菹╗ąĄą║čéčĆąŠąĮąŠą▓, ą▓čŗąĘą▓ą░ąĮąĮąŠą╝ ą┐čĆąĖą╝ąĄčüąĮčŗą╝ąĖ ą░č鹊ą╝ą░ą╝ąĖ (ąĮą░ą┐čĆąĖą╝ąĄčĆ, ą▒ąŠčĆą░), čé.ąĄ. ą┐čĆąĖ ą▓ąŠąĘąĮąĖą║ąĮąŠą▓ąĄąĮąĖąĖ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗčģ ┬½ą┤čŗčĆąŠą║┬╗, ąŠą▒čĆą░ąĘčāąĄčéčüčÅ ą░ą║čåąĄą┐č鹊čĆąĮčŗą╣ čāčĆąŠą▓ąĄąĮčī ą┐čĆąĖą╝ąĄčüąĖ (čĆąĖčü. ą▒). ąŁč鹊čé čāčĆąŠą▓ąĄąĮčī čĆą░čüą┐ąŠą╗ą░ą│ą░ąĄčéčüčÅ ąĮąĄčüą║ąŠą╗čīą║ąŠ ą▓čŗčłąĄ čāčĆąŠą▓ąĮčÅ ą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ąĘąŠąĮčŗ ąŠčüąĮąŠą▓ąĮąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░ (ąĮą░ą┐čĆąĖą╝ąĄčĆ, ą║čĆąĄą╝ąĮąĖčÅ). ąŁą╗ąĄą║čéčĆąŠąĮčŗ ąŠčüąĮąŠą▓ąĮąŠą│ąŠ ą▓ąĄčēąĄčüčéą▓ą░ ą╗ąĄą│ą║ąŠ ą┐ąĄčĆąĄčģąŠą┤čÅčé ąĮą░ ą░ą║čåąĄą┐č鹊čĆąĮčŗą╣ čāčĆąŠą▓ąĄąĮčī, ą░ ą▓ ą▓ą░ą╗ąĄąĮčéąĮąŠą╣ ąĘąŠąĮąĄ ą┐ąŠčÅą▓ą╗čÅčÄčéčüčÅ ą┤ąŠą┐ąŠą╗ąĮąĖč鹥ą╗čīąĮčŗąĄ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗąĄ ┬½ą┤čŗčĆą║ąĖ┬╗, ą║ąŠč鹊čĆčŗąĄ ąĘą░ą┐ąŠą╗ąĮčÅčÄčéčüčÅ ą┤čĆčāą│ąĖą╝ąĖ 菹╗ąĄą║čéčĆąŠąĮą░ą╝ąĖ. ąóą░ą║ąŠąĄ ą▓čüčéčĆąĄčćąĮąŠąĄ ą┤ą▓ąĖąČąĄąĮąĖąĄ ┬½ą┤čŗčĆąŠą║┬╗ ąĖ 菹╗ąĄą║čéčĆąŠąĮąŠą▓ čüąŠąĘą┤ą░ąĄčé 菹╗ąĄą║čéčĆąĖč湥čüą║ąĖą╣ č鹊ą║ ą▓ ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąĄ p-čéąĖą┐ą░.
ą¤čāč鹥ą╝ ą╗ąĄą│ąĖčĆąŠą▓ą░ąĮąĖčÅ ą╝ąŠąČąĮąŠ ą┐ąŠą╗čāčćą░čéčī ą┐ąŠą╗čāą┐čĆąŠą▓ąŠą┤ąĮąĖą║ąĖ čü ąĘą░čĆą░ąĮąĄąĄ ąĘą░ą┤ą░ąĮąĮčŗą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ. ą¦č鹊 ą┐ąŠąĘą▓ąŠą╗čÅčé čüąŠąĘą┤ą░ą▓ą░čéčī 菹╗ąĄą║čéčĆąŠąĮąĮčŗąĄ 菹╗ąĄą╝ąĄąĮčéčŗ, čéą░ą║ąĖąĄ ą║ą░ą║ čéčĆą░ąĮąĘąĖčüč鹊čĆčŗ, ą┤ąĖąŠą┤čŗ, č乊č鹊菹╗ąĄą╝ąĄąĮčéčŗ ąĖ ą┤čĆ. ąĖ ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░čéčī ąĖčģ ą┤ą╗čÅ ą║ąŠąĮčüčéčĆčāąĖčĆąŠą▓ą░ąĮąĖčÅ ą╝ąĖą║čĆąŠčüčģąĄą╝, ą╝ąĖą║čĆąŠą┐čĆąŠčåąĄčüčüąŠčĆąŠą▓, čĆą░ąĘą╗ąĖčćąĮčŗčģ čéąĖą┐ąŠą▓ ą┤ą░čéčćąĖą║ąŠą▓ (č鹥čĆą╝ąŠčŹą╗ąĄą║čéčĆąŠąĮąĮčŗąĄ ą┤ą░čéčćąĖą║ąĖ, čüą▓ąĄč鹊čćčāą▓čüčéą▓ąĖč鹥ą╗čīąĮčŗąĄ ą╝ą░čéčĆąĖčåčŗ ą▓ čåąĖčäčĆąŠą▓čŗčģ č乊č鹊ą░ą┐ą┐ą░čĆą░čéą░čģ) ąĖčüą┐ąŠą╗čīąĘčāąĄą╝čŗčģ ą▓ čüąŠą▓čĆąĄą╝ąĄąĮąĮčŗčģ ą║ąŠą╝ą┐čīčÄč鹥čĆą░čģ, čüą╝ą░čĆčéč乊ąĮą░čģ, ą┐ą╗ą░ąĮčłąĄčéą░čģ ąĖ ą┤čĆčāą│ąĖčģ 菹╗ąĄą║čéčĆąŠąĮąĮčŗčģ čāčüčéčĆąŠą╣čüčéą▓ą░čģ.










